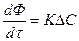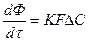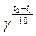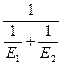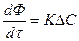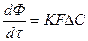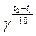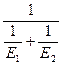Чем измеряется скорость процесса
Измерение производственного процесса
Измерение процесса создания ПО заключается в сборе количественных данных, характеризующих этот процесс. Сбор количественных показателей производственного процесса – необходимая составляющая его совершенствования. Эти показатели помогают узнать, насколько повысилась эффективность процесса после внесения изменений. Например, можно провести измерение времени и средств, потраченных на тестирование до изменения производства. Если совершенствование было эффективным, это должно снизить затраты, время или то и другое. Однако измерения сами по себе ничего не скажут об улучшении качества конечного продукта. Дополнительно необходимо иметь представление о значении показателей программного продукта и сопоставлении полученных результатов с новым процессом разработки.
Среди показателей процесса разработки выделим три вида:
1. Время, потраченное на выполнение отдельного этапа работ. Это может быть только рабочее время выполнения этапа, календарное время выполнения этапа или время работы отдельного специалиста.
2. Ресурсы, необходимые для реализации этапа работ. Ресурсы могут подсчитываться в человеко-днях, затратах на командировки либо ресурсах вычислительной техники.
3. Количество повторений одного и того же события. Среди таких событий можно назвать количество ошибок, обнаруженных при проверке программного кода, количество изменений в системных требованиях, среднее количество измененных строк кода и т.д.
Первые два вида показателей применяются для определения эффективности изменений процесса. Например, процесс разработки содержит несколько фиксированных временных точек, среди которых создание системной спецификации, завершение проектирования системной архитектуры, завершение формирования тестовых данных. При этом можно измерить время и средства, потраченные на переход от одной фиксированной точки к другой. Полученные результаты помогут определить те составляющие процесса, которые нуждаются в совершенствовании. После выполнения изменений следует измерить показатели процесса с тем, чтобы получить данные об эффективности изменений.
Измерение количества повторений одного события имеет более непосредственное отношение к качеству программного продукта. Например, обнаружение большего количества ошибок с помощью новой программы проверки, вероятно, улучшит качество готового продукта.
Основная проблема, связанная с измерением процесса создания ПО, – необходимость знать, что именно следует измерить. Для решения этого вопроса предлагается парадигма GQM (Goal-Question-Metric – цель-вопрос-показатель), с помощью которой определяется вид измерения и способ его использования. Эта парадигма основана «на трех китах».
1. Цель. Что является целью компании по совершенствованию процесса создания ПО? Это может быть повышение производительности труда программистов, сокращение времени разработки, повышение надежности готового продукта и т.д.
2. Вопросы. Это детализация поставленной цели. Как правило, каждая цель соотносится с рядом вопросов. Приведем примеры вопросов к указанным выше целям.
• Как повысить количество строк кода, отлаженных программистом?
• Как сократить время заключительного этапа разработки требований?
• Как повысить эффективность проверки системы на надежность?
3. Показатель. Это та информация, которая поможет ответить на сформулированные вопросы, в частности определить, достигнуты или нет поставленные цели. Например, можно определить показатель производительности программистов, выражаемый в строках написанного ими кода, такой показатель, как уровень их профессионального опыта, показатель, равный количеству официальных контактов между заказчиком и исполнителем по каждому изменению системных требований, а также показатель количества проведенных тестов для выявления ошибок в системе.
Главное преимущество данного подхода состоит в том, что в нем разделены организационная деятельность (цели) и процесс производства (вопросы). Внимание концентрируется на сборе определенных данных и предусматривает разные способы анализа результатов измерения в зависимости от поставленного вопроса.
Подход GQM был объединен с описанной в следующем разделе моделью оценки уровня развития, разработанной Институтом инженерии программного обеспечения (США), что нашло свое воплощение в методе совершенствования процесса разработки ПО. Разработчики этого метода предлагают поэтапный подход к совершенствованию процесса создания ПО. Этот подход основан на введении измерений только после того, как организация достигнет достаточного уровня развития технологии. Подход предлагает руководство и практические советы по внедрению измерений в целях совершенствования производства.
Скорость технологических процессов. Основные формулы скорости процессов. Способы увеличения скорости, увеличения движущей силы процесса и увеличения константы скорости.
Скорость технологического процесса есть величина, результирующая скоростей прямой, обратной и побочных реакций, а также диффузией исходных веществ в зону реакции и продуктов из зоны.
Скорость производственного процесса определяет производительность соответствующих аппаратов, их размеры и их количество, практически скорость процесса рассчитывается на основе практического выхода продукта за время или через константу скорости процесса.
Основные формулы скорости процесса:
1. Для гомогенных реакций согласно закону действующих масс
2. Для гетерогенных процессов, при котором вещества переходят из одной фазы в другую уравнение массопередачи записывается в виде
где DC – движущая сила процесса
F – поверхность соприкосновения взаимодействующих фаз, определяемая гидродинамическими
условиями процесса.
Константа скорости процесса является сложной величиной, зависящей не только от химических свойств реагирующих веществ, но и от их физических свойств, конструкции аппарата, скоростей потоков реагирующих масс или степени перемешивания в гомогенной среде. При обследовании существующих производств, при исследовании новых процессов определяют опытные значения константы скорости при различных условиях.
Способы увеличения скорости процесса:
Одной из основных задач является использование всех путей для увеличения скорости технологического процесса. Анализ путей производится с помощью уравнений (1) и (2), согласно которых для увеличения скорости процесса следует найти способы увеличения определяющих величин DС, К и F.
Затем выбирают наиболее рациональное из этих способов, т.е. требующее наименьших производственных затрат для достижения максимальной скорости процесса.
Увеличение движущей силы процесса может достигаться путём:
а) Увеличения концентрации взаимодействующих компонентов в исходных материалах
б) Отвода продуктов реакции из реакционной зоны
в) Смещения равновесия изменением температуры и давления
а) Способы увеличения концентрации полезных компонентов в сырье определяется агрегатным состоянием материала. Процесс увеличения концентраций полезного компонента в твёрдом материале называется обогащением, а применительно к газовым и жидким смесям называется концентрированием.
Вышеупомянутые способы применяются не только для увеличения концентрации, но и для улучшения качества продукции, путем выделения из неё примесей.
б) Отвод продуктов реакции из реакционной зоны приводит к увеличению суммарной скорости реакции. За счёт увеличения скорости обратной реакции и за счёт снижения или полного устранения величины Ср
где СД – действительная концентрация компонентов в передающей фазе в данный момент времени
СР – концентрация этого же компонента в той же фазе при равновесии
Из газовой смеси продукт реакции может отводиться путём конденсации, избирательной абсорбции или адсорбционных методов. Из жидкой смеси продукт реакции отводится в зависимости от его свойств путём осаждения кристаллов, десорбции в виде паров или адсорбции на твёрдом поглотителе, из которого выделяется затем продукт при нагревании.
в) Изменение давления в процессах с участием газовой фазы равносильно увеличению концентрации газового компонента, так как приводит к увеличению числа сталкиваний взаимодействующих молекул. Давление применяется тогда, когда прямое увеличение концентрации невозможно или нерационально.
Регулирование температуры как средство увеличения движущей силы применяется главным образом в сорбционных процессах и десорбционных процессах.
Увеличение константы скорости процесса может достигаться путём:
а) увеличения температуры взаимодействующей системы
б) применения катализаторов
в) усиления перемешивания реагирующих масс (турбулизация систем)
Влияние температуры реагирующих масс на константу скорости реакции для большинства процессов, идущих в кинетической области описывается формулой Аррениуса
Данная формула для применения в расчетах логарифмируется и приводится к виду
где К1; К2 – константы скорости при температуре Т1; Т2
Е – энергия активации
R – газовая постоянная
Дата добавления: 2018-06-27 ; просмотров: 1284 ; Мы поможем в написании вашей работы!
Скорость процесса
Выход продукта и производительность аппаратуры будет зависеть от того, с какой скоростью протекает данный процесс.
1. Для гомогенных процессов
2. Для гетерогенных процессов
В этом случае K – коэффициент массопередачи, т.е. количество вещества, перешедшее из одной фазы в другую через 1 м 2 поверхности за 1 час и при давлении 1 атм. Коэффициент K является для каждого процесса сложной функцией и определяется k и D, где k – константа скорости, D – коэффициент диффузии
Для гомогенных систем диффузия не является лимитирующей стадией, и поэтому реакция протекает в кинетической области
Для гетерогенных систем скорость всего процесса в основном определяется диффузией, и реакция протекает в диффузионной области
ΔС – движущая сила процесса
ΔC=Cдейств–Сравн для А 
F – поверхность раздела фаз
Т. к. скорость процесса
ΔС то она во многом зависит от последней. Большое влияние (особенно для гетерогенных процессов) оказывает и F.
Для увеличения скорости процесса необходимо найти способы увеличения ΔС, Кр, F.
Способы увеличения скорости процесса.
1. Увеличение движущей силы процесса.
a) Увеличение концентрации реагирующих веществ в исходном материале
Это достигается для твердых веществ – методами обогащения, для жидких – концентрированием.
Увеличение концентрации реагирующих веществ необходимо ещё и для улучшения качества продуктов, т.к. примеси могут переходить в продукты.
b) Отвод продуктов реакции из реакционной зоны.
Для равновесной реакции
A + B 
общая скорость U=V1–V2, отвод продуктов уменьшает V2 (скорость обратной реакции) или ΔC=Cдейств–Сравн, отвод продуктов уменьшает Сравн.
Это достигается круговым циклом, или избирательной адсорбцией (абсорбцией) или осаждением продуктов в виде кристаллов.
3H2 + N2 
Cр уменьшается и ΔС увеличивается
c) Смещение равновесия путем изменения Т и р.
Увеличение давления приводит к увеличению концентрации реагирующих веществ, т.е. к увеличению Сдейств (увеличению числа столкновений молекул) если реакция в газовой фазе. Для сорбционных процессов увеличение давления и уменьшение температуры будет увеличивать Cдейств и уменьшать Сравн если растворение близко к чисто органическому.
Пример: так поглощение HCl из газовой фазы при 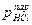
Влияние температуры на применение константы скорости процесса (К) для реакций идущих в кинетической области даёт уравнение Аррениуса.
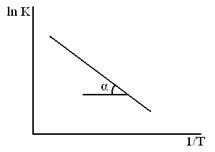
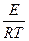
ln K = c – 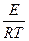
Энергию активации процесса можно определить зная K1 и K2 при T1 и T2 для процесса:
ln K1=K0– 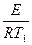 | 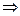 E= E= 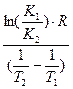 |
ln K2=K0– 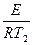 |
На практике часто используют графики V=f( 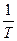
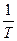
По правилу Вант-Гоффа скорость реакции увеличивается в 2-4 раза при повышении температуры на 10°С:
V2=V1
Для кинетических процессов γ=2-4
Для диффузионных процессов γ=1.2-4.5
Однако повышение температуры не на всех процессах сказывается одинаково.
b) Применение катализаторов
Катализом называют изменение скорости в результате взаимодействия с веществом катализатора, которые, участвуя в процессе, сами остаются неизменными.
Катализаторы ускоряют химические реакции путём замены одноступенчатого процесса многоступенчатым. Назначение катализаторов – снижать энергию активации процесса в целом. Сам катализатор не участвует в процессе. Катализаторы целесообразно применять для реакций, идущих с высокими энергиями активации для возбуждения молекул.
Без катализатора процесс идёт по схеме
A + K → AK c Е1, активированный комплекс
Cуммарная энергия активации Ex=
Дата добавления: 2015-06-17 ; просмотров: 1073 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Скорость процесса



Выход продукта и производительность аппаратуры будет зависеть от того, с какой скоростью протекает данный процесс.
1. Для гомогенных процессов
2. Для гетерогенных процессов
В этом случае K – коэффициент массопередачи, т.е. количество вещества, перешедшее из одной фазы в другую через 1 м 2 поверхности за 1 час и при давлении 1 атм. Коэффициент K является для каждого процесса сложной функцией и определяется k и D, где k – константа скорости, D – коэффициент диффузии
Для гомогенных систем диффузия не является лимитирующей стадией, и поэтому реакция протекает в кинетической области
Для гетерогенных систем скорость всего процесса в основном определяется диффузией, и реакция протекает в диффузионной области
ΔС – движущая сила процесса
ΔC=Cдейств–Сравн для А
F – поверхность раздела фаз
Т. к. скорость процесса
ΔС то она во многом зависит от последней. Большое влияние (особенно для гетерогенных процессов) оказывает и F.
Для увеличения скорости процесса необходимо найти способы увеличения ΔС, Кр, F.
Способы увеличения скорости процесса.
1. Увеличение движущей силы процесса.
a) Увеличение концентрации реагирующих веществ в исходном материале
Это достигается для твердых веществ – методами обогащения, для жидких – концентрированием.
Увеличение концентрации реагирующих веществ необходимо ещё и для улучшения качества продуктов, т.к. примеси могут переходить в продукты.
b) Отвод продуктов реакции из реакционной зоны.
Для равновесной реакции
A + B
общая скорость U=V1–V2, отвод продуктов уменьшает V2 (скорость обратной реакции) или ΔC=Cдейств–Сравн, отвод продуктов уменьшает Сравн.
Это достигается круговым циклом, или избирательной адсорбцией (абсорбцией) или осаждением продуктов в виде кристаллов.
3H2 + N2 
Cр уменьшается и ΔС увеличивается
c) Смещение равновесия путем изменения Т и р.
Увеличение давления приводит к увеличению концентрации реагирующих веществ, т.е. к увеличению Сдейств (увеличению числа столкновений молекул) если реакция в газовой фазе. Для сорбционных процессов увеличение давления и уменьшение температуры будет увеличивать Cдейств и уменьшать Сравн если растворение близко к чисто органическому.
Пример: так поглощение HCl из газовой фазы при 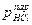
Пример: получение нитрозил серной кислоты

эта реакция идет на границе раздела фаз и она должна лимитироваться диффузией, но изменения р и Т позволяют перевести реакцию в кинетическую область. Повышение Т приводит к увеличению отвода продуктов из пограничных зон за счет конвекции.
2. Увеличение константы скорости процесса.
a) Повышение температуры.
Увеличение Т во всех случаях повышает К процесса, особенно это сказывается для неравновесных процессов. В равновесных реакциях увеличение Т увеличивает скорость и прямой и обратной реакции и изменение общей скорости будет зависеть от Q реакции (теплового эффекта).
Влияние температуры на применение константы скорости процесса (К) для реакций идущих в кинетической области даёт уравнение Аррениуса.
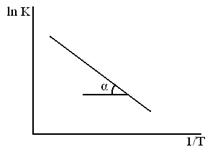
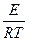
ln K = c –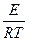
Энергию активации процесса можно определить зная K1 и K2 при T1 и T2 для процесса:
ln K1=K0– 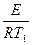 | 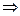 E= E= 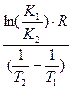 |
ln K2=K0– 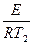 |
На практике часто используют графики V=f(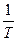
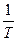
По правилу Вант-Гоффа скорость реакции увеличивается в 2-4 раза при повышении температуры на 10°С:
V2=V1
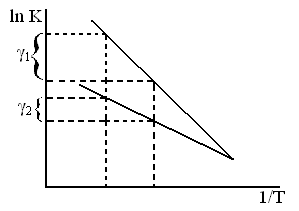
Для кинетических процессов γ=2-4
Для диффузионных процессов γ=1.2-4.5
Однако повышение температуры не на всех процессах сказывается одинаково.
b) Применение катализаторов
Катализом называют изменение скорости в результате взаимодействия с веществом катализатора, которые, участвуя в процессе, сами остаются неизменными.
Катализаторы ускоряют химические реакции путём замены одноступенчатого процесса многоступенчатым. Назначение катализаторов – снижать энергию активации процесса в целом. Сам катализатор не участвует в процессе. Катализаторы целесообразно применять для реакций, идущих с высокими энергиями активации для возбуждения молекул.
Без катализатора процесс идёт по схеме
A + K → AK c Е1, активированный комплекс
Cуммарная энергия активации Ex=
Большая Энциклопедия Нефти и Газа
Скорость производственного процесса определяет производительность соответствующих аппаратов или размеры и количество их. [2]
Скорость производственного процесса определяет производительность соответствующих аппаратов или размеры и количество их. Выход продукта может выражаться в зависимости от условий степенью превращения, равновесным и фактическим выходом. Выход от теоретического, или фактический выход Хф, определяет степень приближения процесса к равновесию и имеет важное значение для оценки скорости производственного процесса. Выходом от теоретического называется отношение количества фактически полученного продукта G к количеству его, которое получилось бы при состоянии равновесия Gp. Выход от теоретического всегда меньше единицы и лишь в пределе стремится к единице. [3]
Скорость производственного процесса определяет производи-тельноть соответствующих аппаратов или размеры и количество их. [5]
С учетом роста скоростей производственных процессов индукционные дефектоскопы будут находить все большее применение, так как их чувствительность прямо пропорциональна увеличению скорости движения изделия. [6]
С учетом роста скоростей производственных процессов индукционные при боры будут находить все большее применение, так как чувствительность их прямо пропорциональна увеличению скорости движения изделия. В частности, в настоящее время проводится разработка магнитно-индукционных индикаторов сварного шва холоднокатаных полос для высокоскоростных листопрокатных станов. [7]
С учетом роста скоростей производственных процессов индукционные дефектоскопы будут находить все большее применение, так как их чувствительность прямо пропорциональна увеличению скорости движения изделия. [8]
Различие скоростей производственных процессов конвертерного и мартеновского переделов принято характеризовать скоростями выгорания углерода. [15]