Чем измеряют объем рабочего раствора
Измерение объемов растворов и посуда в титриметрическом анализе
Для точного измерения объемов в титриметрическом анализе используются мерные колбы, мерные пипетки и бюретки (рис. 19.1-19.3). Для не очень точных измерений применяются мерные цилиндры, мензурки и мерные пробирки.
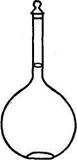
Рис. 19.1. Мерная колба
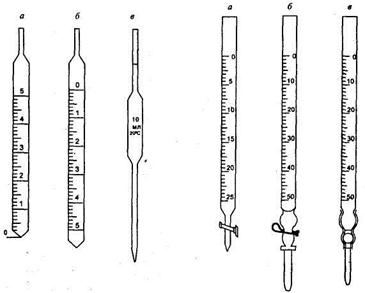
Рис. 19.2. Пипетки: Рис. 19.3. Бюретки:
Мерные пипетки (см. рис. 19.2) применяются для отмеривания и переноса заданного объема раствора из одного сосуда в другой. Пипетки бывают двух типов: градуированные (вместимостью 1, 2, 5, 10 и 25 мл) и пипетки Мора с одной меткой (вместимостью от 1 до 100 мл). Пипетка Мора имеет в средней части расширение, на котором указаны объем и температура калибровки пипетки. Выше расширения имеется круговая метка. Наполнение пипетки производится всасыванием раствора с помощью резиновой груши, плотно приставленной к верхнему концу пипетки. Хранят пипетки в специальных штативах в вертикальном положении.
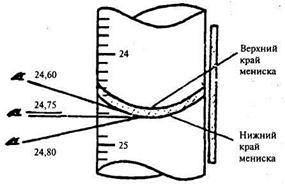
Рис. 19.4. Отсчеты по бюретке при различных положениях глаза (правильный результат подчеркнут)
вертикально в штативе и отсчет делений ведут сверху вниз. Объем бюреток составляет от 10 до 100 мл (макробюретки) и от 1 до 5 мл (микробюретки). В зависимости от объема и диаметра бюретки цена делений составляет от 0,01 до 0,1 мл. Бюретку наполняют раствором сверху через воронку. Имеются также различные устройства для наполнения бюреток.
Мерные колбы (см. рис. 19.1) применяются для приготовления растворов точных концентраций. Это плоскодонные колбы с длинным узким горлышком, на котором имеется круговая метка. На широкой части колбы указан объем (25, 50, 100, 200, 250, 500, 1000, 2000 мл) раствора, который можно приготовить при определенной температуре.
Дата добавления: 2014-11-13 ; просмотров: 65 ; Нарушение авторских прав
Большая Энциклопедия Нефти и Газа
Объем рабочего раствора зависит от геологической и гидродинамической характеристик пласта, свойства применяемого изоляционного реагента и поставленной перед РИР цели. В идеальных условиях ( одинаковая проницаемость по толщине пласта) для отключения пласта достаточно заполнить кольцевое пространство между стенками скважины и обсадной колонны. В действительности из-за анизотропности пластов и наличия зон поглощения необходимый объем раствора увеличивается и должен устанавливаться для каждого месторождения; площади опытным путем. [1]
Затем такой же объем рабочего раствора подвергается озонированию, вследствие чего концентрация тиосульфата в растворе изменяется в соответствия с реакцией ( VIII-2), после чего прореагировавший раствор также подвергается электролизу до момента появления тока в измерительной цепи. Разность времени холостого опыта ( без озонирования) и опыта с озонированным раствором ( At) пропорциональна концентрации озона в газе. [11]
У ндг ] объем рабочего раствора трилона Б, затраченный на титро-влние ( мл), УВОДН. [12]
Для запланированного общего объема рабочего раствора в п м3 полученные значения для 1 м3 увеличиваются в п раз. [13]
При кислотных ванн ах объем рабочего раствора равен объему полости скважины, высотой, равной толщине обрабатываемой зоны пласта, а концентрация основного компонента повышена. [14]
Установив затрачиваемый на титрование объем рабочего раствора арсенита ( V), по формуле ( 2) вычисляют содержание марганца в стали. [15]
Какие растворы называются рабочими?
Титриметрический анализ. Кислотно-основное титрование
В чем сущность титриметрического анализа?
Титриметрия (титриметрический анализ) – это количественный химический метод анализа, основанный на точном измерении объема стандартного раствора (титранта), вступающего в реакцию с определяемым веществом.
Стандартнымназывается раствор реагента с точно известной концентрацией. Стандартный раствор добавляется из бюретки по каплям к определенному объему анализируемого раствора. Этот процесс называется титрованием.
Состояние системы, когда количество добавляемого титранта эквивалентно количеству определяемого вещества, называется точкой эквивалентности,или теоретической точкой конца титрования. Для фиксирования точки эквивалентности используют различные индикаторы или инструментальные методы. Резкое изменение окраски индикатора соответствует конечной точке титрования, которая, строго говоря, не всегда совпадает с точкой эквивалентности.
Титриметрия как метод анализа имеет ряд достоинств. Во-первых, этовысокая скорость и точность анализа, а также применимость для определения различных количеств веществ. Во-вторых,этим методом в одном и том же растворе часто можно определять одновременно несколько веществ. Еще одно достоинство –возможность автоматизировать титрование.
В титриметрии применяются реакции, удовлетворяющие следующим требованиям.
Что такое точка эквивалентности и конечная точка титрования? Чем они отличаются?
Точка эквивалентности и конечная точка титрования. Согласно правилу эквивалентности титрование необходимо продолжать до тех пор, пока количество прибавленного реагента не станет эквивалентным содержанию определяемого вещества. Наступающий в процессе титрования момент, когда количecтвo стандартного раствора реагента (титранта) становится теоретически строго эквивалентным количеству определяемого вещества согласно определенному уравнению химической реакции, называют точкой эквивалентности.
Точку эквивалентности устанавливают различными способами, например по изменению окраски индикатора, прибавляемого в титруемый раствор. Момент, при котором происходит наблюдаемое изменение цвета индикатора, называют конечной точкой титрования. Очень часто конечная точка титрования не совсем совпадает с точкой эквивалентности. Как правило, они отличаются друг от друга не более чем на 0,02-0,04 мл (1-2 капли) титранта. Это то количество титранта, которое необходимо для взаимодейcтвия с индикатором.
В каких единицах и с какой точностью принято измерять обьем в титриметрическом анализе?
Обьем растворов, затраченных на титрование измеряются в мл, и записываются с точностью 0,02-0,03 мл.
Каким требованиям удовлетворяют стандартные вещества?
1. Стандартное вещество должно иметь кристаллическую структуру и отвечать определенной химической формуле.
2. Химический состав вещества должен отвечать формуле.
3. Стандартное вещество не должно содержать посторонних примесей больше, чем допустимые границы для веществ квалификации “х.ч.”.
4. Способы очистки стандартного вещества от сопутствующих примесей (кристаллизация, экстракция, возгонка и т.д.) должны быть доступными в аналитической лаборатории.
5. Стандартное вещество не должна быть гигроскопическим, но должно сравнительно хорошо растворяться.
6. Растворы стандартного вещества не должны изменять своего титра при хранении и контакте с воздухом.
7. Стандартное вещество должно иметь по возможности большую эквивалентную массу. Чем большая эквивалентная масса вещества, тем большая точность установления титра раствора, так как при взвешивании вещества с большой молекулярной массой погрешность взвешивания окажется незначительной.
Какие растворы называются рабочими?
Рабочим раствором называется раствор, с помощью которого проводится титриметрическое определение, т. е. это раствор, которым титруют.
Применяемые в титриметрическом анализе рабочие растворы точно известной концентрации готовят несколькими способами:
· из фиксаналов. Этим термином называют запаянную стеклянную ампулу, в которой содержится определенное количество реагента, обычно 0,1000 моль эквивалента. Фиксаналы готовят в заводских условиях. Если в лаборатории количественно перенести содержимое фиксанала в мерную колбу на 1000 мл и довести растворителем до метки, получится литр точно 0,1000 н раствора. Приготовление фиксанальных растворов не только экономит время аналитика, но и позволяет готовить растворы с точно известной концентрацией из таких веществ, которые не обладают комплексом свойств, необходимых для первичных стандартов (например, фиксанальные растворы соляной кислоты, аммиака или иода).
· по приблизительно известной навеске химического реактива, взятой на технических весах. Эту навеску растворяют в приблизительно известном количестве растворителя. Затем проводят дополнительную операцию – стандартизацию полученного раствора. Например, титруют полученным раствором точную навеску другого вещества (первичного стандарта). Можно поступить и по-другому: взять известный объем (аликвоту) приготовленного раствора и оттитровать его подходящим стандартным раствором. По объему, пошедшему на титрование, рассчитывают точную концентрацию приготовленного раствора. Такие растворы называют стандартизованными. Например, раствор КОН стандартизуют по навеске щавелевой кислоты или с помощью фиксанального раствора соляной кислоты. Если вещество в лаборатории имеется в виде концентрированного раствора приблизительно известной концентрации (например, соляная кислота), то вместо его взвешивания отмеривают некоторый, заранее рассчитанный объем концентрированного раствора. Это требует знания плотности исходного раствора. Затем, как и в предыдущем случае, стандартизуют полученный раствор.
Приготовление растворов с точно известной концентрацией требует использования целого набора специальной мерной посуды, позволяющей измерять объемы с требуемой точностью. Это мерные колбы, пипетки и бюретки. В руководствах к лабораторным работам приводятся описания мерной посуды и правила работы с ней.
ТИТРИМЕТРИЧЕСКИЕ (ОБЪЕМНЫЕ) МЕТОДЫ АНАЛИЗА, точное измерение объемов веществ
ТИТРИМЕТРИЧЕСКИЕ (ОБЪЕМНЫЕ) МЕТОДЫ АНАЛИЗА, точное измерение объемов веществТЕМА 8
Техника выполнения титриметрического анализа.
Приготовление раствора по точной навеске вещества. Молярные растворы.
Затем на аналитических весах взвешивают три навески (равные вычисленной массе) с точностью до 0,0001 г. Эти навески переносят в чистые колбы и растворяют в дистиллированной воде (по 0,25 мл) или в отдельных случаях в кислоте. После полного растворения навески растворы титруют раствором титранта, титр которого необходимо установить.
Расчет титра раствора титранта (Тт) проводят по формуле
В 3-х опытах титр рассчитывают для каждой навески отдельно и по найденным значениям определяют его среднее значение и по полученной величине находят среднее значение нормальности Nпр и коэффициента нормальности К титранта по формулам
Нормальность рассчитывают по формуле
График зависимости рН раствора от количества прибавленного титранта наз-ся кривой титрования. Кривые титрования дают возможность проследить изменение рН раствора в различные моменты титрования, изучить влияние температуры и концентрации реагирующих веществ на процесс нейтрализации, установить конец титрования и помогают сделать правильный выбор индикатора.
Построение кривой титрования сводится к вычислению рН и концентрации титруемого вещества, соли и избыточного титранта в точках, когда к 100 мл титруемого раствора прибавлено 0; 10; 50; 90; 99; 100; 101; 110; 150; 190; 200 мл титранта.
Вычисления концентрации компонентов производят по формулам:
В нулевой точке концентрация титруемого раствора задается условиями задачи. рН рассчитывается по формулам: для сильных кислот:
т.е. рН равняется отрицательному десятичному логарифму концентрации к-ты; для сильных гидроксидов
смесь растворов слабого гидроксида и его соли (щелочной буферный
Элементы титриметрического анализа. Основные понятия термины и формулы.
Если известны нормальности 2-х растворов и их объемы, при которых достигается точка эквивалентности, то можно вычислить количества эквивалента кислоты и щелочи:
где V (Н2SО4) и V(NаОН) выражены в миллилитрах.
Таким образом, при подстановке правых частей 2-х последних уравнений в предыдущее равенство получим очень важное для титриметрического анализа выражение принципа эквивалентности:
В общем виде для любых случаев титрования это соотношение имеет следующее выражение:
Из этого соотношения следует:
Если известен объем анализируемого раствора, то по последнему уравнению можно рассчитать его нормальность:
Вычислив по результатам титрования нормальность анализируемого раствора из вышеприведенных уравнений можно определить массу вещества в любом объеме раствора.
При рассмотрении большинства химических реакций удобно пользоваться понятиями эквивалента и фактора эквивалентности.
К реакциям, протекающим в стехиометрических отношениях, применим закон эквивалентов. Поэтому, если реакция проведена до конца, число эквивалентов определяемого компонента равно числу эквивалентов реагента. Т. е. моль эквивалента любой кислоты способен нейтрализовать моль эквивалента любого основания. Таким образом, и при титровании, поскольку его заканчивают в точке эквивалентности, всегда затрачиваются одинаковые количества эквивалента титруемого и титрующего веществ. Например, в точке эквивалентности титрования раствора Н2SО4 раствором щелочи (Н2SО4 +2NаОН =Nа2SО4 +2Н2О) количества эквивалентов Н2SО4 и NаОН равны между собой: n(1/2Н2SО4=n(NаОН).
Методы титриметрического анализа.
Следовательно, на реакцию израсходовали
По уравнению реакции нетрудно вычислить какой массе NаОН, находящегося в растворе, соответствует эта масса кислоты:
Преимущество титриметрического анализа перед гравиметрическим состоит в скорости, т. е. быстроте определения. В гравиметрическом анализе осаждение (выполнение реакции) для получения осаждаемой формы является лишь началом определения, в титриметрическом анализе выполнение реакции (титрование) и заканчивает определение. Практически одинакова и точность этих анализов.
Стандартные и стандартизированные растворы.
Титрованные растворы могут быть получены разными способами и поэтому различают стандартные (приготовленные) и стандартизированные (установленные) р-ры. Стандартные р-ры. Точную навеску в-ва переносят в мерную колбу определенной емкости, растворяют и доводят объем р-ра водой до метки. В этом случае титр р-ра равен навеске (m, г), деленной на объем р-ра (V, мл): Т = m/V. Чтобы перейти к молярной концентрации эквивалента (с), достаточно титр рас-ра умножить на 1000 и разделить на молярную массу эквивалента растворенного в-ва. Например, если 0,5312 г карбоната натрия Nа2СО3 растворили в мерной колбе вместимостью 100 мл, то титр раствора равен Т=0,5312/100=0,005312 г/мл, а молярная концентрация эквивалента с=0,005312· 1000/53,0=0,1002. Титрованные растворы, полученные по точной навеске вещества, называют стандартными (приготовленными).
Подобным способом могут быть приготовлены р-ры, отвечающие определенным требованиям: они должны быть хч; устойчивыми при хранении как в твердом виде, так и в растворе; состав их должен строго соответствовать определенной химической формуле. Такие р-ры называют первичными стандартами для установления титра других рабочих растворов. Примеры, для установки титра кислот служат тетраборат натрия Nа2В4О7· 10Н2О и карбонат натрия Nа2СО3. Титры (или нормальные концентрации) растворов оснований устанавливают по таким исходным стандартным веществам, как щавелевая Н2С2О42Н2О или янтарная Н2С4Н4О4. Таким образом, теперь следует объяснить, что такое стандартизированные растворы. Как можнопонять из вышесказанного к ним относятся вещества, не обладающие вышеперечисленными свойствами стандартных растворов. Это минеральные кислоты, щелочи, перманганат калия, тиосульфат натрия. Точные их растворы не возможно приготовить по навеске, т. к. продажные минеральные к-ты имеют непостоянный состав, а выделить их в чистом виде невозможно. А щелочи NаОН и КОН даже при взвешивании поглощают С (1V) и воду из воздуха, т. е. изменяют свой состав Перманганат калия и тиосульфат изменяются при растворении, взаимодействуя с примесями воды.
Рассказать, как готовят раствор из фиксанала (боек, воронка, промывалка). Титрованные растворы обычно хранятся несколько месяцев, если нет специальных указаний, особенно требовательны в этом отношении едкие щелочи, при хранении их необходимо предохранять от контакта с воздухом, их хранят в полиэтиленовой плотно закрытой посуде. Для титрования стандартными растворами есть специальные столы и титровальные установки, которые используются при серийных анализах. При этом стандартные или установочные растворы не контактируют с воздухом и с помощью специальных сифонов раствор поступает в бюретку, есть специальные автоматические бюретки. При пользовании мерной посудой существуют определенные правила пользования и мойки. Для бюреток: каждое титрование начинают с конечного деления шкалы, т. к. при этом лучше всего компенсируются погрешности калибрования бюретки.
Выпускают раствор из бюретки не очень быстро (не более 3-4 капель в секунду). Иначе раствор не будет вовремя стекать со стенок и отсчет окажется неверным. Объем расходуемого на тирование р-ра не должен превышать вместимость одной бюретки и не превышать 20 мл для 25 мл бюретки и 30 мл для бюретки на 50 мл. Ошибка на +- 0,02 мл составит 0,02·100 / 10мл = 0,2%. После окончания работы сливают раствор из бюретки, моют, наполняют дистиллированной водой и накрывают пробиркой для предохранения от пыли. Правила заполнения раствором бюретки и удаление пузырьков воздуха. Пипетки. Не следует выдувать или вытряхивать последние капли жидкости из пипетки, моют пипетки обычным способом, перед употреблением ополаскивают рабочим раствором, с которым будут работать. Проверка мерной посуды взвешиванием и бюреток по 5 мл р-ра и с учетом плотности воды и поправки на температуру. Вычисления в титриметрическом анализе.
Главный принцип: вещества реагируют друг с другом всегда в эквивалентных количествах. Так на титрование до точки эквивалентности всегда расходуется одинаковое число эквивалентных масс кислоты и основания. Следовательно при одинаковой нормальной концентрации растворов реагирующих веществ реакции идут между их равными объемами. Например, на титрование 10 мл 0,1н. р-ра всякой кислоты расходуется такой же объем 0,1 н. р-ра любой щелочи. В этом также удобство использования нормальных растворов.
Для расчета используют уравнение с1V1=с2V2. Задача: в мерную колбу внесли 0,6504 г продажной щавелевой к-ты. Растворили и довели объем до метки 100 мл. Пипеткой брали по 10 мл полученного р-ра и титровали 0,1026 н. р-ром гидроксида натрия, расход которого составил в среднем 9,85 мл. Определить массовую долю (%) щавелевой к-ты в продажном препарате. Вычисляем нормальную концентрацию раствора щавелевой к-ты: с(Н2С2О42Н2О) 10,00= 0,1026. 9,85; с =0,1026. 9,85/10,00 =0,1011. Затем находим массу щавелевой к-ты в 0,1 л р-ра. При этом исходить следует из того, что щавелевая к-та превращается в щавелевокислый натрий, следовательно, молярная масса эквивалента ее равна ½ молярной массы, т.е.126,6: 2=63,03 г/моль.
Поэтому m=0,1011. 63,03.0,1=0,6372 г. Следовательно, массовая доля (%) щавелевой к-ты равна: ω (Н2С2О42Н2О)= m (Н2С2О42Н2О)/ m(навески)= 0,6372/0,6504=0,9797, или 97,97%. В случае использования метода отдельных навесок уравнение с1V1=с2V2 не может быть использовано, т. к. навеску растворяют в произвольном объеме воды. Вычисляют результат, исходя из того, что при титровании в-ва взаимодействуют эквивалентными количествами. Какова массовая доля (%) Н2С2О42Н2О в образце щавелевой к-ты, если на титрование 0,1500 г его пошло 25,60 мл 0,09002 н. р-ра NаОН? Вычисляют, сколько молярных масс эквивалента NаОН содержалось в 25,60 мл раствора и участвовало в реакции: 1000 мл р-ра NаОН содержит 0,09002 молярных масс эквивалента NаОН, а 25,60 мл NаОН содержат х молярных масс NаОН, Х = 25,60. 0,09002 / 1000 = 0,002305 молярных масс эквивалента NаОН. Но при титровании 1 эквивалент в-ва взаимодействует с 1 эквивалентом другого. Т. е. Это означает, что в реакции участвовало также 0,002305 молярных масс эквивалента Н2С2О42Н2О. Молярная масса эквивалента щавелевой к-ты равна 63,03 г/моль. Следовательно, анализируемый раствор содержит 0,002305. 63,03 = 0,1453 г Н2С2О42Н2О. В массовых долях (%) это составляет: ω (Н2С2О42Н2О) = m (Н2С2О42Н2О)/m (образца) = 1,1435 г / 0,1500 г = 0,9686 (96,86%). Во многих случаях для уточнения результатов анализа (из-за неточности навесок при приготовлении растворов или исследуемого вещества) вводят понятие поправочного коэффициента.
Следовательно, для расчетов следующие основные правила:
Массу навески в-ва можно вычислить по формуле:
Чем измеряют объем рабочего раствора
Помимо обычной химической посуды, в объемном анализе широко применяют мерную посуду, которая служит для точного измерения объемов растворов.
Мерные колбы (рис. 13) представляют собой круглые плоскодонные стеклянные сосуды с длинной узкой шейкой (горлом) с кольцевой меткой.
Мерные колбы служат для измерения объемов растворов, приготовления растворов определенной концентрации. Объем жидкости, вмещаемой колбой, выражают в миллилитрах. На колбе указывают ее емкость и температуру (обычно 20° С), при которой эта емкость измерена.
Мерные колбы бывают различной емкости: от 25 до 
Пипетки (рис. 14) представляют собой длинные узкие стеклянные трубки, расширенные в средней части; один конец трубки оттянут; трубка снабжена кольцевой меткой. Некоторые пипетки имеют цилиндрическую форму. Пипетки служат для отмеривания небольших объемов растворов и перенесения определенного объема раствора из одного сосуда в другой. Объем жидкости, вмещаемой пипеткой, выражают в миллилитрах. На расширенной части пипетки указывают ее емкость и температуру (обычно 20° С), при которой эта емкость измерена.
Пипетки бывают различной емкости: от 1 до 
Измерительные пипетки небольшой емкости не имеют расширения и градуированы на 
Бюретки (рис. 15) представляют собой узкие, градуированное по длине цилиндрические стеклянные трубки. Один конец бюретки сужен и снабжен стеклянным краном или резиновой трубкой, соединенной с капилляром, через который из бюретки выливается раствор. Резиновая трубка зажимается снаружи металлическим зажимом или закрывается изнутри стеклянным шариком (рис. 16). При надавливании на зажим указательным и большим пальцами или при оттягивании резиновой трубки в том месте, где помещается шарик, из бюретки выливается жидкость.
Обычно бюретки градуируют на миллилитры и доли миллилитра. Для отсчета объемов растворов, расходуемых на титрование, на бюретке нанесены деления и цифры. Нулевое деление помещено в верхней части бюретки.
В макрометоде применяют бюретки емкостью 
Такие бюретки градуируют с точностью до 
Рис. 13. Мерные колбы.
Это дает возможность проводить отсчет с точностью до сотых долей миллилитра; объемы бесцветных растворов отсчитывают по нижней части мениска (рис. 18), окрашенных — по верхней части (рис. 19). Для облегчения отсчета сотых долей миллилитра применяют лупу. В лабораторный журнал результаты отсчета записывают с двумя десятичными знаками (например, 23,05, а не 23,1 или 23).
Для большей точности отсчета иногда противоположная от наблюдателя стенка бюретки снабжается продольной узкой цветной полосой, нанесенной на молочно-белом стекле. В том месте, где устанавливается мениск, наблюдается разрыв цветной полосы кажущийся экспериментатору двумя сходящимися в одной точке углами (рис. 20). По месту схождения углов отсчитывают объем вылитого из бюретки титрованного раствора.
Рис. 16. Зажимы для бюреток.
Рис. 17. Отсчеты по бюретке при различных положениях глаза.
Бюретки, применяемые в микрометоде (рис. 21), градуированы на 
Рис. 18. Отсчеты по бюретке при помощи белого экрана с черной полосой. В бюретку налит прозрачный раствор. Отсчет 
Рис. 19. Отсчет по бюретке уровня непрозрачного раствора. Источник света находится сзади наблюдателя. Отсчет 
Бюретки заполняют титрованными растворами с помощью воронок. Существуют бюретки с автоматически устанавливаемым уровнем; такие бюретки заполняют при помощи специальных приспособлений (рис. 22).
Рис. 20. Отсчет по бюретке, снабженной цветной полосой. Отсчет 
Принцип действия автоматической полумикробюретки (рис. 22, в). Прежде всего устанавливают кран бюретки 8 в положение 1. Затем, открыв пришлифованную стеклянную пробку 1, через сухую стеклянную воронку наливают в баллон 2 стандартный (титрованный) раствор. Заполнив баллон 2 титрантом, закрывают сосуд пробкой 1 и поворачивают кран 8 в положение 11. При этом жидкость под давлением собственной тяжести поступает по трубке 7 в бюретку 6. Избыток титранта через капилляр 10 переливается в промежуточную емкость 5 и через капилляр 11 по трубке 3 автоматически сбрасывается в баллон 2.
Рис. 21. Микробюретка.
Благодаря такому устройству происходит автоматическая установка уровня стандартного раствора на нулевой отметке.
Заполнив бюретку 6 стандартным раствором, кран 8 переводят в положение 

Рис. 22. Бюретки: а, б — с автоматически устанавливаемым уровнем; в — автоматическая полумикробюретка: 


Бюретки применяют для измерения объемов стандартных растворов, расходуемых на титрование определяемых компонентов. Поэтому чем тщательней проводят эти измерения, тем точнее результаты объемного анализа. Следует помнить, что измерение объемов титрованных растворов неточными измерительными приборами (бюретками) — ошибка систематическая — или допущение небрежного отсчета показаний бюреток — ошибка случайная — являются причинами неправильных результатов объемного анализа.