Чем лечат папилломавирус человека лекарства
Лечение папиллом. Вопросы и ответы
Принято считать, что около 93% населения земного шара являются носителями вируса папилломы человека. Однако лишь у небольшой части людей заболевание проявляется появлением папиллом. Сегодня мы поговорим о том, как можно лечить папилломы и что можно сделать если они появились вновь после удаления.
Как на самом деле они выглядят?
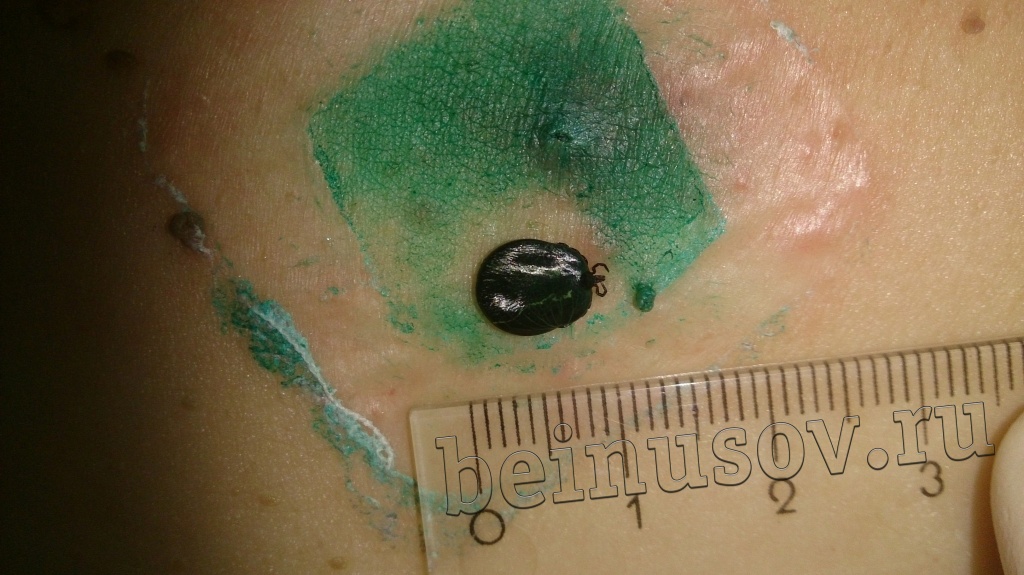
Очень часто пациенты, которые приходят ко мне на приём, просят удалить им папиллому или несколько и указывают на пигментный невус, фибропапиллому или бородавку. Один раз в качестве папилломы для удаления мне предложили клеща (не шучу):
Как избавиться от папиллом?
Существует всего два основных метода лечения папиллом
Если папилломы появились вновь после удаления?
Как проходит удаление папиллом?
В нашей клинике удаление папиллом производится методом радиоволновой хирургии.
Просто посмотрите это короткое видео и многие вопросы отпадут сами собой.
Коротко о главном:
Решили расстаться с Вашими папилломами? Это можно сделать по адресам в Санкт-Петербурге (Асафьева 7/1)
Другие статьи:
Полезная статья? Сделайте репост в Вашей социальной сети!
Оставьте комментарий или задайте вопрос
Записывайтесь на вебинар «Канцерогены в косметике: правда, ложь и. маркетинг»
Что такое папилломавирусная инфекция (ВПЧ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Борисова Э. В., гинеколога со стажем в 34 года.
Определение болезни. Причины заболевания
Папилломавирусная инфекция — это состояние, развивающееся при заражении какой-либо разновидностью вируса папилломы человека (ВПЧ). Возбудители данной группы могут существовать только в человеческом организме, поражая кожу и слизистые оболочки, приводя к появлению папиллом, бородавок, плоских и остроконечных кондилом. [1] [2] [4]
ВПЧ довольно широко распространён в человеческой популяции, особенно среди сексуально активных людей, а это свыше 80% всего населения. До недавнего времени вирусы этой группы считались относительно безобидными, вызывающими лишь косметические дефекты, но последние научные исследования показывают, что проблема гораздо серьёзнее. [9]
Чаще всего заражение происходит в молодом возрасте, как правило, с началом половой жизни, при этом возможно неоднократное инфицирование. Наиболее уязвимой группой в плане вероятности заражения ВПЧ и развития неблагоприятных последствий являются молодые женщины в возрасте 15-30 лет.
Помимо этого ВПЧ может перейти от инфицированной матери к ребёнку, например, при родах. Не исключается и контактно-бытовой способ передачи возбудителя, например, при соприкосновениях и даже при совместном использовании предметов личной гигиены.
К факторам риска, способствующим заражению ВПЧ, развитию хронической папилломавирусной инфекции и её переходу в предраковые состояния с потенциальным перерождением в злокачественную опухоль, относятся:
Симптомы папилломавирусной инфекции
Далеко не всегда человек догадывается о наличии в своём организме папилломавирусной инфекции, оставаясь при этом источником заражения для потенциальных партнёров. [1] [2] Дело в том, что заболевание может долгое время протекать бессимптомно: вирус скрыто существует в организме от нескольких месяцев до нескольких лет, никак себя не проявляя. Кроме того, уже имеющиеся проявления инфекции не всегда доступны для наружного обзора. Например, если папилломы, бородавки и кондиломы на открытых участках тела и поверхности гениталий ещё можно заметить самостоятельно, то патологические изменения, локализующиеся на шейке матки, сможет обнаружить только специалист в ходе осмотра с применением соответствующих инструментов.
И всё же существует несколько симптомов, которые прямо или косвенно могут указывать на наличие папилломавирусной инфекции и её неблагоприятных последствий. [3] К ним относятся:
Наиболее тревожными признаками заболевания являются:
Патогенез папилломавирусной инфекции
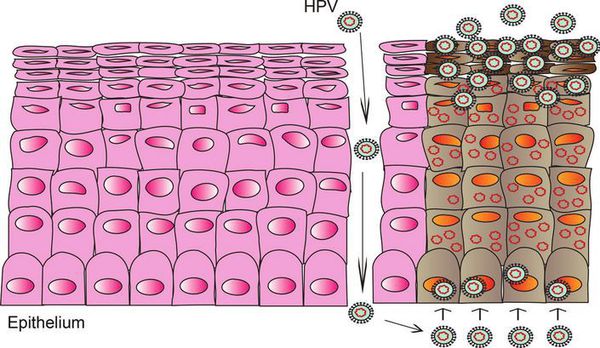
Заражение папилломавирусной инфекцией происходит при попадании вирусных частиц на кожу или слизистую оболочку. [1] [2] Излюбленная локализация инфекции на теле женщины — промежность, большие и малые половые губы, вульва, влагалище и шейка матки, у мужчин — половой член. Может также произойти поражение слизистой полости рта, пищевода, мочевого пузыря, трахеи, конъюнктивы и других органов и тканей.
Заражению способствуют микротравмы и потёртости. Особенно благоприятные для инфицирования условия создаются при половом акте. В 60–80% случаев достаточно однократного сексуального контакта с больным папилломавирусной инфекцией или бессимптомным носителем ВПЧ. К развитию заболевания может привести попадание в организм буквально единичных вирусных частиц.
При наличии предрасполагающих факторов (микроповреждения, слабого иммунитета и других) возбудитель проникает в эпителиальную ткань до её базального слоя. Там он прикрепляется к оболочке незрелой клетки и внедряется сначала в её цитоплазму, а затем и в ядро, где повреждает генетический аппарат. После этого начинается деление клеток с изменённым геномом, что приводит к появлению в месте внедрения вируса генитальных кондилом (образований, которые постепенно разрастаются), а, например, на шейке матки — к развитию диспластических процессов различной степени тяжести (дисплазия шейки матки).
В случае ВПЧ высокого онкогенного риска определённые гены в вирусной ДНК кодируют синтез специфических белков-онкопротеинов (Е6 и Е7), которые подавляют противораковую защиту клеток. Под действием онкопротеинов нарушается стабильность генома клеток, стимулируется их размножение и снижается способность к дифференцировке — всё это со временем может привести к онкопатологии. [12]
Формирование новых полноценных вирусных частиц, способных инфицировать другого человека, происходит уже не в базальном, а в самых поверхностных слоях поражённого эпителия. Возбудитель может содержаться в слущивающихся отмирающих клетках, которые отделаются слизистой оболочкой. Таким образом они переходят к новому хозяину при тесном (сексуальном или бытовом) контакте.
Классификация и стадии развития папилломавирусной инфекции
По способности индуцировать развитие злокачественных новообразований ВПЧ подразделяют на четыре группы: [8]
Максимально опасными считаются 16-й и 18-й типы: на их долю приходится до 70% случаев рака шейки матки. [7] [8]
Клинические формы папилломавирусной инфекции: [5]
Латентная инфекция может переходить в субклиническую и манифестную форму в случае возникновения предрасполагающих условий (факторов риска), но чаще всего она протекает бессимптомно, не манифестируя.
Клинические проявления папилломавирусной инфекции:
Разновидности поражений:
Осложнения папилломавирусной инфекции
Основными наиболее опасными осложнениями папилломавирусной инфекции являются злокачественные новообразования. Но возможны и другие серьёзные последствия:
Диагностика папилломавирусной инфекции
Основные цели диагностических мероприятий: [3]
Для выявления папилломавирусной инфекции на сегодняшний день существует целый комплекс диагностических процедур:
Целесообразно дополнительное обследование пациента на наличие других инфекций, передающихся половым путём, так как папилломавирус в 90% случаев с ними сочетается, и это может осложнять течение заболевания.
Лечение папилломавирусной инфекции
Лечение папилломавирусной инфекции должно быть комплексным и включать следующие составляющие: [3] [5]
Деструктивные методы делятся на две основные группы:
Лечение сопутствующих половых инфекций проводят до начала деструктивной терапии на фоне адекватной иммунокоррекции.
Удаление видимых проявлений папилломавирусной инфекции должно сочетаться с противовирусной терапией — как с общей, так и с применением препаратов местного действия после удаления кондилом.
Следует помнить, что успешно проведённое лечение не исключает развитие рецидивов в дальнейшем, особенно у пациентов с нарушениями иммунитета. Поэтому за ними устанавливается динамическое наблюдение в течение как минимум 1-2 лет.
Прогноз. Профилактика
В 90% случаев здоровая иммунная система человека справляется с папилломавирусной инфекцией самостоятельно за период от полугода до двух лет с момента инфицирования, после чего происходит полное выздоровление с исчезновением вируса из организма. При этом не формируется напряжённого пожизненного иммунитета, то есть человек может заразиться повторно.
В других случаях, при наличии предрасполагающих факторов, заболевание приобретает хроническую форму, склонную к длительному скрытому течению с периодическими рецидивами и возможным развитием тяжёлых осложнений.
От момента попадания вируса в организм до развития предраковых состояний и тем более возникновения рака может пройти достаточно много времени, иногда десятки лет. Поэтому регулярные профилактические обследования, своевременное выявление и лечение предраковых состояний — вполне реальный и эффективный способ избежать самого неблагоприятного варианта развития событий. [13] С этой целью Всемирная организация здравоохранения рекомендует всем женщинам старше 30 лет при первичном скрининге проходить не только “рутинное” цитологическое исследование, но и делать тест на наличие ВПЧ. [10]
Регулярное посещение гинеколога (при отсутствии каких-либо жалоб — раз в год) с проведением теста Папаниколау позволяет своевременно обнаружить начальные признаки дисплазии и предпринять все необходимые меры для предотвращения прогрессирования процесса и его перехода в онкологическое заболевание.
Использование методов барьерной контрацепции хоть и не полностью защищает от инфицирования, но несколько снижает его вероятность.
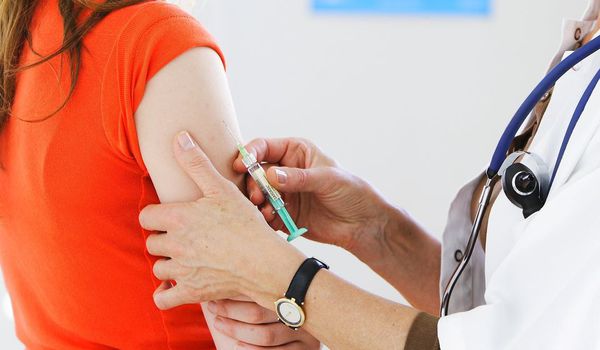
Главным методом первичной профилактики папилломавирусной инфекции считается вакцинация. [11] Современные вакцины разработаны с целью защиты от наиболее опасных, высокоонкогенных штаммов ВПЧ, ответственных за 70-80% случаев развития рака шейки матки. Стандартный курс, состоящий из трёх прививок, даёт вполне надёжную защиту.
Целесообразно вакцинировать детей (девочек, а для сдерживания распространения инфекции и мальчиков) с 9-10 до 17 лет, а также молодых женщин (18-25 лет) до вступления в половую жизнь, так как вакцина предотвращает заражение, но не является средством лечения уже развившейся инфекции. Если пациентка уже живёт половой жизнью, то перед вакцинацией ей необходимо пройти исследование на наличие папилломавирусной инфекции. Однако даже при выявлении одного из штаммов, входящих в состав вакцины, проводить вакцинирование всё равно можно, так как это не является противопоказанием.
Современные подходы к лечению папилломавирусной инфекции урогенитального тракта
В последние годы в России, как и во многих странах мира, увеличивается заболеваемость папилломавирусной инфекцией. Проблема ее диагностики и лечения привлекает внимание врачей различных специальностей: дерматологов, гинекологов, урологов, онкологов, пато
В последние годы в России, как и во многих странах мира, увеличивается заболеваемость папилломавирусной инфекцией. Проблема ее диагностики и лечения привлекает внимание врачей различных специальностей: дерматологов, гинекологов, урологов, онкологов, патоморфологов, иммунологов, вирусологов. Это объясняется высокой контагиозностью и тенденцией к росту частоты данного заболевания, а также способностью некоторых разновидностей вируса папилломы человека (ВПЧ) инициировать злокачественные процессы. Последнее большей частью касается генитальных проявлений папилломавирусной инфекции.
Папилломавирус человека (ПВЧ) является эпителиотропным и обнаруживается в кожном покрове, слизистой оболочке рта, конъюнктиве, пищеводе, бронхах, прямой кишке.
В литературе имеются сведения о том, что внедрение ПВЧ-инфекции происходит на уровне незрелых клеток эпителия кожи и слизистых оболочек (базальный слой). Результатом этого внедрения является пролиферация клеток, но без продукции вирусных частиц, поскольку пролиферирующие клетки эпителия не способны поддерживать жизненный цикл вирусов. Полная репликация ПВЧ происходит только в высокоспециализированных клетках многослойного плоского эпителия: зернистых, шиповатых клетах кожи, поверхностных эпителиоцитах слизистой шейки матки. В настоящее время описано порядка 100 типов папилломавирусов. Следует отметить их ткане- и видоспецифичность. Различные типы ПВЧ связаны с различными видами поражений. Установлено, что с урогенитальной областью ассоциированы определенные типы ПВЧ. Выделяются разновидности:
Структура вирусного генома
Вирусы папиллом относятся к семейству паповавирусов (Papovaviridae), поражающих крупный рогатый скот, птиц, а также человека и способных инфицировать базальные клетки кожи и плоского эпителия. Папилломавирусы — эта одна из наиболее гетерогенных групп вирусов, критерием дифференциации которой является степень генетического родства вирусов по данным молекулярной гибридизации: она колеблется от 10 до 85%. Диаметр вирусных частиц составляет 55 нм. Вирус не имеет внешней оболочки. Капсид вируса состоит из 72 капсомеров. Детальный анализ молекулы ДНК ВПЧ стал возможен после разработки методики расщепления ДНК с использованием эндонуклеаз и анализа этих фрагментов с помощью гель-электрофореза.
При изучении препаратов, окрашенных по Папаниколау, определен специфический комплекс признаков, характеризующих ядро и цитоплазму эпителиальных клеток (койлоцитарная атипия клеток), обусловленных цитопатическим действием вирусов папиллом.
Специфической клеткой для этой инфекции является койлоцит, представляющий собой оксифилтноокрашенную клетку эпителия с четкими границами и ясно выраженной перинуклеарной зоной просветления и многочисленными вакуолями в цитоплазме.
Термин «койлоцитарная дисплазия» введен H. S. Stegner в 1981 г. Предполагается, что эти изменения являются следствием репродукции вируса, вызывающего нарушение метаболизма клеток, приводящие к их частичному некрозу с образованием баллоноподобных клеток.
Цитологическое исследование очагов, вызванных ПВЧ-инфекцией, показало, что в клеточном материале находятся большей частью безъядерные, или ортокератотические, клетки. Около 20% чешуек содержат ядра — т. наз. «паракератотические клетки».
Следует помнить, что для выявления ПВЧ одной морфологии недостаточно. В этой связи целесообразно использовать метод полимеразной цепной реакции (ПЦР), гибридизацию in situ. В литературе все чаще появляются сообщения об определении ПВЧ-инфекции в моче с помощью ПЦР как альтернативном методе тестирования образцов из шейки матки. Наряду с этим используется гнездовая ПЦР в одной пробирке и типоспецифическая гибридизация нуклеотидов.
Метод ПЦР используется при малосимптомных или асимптомных формах заболевания, вызванного ПВЧ-инфекцией.
Иммунохимическими методами удается выявить антигены ПВЧ в тканях остроконечных кондилом в 71,4% случаев, методом гибридизации — в 96,5% и с помощью ПЦР — в 10% случаев.
Эффективность ДНК-гибридизации не превышает эффективности гистологического исследования, но позволяет выявить пациентов с высокой степенью этой инфекции.
Клиника ПВЧ-инфекции
Клинические проявления ПВЧ-инфекции гениталий очень вариабельны. В настоящее время они подразделяются на остроконечные кондиломы, папиллярные разновидности кондилом (с выраженным экзофитным ростом), а также плоские и инвертированные (внутриэпителиальные) с эндофитным ростом. Последний вариант, известный также под названием «субклиническая ПВЧ-инфекция», наиболее сложен в диагностическом плане, поскольку отсутствуют четкие микроскопические изменения эпителия. В этом случае для определения четких границ поражения требуются специальные скрининговые приемы.
Своеобразным вариантом остроконечных кондилом является бовеноидный папуллез и гигантская кондилома Бушке — Левенштейна. Остроконечные кондиломы (ОК) представляют собой фиброэпителиальное образование на поверхности кожи и слизистых, с тонкой ножкой или широким основанием в виде единичного узелка или множественных эпителиальных выростов, напоминающих по своему виду петушиные гребни или цветную капусту. Диагностика крупных кондилом затруднений не вызывает. Генитальные кондиломы локализуются в основном в местах мацерации: малые половые губы, влагалище, шейка матки, устье уретры, область ануса, кожные покровы. У мужчин ОК располагаются в области крайней плоти, на головке полового члена, перинатальной области, реже эндоуретально. Инкубационный период колеблется от одного до 12 месяцев (в среднем 3-6 месяцев).
Исследования последних десятилетий свидетельствуют о том, что 85% пациенток с типичным ОК вульвы и промежности имеют дополнительные очаги ПВЧ-инфекции во влагалище или шейке матки, и почти у каждой четвертой из них выявляются ассоциированные ПВЧ-инфекцией заболевания — цервикальные интраэпителиальные неоплазии (ЦВН) различной степени тяжести. Одной из клинических разновидностей заболеваний, вызываемых ПВЧ-инфекцией, являются боуэноидные папулы, связанные с ПЧ 16, иногда пигментированные на коже и слизистых оболочках представителей обоих полов, чаще напоминающие обычные бородавки или себорейный кератоз. В противоположность болезни Боуэна, боуэноидные папулы доброкачественные и спонтанно регрессируют, хотя изредка могут озлокачествляться. Течение бессимптомное.
Некоторые авторы к этой группе заболеваний относят верруциформную эпидермодисплазию Левандовского — Лютца. В основе этого заболевания лежат локальные и генетические нарушения, ассоциирующиеся с хронической ПВЧ-инфекцией.
J. M. Handley и W. J. Dinsmore (1994) на основании литературных данных, а также своих собственных исследований предложили классификацию клинических форм ПВЧ-инфекции и ассоциированных с ней заболеваний (табл.1).
В подавляющем большинстве случаев манифестные формы ПВЧ-инфекции сочетаются с другими заболеваниями, передающимися половым путем. По данным Бернарда К. и Муги К. (1996), манифестные формы ПВЧ-инфекции возникают, как правило, в результате действия ряда факторов:
Наиболее существенным является влияние ассоциированных с ПВЧ-поражениями инфекций урогенитального тракта: урогенитального хламидиоза, микоплазмоза, цитомегаловирусной и герпетической инфекции, дисбиотических состояний. Результатом их влияния на течение ПВЧ-инфекции является хронизация процесса, формирование стойких, как правило уже неспецифических воспалительных изменений со стороны мочеполовой сферы и значительные трудности в проведении терапевтических мероприятий.
Значимость наличия сопутствующей инфекции для лечения кондиломатоза объясняется следующими обстоятельствами.
В течение многих лет обсуждалась возможность существования взаимосвязи между неоплазиями шейки матки с венерическими заболеваниями. В группе женщин, страдающих инвазивным раком шейки матки (РШМ), отмечена более высокая частота выявления неспецифической микрофлоры, включая трихомонадные и гарднереловые инфекции. Примеры такого влияния обсуждались в отношении Treponema pallidum, Neisseria gonorrhoeae, Chlamidia trachomatis, вируса простого герпеса типа 2, цитомегаловируса, вируса папилломы человека. Эпидемиологические исследования убедительно показали, что неоспоримым фактором риска возникновения предраковых изменений и рака шейки матки является генитальная ПВЧ-инфекция.
Принципы лечения ПВЧ-инфекции
Учитывая тот факт, что специфические противовирусные препараты и вакцины, действующие на ПВЧ, пока отсутствуют, принято считать, что полного устранения вируса из организма достичь невозможно. Задача терапии — устранение клинических и субклинических форм ВПЧ-инфекции.
На сегодняшний день в арсенале практикующих врачей имеется множество методов удаления аногенитальных бородавок. Эффективность их варьирует от 30 до 90%, но ни один из методов не является панацеей, так как частота рецидивов достаточно высока при любом способе лечения. Лечение должно быть строго индивидуальным: необходимо подбирать наиболее оптимальное решение в каждом конкретном случае, иногда учитывая пожелания самого пациента. Проблема рецидивов не зависит от выбора терапии. Рецидивы аногенитальных бородавок связаны чаще всего не с реинфекцией от полового партнера, а с реактивацией инфекции. Существуют три пути развития событий при отсутствии лечения:
При этом всегда нужно принимать во внимание возможность персистенции вируса при отсутствии каких-либо клинических проявлений.
Выбирая наиболее оптимальный в каждом конкретном случае метод, необходимо руководствоваться четырьмя основными характеристиками:
Помимо удаления аногенитальных бородавок необходимо решать следующие немаловажные задачи:
1. Выявлять и лечить у больных с аногенитальными бородавками (и их половых партнеров) другие заболевания, передающиеся половым путем (ЗППП).
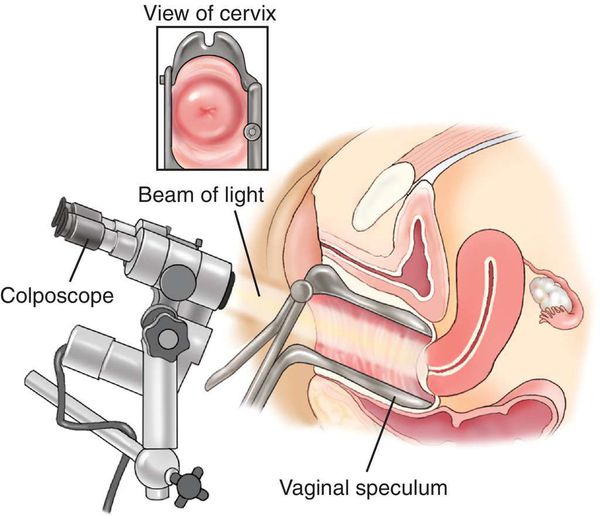
2. Проводить скрининг всех женщин с бородавками аногенитальной области на цервикальную внутриэпителиальную неоплазию (ЦВН) с применением цитологического исследования и кольпоскопии.
3. Поддерживать дальнейшее наблюдение за очагами ЦВН на ранних стадиях для своевременного выявления их прогрессирования или развития микроинвазивной карциномы.
4. Проводить активное лечение аногенитальных бородавок, неоплазий на ранних стадиях, протекающих с развернутой клинической картиной, неоплазий на поздних стадиях и плоскоклеточной карциномы.
5. Давать больным рекомендации по использованию презервативов и ограничению случайных половых контактов для предотвращения инфицирования (и реинфицирования) ВПЧ-инфекцией и другими ЗППП.
По сути, лечение аногенитальных ВПЧ-поражений направлено либо на разрушение папилломатозных очагов тем или иным методом, либо на стимуляцию противовирусного иммунного ответа, возможно сочетание этих подходов.
Деструктивные методы
Физические деструктивные методы
Хирургическое иссечение. В настоящее время применяется нечасто, в основном используется при лечении злокачественных новообразований, когда необходимо широкое иссечение. Данный метод может потребовать госпитализации в связи с тем, что при проведении иссечения может возникнуть достаточно сильное кровотечение, а длительный послеоперационный период потребует специальной терапии.
Электрохирургические методы. К ним относят электрокоагуляцию, электроакустику, фульгацию, электрохирургическое иссечение (электроэксцизия) с использованием электроножа. Не так давно в медицине стали использовать плазму. Нашими учеными был разработан оригинальный плазменный коагулятор (плазмаскин) ЭКХ-1, не имеющий зарубежных аналогов. Измерения температуры в плазме показали, что она может достигать 2000-2500°С. Такие высокие значения температуры, в свою очередь, обеспечивают возможность работать в бесконтактном режиме, существенно снижается время операции и тем самым уменьшается зона некроза. Кроме того, при таком воздействии в большинстве случаев не превышается болевой порог. Данный температурный режим обеспечивает практически полное сжигание новообразований.
Достоинства данного метода:
Лазерное иссечение. Достаточно эффективным и безопасным методом является иссечение бородавок с помощью лазера. В практике применяют неодимовый и СО-лазеры. При использовании СО-лазера меньше повреждаются окружающие ткани, а неодимовый лазер дает лучший гемостатический эффект. Помимо того что лазер физически удаляет поражения, исследования показали, что лазерное излучение оказывает на ВПЧ токсическое действие. Для выполнения процедур требуется хорошо обученный персонал. При использовании лазеров необходимо обезболивание — чаще достаточно местной или локальной анестезии, что позволяет проводить процедуры в амбулаторных условиях. Лазерное иссечение и хирургические методы примерно одинаково эффективны. Лазеротерапию можно успешно применять для лечения распространенных, устойчивых к другой терапии кондилом. Она позволяет прекратить рецидивирование примерно у 40% больных. Исследования показали, что столь малоэффективный результат связан с тем, что СО-лазер неэффективен, когда речь идет об устранении генома из поражений, устойчивых к лечению (по данным метода ПЦР, молекулярно-биологическое излечение наступает у 26% больных).
Использование СО-лазера представляет собой метод выбора при лечении ЦВН. Применяют лазерную конизацию шейки матки. Рецидивы наблюдаются у 2% больных. Мягким методом лазеротерапии является вапоризация, не вызывающая практически никаких осложнений. Лазерная вапоризация успешно применяется при лечении ЦВН низкой степени. Рецидивы наблюдаются у 4% больных.
Лазеротерапия успешно используется для лечения остроконечных кандилом у беременных. Имеются сообщения о лечении беременных на 28–35-й неделе беременности. У большинства пациенток излечение наступало после первого сеанса. Каких-либо осложнений в родах или у новорожденных не выявлено.
Из побочных эффектов следует отметить изъязвление, кровотечение, вторичное инфицирование, рубцевание. Как и при использовании электрохирургических методов, происходит выделение ДНК ВПЧ с дымом, что также требует мер предосторожности.
Лазеротерапия не используется достаточно широко в связи с высокой стоимостью оборудования и необходимостью подготовки опытного персонала.
Криотерапия. Достаточно эффективный и безопасный метод, предполагающий использование в качестве хладагента жидкого азота, оксида азота и диоксида углерода. При этом происходит быстрое замораживание как внутри-, так и внеклеточной жидкости, приводящее к лизису и гибели клеток при оттаивании. Проведение криотерапии обычно не требует обезболивания, хотя при необходимости можно использовать местные анестетики. Криотерапию можно применять при лечении не очень больших бородавок различной локализации. Если же бородавки множественные, то удаление должно проводиться в несколько этапов. Для данного метода характерны следующие побочные явления: развитие местного покраснения, припухлости с последующим образованием пузырей и их изъязвлением. Для уменьшения повреждения окружающих тканей перед процедурой поверхность бородавок обрабатывают KY-гелем, который при замораживании дает возможность осторожно приподнять и отделить очаг поражения от подлежащего эпителия.
Метод может быть использован в гинекологической практике.
Чрезвычайно перспективным нам представляется сочетанное применение криодеструкции и плазменной коагуляции, позволяющее избежать недостатков, присущих вышеописанным методам в отдельности.
Химические деструктивные методы. Данная группа средств включает в себя растворы кислот, щелочей, солей. Среди них можно упомянуть ферезол, пероксид водорода, растворы акрихина и хингамина, препараты ртути и мышьяка, висмута, препараты на основе салициловой и молочной кислот, уксусную и азотную кислоты, соки туи и чистотела. Все эти средства легко доступны, однако обладают невысокой, плохо прогнозируемой эффективностью, дают многочисленные побочные эффекты.
Изопринозин следует применять в сочетании с местнодеструктивными методами лечения.
Эффективность комбинированного лечения ИП, по литературным данным, составляет от 38 до 96%.
Комбинированные методы лечения. Для лечения проявлений ПВЧ-инфекции предлагаются различные методики, основанные на использовании иммунных препаратов в сочетании с лазерным, электрохирургическим и криодеструктивным воздействием.
Сочетанное применение вышеуказанных методов позволяет уменьшить число рецидивов и тем самым повысить эффективность лечения.
Получены хорошие результаты при использовании комбинированного метода лечения кондилом, включающего разрушение очагов с помощью криодеструкции (температура воздействия от –160 до –180°С, экспозиция 40–120 с, двукратно) в сочетании со стимуляцией иммунитета. Для стимуляции местного иммунитета область поражения обрабатывали эмульсией, содержащей интерферон (ИФ), а для стимуляции иммунной системы всего организма назначали препарат кемантан по 0,2 г три раза в день внутрь в течение 10 дней.
Возможно сочетание различных деструктивных методов. При наличии проявлений ПВЧ-инфекции на коже и слизистых оболочках предварительно производят криораспыление в течение 10–30 с, позволяющее четко выявить границы поражения за счет характерной сосочковой поверхности поражений, которая при этом белеет. Затем область поражения подвергается воздействию плазмы (с помощью аппарата плазмаскин).
Ряд исследователей лучшим способом лечения аногенитальных бородавок признают хирургическое удаление всех видимых поражений с последующим местным введением ИФ. В некоторых случаях целесообразно общее и местное применение ИФ перед хирургическим иссечением обширных кондилом.
Терапевтический эффект от применения ИФ отсутствует, если заболевание длится более одного года, а также при иммунодефиците.
В настоящее время существует не так много средств, которые можно использовать после применения деструктивных методов. В частности, сейчас появился препарат импран для местного применения в области очагов поражения после деструктивного воздействия.
Специфическая противовирусная терапия
В настоящее время не существует препаратов, оказывающих специфическое действие на ВПЧ. Известные средства, подавляющие репликацию вируса простого герпеса (ацикловир, ганцикловир), оказались неэффективны при лечении аногенитальной ВПЧ-инфекции.
Теоретически вакцинация представляет собой идеальный метод лечения и профилактики аногенитальных бородавок.
Есть сообщения об эффективном применении индукторов ИФ. Представляет интерес местное применение низкомолекулярного производного имиквидахинолинамина — имиквимода, который является индуктором цитокинов и, в частности, Л-ИФ. Его используют в виде 5%-ного крема три раза в неделю либо ежедневно на ночь до полного исчезновения высыпаний (но не более 4 месяцев). Полное исчезновение кондилом наблюдается в 13–56% случаев. При ежедневном применении чаще развивались местные побочные эффекты: покраснение, отечность, эрозии. Крем особенно показан для лечения субклинической ВПЧ-инфекции. Возможно применение виразола.
Эффект от использования монотерапии ИФ все-таки недостаточно изучен и не очень высок, кроме того, необходимо принимать во внимание высокую стоимость такого лечения. В связи с этим данный метод не получил широкого распространения в практике.
Изопринозин. В последние годы пристальное внимание иммунологов привлек новый иммуномодулятор изопринозин, представляющий собой комплекс инозина и соли N,N-диметиламина-2-пропанола и Р-ацетаминобензойной кислоты. Препарат может применяться в виде таблеток либо раствора для парентерального инъецирования. Активным веществом в этом комплексе, по-видимому, является инозин, а соль аминоспирта стимулирует его проникновение через мембрану лимфоцитов и других клеток.
Изопринозин обладает мощным и широким иммуномодулирующим действием. Многочисленные данные и обширная литература свидетельствуют о том, что in vitro препарат существенно усиливает пролиферацию Т-лимфоцитов, индуцированную митогенами или специфическими антигенами, а также дифференцировку пре-Т-лимфоцитов в более зрелые Т-лимфоциты, сопровождающуюся появлением на их поверхности соответствующих антигенов. ИП также стимулирует индуцированную митогеном пролиферацию В-лимфоцитов. Доказано стимулирующее действие изопринолина на активность натуральных киллерных клеток (НК-клеток) у здоровых людей и функциональную способность цитотоксических Т-лимфоцитов. Препарат улучшает соотношение CD4+/CD8+; повышает выработку Т-лимфоцитами ИЛ-2; содействует созреванию и пролиферации Т-клеток; активизирует синтез ИЛ-1 макрофагами. ИП обладает противовирусным действием и препятствует использованию рибосомальной РНК для размножения вируса. Следует отметить, что в случае применения изопринолина с другими иммунокорректорами он существенно усиливал противовирусное действие последних.
Приняты различные схемы лечения с применением изопринолина в зависимости от размеров кондилом, их локализации и степени малигнизации.
Схема 1: лечение мелких, множественных остроконечных кандилом с низкой степенью малигнизации.
Препарат принимают по 2 табл. три раза в день в течение 14–28 дней.
Схема 2: лечение множественных кондилом с отдельными крупными кондиломами или плоской кондиломы шейки матки.
Среди применяемых в нашей стране и за рубежом химических препаратов, оказывающих деструктивное действие, можно выделить ТХУ и азотную кислоту, а также комбинированный кислотный препарат — солкодерм.
ТХУ и азотная кислота. ТХУ применяется в 80-90%-ной концентрации и вызывает образование локального коагуляционного некроза. Аналогичное действие оказывает раствор азотной кислоты. В силу своей дешевизны и доступности оба метода достаточно широко распространены и по сей день. Кислоты эффективны для лечения кондилом вульвы, препуциального мешка, венечной борозды, головки полового члена, особенно в тех случаях, когда противопоказано применение ПФ и ПФГ. Прижигания проводят один раз в неделю в течение 5-6 недель. Эффективность применения ТХУ и азотной кислоты составляет примерно 70-80%. В некоторых случаях может развиться местная реакция в виде мокнутия и изъязвления.
Солкодерм. Солкодерм — водный раствор, в качестве активной составляющей которого выступают продукты взаимодействия органических кислот (уксусной, щавелевой и молочной) и ионов металлов с азотной
кислотой. Раствор содержит нитриты в количестве 0,02 мг/мл.
Ниже перечислены свойства и механизм действия солкодерма, которые выделяют его среди других препаратов этой группы, использующихся в рамках деструктивных методов:
Общая характеристика лечения солкодермом:
Показания к применению солкодерма: простые бородавки, подошвенные бородавки, аногенитальные бородавки (остроконечные кондиломы), себорейные кератозы, актинокератозы, базально-клеточные эпителиомы (базалиомы).
Солкодерм очень удобен в применении и достаточно эффективен для лечения кондилом любой локализации. В большинстве случаев достаточно однократного применения.
Цитотоксические препараты
Подофиллин (ПФ). Пофиллин — смола, полученная из растений P.pelatum и P.emodi, растущих в Северной Америке и Гималаях. Для лечения бородавок аногенитальной области применяют 10-25%-ный раствор ПФ в этаноле или настойке бензоина. Он связывается с аппаратом микротрубочек клетки и ингибирует митозы, а также подавляет транспорт нуклеиновых кислот, в результате чего происходит ингибирование синтеза ДНК и клеточного деления.
Применение ПФ является простым, доступным, достаточно безопасным методом лечения, который может быть использован в амбулаторных условиях, а также самостоятельно пациентами. Препарат наносят один-два раза в неделю в течение максимум 5 недель в количестве не более 0,5 мл за одну процедуру. Больному необходимо следить, чтобы вода не попадала на обработанное место в течение 4-6 часов после процедуры. ПФ не рекомендуется применять при вагинальных, цервикальных и внутриэпителиальных бородавках. По сведениям ряда авторов, частота рецидивирования варьирует от 0 до 67%.
Примерно у 10-15% больных развиваются местные побочные реакции в виде мокнущего контактного дерматита. Особенно тяжелые осложнения в виде множественных изъязвлений возникают при неправильном самостоятельном применении. В результате длительного или неправильного применения ПФ у больных могут возникать различные побочные реакции, такие как тошнота, рвота, боли в животе, диарея, симптомы поражения почек, миокарда, печени, ЦНС и костного мозга.
Применение ПФ противопоказано при беременности, т. к. были отмечены случаи тератогенного действия на плод и внутриутробной гибели плода.
Многие исследователи считают ПФ недостаточно изученным и грубоочищенным растительным экстрактом, в связи с чем рекомендуют использовать только высокоочищенные подофиллотоксины, причем самостоятельное применение препарата самими больными нежелательно в силу вышеуказанных осложнений.
Подофиллотоксин (ПФТ) (кондилин). ПФТ — наиболее активная в терапевтическом отношении фракция ПФ. Выпускается в виде растворов 0,25, 0,3 и 0,5%, а также в виде крема 0,15, 0,3 и 0,5%.
Обычно его назначают два раза в день в течение трех дней в неделю подряд на протяжении 4-5 недель.
Несмотря на то что ПФТ лучше очищен по сравнению с ПФ, сообщается о большой частоте побочных явлений при использовании ПФТ, особенно его 0,5%-ного раствора. Наиболее часто в результате применения ПФТ наблюдаются следующие побочные эффекты: местные воспалительные реакции (эритема, жжение, болезненность, зуд, мокнутие и эрозии в области аппликации). Хотя в литературе не описано системных побочных эффектов, рекомендуется ограничивать применение ПФТ дозой 0,2 мл за одну процедуру.
Недостатками ПФТ являются его высокая стоимость и большая длительность лечения.
5-фторурацил (5-ФУ). 5-фторурацил (5-ФУ) является антагонистом пиримидина и обладает способностью нарушать синтез как клеточной, так и вирусной ДНК. Для лечения бородавок аногенитальной области его назначают в виде 5%-ного крема. При лечении интравагинальных бородавок препарат назначается один раз на ночь в течение недели или один раз в неделю в течение 10 недель. Степень эффективности препарата, по мнению различных исследователей, составляет 85-90%. При применении 5-ФУ могут возникнуть мокнущие эрозии на слизистой влагалища, вплоть до развития тяжелого мокнущего контактного дерматита. При лечении бородавок терминальной части уретры крем вводится сразу после мочеиспускания на ночь в течение 3-8 дней. Полное излечение внутриуретральных бородавок наблюдается у 90-95% мужчин. Однако при лечении наблюдается множество побочных эффектов: стеноз и стриктуры уретры, дизурия, изъязвления. Препарат противопоказан при беременности.
Иммунологические методы
Интерферон. Поскольку вирус папилломы человека сохраняется в эпителиальных клетках и использование деструктивных методов не гарантирует от рецидивов, перспективным в этом плане является применение ИФ как в качестве монотерапии, так и в сочетании с другими методами лечения.
ИФ являются эндогенными цитокинами, обладающими противовирусными, антипролиферативными и иммуномодулирующими свойствами. Существуют три основных класса ИФ: лейкоцитарный (Л-ИФ), фибробластный (Ф-ИФ) и Т-лимфоцитарный (Т-ИФ). ИФ можно применять местно, внутриочагово и системно (подкожно, в/м или в/в). Установлено, что при использовании ИФ у пациентов в очагах поражения снижается количество вирусной ДНК (по данным ПЦР), что коррелирует с клиническим улучшением или исчезновением поражения.
Имеются данные, касающиеся использования для лечения кондилом отечественного ИФ — человеческого лейкоцитарного интерферона (ЧЛИ). Его применяли внутриочагово (под папиллому) в дозе 100 000-500 000 МЕ, на курс 3-6 процедур в сочетании с нанесением на поражения интерфероновой мази с активностью 40 МЕ. ЧЛИ можно назначать системно и при лечении распространенных поражений в сочетании с деструктивными методами.
Наиболее эффективным препаратом при различных способах, схемах и дозах введения можно считать Л-ИФ. При системном применении Л-ИФ полное исчезновение бородавок наблюдали у 11–100% пациентов. Эффективность применения Ф-ИФ составила 45–82%. Эффективность Т-ИФ, показанная в разных исследованиях, гораздо ниже, чем у Л-ИФ и Ф-ИФ, и варьирует от 7 до 57%.
Следует помнить, что бессистемное использование различных методов лечения приводит к высокому проценту рецидивов, однако разработка определенных алгоритмов, учитывающих пол больных, локализацию и количество высыпаний, позволяет существенно снизить количество рецидивов.
Таблица 1. Аногенитальная ВПЧ-инфекция и ассоциированные с ВПЧ заболевания
ВПЧ-инфекция
Развернутые клинические формы (видимые невооруженным глазом или не видимые, но определяющиеся при наличии соответствующей симптоматики):
Субклинические формы (не видимые вооруженным глазом и бессимптомные, выявляемые только при кольпоскопии и/или цитологическом или гистологическом исследовании
Латентные формы (отсутствие морфологических или гистологических изменений при обнаружении ДНК ВПЧ)
«Эффективное лечение ВПЧ» — ложь или правда?
Ольга Золоткова СПИД.ЦЕНТР
Вирус папилломы человека — самая распространенная вирусная инфекция, по данным ВОЗ. Она появляется у подавляющего большинства людей, ведущих сексуальную жизнь. Причем российские врачи, в частности гинекологи, регулярно рекомендуют пациентам проверяться на ВПЧ, аргументируя это так: если вирус найдут, то он «эффективно лечится». СПИД.ЦЕНТР объясняет, можно ли вылечить этот вирус на самом деле.
ВПЧ есть у всех?
Особенность этого вируса в том, что он высококонтагиозен, то есть передается как половым путем, так и при простом кожном контакте. Поэтому плохая новость: презервативы совершенно не гарантируют защиту от него. Им инфицируются большинство взрослых и многие дети, но это нестрашно и почти всегда проходит бесследно. В 90—98 % случаев через 1—2 года организм справиться с вирусом сам, в подобных случаях инфекция называется транзиторной.
Но есть и опасности, например, если ВПЧ долгое время находится в женском организме, риск рака шейки матки повышается. По данным ВОЗ, два типа ВПЧ (16 и 18) вызывают до 70 % всех случаев рака шейки матки. Вирус папилломы человека выявляется при скрининге рака шейки матки.
Однако в то же время нет и не может быть термина «ВПЧ-положительный статус» — сегодня вирус обнаруживается, а через несколько месяцев его уже нет. До сих пор лекарства от ВПЧ еще не изобрели, при том что вакцины от некоторых типов давно существуют.
Обзор противовирусных и иммуномодулирующих «лекарств»
В России и странах СНГ гинекологи назначают противовирусную терапию ВПЧ. Схемы лечения громоздкие и дорогостоящие: пациентке вручают список из нескольких препаратов.
по теме
Лечение
«Химия» и жизнь: мифы о раке
Важно понимать, что ни по одному вышеперечисленному препарату нет серьезных и полных исследований — рандомизированных двойных слепых плацебо-контролируемых испытаний. Рекламно-хвалебные публикации и исследования с нерепрезентативными выборками размещены только на сайтах производителей и русскоязычных ресурсах. Кроме стран СНГ, эти средства нигде не зарегистрированы и не применяются.
Многие российские гинекологи утверждают, что препараты с недоказанной эффективностью успешно лечат ВПЧ: анализ на вирус после одного или нескольких курсов становится отрицательным. Но такой результат — не заслуга лечения, он означает, что инфекция была транзиторной и устранилась бы сама, даже без ненужной лекарственной и денежной нагрузки.
Мировая практика
Центр по контролю заболеваний США пишет, что специфическая терапия ВПЧ не рекомендуется. ВОЗ в информационном бюллетене говорит только о необходимости лечения последствий, которые может вызвать ВПЧ: рака шейки матки, анальных или генитальных бородавок. У мужчин онкогенные типы ВПЧ способны провоцировать рак прямой кишки и полового члена.
В современном мире медикаментозной терапии не существует, но большое внимание уделяется вакцинации.
Вакцинация от ВПЧ
Две вакцины прошли клинические испытания и зарегистрированы на рынке:
Препараты очень дорогие (цена одной инъекции составляет около 6 000 — 10 000 рублей), поэтому массовую вакцинацию могут себе позволить только развитые страны.
В идеале должны быть вакцинированы все подростки в возрасте 11—12 лет независимо от пола (два раза в течение полугода) и взрослые до 26 лет (три раза после 14 лет в течение полугода). В российской инструкции к вакцинам рекомендуется трехкратная вакцинация в любом возрасте.
Отдельно стоит упомянуть, что Американский альянс иммунологов рекомендует прививаться от ВПЧ при ВИЧ. Об эффективности вакцинации ВИЧ-положительных девушек говорят ВОЗ, клинические исследования Канадского института исследований здоровья и другие публикации.
Когда нужно сдавать тест на ВПЧ?
Анализ на ВПЧ назначается женщинам после 30 лет при аномальных результатах цитологии или гистологии. Просто так проводить его бессмысленно и затратно. Результаты ПАП-теста вместе с анализом на ВПЧ помогают выбрать правильный интервал до повторного цитологического исследования или кольпоскопии.
Положительный анализ на ВПЧ не означает рак, он лишь позволяет сделать приблизительный прогноз; к тому же вирус — не единственный фактор риска рака шейки матки.
Тест на ВПЧ не должен использоваться массово — это дополнительный (и дорогостоящий) метод скрининга.
Итог:
Доказанной противовирусной терапии ВПЧ не существует, как и лекарств, укрепляющих иммунитет.
Лечат не ВПЧ, а его последствия: предраковые состояния и рак шейки матки, новообразования на коже и слизистых. Лечение не медикаментозное, а хирургическое: лазер, криодеструкция, операция.
Сдавать анализ на ВПЧ всем подряд не нужно.
Чем лечат папилломавирус человека лекарства
Генитальная папилломавирусная инфекция (ПВИ) является одной из самых частых инфекций, передаваемых половым путем (ИППП). Только в США ею поражено около 20 млн и ежегодно заражается 5,5 млн человек [16]. Чрезвычайная опасность и важная социальная значимость этой инфекции обусловлена ее этиологической ролью в развитии практически всех случаев рака шейки матки, около 50% других раков аногенитальной области, а также целого ряда разновидностей злокачественных новообразований верхних дыхательных путей и кожи [18, 23].
В России, где официально регистрируются лишь случаи аногенитальных (венерических) бородавок, интенсивный показатель заболеваемости ими, составивший в 2004–2005 годах 32,9–32,1 случая на 100 тысяч населения, свидетельствует об эпидемическом характере распространенности этой категории ПВИ [5]. В то же время даже с учетом десятикратного роста регистрируемой за последние десять лет заболеваемости ПВИ [7], эти цифры не отражают масштабов ее истинной распространенности. Во многом это связано со сложностью диагностики субклинических и латентных форм инфекции.
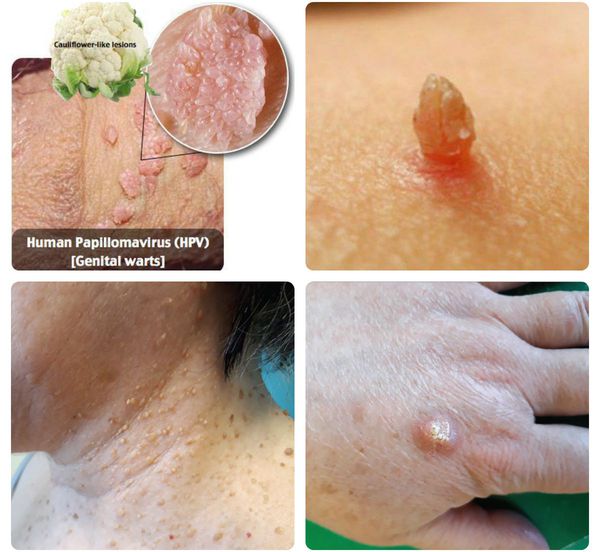
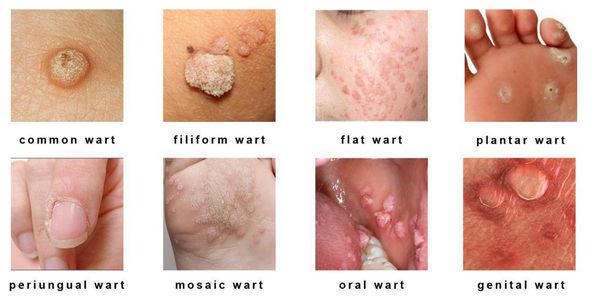
При половом заражении чаще всего приводит к развитию аногенитальных бородавок, классической формой которых являются остроконечные кондиломы — доброкачественные мягкие папилломатозные разрастания, расположенные, как правило, в аногенитальной области и обычно обусловленные и 11 и реже другими, в том числе высокоонкогенными типами ВПЧ. В целом же не менее 35 типов ВПЧ (16, 18 и др.) вызывают дисплазию и рак половых органов (шейки матки, вульвы, влагалища, полового члена), гортани и заднего прохода [3].
2. Кератотические бородавки — папулы, имеющие роговой вид и часто напоминающие цветную капусту или себорейный кератоз, обычно располагающиеся на коже ствола полового члена, мошонки, половых губ, паховых складок.
3. Папулезные бородавки — куполообразные папулы диаметром от 1 до 4 мм с гладкой поверхностью (менее роговой, чем кератотические), имеющие цвет сырого мяса и располагающиеся на коже, покрытой полностью ороговевшим эпителием.
4. Плоские бородавки — пятнистые элементы или слегка приподнятые папулы, обычно невидимые невооруженным глазом, располагающиеся на фоне частично или полностью ороговевшего эпителия.
Без лечения генитальные бородавки могут спонтанно инволюцировать (в 90% случаев), длительно персистировать или увеличиваться в размере и количестве, трансформируясь в рак (10%). Рак in situ без лечения переходит в инвазивный рак в 36% случаях за 3,8–5,7 лет [18]. С меньшей частотой спонтанной инволюции подвергаются более длительно существующие очаги поражений. Отсутствие спонтанной инволюции генитальных бородавок также может быть связано с повторным инфицированием новыми типами ВПЧ. Реинфекция же одним и тем же типом ВПЧ встречается не часто, возможно, благодаря приобретенному иммунитету.
Прогноз генитальных бородавок зависит от типа обусловливающих их ВПЧ, сопутствующих заболеваний (включая ИППП). Если обычно приводит к развитию плоскоклеточного рака, то — к развитию аденокарценомы шейки матки — формы рака с очень плохим прогнозом. Плохим прогностическим факторам является и молодой возраст пациентки [10].
Для выявления чаще всего применяются методы: неамплификационные (, гибридизация, гибридизация in situ на фильтре и ткани) и амплификационные (ПЦР и Hybrid Capture (HC)-анализ). При сравнении эффективности методов цервикальной цитологии и ПЦР в обнаружении установлено, что является более чувствительным, чем цитологический.
В то же время ценность в клинической практике все еще не совсем ясна. Во всяком случае положительные результаты не являются определяющими в предсказании исхода этой инфекции. Это связано как с возможностью технических ошибок при выявлении ВПЧ высокого риска, так и с необходимостью тщательного наблюдения за лицами с обнаруженными у них ВПЧ среднего и высокого риска, поскольку клинические и гистологические признаки развиваются через 1–8 месяцев после первоначальной экспозиции вируса, и даже нелеченные элементы могут регрессировать спонтанно, длительно существовать как доброкачественные или прогрессировать в предраковые поражения и рак.
Для использования в скрининге и мониторинге терапии тестирования на ДНК ВПЧ и для уверенности в надежности результатов используемый тест должен отвечать ряду требований. Это выявление широкого спектра генотипов ВПЧ высокого онкогенного риска (не менее 10 высоко распространенных) и невыявление низкоонкогенных типов ВПЧ, снижающих специфичность исследования. Кроме того, важной задачей является возможность определения вирусной нагрузки. При этом выявление вируса в количестве, не превышающем порогового, имеет малое клиническое значение, так как говорит о высокой вероятности спонтанного излечения. При этом как положительные должны учитываться только случаи вирусной нагрузки, превышающей порог. В то же время при послеоперационном мониторинге введение порога неоправданно, поскольку выявление вируса даже с низкой нагрузкой может быть маркером рецидива [9].
Несмотря на то что генитальные бородавки редко персистируют, а тем более увеличиваются в размере и количестве и обычно регрессируют спонтанно, выраженный онкогенный потенциал целого ряда типов ВПЧ, особенно в условиях иммуносупрессии, ставит проблему лечения генитальных бородавок в разряд весьма актуальных проблем современной медицины.
В настоящее время эффективность различных методов лечения генитальных бородавок, даже с учетом проведения повторных курсов, составляет 60–80% [13]. Рецидивы в 25–50% случаев наступают в течение первых трех месяцев после лечения и чаще всего обусловлены реактивацией вируса.
При разработке стратегии лечения важно учитывать возраст больного, локализацию, количество элементов, площадь очагов поражения, частоту рецидивов, наличие сопутствующей соматической патологии (в том числе урогенитальных инфекций), переносимость метода лечения, а также клинический опыт врача.
Наиболее часто применяются следующие методы лечения остроконечных кондилом.
1. Физические методы:
2. Химическая цитодеструкция:
3. Антивирусная и иммуномодулирующая химиотерапия:
4. Фотодинамическая терапия:
В большинстве случаев бывает достаточно криодеструкции, электрокоагуляции, лечения лучами лазера или фотодинамической терапии (ФДТ).
При распространенном рецидивном процессе более эффективна комбинация местного и общего лечения. При этом обычно вначале проводится деструктивное лечение. Затем, в связи с тем, что латентная стадия жизненного цикла ВПЧ протекает в клетках базального слоя эпидермиса и физическими методами очаг поражения трудно удалить полностью (ДНК ВПЧ могут быть на расстоянии до 1 см от видимых границ опухоли), сразу после регенерации эпидермиса, во избежание рецидива, осуществляется противовирусная терапия препаратами интерферона или кремом имиквимод. В случае рецидива применяют антивирусные и иммунотропные препараты.
Все интерфероны (ИФН) эффективны в отношении ВПЧ. При остроконечных кондиломах их применяют (инъекции внутрь очага или системно) в качестве терапии резерва, особенно при отсутствии эффекта от общепринятой терапии. ИНФ — это цитокины первой фазы иммунного ответа, обладающие антивирусными, антипролиферативными и иммуностимулирующими свойствами благодаря способности усиливать цитотоксическую активность и стимулировать их способность уничтожать клетки с измененной антигенной структурой.
Внутриочаговые инъекции под основание генитальных бородавок проводят препаратами ИНФ-α2 в дозе 5 млн МЕ три раза в неделю в течение трех недель. ИФН применяют также с целью предварительной терапии крупных очагов поражения для уменьшения их площади перед деструктивным методом, а также с целью профилактики рецидивов [17].
Необходимо отметить техническую трудность проведения местного обкалывания генитальных бородавок, выраженный гриппоподобный синдром при парентеральном введении интерферона, а также выраженную болезненность при проведении таких манипуляций.
Подобных недостатков лишен препарат рекомбинантного интерферона-*2 виферон. В его состав входят мембраностабилизирующие препараты — антиоксиданты — витамины Е и С в терапевтически эффективных дозах. Это усиливает противовирусную и иммуномодулирующую активность препарата в 10–14 раз по сравнению с препаратом интерферона-*2b реафероном [2]. Применение его позволяет снизить суточную дозу интерферона при однократном введении и пролонгировать его действие. Лекарственная форма препарата — ректальные суппозитории — также обеспечивает уменьшение побочных реакций, характерных для парентерального введения препаратов интерферона (таких как повышение температуры, гриппоподобный синдром), и, кроме того, придает препарату новые фармакокинетические свойства: при сравнении титров интерферона в сыворотке крови здоровых добровольцев при внутривенном, внутримышечном и ректальном с антиоксидантами введении рекомбинантного интерферона-*2b отмечено, что при введении 1 млн МЕ интерферона ректально титр интерферона в сыворотке крови превышал таковой при внутривенном или внутримышечном введении 2 млн МЕ интерферона [4]. Существенно, что даже при длительном применении виферона (в течение двух лет) не образуются антитела, нейтрализующие антивирусную активность интерферона- *2b [6].
При лечении эндоуретральных кондилом используют ежедневные инстилляции ИФН-α2 в дозе 25 млн МЕ в течение шести недель и цитологическим контролем через две и шесть недель после окончания курса лечения, а затем — каждые три месяца в течение года. Рецидив служит показанием к проведению повторного курса лечения [17].
По нашему мнению, для лечения эндоуретральных кондилом наиболее оправдано использование геля виферон. Основной компонент препарата — человеческий рекомбинантный интерферон обладает выраженным противовирусным действием. Природный антиоксидант — витамин Е и его синергисты — бензойная и лимонная кислоты, метионин — способствуют стабилизации клеточных мембран, обладают ранозаживляющим действием. Гелевая основа обеспечивает пролонгацию воздействия препарата, а вспомогательные вещества — стабильность специфической активности и надлежащую микробиологическую чистоту препарата.
Под нашим наблюдением находилось 18 пациентов (12 мужчин и 6 женщин) с диагнозом «остроконечные кондиломы аногенитальной области». Возраст пациентов варьировал от 19 до 38 лет, и в среднем составлял 24,7 года. Для идентификации типа ВПЧ в каждом случае проводилась ПЦР. Необходимо отметить, что наиболее часто выявлялись ВПЧ 6, 11, 31 и 33 типов, при этом в группе женщин из шести пациенток у пяти был выявлен ВПЧ 6 типа. Все пациенты ранее неоднократно проходили лечение по поводу остроконечных кондилом с применением различных методов деструкции: электрокоагуляции, криодеструкции, лазерной вапоризации и др. В среднем количество рецидивов составляло 2,8, при этом средний межрецидивный период составлял 2,1 месяца, и ни в одном случае его продолжительность не превышала четырех месяцев.
Всем пациентам проводился курс терапии ректальными суппозиториями виферон по 3 млн МЕ в сутки, местно применялся гель виферон. На пятнадцатый день проводилась деструкция новообразований методом электрокоагуляции, после чего рекомендовалось продолжить применение ректальных суппозиториев виферон по 1 млн МЕ в сутки в течение еще пятнадцати дней. Ближайшие результаты лечения в каждом случае были хорошими (рис. 1, 2). В период наблюдения не менее восьми месяцев рецидивов заболевания не было отмечено ни в одном случае. Особо необходимо отметить хорошую переносимость применявшихся препаратов — побочных эффектов или осложнений не было отмечено ни в одном случае.
Подписи к рисункам
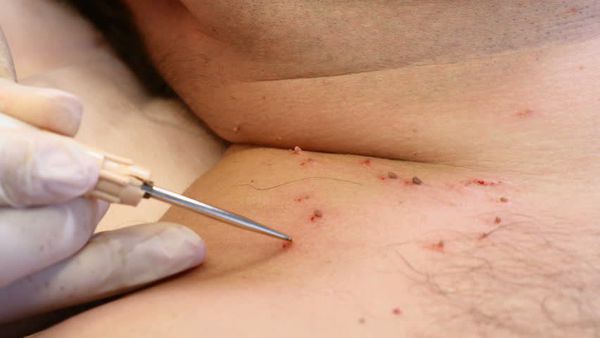
Рисунок 1. Больной К., 27 лет, остроконечные кондиломы в перианальной области
Рисунок 2. Тот же больной через пять дней после окончания курса лечения
Вирус папилломы человека (ВПЧ) у женщин
Оглавление
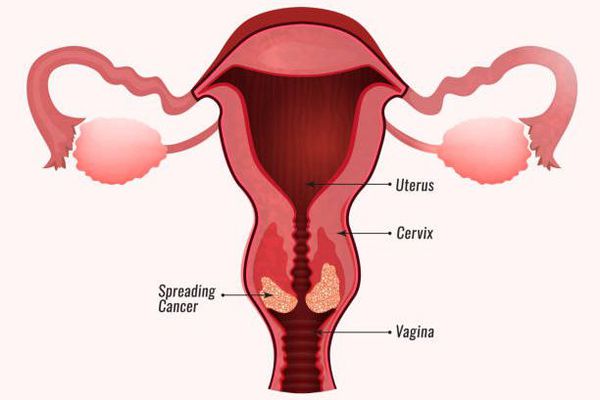
ВПЧ (вирус папилломы человека) у женщин является распространенной инфекцией, поражающей слизистые оболочки и кожные покровы. Опасна она тем, что длительное время может «жить» в организме, никак не проявляя себя. Признаки патологии становятся заметны исключительно при снижении иммунитета. Для женщин ВПЧ опасен тем, что может стать причиной развития рака влагалища и шейки матки.
Причины
Вирус папилломы человека передается следующими путями:
Возможна и передача вируса от матери к ребенку во время родов.
Факторами, способствующими заражению и проявлению признаков заболевания, являются:
Зараженный человек зачастую страдает от внешних проявлений вируса. На коже при развитии патологии появляются неэстетичные наросты различных типов.
Признаки
При развитии ВПЧ у женщин образуются:
Также ВПЧ различных типов у женщин может проявляться в форме дисплазии шейки матки.
Важно! При раннем выявлении заболевания пациентка может быть вылечена.
Диагностика
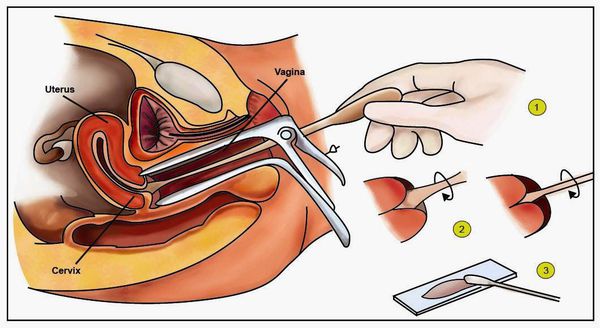
Для выявления ВПЧ различных типов у женщин применяют метод полимеразной цепной реакции (ПЦР). Для анализа производится забор мазка из влагалища. Метод является достаточно простым в реализации, но отличается высокой чувствительностью.
Для диагностики изменений на шейке матки проводят кольпоскопию. Такое обследование выполняется с применением специального прибора и включает 2 пробы:
После мазка и кольпоскопии может проводиться биопсия подозрительных очагов. Она позволяет дифференцировать добро- и злокачественные новообразования и принять решение о дальнейшей терапии женщины.
Как лечится вирус папилломы человека у женщин?
Следует понимать, что современные разрекламированные препараты, которые направлены на повышение иммунитета, в терапии не эффективны! Они не прошли необходимых исследований и не доказали продуктивность.
Как тогда лечить ВПЧ у женщин?
В настоящий момент эффективных способов терапии просто не существует. Можно только удалить патологические новообразования (папилломы и др.) со слизистых и кожных покровов. Также возможно лечение выявленной дисплазии и иных предраковых состояний и рака. Терапия проводится комплексно, нередко включает оперативные вмешательства и другие способы.
Важно! Лечение вируса папилломы человека у женщин медикаментами невозможно! Если вам предлагают пройти его, советуем сменить клинику и специалиста. Вы лишь напрасно потратите время и допустите развитие процесса распространения потенциально опасного вируса.
Избавиться от новообразований можно достаточно быстро. Вмешательства проводятся стандартным хирургическим путем, с помощью лазера, радионожа, криодеструкции и иных методик. Подходящая методика подбирается индивидуально, с учетом особенностей новообразований.
В МЕДСИ для удаления новообразований при вирусе папилломы человека у женщин применяются следующие методики:
Предлагаемое лечение (удаление) проявлений ВПЧ у женщин не требует существенных временных затрат. Все процедуры проводятся в течение 10-15 минут. Сразу же после удаления новообразований пациентка может вернуться к привычному образу жизни. Обычно ограничения накладываются только на посещение бань, саун и бассейнов. Не рекомендуется мочить ранку и пользоваться различными уходовыми средствами.
Важно! Обо всех особенностях восстановления после удаления новообразований расскажет врач.
Профилактика
Несмотря на то, что лечение вируса папилломы человека у женщин не проводится, возможно предотвратить заражение и появление симптомов заболевания. Для этого необходимо проводить профилактику!
Основным способом эффективной профилактики сегодня является вакцинация. Постановка прививки позволяет обеспечить защиту от заражения и сократить риски опасных для здоровья и жизни последствий развития вируса.
В нашей стране в настоящий момент зарегистрировано 2 препарата для вакцинации: «Церварикс» и «Гардасил». Обе вакцины являются безопасными и эффективными. «Гардасил» является более продуктивной, так как действует против 4 типов вируса.
Вакцинация возможна в возрасте от 9 до 45 лет и подразумевает введение 3 доз препарата. При этом используется схема: 0-2-6. Это значит, что сначала вводится первая доза, через 2 месяца еще одна и через 6 месяцев (с даты первого введения) – третья.
Важно! Вакцинация может проводиться даже пациенткам, у которых уже выявлен вирус папилломы человека. Это обусловлено тем, что женщина может быть заражена лишь определенными типами ВПЧ.
Во многих странах Европы и в США вакцина уже входит в перечень обязательных. При проведенных исследованиях доказана эффективность профилактических мер.
Также пациентке следует регулярно проходить осмотры у гинеколога и необходимые скрининговые обследования. Они позволят своевременно обнаружить симптомы ВПЧ у женщины и принять необходимые меры по предотвращению развития раковых новообразований.
Преимущества обращения в МЕДСИ
Если вы хотите проконсультироваться с врачом по вопросам ВПЧ у женщин, пройти удаление новообразований, сделать вакцинацию, позвоните Специалист ответит на все вопросы.
Консервативная терапия поражений, вызванных папилломавирусной инфекцией
Проблема лечения генитальных вирусных инфекций стоит в настоящее время наиболее остро. Исходя из биологии вирусов, эти инфекции наиболее трудно поддаются эпидемиологическому контролю и лечению. Среди вирусных инфекций, поражающих аногенитальную область,
Проблема лечения генитальных вирусных инфекций стоит в настоящее время наиболее остро. Исходя из биологии вирусов, эти инфекции наиболее трудно поддаются эпидемиологическому контролю и лечению. Среди вирусных инфекций, поражающих аногенитальную область, наиболее распространены герпетическая и папилломавирусная инфекция. Целью данной статьи является обзор современных консервативных методов лечения больных с аногенитальными поражениями, вызванными вирусом папилломы человека (ВПЧ-поражений).
К ВПЧ-поражениям относят (по J. Handley [1]): клинические формы — аногентальные бородавки (остроконечные кондиломы, вульгарные бородавки), симптоматические внутриэпителиальные неоплазии на ранних стадиях при отсутствии дисплазии (плоские кондиломы); субклинические формы — бессимптомные внутриэпителиальные неоплазии при отсутствии дисплазии; латентные формы (отсутствие морфологических или гистологических изменений при обнаружении ДНК ВПЧ).
Принципиально лечение аногенитальных ВПЧ-поражений направлено либо на разрушение папилломатозных очагов тем или иным методом, либо на стимуляцию противовирусного иммунного ответа, либо на сочетание этих подходов. Оптимальной представляется следующая классификация методов лечения аногенитальных бородавок.
I. Деструктивные методы
II. Цитотоксические препараты:
III. Иммунологические методы:
IV. Комбинированные методы:
При выборе оптимальной лечебной тактики врач все чаще вынужден учитывать мнение представителей страховой медицины как в обязательном, так и в добровольном ее вариантах, поскольку оплата за диагностику и лечение зависит от тех стандартов, которые принимаются во внимание страховыми компаниями.
В связи с этим особую роль приобретают справочные руководства, в которых представлена официальная тактика лечения, одобренная Министерством здравоохранения. Сегодня одним из самых авторитетных справочных изданий такого типа является «Федеральное руководство по использованию лекарственных средств» (ФР), последнее, 4-е издание которого датируется 2003 г. К сожалению, этот справочник пока не содержит раздела, посвященного терапии папилломавирусной инфекции. Такая информация, по-видимому, будет присутствовать в российских стандартах по лечению ИППП, но они пока не изданы. Единственными руководствами для практикующих врачей, работающих в этой области, могут являться различные методические материалы, выпускаемые авторитетными учреждениями и организациями. К таким пособиям можно отнести «Методические материалы по диагностике и лечению наиболее распространенных инфекций, передаваемых половым путем (ИППП), и заболеваний кожи», изданные ГУ ЦНИКВИ в 2001 г. и «Методические материалы по диагностике и лечению наиболее распространенных инфекций, передаваемых половым путем (ИППП), и ассоциированных с ними заболеваний» Российской ассоциации акушеров и гинекологов, утвержденные в 2000 г. В этих руководствах для лечения ВПЧ-поражений рекомендуются физические и химические деструктивные методы, использование подофиллотоксина, а также комбинированные методы, основанные на сочетании деструкции поражений с системной и местной иммунотерапией.
Кроме упомянутых руководств при выборе наиболее оптимального метода в каждом конкретном случае врачу необходимо руководствоваться четырьмя основными характеристиками:
Физические деструктивные методы
Основным отличием этих методов от остальных является то, что при их применении происходит быстрое, как правило, одномоментное разрушение поражений. При использовании других методов очаг поражения подвергается воздействию, и необходимо время — от нескольких часов до нескольких недель, — чтобы поражения ликвидировались. Как правило, этот период сопоставим со временем заживления очагов после воздействия физических методов. Частота рецидивов, по данным литературы, не зависит от выбора метода лечения. Таким образом, очевидные, казалось бы, преимущества физических методов нивелируются. Для применения физических деструктивных методов необходимы специальные помещения, дорогостоящее оборудование, обученный персонал, имеющий сертификаты на данный вид медицинской деятельности. Все это ограничивает использование данных видов лечения в широкой практике, особенно в условиях небольших медицинских центров или в районах, где имеются лишь дерматовенерологический, гинекологический или урологический кабинет в поликлинике. Поэтому особый интерес представляют консервативные методы лечения, доступные для применения любому практикующему врачу.
Химические деструктивные методы
Применяются концентрированные растворы кислот, щелочей, солей и др. Среди таких препаратов можно упомянуть ферезол, перекись водорода, растворы акрихина и хингамина, препараты на основе салициловой и молочной кислот, уксусную и азотную кислоту, соки туи и чистотела. Все эти лекарственные средства обладают невысокой, плохо прогнозируемой эффективностью, многочисленными побочными эффектами. Упорядоченных данных относительно действенности этих препаратов немного. Среди применяемых в нашей стране и за рубежом химических препаратов, обладающих деструктивным действием, о которых достаточно данных в литературе, можно выделить трихлоруксусную (ТХУ) кислоту и азотную кислоту, а также комбинированный кислотный препарат — солкодерм.
Трихлоруксусная и азотная кислоты
ТХУ кислота применяется в концентрации 80—90% и вызывает образование локального коагуляционного некроза. Таким же действием обладает раствор азотной кислоты. Из-за своей дешевизны и доступности метод применяется довольно широко. Кислоты эффективны для лечения кондилом вульвы, крайней плоти, венечной борозды и головки полового члена, особенно в случаях, когда противопоказано применение цитотоксических методов и лазера (например, во время беременности). Препараты обычно не рекомендуются для лечения вагинальных и уретральных бородавок. Прижигания проводят один раз в неделю в течение пяти-шести недель. Эффективность ТХУ и азотной кислот составляет примерно 70–80%. У 1/3 больных может развиваться местная реакция в виде мокнутия и изъязвлений.
Солкодерм
Солкодерм — это водный раствор, в качестве активной составляющей которого выступают продукты взаимодействия органических кислот (уксусной, щавелевой и молочной) и ионов металлов с азотной кислотой.
Представленные ниже свой-ства и механизм действия солкодерма выделяют его среди других деструктивных методов: при местном применении солкодерм вызывает немедленную прижизненную фиксацию ткани, на которую он наносится; действие препарата строго ограничивается местом применения; признаком немедленного эффекта является изменение окраски обрабатываемого участка; девитализированная ткань высыхает и темнеет (мумифицируется); «мумифицированный» струп отторгается самостоятельно; процесс заживления непродолжителен, а осложнения (вторичная инфекция или рубцевание) редки. Лечение практически безболезненно и проводится амбулаторно, так как не требует специальной аппаратуры.
Солкодерм высокоэффективен для лечения остроконечных кондилом любой локализации, в большинстве случаев достаточно однократного применения.
Цитотоксические препараты
Подофиллин
ПФ представляет собой смолу, полученную из растений P. pelatum и P. emodi, встречающихся в Северной Америке и Гималаях. Для лечения бородавок аногенитальной области применяют 10-25-процентный раствор ПФ в этаноле или настойке бензоина. ПФ является препаратом выбора в клиниках Великобритании. Он связывается с аппаратом микротрубочек клетки и ингибирует митозы, а также подавляет транспорт нуклеиновых кислот, в результате чего происходит ингибирование синтеза ДНК и размножения клетки. В России ПФ не зарегистрирован. Не все исследователи приветствуют использование ПФ, особенно его самостоятельное применение пациентами. В частности, Pedersen et al. характеризуют ПФ как плохо изученный, грубо очищенный растительный экстракт. Методом жидкостной хроматографии эти авторы определили, что примерно 10% сухого вещества 20-процентного раствора ПФ составляют два мутагенных флавоноида — кверцетин и кемферол. Предлагается применять только высокоочищенные подофиллины, да и то их самостоятельное использование рекомендуется больным только после подробного инструктажа.
Подофиллотоксин
Подофиллотоксин представляет собой наиболее активную в терапевтическом отношении фракцию в составе подофиллина. В других странах выпускается в виде растворов 0,25%, 0,3% и 0,5%, а также в виде крема 0,15%, 0,3% и 0,5%. В России зарегистрированы раствор и крем подофиллотоксина. Его несомненное достоинство — возможность безопасного самостоятельного использования пациентами. Обычно его применяют два раза в день в течение трех последовательных дней в неделю в течение четрых-пяти недель.
Для ПФТ показатель эффективности составляет 26—87% у мужчин и 50—77% у женщин. Столь большой разброс в показателе эффективности связан с различным сроком наблюдения за больными, а также с тем, что в некоторых работах авторы не учитывают рецидивы. По данным Hendley, полное исчезновение бородавок наблюдается только в 30—40% случаев, по данным Bonnez — только у 29% больных, по данным Wang — у 86,5%, по данным Kinghorn et al. — у 86% мужчин и 72% женщин. По данным Syed, рецидивы наблюдаются в 5,5% случаев при применении раствора 0,3% и крема и в 51% — при использовании кремов 0,3% или 0,5%, по данным von Krogh, при использовании раствора 0,5% — в 38% случаев, по данным Wang — у 17% больных, по данным Hellberg — у 23% (при использовании крема 0,5%).
Наиболее частыми побочными эффектами ПФТ являются местные воспалительные реакции (у 57% пациентов), эритема, жжение (у 48%), болезненность (у 47%), зуд (у 44%), незначительное мокнутие и эрозии в области аппликации (у 39%). Хотя и не было описано системных побочных эффектов, рекомендуется ограничивать применение ПФТ в количестве 0,2 мл за одну процедуру.
Handley считает ПФТ препаратом выбора для самостоятельного применения больными с небольшим количеством неороговевающих кондилом, располагающихся на крайней плоти, головке полового члена, в венечной борозде и вульве. Препарат малоэффективен при лечении бородавок перианальной области, влагалища и уретры.
Недостатками ПФТ являются его высокая стоимость, большая длительность лечения при не самой высокой эффективности.
5-фторурацил
5-фторурацил (5-ФУ) является антагонистом пиримидина и способен нарушать синтез как клеточной, так и вирусной ДНК. Для лечения бородавок аногенитальной области его назначают в виде крема 5%. По мнению Handley, 5-ФУ — это эффективный метод лечения интравагинальных бородавок и кондилом терминальной части уретры. При лечении интравагинальных бородавок препарат назначается один раз на ночь в течение недели или один раз в неделю в течение 10 недель. Хотя препарат при такой схеме лечения обладает достаточно высокой эффективностью (85—90%), при его применении могут возникать мокнущие эрозии на слизистой влагалища, вплоть до развития тяжелого мокнущего контактного дерматита.
При лечении бородавок терминальной части уретры крем вводится сразу после мочеиспускания, на ночь, в течение трех—восьми дней. Полное излечение внутриуретральных бородавок наблюдается у 90—95% мужчин. Однако так же, как в случае с женщинами, при лечении мужчин наблюдается множество побочных эффектов: стеноз и стриктуры уретры, дизурия, изъязвления.
Несмотря на достаточно высокую эффективность 5-ФУ, доступность и дешевизну, его применение ограничено в широкой практике из-за высокой частоты побочных эффектов. Препарат противопоказан при беременности.
Одним из основных показателей эффективности любого метода является отсутствие рецидивов. Так как частота рецидивов ВПЧ-инфекции не зависит от метода деструкции поражений (физическая, химическая или цитотоксическая), то представляет интерес еще одна группа консервативных методов — это терапия иммунными препаратами, которые могут применяться самостоятельно или в комбинации с деструктивными методами.
Иммунологические методы
Интерфероны (ИФ)
Так как ВПЧ сохраняется в эпителиальных клетках и использование деструктивных методов не гарантирует от рецидивов, перспективным в этом плане является применение интерферонов как в качестве монотерапии, так и в комплексе с другими методами лечения.
ИФ представляют собой эндогенные цитокины, обладающие противовирусным, антипролиферативным и иммуномодулирующим действием. Существует три основных класса интерферонов: α-ИФ (лейкоцитарный), β-ИФ (фибробластный) и γ-ИФ (Т-лимфоцитарный). ИФ можно применять местно, внутриочагово и системно (подкожно, внутримышечно или внутривенно). Установлено, что при применении ИФ у пациентов в очагах поражения снижается количество вирусной ДНК (по данным ПЦР), что коррелирует с клиническим улучшением или исчезновением поражений.
В большинстве исследований была показана невысокая эффективность наружного применения ИФ. Некоторые авторы считают, что важным показанием для наружного применения ИФ является наличие субклинических очагов ВПЧ-инфекции и цервикальных внутриэпителиальных неоплазий (ЦВН), особенно вызванных типами ВПЧ высокого онкогенного риска.
По данным различных авторов, при системном применении α-ИФ в дозе от 1,5 до 3 млн МЕ внутримышечно или подкожно через день в течение четырех недель полное исчезновение бородавок наблюдается у 11—100% пациентов.
Из побочных эффектов при системном применении ИФ обычно наблюдаются гриппоподобные явления, выраженность которых зависит от полученной дозы. Эти побочные воздействия можно ослабить приемом нестероидных противовоспалительных препаратов.
Учитывая, что эффективность системной монотерапии ИФ все-таки недостаточно предсказуема и не очень высока, а также принимая во внимание высокую стоимость такого лечения, этот метод не получил широкого распространения в клинической практике.
По данным различных авторов, наиболее эффективно внутриочаговое применение α- и β-ИФ. Такой способ терапии приводит к исчезновению 35—62,5% бородавок, причем как подвергавшихся, так и не подвергавшихся воздействию. Есть сообщения о достаточно высокой эффективности внутриочагового применения α-ИФ при лечении упорных к терапии (ПФ, электрокаутером, жидким азотом, лазером) плоских генитальных бородавок: его применяли в дозе 1 млн МЕ внутриочагово — полное излечение 78% больных (при контроле через четыре месяца).
На российском рынке сегодня представлен широкий выбор интерферонов различных производителей, как отечественных, так и зарубежных, — виферон, кипферон, реаферон, роферон-А, интрон А, реальдирон и т. д. Предпочтительнее сегодня использовать рекомбинантные, а не человеческие интерфероны.
Есть сообщения об эффективном применении индукторов ИФ в виде монотерапии. Представляет интерес местное использование низкомолекулярного производного имиквидазохинолинамина — имиквимода, который является индуктором цитокинов и, в частности, α-ИФ. Его применяют в виде крема 5% три раза в неделю либо ежедневно на ночь, до полного исчезновения высыпаний (но не более четырех месяцев). Полное исчезновение кондилом наблюдается у 56% больных при первом режиме дозирования и у 71% при ежедневном применении (плацебо — 14%), а с учетом случаев, когда удалось достичь регрессии высыпаний более чем на 50%, лечение может быть признано успешным у 81—93% пациентов. При контрольных обследованиях, проводившихся в течение одного года, рецидивы наблюдались лишь у 13—19%. При ежедневном применении чаще развивались местные побочные эффекты: покраснение, отечность, эрозии. Крем особенно интересен при лечении субклинической ВПЧ-инфекции. Имиквимод в России пока не зарегистрирован.
Комбинированные методы
Более предпочтительным является применение ИФ или его индукторов, а также других активаторов противовирусного иммунитета, в качестве адъювантной терапии в комбинации с различными деструктивными методами. Иммунные препараты повышают эффективность лечения и позволяют снизить частоту рецидивов. Определенное значение комбинированная иммунотерапия имеет при лечении упорных, плохо поддающихся лечению бородавок. Для лечения предложены различные методики, основанные на применении иммунных препаратов в сочетании с криотерапией, лазеротерапией, электрокоагуляцией, солкодермом и т. д.
Так, например, выявлено, что сочетание ИФ с лазеротерапией более эффективно, чем только лазеротерапия: полное исчезновение бородавок наблюдается у 52–81,5% и 19–61% пациентов соответственно. СО2-лазерное иссечение в сочетании с терапией низкими дозами α-ИФ (по 1—3 млн МЕ в сутки в течение пяти—семи дней, затем перерыв три-четыре недели, таких три-четыре цикла) повышает эффективность лечения и позволяет снизить процент рецидивов, наблюдающихся после применения только лазеротерапии. При небольших остроконечных кондиломах дополнение лазерной терапии или электрокоагуляции местным применением геля, содержащего β-ИФ 0,1 млн МЕ/г пять раз в день в течение четырех недель эффективно предотвращает рецидивы.
Однако, по данным The Condylomata International Collaborative Study Group, применение α-ИФ (три раза в неделю в течение четырех недель) после удаления всех видимых кондилом СО2-лазером не дает каких-либо положительных результатов в сравнении с плацебо (полное излечение у 18%, рецидивы у 35% больных). Согласно M. R. Hopel соавт., сочетание α-ИФ (3—6 пятидневных курсов с интервалом в две недели) с деструктивными и/или хирургическими методами, несмотря на повышение эффективности лечения упорных, не поддающихся терапии кондилом, не предотвращает развитие рецидивов (они возникают у 50% больных).
При лечении кондилом заднего прохода предлагается сначала хирургическое удаление крупных образований, затем прижигание очагов эл/током и одна инъекция α-ИФ в дозе 500 тыс. МЕ в прямую кишку. Применение ИФ таким способом позволяет сократить число рецидивов (12% при применении ИФ, 39% — без ИФ).
Повысить эффективность лечения, воздействуя на противовирусный иммунитет, можно благодаря применению индукторов эндогенного интерферона и других активаторов иммунитета. На российском аптечном рынке представлено множество индукторов интерферона, в основном отечественных производителей; наиболее известные из них — гепон, ридостин, циклоферон, неовир — при системном и/или местном применении позволяют повысить эффективность лечения, воздействуя на частоту рецидивов. Так, например, аппликации гепона на очаги ВПЧ-поражений после их удаления каким-либо деструктивным методом (от трех до шести аппликаций через день) позволяют ускорить процесс заживления и снижают уровень рецидивирования.
Интересным и перспективным является применение активатора противовирусного иммунитета — иммуномакса. Его можно использовать при рецидивирующих остроконечных кондиломах в комбинации с любым из деструктивных методов. Больным удаляют остроконечные кондиломы и одновременно назначают внутримышечные инъекции иммуномакса по 200 ед. один раз в сутки на 1-й, 2-й, 3-й, 8-й, 9-й и 10-й дни лечения. Отсутствие рецидивирования кондилом сразу по окончании лечения наблюдается у 68% больных, после дополнительных сеансов деструкции эффективность лечения достигает 98% (при контрольном наблюдении не менее трех месяцев). Сегодня в литературе очень редко можно встретить работы, авторы которых обращали бы внимание на выделение вируса папилломы человека (ВПЧ) из очагов поражений до и после лечения. Интересен факт исчезновения ВПЧ из очагов поражения в ходе терапии иммуномаксом. Сразу после лечения в полтора-два раза сокращается число больных с резко положительным результатом ДНК-исследования на ВПЧ, как для вирусов высокого риска онкогенности (с 48,9 до 21,3%), так и для низкого риска (с 48,9 до 34%). К концу периода наблюдения вирусы с высоким риском онкогенности обнаруживаются у 19,2% больных (только слабоположительные результаты), до лечения — у 63,8%. Вирусы с низким риском онкогенности выделяются у 25,6% (до лечения у 61,9%). Полученные результаты показывают возможность применения иммуномакса в качестве монотерапии при бессимптомном вирусоносительстве. Особенно это актуально для женщин, у которых при наличии ВПЧ повышен риск развития цервикальной дисплазии и рака шейки матки. При лечении дисплазии одним из деструктивных методов, которые приводят к ликвидации только клинических и субклинических изменений, можно попробовать добиться исчезновения ВПЧ из генитального тракта, добавляя к курсу стандартной терапии иммуномакс.
Комбинированные методы терапии, основанные на сочетании деструкции видимых поражений с назначением активаторов противовирусного иммунитета (интерферонов, их индукторов, иммуномакса), наиболее соответствуют критериям выбора оптимального способа лечения — высокая эффективность и низкая частота рецидивов.
Таким образом, существует множество различных консервативных методов удаления аногенитальных бородавок. Эффективность методов, по данным разных авторов, варьирует от 50% до 94%. Ни один из способов лечения не может быть признан панацеей, так как частота рецидивов, являющаяся очень важным показателем любого метода, достаточно высока при любом способе лечения. Врач выбирает терапию в зависимости от сопутствующих обстоятельств, включая пожелания самого больного. Лечение должно быть индивидуальным: в каждом конкретном случае необходимо подбирать наиболее оптимальный метод. Проблема рецидивов не зависит от выбора терапии. Уровень рецидивирования составляет в среднем 25—30% в течение трех месяцев после лечения. Рецидивы аногенитальных бородавок чаще всего связаны с реактивацией инфекции, а не с реинфекцией от полового партнера. При отсутствии терапии существуют три варианта развития событий: бородавки могут разрешаться самостоятельно, оставаться без изменений или прогрессировать. При этом всегда нужно принимать во внимание возможность персистенции вируса при отсутствии каких-либо клинических проявлений.
При лечении аногенитальных бородавок кроме удаления самих очагов следует решать следующие важные задачи:
А. М. Соловьев, кандидат медицинских наук
МГМСУ, Москва