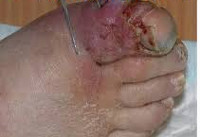
Чем лечить анаэробы у мужчин
Лечение урогенитальных инфекций
Записаться к врачу
+7 (812) 953-97-00
Урогенитальные инфекции ИППП – это бактерии и вирусы, которые при попадании в половые пути могут привести к неприятным симптомам, таким как: Урогенитальные инфекции
Возбудителями инфекционного процесса являются различные группы микроорганизмов, как патогенные — пагубно влияющие на организм, вызывающие опасные заболевания, так и условно — патогенные формы, которые вредят организму только в определенных условиях.
Заражение урогенитальными инфекциями происходит только половым путем: вагинальным, анальным, генитально-оральным. Таким образом урогенитальные инфекции могут быть обнаружены как во влагалище — у женщин, в мочеиспускательном канале — у мужчин, так и в прямой кишке и ротовой полости у обоих полов.
| Урогенитальные инфекции: | Опасность для организма и действия пациента: |
| ДНК Enterobacterium spp (входит в показатель «общая бактериальная масса» в женском мазке) | Энтеробактерии – кишечные бактерии – не являются ИППП. Вызывают воспалительные процессы в органах малого таза у мужчин и женщин. Может понадобиться профилактическое лечение у врача венеролога. |
| ДНК Streptococcus spp (входит в показатель «общая бактериальная масса» в женском мазке) | Стрептококк – грамоположительная бактерия обитает в кишечнике, носоглотке и урогенитальном тракте – не является ИППП. Повышенное количество может вызвать бактериальный вагиноз, эндометрит – у женщин, у мужчин – простатит, баланопостит, уретрит. Может понадобиться профилактическое лечение у врача венеролога. |
| ДНК Staphylococcus spp. (входит в показатель «общая бактериальная масса» в женском мазке) | Стафилококк – грамположительная бактерия обитает в кишечнике, носоглотке и урогенитальном тракте – не является ИППП. Повышенное количество может вызывать дисбиоз, циститы, уретриты. Может понадобиться профилактическое лечение у врача венеролога. |
| ДНК Gardnerella vaginalis / Prevotella bivia / Porphyromonas spp. | Гарднереллез – микроаэрофильная влагалищная бактерия – не является ИППП. У мужчин может вызывать уретрит и баланопостит. У женщин вызывает бактериальный вагиноз, выделения с «рыбным» запахом. Требует лечения у врача венеролога. |
| ДНК Eubacterium spp. (входит в показатель «общая бактериальная масса» в женском мазке) | Эубактериум – анаэробный микроорганизм обитающий в кишечнике – не является ИППП. При попадании в мочеполовой тракт может вызвать воспалительные процессы у мужчин и женщин. Может понадобиться профилактическое лечение у врача венеролога. |
| ДНК Sneathia spp./Leptotrihia spp./Fusobacterium spp. (входит в показатель «общая бактериальная масса» в женском мазке) | Снетия / Лептотрихия / Фузобактериум – облигатно-анаэробные микроорганизмы – не являются ИППП. В большом количестве могут вызвать неприятные выделения из половых путей. Требуют лечения только при наличии жалоб. |
| ДНК Megasphaera spp./Veilonella spp./Dialister spp. (входит в показатель «общая бактериальная масса» в женском мазке) | Мегасфера / Виелонелла / Диалистер –облигатно-анаэробные микроорганизмы, обитающие в кишечнике и ротовой полости – не являются ИППП. Требуют лечения у врача венеролога в профилактических целях и при наличии жалоб. |
| ДНК Lachnobacterium spp./Clostridium spp. (входит в показатель «общая бактериальная масса» в женском мазке) | Лахнобактериум / Клостридии – облигатно-анаэробные микроорганизмы, обитающие в кишечнике – не являются ИППП. Могут приводить к воспалительным процессам мочеполового тракта. Требуют лечения у врача венеролога в профилактических целях и при наличии жалоб. |
| ДНК Mobiluncus spp./Corynebacterium spp. (входит в показатель «общая бактериальная масса» в женском мазке) | Мобилункус / Корнибактериум – анаэробные микроорганизмы мочеполового тракта мужчин и женщин – не являются ИППП. При снижении иммунитета могут вызвать простатит, уретрит. Требуют лечения у врача венеролога в профилактических целях и при наличии жалоб. |
| ДНК Peptostreptococcus spp. (входит в показатель «общая бактериальная масса» в женском мазке) | Пептострептококус – анаэробная бактерия, обитает в ротовой полости, кишечнике, влагалище – не является ИППП. При наличии жалоб требует лечения у врача венеролога. |
| ДНК Atopobium vaginae (входит в показатель «общая бактериальная масса» в женском мазке) | Атопобиум – влагалищный облигатно-анаэробный микроорганизм – не является ИППП. У мужчин может вызывать уретрит и баланопостит, требует лечения у врача венеролога в профилактических целях. |
| ДНК Candida spp. | Кандида – дрожжеподобная грибковая инфекция, не является ИППП. При наличии жалоб требует лечения у врача венеролога. |
| ДНК Mycoplasma hominis | Микоплазма хоминес – условно-патогенный микроорганизм – ИППП, требует лечения у врача венеролога, независимо от сопутствующей симптоматики. |
| ДНК Ureaplasma (urealyticu+parvum) | Уреаплазма уреалитикум + парвум – условно-патогенный микроорганизм – ИППП, требует лечения у врача венеролога, независимо от сопутствующей симптоматики. |
| ДНК Neisseria gonorrhoeae | Гонококовая инфекция (гонорея) – особо опасная ИППП, требует экстренного лечения у врача венеролога, независимо от сопутствующей симптоматики. |
| ДНК Chlamydia trachomatis | Хламидия (хламидиоз) – особо опасная ИППП, требует экстренного лечения у врача венеролога, независимо от сопутствующей симптоматики. |
| ДНК Mycoplasma genitalium | Микоплазма гениталиум (микоплазмоз) – ИППП, требует экстренного лечения у врача венеролога, независимо от сопутствующей симптоматики. |
| ДНК Trichomonas vaginalis | Трихомонада (трихомониаз) – особо опасная ИППП, требует экстренного лечения у врача венеролога, независимо от сопутствующей симптоматики. |
| ДНК Herpes Simplex Virus 1,2 | Вирус генитального герпеса 1 и 2 типа – ИППП. Требуется лечение у врача венеролога, независимо от сопутствующей симптоматики. |
ВАЖНО!! УВАЖАЕМЫЕ ПАЦИЕНТЫ — УРОГЕНИТАЛЬНЫЕ (ПОЛОВЫЕ) ИНФЕКЦИИ НЕ ЛЕЧАТСЯ ОДНОЙ ВОЛШЕБНОЙ ТАБЛЕТКОЙ ИЛИ СВЕЧКОЙ ОТ ВСЕХ ИНФЕКЦИЙ, ДЛЯ ЛЕЧЕНИЯ КАЖДОЙ ИНФЕКЦИИ СУЩЕСТВУЕТ СВОЙ ПРЕПАРАТ, ДОЗИРОВКА КОТОРОГО НАЗНАЧАЕТСЯ ВРАЧОМ ИСХОДЯ ИЗ ДАВНОСТИ И СТЕПЕНИ ЗАРАЖЕНИЯ
ИППП — инфекции передающиеся половым путем требуют срочного лечения у врача венеролога. Самолечение сбивает симптоматику и переводит инфекцию в хроническую форму, которую в последствие трудно будет вылечить.
Условно — патогенные микроорганизмы — не так безобидны как могут казаться. При определенных факторах: стрессы, недосыпы, переутомляемость, снижение иммунитета — условно-патогенные микроорганизмы начинают усиленно размножаться и вызывать заболевания репродуктивных органов.
Урогенитальные инфекции последствия:
Профилактика урогенитальных инфекций урогенитальные инфекции
Для того, чтобы избежать присоединения инфекции следует соблюдать несложные правила:
Что такое бактериальный вагиноз (дисбактериоз влагалища)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Чурсиной Ю.А., гинеколога со стажем в 7 лет.
Определение болезни. Причины заболевания
Бактериальный вагиноз — это инфекционное невоспалительное заболевание, при котором во влагалище происходит обильный рост определённых микроорганизмов и резкое снижение молочнокислых бактерий, обладающих защитными свойствами.
Причины бактериального вагиноза весьма разнообразны. К ним можно отнести как банальные нарушения интимной гигиены, так и более сложные ситуации.
К факторам, влияющим на микрофлору и способствующим возникновению болезни можно отнести:
Возможен ли бактериальный вагиноз у мужчин
Бактериальный вагиноз у мужчин невозможен. Однако мужчина может быть носителем инфекции, которая станет причиной бактериального вагиноза у женщины.
Бактериальный вагиноз у ребёнка
Биоценоз микрофлоры ребёнка формируется при прохождении через родовые пути матери. Если мама — носитель возбудителей бактериального вагиноза, то такая же флора будет и у ребёнка. В таком случае у девочки может развиться бактериальный вагиноз.
Влияние вагиноза на процесс зачатия и на беременность
Бактериальный вагиноз связан со следующими заболеваниями: бесплодие, невынашивание беременности, замершие беременности, преждевременные роды, хориоамнионит (инфицирование оболочек плода и жидкости, окружающих ребёнка в утробе матери) и истмико-цервикальная недостаточность (преждевременное открытие шейки матки при беременности). В основе этих заболеваний лежит хронический эндометрит, возникающий под влиянием возбудителей вагиноза.
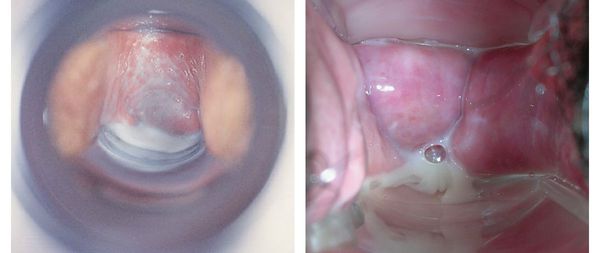
Симптомы бактериального вагиноза
Основной признак бактериального вагиноза — это обильные жидкие однородные выделения из половых путей с неприятным запахом. Они могут быть серого или белого цвета.
Чувство жжения и зуда также характерны для вагинита — воспалительного процесса во влагалище. От бактериального вагиноза его отличает чувство сухости влагалища, а также покраснение и отёк его оболочки.
Патогенез бактериального вагиноза
У бактериального вагиноза нет одного конкретного возбудителя — он может быть вызван различными микроорганизмами. К наиболее частым причинам вагиноза относят не только упомянутые G.vaginalis, но и фузобактерии, пептострептококки, вейлонеллу, вагинальный атопобиум, а также бактерии Peptoniphilus, Prevotella, P. bivia и M. Mulieris. Чаще всего развитие болезни провоцирует сочетание 2-3 микроорганизмов и более.
Как передаётся бактериальный вагиноз
Классификация и стадии развития бактериального вагиноза
На данный момент какая-либо классификация и разделение на стадии заболевания отсутствуют. Кода в МКБ-10 (Международной классификации болезней), который бы соответствовал диагнозу «Бактериальный вагиноз», тоже нет. Для кодирования данного состояния используются другие коды. Чаще всего его относят к «N86. Другие воспалительные заболевания влагалища», что является неправильным и не всегда корректным.
Ранее использовалась классификация, предложенная Е.Ф. Кира в 1995 году. Согласно ей, выделяли четыре типа вагинального микробиоценоза — совокупности микроорганизмов, обитающих во влагалище:
Сегодня такая классификация не используется из-за значительного расширения познаний о микробиоценозе влагалища и появлении современных методов лабораторной диагностики.
Классификация бактериального вагиноза на основании микроскопического исследования:
Осложнения бактериального вагиноза
Чем опасен бактериальный вагиноз
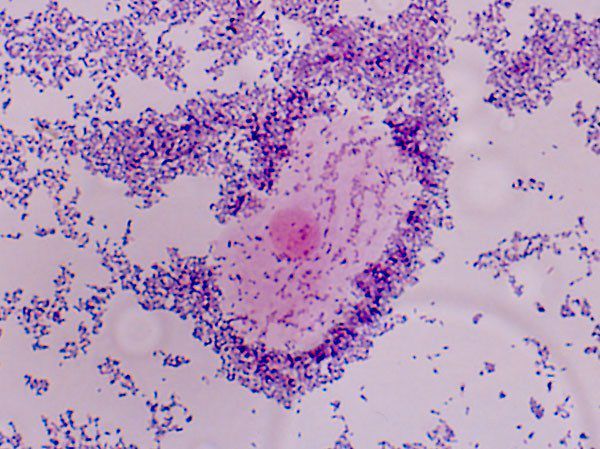
Диагностика бактериального вагиноза
Диагностика бактериального вагиноза обычно не представляет существенных трудностей. Тем не менее при постановке диагноза часто можно встретить ошибки: как гипердиагностику (когда пациентке приписывается болезнь, которой у неё на самом деле нет), так и гиподиагностику.
Чаще всего правильно определить заболевание удаётся уже при первом обращении женщины к врачу. В таких случаях диагноз ставится на основании характерных жалоб, данных осмотра и Рh-метрии влагалищных выделений. Иногда может понадобится достаточно обширное клинико-лабораторное обследование.
Какие показатели важны для диагностики бактериального вагиноза
В диагностике бактериального вагиноза используются критерии R. Amsel. К ним относятся:
Диагноз «Бактериальный вагиноз» устанавливается при наличии минимум трёх признаков.
Также существует полуколичественная оценка мазков влагалищной жидкости, окрашенных по Граму, по шкале от 0 до 10. Сейчас этот метод практически не используется.
Для лабораторной диагностики бактериального вагиноза применяется метод PCR Real Time в рамках комплексного анализа микрофлоры влагалища. Существует ряд тест-систем, самыми распространёнными из которых являются Фемофлор 16+КВМ и Фемофлор скрин. Данные тест-системы позволяют получить достаточно полное представление об особенностях микробиоценоза влагалища женщины и назначить обоснованное лечение.
К клиническим методам диагностики относят различные экспресс-тесты: Fem-exam, BVBlue, Pip-activity TestCard. Однако все они диагностики широко не применяются в клинической практике. В основном это связано с их недостаточной чувствительностью.
Дифференциальная диагностика с трихомониазом, кандидозом и уреаплазмозом
Лечение бактериального вагиноза
К какому врачу обратиться
Лечением бактериального вагиноза занимается гинеколог.
Когда стоит обратиться к врачу
К врачу следует обратиться при появлении симптомов бактериального вагиноза: обильных выделениях из половых путей с неприятным запахом, зуде или жжении во влагалище и в области прямой кишки, нарушении мочеиспускания и болезненных ощущениях во время или после полового акта.
Как лечить вагиноз дома. Народные средства от бактериального вагиноза
Ни в коем случае нельзя заниматься самолечением — его должен назначать врач, иначе это может негативно сказаться на здоровье женщины.
Чем лечить бактериальный вагиноз
Для устранения бактериального вагиноза используют антисептические средства и различные комбинированные препараты. В настоящее время доказана эффективность двухэтапной схемы лечения бактериального вагиноза: первый этап заключается в применении антисептических средств, а второй — в восстановлении микрофлоры влагалища.
Существует достаточно много как зарубежных, так и российских рекомендаций и схем лечения данного заболевания. В соответствии с Евразийскими клиническими рекомендациями по рациональному применению антимикробных средств в амбулаторной практике, при устранении бактериального вагиноза следует использовать следующие препараты [7] :
Средства терапии первой линии:
Средства терапии второй линии:
Продолжительность и кратность приёма этих средств определяется врачом индивидуально. Кроме того, существует значительное количество комбинированных препаратов.
Эубиотики (пробиотики)
Для восстановления вагинальной микрофлоры могут быть использованы вагинальные капсулы с живыми лактобактериями и гель с молочной кислотой.
Особенности лечения у беременных
В первом триместре беременности не применяют препараты системного действия. Лечение проводят только местно, свечами, например «Клиндацином». Со второго-третьего триместра, помимо местного лечения, можно применять метронидазол и клиндамицин в таблетках.
Питание при бактериальном вагинозе
Соблюдение диеты на течение бактериального вагиноза не влияет. При лечении следует исключить алкоголь, так как применяемые препараты могут замедлить расщепление этилового спирта, в результате чего общее самочувствие ухудшится.
Прогноз. Профилактика
Прогноз при своевременно начатом лечении в большинстве случаев благоприятный. Иногда возможны рецидивы заболевания. При их возникновении необходим комплексный подход к пациентке, полное клинико-лабораторное обследование и исключение сопутствующих заболеваний, которые могут увеличивать риск повторного появления бактериального вагиноза. Также нужно проконсультироваться по вопросам питания и образа жизни.
В качестве профилактики возникновения бактериального вагиноза прежде всего нужно исключить такие факторы риска, как:
Существенный вклад в развитие и рецидивы заболевания вносят частые смены половых партнёров, тяжёлые сопутствующие заболевания, злоупотребление алкоголем, курение. Всего этого следует избегать.
Немаловажную роль в профилактике играет здоровый образ жизни, адекватная физическая активность и приверженность к правильному питанию — вегетарианская диета и повышенное потребление «быстрых» углеводов увеличивают риск рецидива.
Для предупреждения бактериального вагиноза нужно следовать рекомендациям по интимной гигиене:
Можно ли заниматься сексом при бактериальном вагинозе
Заниматься сексом при бактериальном вагинозе можно, так как он не относится к заболеваниям, передающимся половым путём. Однако бактериальный вагиноз ассоциирован с уреаплазмозом и микоплазмозом, поэтому клинические проявления могут возникнуть и у сексуального партнёра заражённой женщины. Кроме того, бактериальный вагиноз зачастую сопровождается характерным «рыбным» запахом и обильными выделениями, что может стать психологической преградой для полового акта.
Негонококковые уретриты у мужчин: этиология и обоснование этиотропной терапии
Термин «негонококковые уретриты» (НГУ) впервые был предложен в 1954 г. для обозначения случаев воспаления уретрального канала, вызванного иной, чем гонококк, инфекцией. До этого происхождение всякого уретрита считали гонококковым, а случаи отсутствия в м
Термин «негонококковые уретриты» (НГУ) впервые был предложен в 1954 г. для обозначения случаев воспаления уретрального канала, вызванного иной, чем гонококк, инфекцией. До этого происхождение всякого уретрита считали гонококковым, а случаи отсутствия в материале из уретры гонококка объясняли диагностическими трудностями.
Статистические данные свидетельствуют о том, что НГУ является широко распространенным заболеванием, как в Российской Федерации, так и за рубежом. Если в 1996 г. в США частота выявления НГУ составила 2 млн случаев за год (S. O. Aral и соавт., 1999), то к 2000 г. она уже выросла до 3 млн случаев за год (CDC, 2000). В мире, по суммарной оценке, регистрируют около 50 млн случаев НГУ в год (S. O. Aral и соавт., 1999). Только по официальным данным, НГУ в России ежегодно заболевают около 350 тыс. человек, однако эти цифры явно занижены из-за недостаточной регистрации инфекций, вызывающих НГУ.
Этиологические факторы НГУ
Негонококковые уретриты у мужчин могут быть вызваны самыми разнообразными возбудителями, включая облигатные патогены, такие как Chlamydia (C.) trachomatis или Mycoplasma (M.) genitalium, и условно-патогенные микроорганизмы, например другие микоплазмы, в частности Ureaplasma (U.) urealyticum. Причиной НГУ могут быть также вирусы и простейшие.
Роль хламидий в возникновении НГУ. В 70–80-е гг. прошлого века считалось, что около 50% и более случаев НГУ вызваны хламидийной инфекцией. Исследования последующих десятилетий продемонстрировали существенное снижение частоты уретритов у мужчин, вызванных C. trachomatis, — до 20% и менее (M. Shahmanesh, 2001; М. А. Гомберг и соавт., 2002; C. S. Bradshaw и соавт., 2006). В то же время в течение последних лет в Российской Федерации заболеваемость урогенитальной хламидийной инфекцией вышла на первое место среди всех бактериальных инфекций, передаваемых половым путем (ИППП). В нашей стране, начиная с 2004 г., это вторая по распространенности регистрируемая ИППП после трихомониаза.
Уретриты, вызванные С. trachomatis, проявляются обычно скудной клинической симптоматикой, но могут сопровождаться, хотя это нетипично, и признаками острого воспаления, сходными с теми, которые характерны для гонореи.
Роль генитальных микоплазм в возникновении НГУ. Установлено, что человек является естественным хозяином 13 видов микоплазм, из которых возможными возбудителями НГУ могут являться M. hominis, M. genitalium и U. urealyticum. Кроме этих видов микоплазм в урогенитальном тракте также обнаруживают M. fermentans, M. primatum, M. pirum, M. spermatophilum, M. penetrans, M. pneumoniae. Их роль и взаимодействие с организмом человека сегодня активно исследуются, но пока их значение в возникновении уретритов у мужчин не вполне ясно. Так, S. Sharma и соавторы (1998), используя полимеразную цепную реакцию (ПЦР) в дополнение к бактериологическому исследованию, выявили M. pneumoniae у мужчин, которые болели рецидивирующим уретритом и предъявляли жалобы на боль в области уретры и предстательной железы.
Вопрос о роли генитальных микоплазм в этиологии НГУ остается нерешенным из-за широкого распространения этих микроорганизмов и их частого выявления у лиц, не имеющих клинической симптоматики. Мнения исследователей по данному вопросу расходятся. Одни авторы склонны относить микоплазмы к облигатным патогенам, вызывающим уретриты, цервициты, простатиты, послеродовые эндометриты, пиелонефриты, бесплодие, различную патологию беременности и плода. Соответственно, по мнению этих авторов, следует добиваться эрадикации микоплазм в случае их выявления. Другие считают, что микоплазмы являются условно-патогенной флорой урогенитального тракта, и лишь при определенных условиях способны вызывать инфекционно-воспалительные заболевания мочеполовых органов. Большинство зарубежных авторов относят все микоплазмы, за исключением M. genitalium, к условно-патогенной флоре. Именно поэтому в МКБ-10 таких заболеваний, как «микоплазмоз», «уреаплазмоз» или «уреаплазменная инфекция», не зарегистрировано. По мнению многих исследователей, из микоплазм без всяких оговорок к числу патогенов, способных вызывать уретриты, можно отнести только M. genitalium. Однако опыты на экспериментальных моделях, эксперименты по аутоинокуляции культуры U. urealyticum, а также изучение иммунного ответа макроорганизма доказывают участие этих прокариотов в возникновении НГУ. Статистические исследования установили достоверную корреляцию между наличием в мазках из уретры уреаплазмы и хроническими НГУ, в то же время не выявлено достоверной взаимосвязи U. urealyticum c острыми НГУ (P. Horner, 2001). Также не доказана роль U. parvum в возникновении уретритов.
Показатели инфицированности урогенитального тракта микоплазмами весьма разноречивы и среди сексуально активного населения варьируют от 10 до 50%. У больных с НГУ U. urealyticum выделяют в 20–34% и выше (В. И. Кисина, 2002). Уреаплазмы, как правило, обнаруживают у людей, ведущих активную половую жизнь, а наиболее часто эти микроорганизмы выявляют у лиц, имеющих трех и более половых партнеров. Обобщенные данные об эпидемиологии M. genitalium были представлены David Taylor-Robinson (2001) на основе анализа работ 19 наиболее авторитетных исследователей, согласно которым эти микроорганизмы выделяли в 10–50% среди больных НГУ и у 0–17,7% здоровых лиц. Позже N. Dupin и соавторами (2003) было показано, что исчезновение этих микроорганизмов из уретры сопровождается разрешением уретрита, и наоборот — рецидив заболевания может быть связан с использованием препаратов, недостаточно активных в отношении M. genitalium.
Клиническая картина уретрита, при котором обнаруживаются микоплазмы, так же как при инфицировании хламидиями, не имеет патогномоничных симптомов. M. genitalium чаще обнаруживают у лиц с хроническими уретритами, вероятной причиной рецидивирования которых она является. L. Mena и соавторы (2002) показали, что пациенты с M. Genitalium-ассоциированными уретритами в меньшей степени, чем больные с гонококковыми уретритами, предъявляют жалобы на дизурию и выделения, а выделения у них гораздо реже носят гнойный характер.
Как и в большинстве случаев выявления условно-патогенной флоры, для микоплазм выделяют ряд факторов, способствующих развитию инфекционно-воспалительных процессов. Наиболее важными из них являются иммунные нарушения, изменения гормонального статуса, массивность колонизации, ассоциации с другими бактериями. Все эти факторы следует учитывать при выборе тактики ведения таких больных.
Роль аэробной и анаэробной сапрофитной флоры в возникновении НГУ. Роль различной сапрофитной флоры при НГУ весьма спорна. С одной стороны, очевидно, что часто высокие уровни колонизации этими бактериями урогенитального тракта обнаруживаются у мужчин с уретритом, но, с другой стороны, нередко такие же высокие показатели колонизации выявляются у мужчин без признаков воспаления. Можно предположить, что в ряде случаев отдельные представители условно-патогенной флоры или их ассоциации благодаря определенным условиям способны стать возбудителями уретрита, а в иных ситуациях они могут поддерживать воспаление, инициированное другими факторами.
Исследования пациентов с НГУ показали, что это заболевание может быть проявлением мочевой инфекции верхних отделов мочевыводящих путей, основную роль в которой играют грамотрицательные микробные агенты — Pseudomonas aeruginosa, Proteus spp., Escherichia coli и др.
(I. Schugt и соавт., 2004). Имеются также сведения об определенном значении грамположительной флоры — Staphilococcus spp., Corinebacterium spp. В таких случаях, когда роль этой флоры в возникновении НГУ вероятна, при выборе адекватной терапии необходимо определять чувствительность этих микроорганизмов к антимикробным препаратам (W. W. Li и соавт., 2003). Исследования, проведенные в начале 90-х гг. прошлого века (J. C. Lefevre и соавт., 1991), указывают на частое выявление у пациентов с уретритами Haemophilus spp., Gardnerella vaginalis, стрептококков группы В и Escherichia coli.
Возбудители кишечных инфекций привлекают к себе внимание как агенты, способные вызвать НГУ, в связи с возможностью передачи этих микроорганизмов при орогенитальных и аногенитальных контактах. На потенциальную способность энтеробактерий вызывать инфицирование уретры указывали Ю. К. Скрипкин и соавторы (1999). Как показал в своей работе В. П. Ковалык (2006), нередко НГУ, вызванные условно-патогенной флорой, являются следствием незащищенных орогенитальных и аногенитальных контактов.
При уретритах выявляются различные виды негонококковых нейссерий, причем в 85% случаев это Neisseria (N.) meningitidis (М. Maini и соавт., 1992). Вероятными путями передачи инфекции в этих случаях моут быть орогенитальный или аногенитальный половые контакты, которые имеются в анамнезе у большинства из этих пациентов. Изредка такие уретриты клинически сильно напоминают гонококковую инфекцию, сопровождаясь гнойными выделениями и значительно выраженной дизурией.
Часто при исследовании уретрального содержимого как у здоровых людей, так и у мужчин с НГУ выявляются анаэробные бактерии. Сведения о роли анаэробов в возникновении уретритов противоречивы. Большинство исследователей не нашли каких-либо свидетельств патогенной роли этих микроорганизмов. В ходе микробиологических исследований, посвященных сравнительному изучению бактериальной флоры уретры у здоровых и больных НГУ, существенных различий в этом вопросе выявлено не было. E. A. Fontaine и соавторы (1986) отмечали лишь, что Bacteroides urealyticus, возможно, причастны к небольшому количеству случаев НГУ вследствие того, что этот вид несколько чаще выявляют у мужчин с НГУ, чем у здоровых лиц.
О роли анаэробов косвенно можно было бы судить по результатам двойных слепых плацебоконтролируемых исследований по применению метронидазола, который активен в отношении этих микроорганизмов. Однако работы P. D. Woolley и соавторов (1990) показали, что применение метронидазола в дополнение к тетрациклину не позволило улучшить эффективность терапии НГУ. В то же время D. A. Hawkins и соавторы (1988), применяя метронидазол, обнаружили, что в тех случаях, когда заболевание было ассоциировано с анаэробными бактериями, положительная динамика отмечалась значительно чаще, чем в группе без анаэробов.
Кроме перечисленных представителей условно-патогенной флоры, этиологическим или ассоциированным агентом при НГУ, согласно данным литературы, оказывались Streptococcus (Str.) pneumoniae, Str. viridans, Str. mitis, Str. sanguis, Str. аnginosus, Str. agalactiae, Enterococcus faecium, N. subflava, N. perflava и N. flava, Staphilococcus (S.) aureus, S. epidermidis, Corynebacterium pseudodiphtheriae, бактерии, входящие в роды Enterobacter (Spp.), Proteus (Spp.), Branhamella (Spp.), Moraxella (Spp.), Pseudomonas (Spp.) и др.
Роль простейших в возникновении НГУ. Практически единственным представителем этой группы микроорганизмов, который может являться возбудителем уретрита, являются Trichomonas (T.) vaginalis. Они впервые были описаны Alfred Donne в 1837 г., задолго до открытия других ныне известных ИППП. Длительное время T. vaginalis рассматривали как урогенитальный патоген, вызывающий воспалительные заболевания женской половой сферы. В настоящее время доля этих простейших в этиологическом спектре НГУ у мужчин составляет, по некоторым сообщениям, до 17%. В то же время при обследовании мужчин, сексуальных партнеров инфицированных T. vaginalis женщин, трихомонады выделяли лишь в 14–60% случаев (J. N. Krieger и соавт., 1995). Трихомонадная инфекция у мужчин часто протекает бессимптомно. В случае наличия симптомов клиническая картина трихомонадной инфекции у мужчин представлена в большинстве случаев острым НГУ, как правило, коротким по продолжительности. Также простейшие выявляли у 15% больных персистирующим уретритом. Трихомонадная инфекция — одна из самых распространенных ИППП в мире: ежегодно ею заболевают около 174 млн человек (ВОЗ, 2001).
Роль вирусов в возникновении НГУ. По современным представлениям, вирус простого герпеса (ВПГ) может быть причиной возникновения уретритов (P. J. Horner, 2001). Работы, проведенные с использованием современных методов диагностики, показали, что герпетические уретриты выявляются в 42,4–46,6% случаев у мужчин, страдающих рецидивирующим генитальным герпесом (Э. С. Балуянц, 1991; Т. Б. Семенова и соавт., 2001). По данным зарубежных исследований, частота обнаружения ВПГ при уретритах колеблется от 6 до 25% (P. D. Sturm и соавт., 2004; A. A. Oni и соавт., 1997). По данным В. П. Ковалыка (2006), у 44,4% больных с НГУ, возникшими после незащищенных орогенитальных контактов, этиологической причиной уретрита является ВПГ.
В. Н. Гребенюком и соавторами (1986) отмечено, что ассоциация ВПГ с грамотрицательными бактериями усиливает патогенность каждого возбудителя и является причиной устойчивости уретритов к лечению.
По данным N. Avgustinaki и соавторов (2004), у большинства пациентов с НГУ, ассоциированными с ВПГ первого и второго типа, в анамнезе нет указаний на эрозивные поражения половых органов, характерных для генитального герпеса.
Многие эксперты рекомендуют проводить исследования на ВПГ в качестве стандартного обследования при наличии синдрома выделений из уретры.
Аденовирусы также выделяли из урогенитального тракта у мужчин. Уретриты, ассоциированные с аденовирусами, чаще всего сопровождаются появлением эрозивно-язвенных поражений гениталий, конъюнктивитом, симптомами «простуды». Кроме того, клинические особенности уретрита включают наличие меатита и симптомов дизурии (C. S. Bradshaw и соавт., 2002). Первые сообщения появились в 1985 г. — при проведении иммунофлуоресцентного исследования авторы находили аденовирусы у 11,47% пациентов (S. Anghelescu и соавт., 1985). Эпидемиологические исследования последних лет указывают на то, что выделение аденовирусов происходит чаще в осенне-зимний период и встречается у 0,33–4% пациентов, обследующихся на ИППП (P. D. Swenson и соавт., 1995; C. S. Bradshaw и соавт., 2006).
В анамнезе у всех больных имелись незащищенные орогенитальные контакты.
Лечение больных с НГУ
Для разработки индивидуального плана лечения важно учитывать такие факторы, как вид возбудителя, давность инфицирования, история предшествовавшего лечения, наличия сопутствующей патогенной и условно-патогенной флоры.
Этиотропное лечение НГУ основывается на применении антибактериальных препаратов различных групп, активных в отношении основных возбудителей НГУ — хламидий и микоплазм. Активность препаратов в отношении любой инфекции определяется минимальной подавляющей концентрацией (МПК) в исследованиях in vitro. Показатели МПК, как правило, коррелируют с результатами клинического излечения. Оптимальными препаратами считаются антибиотики с наименьшей МПК, но следует помнить о важности таких параметров, как биодоступность, способность к созданию высоких внутритканевых и внутриклеточных концентраций, переносимость и комплаентность лечения.
Для выбора схемы адекватной терапии в конкретных случаях рекомендуется лабораторное определение чувствительности выделенных культур к различным антибиотикам. Но это в основном касается выявленной сапрофитной флоры. Так, многие авторы отмечают способность микоплазм быстро приобретать устойчивость к антибактериальным препаратам при их пассировании in vitro. Следовательно, необходимо тестирование свежевыделенных от больных штаммов. Другая сложность состоит в том, что при выявлении хламидий и микоплазм чувствительность к антибиотикам in vitro необязательно коррелирует с положительным эффектом in vivo. Это может быть связано с фармакокинетикой препаратов. Все эти факторы необходимо учитывать при назначении этиотропной терапии, которая во многих случаях может являться частью комбинированной терапии, особенно при смешанных инфекциях.
Европейское руководство по ведению больных с уретритами (2001) содержит рекомендации, согласно которым следует проводить лечение НГУ по базовым и альтернативным схемам.
Из приведенных схем видно, что основными антибиотиками, рекомендованными для лечения НГУ, являются препараты тетрациклинового ряда, макролиды и фторхинолоны.
Специально разработанных официальных отечественных руководств по лечению НГУ пока нет, но существуют рекомендации по лечению отдельных разновидностей НГУ — трихомонадной, хламидийной и микоплазменных инфекций. Если обобщить рекомендации, изложенные в основных отечественных руководствах («Федеральное руководство по использованию лекарственных средств», «Рациональная фармакотерапия заболеваний кожи и инфекций, передаваемых половым путем» (под ред. акад. РАМН, профессора А. А. Кубановой), «Методические материалы по диагностике и лечению наиболее распространенных инфекций, передаваемых половым путем, и заболеваний кожи (протоколы ведения больных), изданных ЦНИКВИ), то можно представить следующие схемы этиотропного лечения НГУ.
Антибиотики тетрациклинового ряда. Основные препараты:
Макролиды. Основные препараты:
Фторхинолоны:
Препараты тетрациклинового ряда являются самыми распространенными лекарственными средствами для этиотропного лечения больных НГУ. Несмотря на то что доксициклин применяется в лечении различной патологии несколько десятилетий, его активность против главных возбудителей НГУ остается высокой (D. Kilic и соавт., 2004).
В период лечения препаратами группы тетрациклинов больным необходимо избегать инсоляции из-за возможности фотосенсибилизации.
Этого побочного действия совершенно лишены антибиотики из группы макролидов. Все упомянутые руководства к препаратам выбора при лечении НГУ относят макролидный антибиотик азитромицин. Этому способствуют уникальные фармакокинетические характеристики азитромицина: продолжительный период полувыведения, высокий уровень всасывания и устойчивость к кислой среде, способность этого антибиотика транспортироваться лейкоцитами к месту воспаления, высокая и продолжительная концентрация в тканях, а также возможность проникновения внутрь клетки. Благодаря тому, что высокая терапевтическая концентрация азитромицина в тканях достигается после однократного приема стандартной дозы антибиотика и сохраняется в местах воспаления не менее 7 сут, с появлением азитромицина впервые возникла возможность эффективного лечения больных хламидийной инфекцией однократным приемом антибиотика внутрь. Сейчас на рынке появилось много дженериков азитромицина (например: азитрокс, хемомицин, зитролид). Оригинальным и наиболее известным препаратом азитромицина является сумамед, который используется в Российской Федерации с начала 90-х гг. прошлого века.
Преимуществами всех современных макролидных антибиотиков перед первым антибиотиком из этой группы эритромицином являются более высокая эффективность, улучшенная фармакокинетика, хорошая переносимость и меньшая кратность приема.
При приеме макролидов могут наблюдаться побочные эффекты со стороны желудочно-кишечного тракта (тошнота, рвота, диарея) и печени (повышение активности трансаминаз, холестаз, желтуха), а также аллергические реакции.
Наиболее благоприятный, по сравнению с другими макролидами, профиль безопасности имеет джозамицин. Частота побочных эффектов при его приеме не превышает 2–4%. Препарат не обладает гепатотоксичностью и почти не изменяет нормальную микрофлору кишечника. Кроме того, этот препарат в Российской Федерации разрешен к применению у беременных. На нашем фармацевтическом рынке джозамицин пока представлен единственным препаратом вильпрафен.
Необходимо обратить внимание, что уреаплазмы устойчивы к линкозаминам, но чувствительны к макролидам и стрептограминам, а остальные микоплазмы могут быть устойчивы к «старым» макролидам (эритромицин, ровамицин, олеандомицин) и стрептограминам, но высоко чувствительны к новейшим макролидам (джозамицин, кларитромицин) и линкозаминам.
Следующую группу препаратов, обладающих высокой активностью против широкого спектра возбудителей НГУ, составляют фторхинолоны. Единственными препаратами этой группы, которые авторы современных руководств рекомендуют для лечения хламидийной инфекции, являются офлоксацин и его усовершенствованный аналог — левофлоксацин. Ограничения в использовании фторхинолонов для лечения хламидийной инфекции связаны с тем, что в сравнении с антибиотиками других вышеперечисленных групп после терапии слишком высок процент рецидивов.
Такие фторхинолоны, как офлоксацин и спарфлоксацин, особенно высокоэффективны при НГУ, вызванных условно-патогенной сапрофитной флорой, так как обычно эта флора чувствительна к этим антибактериальным препаратам. Их «лидирующее положение» обусловлено широтой антибактериального спектра, высокой бактерицидной активностью, отличными фармакокинетическими характеристиками (быстротой всасывания, высокими концентрациями препарата в тканях, клетках, биологических жидкостях), низкой токсичностью. При лечении спарфлоксацином достигается более высокая комплаентность, так как препарат принимают лишь 1 раз в сутки. По данным Ю. Н. Перламутрова и соавторов (2002), спарфлоксацин также высокоэффективен при микоплазменной и уреаплазменной инфекциях.
Как и тетрациклины, фторхинолоны обладают фотосенсибилизирующим эффектом. Кроме того, препараты из группы фторхинолонов противопоказаны больным с нарушением функции печени и почек. Из побочных реакций после приема фторхинолонов могут наблюдаться диспепсические расстройства, тошнота, рвота, головокружение, аллергические реакции, тендиниты.
Для лечения трихомонадных НГУ рекомендован метронидазол — 2 г перорально однократно по 2,0 г в течение 3 дней или по 500 мг 2–3 раза в сутки в течение 5–7 дней. Кроме метронидазола, могут применяться и другие нитроимидазолы:
Эти препараты обладают несколько лучшими фармакокинетическими параметрами, чем метронидазол, что позволяет снижать дозировки и кратность применения. При этом существенных преимуществ перед метронидазолом эти препараты не имеют, поскольку если трихомонады оказываются устойчивыми к метронидазолу, они будут устойчивы и к другим нитроимидазолам.
Лечение, проводимое одновременно у обоих сексуальных партнеров, увеличивает эффективность лечения НГУ.
По данным В. П. Ковалыка (2006), для лечения НГУ, в этиологии которых установлена роль герпетической инфекции, эффективен валацикловир в курсовой дозе 4,0 г (по 2,0 г с интервалом 12 ч). Можно использовать и схемы, предполагающие более длительный прием противовирусных препаратов:
Если у пациента с НГУ, кроме герпетической инфекции, выявляют и бактериальную, то противогерпетическое лечение назначают как дополнение к антибактериальной терапии. В тех же случаях, когда кроме вирусов при уретритах ничего не обнаруживают, рекомендуется назначать только противовирусную терапию.
Несмотря на правильно проведенную антибиотикотерапию острых НГУ, в 20–69% случаев после окончания лечения через 1–2 нед развивается персистирующий или рецидивирующий уретрит (M. Janier и соавт., 1995; P. J. Horner и соавт., 1999; P. J. Horner и соавт., 2001).
Продолжающийся после лечения уретрита воспалительный процесс является одной из наименее изученных клинических проблем в венерологии. Несмотря на значительные усилия, которые предпринимаются для изучения этого явления, его этиология остается неясной.
Лечение больных хроническим или рецидивирующим НГУ
Поздняя обращаемость пациентов с НГУ, распространение самолечения являются причинами хронизации и осложненного течения заболевания. Терапия больных с длительно протекающими НГУ сопряжена со значительными трудностями в плане достижения клинической эффективности.
Единого подхода к лечению хронического уретрита не существует. Важно клинически и лабораторно подтвердить наличие такого уретрита, поскольку доля пациентов с уретральными симптомами, но без уретрита, достаточно высока.
Схема, предлагаемая Европейским руководством по лечению хронического уретрита: эритромицин — 500 мг 4 раза в день на протяжении 2 нед плюс метронидазол — 2 г однократно или по 400 мг 2 раза в день в течение 5 дней.
По данным K. K. Holmes и соавторов (1998), около 2/3 пациентов после прохождения этого курса лечения избавляются от уретрита, а у оставшейся 1/3 развиваются рецидивы или персистирующие уретриты.
Предлагаются также схемы лечения, отличающиеся большей длительностью приема антибиотиков — от 3 до 6 нед. Однако и они могут оказаться эффективными не для всех пациентов. Врачу важно попытаться найти причину неэффективности антибактериальной терапии и рецидивирования или персистенции уретрита.
Так, например, при длительном существовании в организме C. trachomatis могут менять свой типичный жизненный цикл на атипичный, когда происходит приостановка нормального жизненного цикла хламидий. При этом происходит формирование особых взаимоотношений в системе макро- и микроорганизмов, позволяющих этой системе сосуществовать. Такое явление получило название латенции и персистенции. Клинических проявлений при таком течении инфекции может не быть, как и передачи инфекции от одного сексуального партнера другому.
И антибактериальная терапия на этой стадии может не дать эффекта.
Персистенция хламидий требует особого подхода к больному. Применения одних антибиотиков при этой форме инфекции, как правило, недостаточно, поскольку все эффективные в отношении хламидий антибиотики обладают бактериостатическим действием и способны оказывать свое действие только на размножающиеся бактерии. При лечении таких состояний обычно рекомендуют сочетанную терапию антибиотиками и иммунокорректорами.
Наши наблюдения, основанные на лечении более 1000 больных персистирующим хламидиозом, показывают, что наиболее оптимальным в этих случаях является комбинированная терапия, основанная на сочетании антибиотиков и иммунных препаратов. При антибиотикотерапии используют стандартные для осложненной инфекции курсы и дозировки перечисленных выше антибиотиков. Но начинать лечение желательно с курса иммунотерапии. На основании собственных исследований мы предлагаем следующие варианты предшествующей назначению антибиотиков иммунотерапии:
Комбинированная терапия может оказаться эффективной и при рецидивирующих уретритах микоплазменной этиологии. В работе M. M. T. Hadson и соавторов (1998) сообщается о важности иммунологического статуса больного при уреаплазменной инфекции. Использование иммунотропной терапии может быть особенно актуальным при неэффективности хотя бы одного курса противомикробного лечения.
Наши собственные исследования показали, что при выборе иммунотропной терапии особенно высокую эффективность демонстрировал препарат иммуномакс. Этот препарат относится к группе иммуномодуляторов, и показан для коррекции ослабленного иммунитета, лечения и профилактики вирусных и бактериальных инфекций. Схема применения иммуномакса не отличается от способа его применения при рецидивирующей хламидийной инфекции.
Таким образом, адекватная, т. е. основанная на результатах клинико-лабораторных исследований и существующих рекомендациях, антибактериальная терапия позволяет достичь положительного эффекта при НГУ.
М. А. Гомберг, доктор медицинских наук, профессор
А. М. Соловьев, кандидат медицинских наук, доцент
В. П. Ковалык, кандидат медицинских наук
ЦНИКВИ, МГМСУ, Москва
Анаэробная инфекция
Анаэробная инфекция – это инфекционный процесс, вызываемый спорообразующими или неспорообразующими микроорганизмами в условиях, благоприятных для их жизнедеятельности. Характерными клиническими признаками анаэробной инфекции служат преобладание симптомов эндогенной интоксикации над местными проявлениями, гнилостный характер экссудата, газообразующие процессы в ране, быстро прогрессирующий некроз тканей. Анаэробная инфекция распознается на основании клинической картины, подтвержденной результатами микробиологической диагностики, газожидкостной хроматографии, масс-спектрометрии, иммуноэлектрофореза, ПЦР, ИФА и др. Лечение анаэробной инфекции предполагает радикальную хирургическую обработку гнойного очага, интенсивную дезинтоксикационную и антибактериальную терапию.
МКБ-10
Общие сведения
Анаэробная инфекция – патологический процесс, возбудителями которого выступают анаэробные бактерии, развивающиеся в условиях аноксии (отсутствия кислорода) или гипоксии (низкого напряжения кислорода). Анаэробная инфекция представляет собой тяжелую форму инфекционного процесса, сопровождающуюся поражением жизненно важных органов и высоким процентом летальности. В клинической практике с анаэробной инфекцией приходится сталкиваться специалистам в области хирургии, травматологии, педиатрии, нейрохиругии, отоларингологии, стоматологии, пульмонологии, гинекологии и других медицинских направлений. Анаэробная инфекция может возникнуть у пациентов любого возраста. Доля заболеваний, вызываемых анаэробной инфекцией, точно не известна; из гнойных очагов в мягких тканях, костях или суставах анаэробы высеваются примерно в 30% случаев; анаэробная бактериемия подтверждается в 2-5% случаев.
Причины
Анаэробы входят в состав нормальной микрофлоры кожи, слизистых оболочек, желудочно-кишечного тракта, органов мочеполовой системы и по своим вирулентным свойствам являются условно-патогенными. При определенных условиях они становятся возбудителями эндогенной анаэробной инфекции. Экзогенные анаэробы присутствуют в почве и разлагающихся органических массах и вызывают патологический процесс при попадании в рану извне. Анаэробные микроорганизмы делятся на:
Факторы риска
Условиями, благоприятствующими развитию анаэробной инфекции, являются повреждение анатомических барьеров с проникновением анаэробов в ткани и кровеносное русло, а также снижение окислительно-восстановительного потенциала тканей (ишемия, кровотечение, некроз). Попадание анаэробов в ткани может происходить при оперативных вмешательствах, инвазивных манипуляциях (пункциях, биопсии, экстракции зуба и др.), перфорации внутренних органов, открытых травмах, ранениях, ожогах, укусах животных, синдроме длительного сдавления, криминальных абортах и т. д. Факторами, способствующими возникновению анаэробной инфекции, выступают:
Кроме этого, большое значение имеет нерациональная антибиотикотерапия, направленная на подавление сопутствующей аэробной микрофлоры.
Патогенез
Основными факторами патогенности анаэробных микроорганизмов служат их количество в патологическом очаге, биологические свойства возбудителей, наличие бактерий-ассоциантов. В патогенезе анаэробной инфекции ведущая роль принадлежит продуцируемым микроорганизмами ферментам, эндо- и экзотоксинам, неспецифическим факторам метаболизма. Так, ферменты (гепариназа, гиалуронидаза, коллагеназа, дезоксирибонуклеаза) способны усиливать вирулентность анаэробов, деструкцию мышечной и соединительной тканей.
Классификация
В зависимости от локализации различают анаэробную инфекцию:
Течение анаэробной инфекции может быть молниеносным (в течение 1 суток с момента операции или травмы), острым (в течение 3-4 суток), подострым (более 4 суток).
Симптомы анаэробной инфекции
Независимо от вида возбудителя и локализации инфекционного очага, различным клиническим формам свойственны некоторые общие черты. В большинстве случаев анаэробная инфекция имеет острое начало и характеризуется сочетанием местных и общих симптомов. Инкубационный период может составлять от нескольких часов до нескольких суток (в среднем около 3-х дней).
Типичным признаком анаэробной инфекции служит преобладание симптомов общей интоксикации над местными воспалительными явлениями. Резкое ухудшение общего состояния больного обычно наступает еще до возникновения локальных симптомов. Проявлением тяжелого эндотоксикоза служит высокая лихорадка с ознобами, выраженная слабость, тошнота, головная боль, заторможенность. Характерны артериальная гипотония, тахипноэ, тахикардия, гемолитическая анемия, иктеричность кожи и склер, акроцианоз.
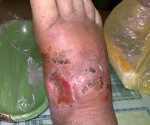
При раневой анаэробной инфекции ранним местным симптомом выступает сильная, нарастающая боль распирающего характера, эмфизема и крепитация мягких тканей, обусловленные газообразующими процессами в ране. К числу постоянных признаков относится зловонный ихорозный запах экссудата, связанный с выделением азота, водорода и метана при анаэробном окислении белкового субстрата. Экссудат имеет жидкую консистенцию, серозно-геморрагический, гнойно-геморрагический или гнойный характер, неоднородную окраску с вкраплениями жира и наличием пузырьков газа. На гнилостный характер воспаления также указывает внешний вид раны, содержащей ткани серо-зеленого или серо-коричневого цвета, иногда струпы черного цвета.
Осложнения
Анаэробная инфекция часто сопровождается развитием полиорганной недостаточности (почечной, печеночной, сердечно-легочной), инфекционно-токсического шока, тяжелого сепсиса, являющихся причиной летального исхода.
Диагностика
Для своевременной диагностики анаэробной инфекции большое значение имеет правильная оценка клинических симптомов, позволяющая своевременно оказать необходимую медицинскую помощь. В зависимости от локализации инфекционного очага диагностикой и лечением анаэробной инфекции могут заниматься клиницисты различных специальностей – общие хирурги, травматологи, нейрохирурги, гинекологи, отоларингологи, челюстно-лицевые и торакальные хирурги. С целью определения патогенного агента и тяжести инфекционного процесса используют:
Анаэробную инфекцию необходимо дифференцировать от рожистого воспаления мягких тканей, полиморфной экссудативной эритемы, тромбоза глубоких вен, пневмоторакса, пневмоперитонеума, перфорации полых органов брюшной полости.
Лечение анаэробной инфекции
Комплексный подход к лечению анаэробной инфекции предполагает проведение радикальной хирургической обработки гнойного очага, интенсивной дезинтоксикационной и антибактериальной терапии. Хирургический этап должен быть выполнен как можно раньше – от этого зависит жизнь больного. Как правило, он заключается в широком рассечении очага поражения с удалением некротизированных тканей, декомпрессии окружающих тканей, открытом дренировании с промыванием полостей и ран растворами антисептиков. Особенности течения анаэробной инфекции нередко требуют проведения повторных некрэктомий, раскрытия гнойных карманов, обработки ран ультразвуком и лазером, озонотерапии и т. д. При обширной деструкции тканей может быть показана ампутация или экзартикуляция конечности.
Важнейшими составляющими лечения анаэробной инфекции являются интенсивная инфузионная терапия и антибиотикотерапия препаратами широкого спектра действия, высокотропными к анаэробам. В рамках комплексного лечения анаэробной инфекции находят свое применение гипербарическая оксигенация, УФОК, экстракорпоральная гемокоррекция (гемосорбция, плазмаферез и др.). При необходимости пациенту вводится антитоксическая противогангренозная сыворотка.
Прогноз и профилактика
Исход анаэробной инфекции во многом зависит от клинической формы патологического процесса, преморбидного фона, своевременности установления диагноза и начала лечения. Уровень летальности при некоторых формах анаэробной инфекции превышает 20%. Профилактика анаэробной инфекции заключается в своевременной и адекватной ПХО ран, удалении инородных тел мягких тканей, соблюдении требований асептики и антисептики при проведении операций. При обширных раневых повреждениях и высоком риске развития анаэробной инфекции необходимо проведение специфической иммунизации и противомикробной профилактики.
Роль условно-патогенная микрофлора в развитии воспалительных заболеваний мочеполовых органов мужчин и женщин.
Можно выделить несколько групп микроорганизмов, которые могут колонизировать мочеполовые органы человека:
Кишечные микроорганизмы (толстого кишечника и прямой кишки): кишечная палочка (Escherichia coli), энтерококк (Enterococcus species), амебиаз (Entamoeba histolytica). Инфицирование происходит при анально-генитальных контактах или заносом женщинами из прямой кишки из-за анатомической близости ануса и влагалища.
По течению инфекционного процесса различают:
Как протекают инфекционные воспалительных заболеваний мочеполовых органов мужчин и женщин, обусловленные условно-патогенной микрофлорой.
У мужчин, в ряде случаев, развиваются баланопоститы или уретриты, самоизлечивающиеся в 30-40% случаев. Но при наличии хронического простатита, ранее перенесенных половых инфекций, приведших к частичному повреждению слизистой уретры (хламидийная и гонококковая инфекция), злоупотреблении местными антисептиками (ожог уретры) у мужчин развивается персистенция (стойкое носительство) и развитие заболеваний, как острых, так и хронических, требующих индивидуального лечения (хронические баланопоститй и уретриты, острые эпидидимиты, нарушение качества спермы).
У женщин стойкое носительство условно-патогенной микрофлорой, проявляется латентным и торпидным течением инфекционного процесса (хронические уретриты, кольпиты, эндоцервициты). Инфицирование условно-патогенной микрофлорой происходит при половых контактах; чем больше половых контактов у женщины, тем больше риск ее инфицирования. Персистенция опасна для женщины в эпидемиологическом плане (заражение половых партнеров), значительной вероятностью инфекционных осложнений при различных гинекологических вмешательствах (аборты, инструментальные обследования) и при беременности (инфицирование плода и новорожденного). Наиболее часто под влиянием условно-патогенной микрофлоры происходит снижение количества нормальной микрофлоры влагалища со сдвигом вагинального рН в щелочную сторону. При этом возникает либо бактериальный вагиноз, вызванный анаэробной микрофлорой, либо аэробный вагинит, вызванные аэробной микрофлорой, которые опасны для женщины развитияем воспалительных заболеваний органов малого таза, вульвовагинитов, циститов, нарушений течения беременности.
Инфицирование условно-патогенной микрофлорой происходит:
— при половых контактах, ( в том числе и орально-генитальный и анально-генитальный ), являющихся наиболее частой причиной инфицирования условно-патогенной микрофлорой;
Нормальная микрофлора мочеполовых органов человека.
Частота выявления в передней уретре здорового мужчины: Staphylococcus epidermidis 50-100%, Staphylococcus aureus 0-5%, Streptococcus mitis 25%, Enterococcus faecalis 25%, Neisseria sp. 25%, Enterobacteriaceae (Escherichia coli) 25%, Proteus sp. 25%, Pseudomonas aeruginosa 0-5%, Bacteroides sp. 25%, Corynеbacteria 25%.
Частота выявления во влагалище здоровой женщины: Staphylococcus epidermidis 50-100%, Staphylococcus aureus 25%, Streptococcus mitis 25%, Enterococcus faecalis 25%, Streptococcus pneumoniae 0-5%, Streptococcus pyogenes 0-5%, Neisseria sp. 25%, Neisseria meningitidis 25%, Enterobacteriaceae (Escherichia coli) 25%, Proteus sp. 25%, Bacteroides sp. 0-5%, Lactobacillus sp. 50-100%, Corynebacteria 25%, Mycoplasmas 25%.
Записаться на лечение и обследование можно по тел.+7-921-577-20-60.
Дисбиоз мочеполовой системы (уретрит)
Описание исследования
На момент рождения мочеиспускательный тракт мальчиков стерилен. Однако его заселение начинается буквально с первых минут жизни. «Стартовой площадкой» для проникновения представителей микрофлоры внутрь являются кожа и слизистые оболочки.
Микроорганизмы, составляющие нормальную микрофлору мочеиспускательного канала, заселяют его начальный отрезок (порядка 5 см от наружного отверстия). Особенно большое количество микроорганизмов скапливается в области ладьевидной ямки, промываемой мочой хуже, чем весь остальной урогенитальный тракт.
Как показывают мазки на микрофлору, в уретре здоровых мужчин могут присутствовать следующие микроорганизмы:
Количество представителей нормальной микрофлоры в нижних отделах мочеиспускательного канала невелико. Однако ряд факторов могут спровоцировать их патологический рост, а также рост патогенных бактерий. Данное состояние определяется как дисбиоз половых органов мужчин.
Причинами его возникновения могут быть:
1. Проникновение в уретру при половых контактах болезнетворных микроорганизмов. Особенно велика опасность заражения для лиц, ведущих беспорядочную половую жизнь. Риск развития дисбиоза велик также для тех мужчин, чьи постоянные половые партнерши имеют нарушение в микрофлоре влагалища.
2. Резкое и значительное ослабление иммунитета. Иммунная система организма четко контролирует количество микробов. При их усиленном размножении специальные защитные клетки стабилизируют число бактерий, приводя их в норму. Однако различные инфекции, травмы, переохлаждение, применение ряда лекарственных средств ослабляют иммунную защиту, что становится причиной неконтролируемого размножения бактерий и, как следствие, развития дисбиоза.
3. Повышение температуры в мужских половых органах. Обычно температура в них относительно низкая. Однако воспалительные процессы в малом тазу могут привести к повышению местной температуры, что вызывает стремительный рост кокков и палочек.
4. Нарушение функций предстательной железы. Секрет простаты содержит ряд веществ, обладающих антибактериальными свойствами. При снижении функциональности простаты (например, гормональной недостаточности), нерегулярной половой жизни и влиянии прочих факторов нарушается процесс естественного очищения мочеиспускательного канала от лишних микроорганизмов, что становится причиной нарушения микрофлоры уретры.
5. Нарушение кровообращения в малом тазу. Снижение скорости тока крови и ее застой также вызывает местное повышение температуры, создавая тем самым благоприятные условия для усиленного размножения микробов. Это может наблюдаться:
6. Травма стенок уретры. Она может быть получена при неквалифицированном отборе мазков или введении катетера, при мочекаменной болезни во время прохождения по каналу песка и камней.
7. Несбалансированное питание и неправильный питьевой режим. Избыток кислой, острой пищи, алкоголя может стать причиной химического поражения стенок мочеиспускательного канала, что служит причиной для развития болезни. Недостаток жидкости приводит к тому, что мочеиспускание происходит реже, а, следовательно, бактерии, которые могли бы вымыться струей мочи, остаются в уретре.
8. Отсутствие полноценного отдыха. Усиленные физические нагрузки, вызывающие хроническую усталость, могут стать причиной снижения иммунной защиты организма в целом, и уретры в частности.
9. Наличие хронических заболеваний. Возбудители болезни могут попадать в уретру с кровотоком из любой части организма, что может послужить причиной развития инфекции в ней.
Основными симптомами уретрита являются:
У мужчин они проявляются значительно чаще, чем у женщин. Проявления заболевания могут быть острыми или носить «смазанных» характер (что свойственно хронической формы инфекции).
Само по себе заболевание не является опасным, однако отсутствие лечения может привести к весьма неприятным осложнениям:
В рамках данного теста проводится выявление в микрофлоре уретры следующих микроорганизмов:
Исследование проводится методом полимеразной цепной реакции в режиме реального времени. Цель тестирования – выявление в пробе мочи специфических фрагментов ДНК перечисленных выше микроорганизмов.
Подготовка к исследованию
Для проведения анализа отбирается первая утренняя моча в объеме 10-15 мл. Пациенту необходимо получить в пункте забора проб медицинской компании «Наука» или приобрести в аптеке одноразовый пластиковый контейнер.
Перед сбором мочи необходимо провести тщательную гигиену половых органов. Накануне необходимо исключить из рациона питания фрукты и овощи, изменяющие цвет мочи (морковь, свеклу).
Для получения корректных результатов исследования необходимо исключить прием витаминов. Перед проведением тестирования запрещено принимать мочегонные препараты.
Показания к исследованию
Интерпретация исследования
Результаты обследования выдаются на бланке лаборатории медицинской компании «Наука». В столбце «результат» в формулировках «обнаружено» или «не обнаружено» указывается наличие/отсутствие в исследуемой пробе следующих видов бактерий:
В столбце «Нормы интерпретации» содержится информация о референсных для данного исследования значениях. Нормой является отсутствие всех перечисленных видов микроорганизмов (результат «не выявлено»).
Положительный ответ свидетельствует о наличии в моче специфических фрагментов ДНК микроорганизмов и заражении выявленными бактериями.
Отрицательный результат может означать, что:
Пример по данному анализу представлен ниже:
Ф.И.О.: Иванов Иван Иванович Пол: м Год рождения: 01.01.0000
Дата исследования: 12.12.0000
Дисбактериоз: причины, симптомы, диагностика, лечение
Дисбактериоз – качественное и количественное изменение микрофлоры в организме на любом его участке, включая кожные покровы, кишечник, полость рта, влагалище и другие области, населяемые микроорганизмами. Патология встречается при многих заболеваниях, длительном или неконтролируемом употреблении антибиотиков и иммунодепрессантов, развивается под влиянием вредных факторов окружающей среды.
Состояние опасно сопутствующим снижением иммунитета, нарушением барьерной функции кожи и слизистых оболочек, через которые патогенная флора проникает во внутренние органы.
Роль микробиоты в организме
Причины дисбиоза
Одна из причин кожного дисбактериоза – чрезмерная гигиена, применение агрессивных уходовых средств, смывающих защитный водно-жировой слой с эпителия.
Классификация дисбактериоза
Также, в зависимости от длительности процесса и выраженности симптомов, выделяют острый и хронический дисбактериоз.
Кишечный дисбактериоз протекает в три стадии:
Симптомы нарушенной микрофлоры
Проявления дисбактериоза кишечника у взрослых зависят от пола пациента. У женщин болезненные ощущения в животе усиливаются перед менструацией. Наблюдается повышенная активность сальных желез, на лице и на теле появляются высыпания. Слизистая оболочка влагалища раздражается, больную беспокоит зуд и жжение вульвы. Кожа становится сухой, дряблой и шелушится. Дисбактериоз кишечника у мужчин сопровождается ухудшением потенции, проблемами с мочеиспусканием.
По мере прогрессирования дисбактериоза присоединяются и симптомы осложнений.
При нейропсихическом расстройстве появляются слабость, апатия, тревожность, пониженное настроение, снижение концентрации внимания и стрессоустойчивости, навязчивые мысли, судороги.
Для инсулинорезистентности характерны прибавка в весе, высокая концентрация глюкозы и липидов крови, ощущение тяжести в правом подреберье. При генерализованной воспалительной или аутоиммунной реакции возможно появление боли в суставах, сыпи на коже, примеси слизи либо крови в испражнениях, повышения температуры тела, озноба, быстрой утомляемости.
Для кожного дисбиоза характерны сыпь на теле, дряблость, краснота, зуд, сухость либо избыточная жирность кожных покровов. При дисбактериозе влагалища проявляются молочница – творожистые выделения белого цвета, жжение и зуд в области наружных половых органов. При дисбалансе флоры ротовой полости прогрессируют стоматит, пародонтоз и кариес, ощущаются неприятный привкус и запах изо рта, появляется белый налет на языке.
Осложнения дисбиоза
Диагностика дисбактериоза
Лечение дисбактериоза
Полезными для микрофлоры считаются продукты, обогащенные клетчаткой – цельнозерновая выпечка, крупы, за исключением белого риса, овощи, листовая зелень и сушеные фрукты. Рекомендована также кисломолочная продукция, содержащая пребиотики и стимулирующая рост полезной микрофлоры.
Также применяются средства патогенетической терапии для восстановления моторики кишечника, уменьшения воспаления и восстановления ферментной активности органов пищеварения. Для облегчения проявлений диареи, боли в животе, метеоризма назначаются препараты симптоматической терапии.
Профилактика
Для предотвращения нарушения микрофлоры у новорожденных рекомендуется отдавать предпочтение естественному родоразрешению и грудному вскармливанию.
Условно-патогенная микрофлора
В организме существует множество бактерий, которые находятся с человеком в разных взаимоотношениях. Большую часть микрофлоры (микробиоценоза) представляют микроорганизмы, которые сосуществуют с человеком на основе симбиоза. Иными словами, основная масса микробов получает от человека пользу (в виде постоянной температуры и влажности, питательных веществ, защиты от ультрафиолета и так далее). В то же время эти бактерии сами приносят пользу, синтезируя витамины, расщепляя белки, соперничая с болезнетворными микроорганизмами и выживая их со своей территории. И одновременно с такими полезными бактериями у человека есть «сожители», которые в небольших количествах не приносят существенного вреда, но при определенных условях становящиеся болезнетворными. Такую часть микробов называют условно-патогенной микрофлорой.
Условно-патогенные микроорганизмы (УПМ) желудочно-кишечного тракта борются за свое выживание, поэтому их поколения вырабатывают устойчивость к конкурентной нормальной флоре. Лакто– и бифидобактерии в процессе жизнедеятельности производят вещества, сходные с антибиотиками по своему действию. Кроме того, сам организм, благодаря иммунной системе сдерживает размножение болезнетворных бактерий. Прием алкоголя и табакокурение, не говоря уже о наркомании, нервные стрессы, физические перегрузки, возрастные изменения, физиологическое несовершенство лимфатической системы (у маленьких детей), различные заболевания (в первую очередь – вирусного происхождения) – все это нарушает нормальный баланс микрофлоры в желудочно-кишечном тракте, приводит к гибели полезных микроорганизмов. Природа не терпит пустоты, и на смену погибшим полезным бактериям приходят условно-патогенные. С этого момента начинается развитие дисбиоза и дисбактериоза. Если же бывшие условно-патогенными, а теперь ставшие болезнетворными, бактерии покидают свое привычное место жительства, проникая через тканевые барьеры, то развивается оппортунистическая инфекция.
Состав условно-патогенной микрофлоры
Нормофлора у каждого человека индивидуальна по своему составу. То же самое касается и условно-патогенной микрофлоры, как части нормального биоценоза. Да-да! Несмотря на свою пагубную деятельность, условно-патогенные микроорганизмы нужны нормальной микрофлоре. Бактерии живут по принципу: «Что нас не убивает, то делает сильнее». То есть, постоянно соперничая за место, наши полезные бактерии становятся более выносливыми, вырабатывают «навыки» борьбы с УПМ на генном уровне. То же самое происходит и с остальной иммунной системой. Так что, можно сказать, что даже условно-патогенные микробы нужны нашему организму в качестве своеобразного «тренера» иммунитета.
К условно-патогенным микроорганизмам желудочно-кишечного тракта относится практически все семейство Enterobacteriaceae. Сюда входят клебсиелла пневмония, энтеробактеры (аэрогенес и клоацеа), цитробактер фреунди, протеи. Предельно допустимой нормой для семейства энтеробактерий в ЖКТ является показатель в 1000 микробных единиц. Из семейства стафилококков в кишечнике обитают на постоянной основе негемолитические формы стафилококка, количество которого может достигать в норме 10 000 микроорганизмов на 1 гкала. Гемолитических форм, то есть растворяющих эритроциты, в кишечнике в норме быть не должно вообще. Из УПМ очень большое количество бактероидов (фрагилис, например), можно встретить в толстом отделе кишечника. Эти бактерии принимают участие в жировом (липидном) обмене. Но их количество не должно выходить за пределы 10 9 колониеобразующих единиц, то есть отдельных особей, в1 г кала. В кишечнике можно также встретить небольшое количество стрептококков, которые помимо антагонистических (враждебных) свойств несут также и полезную нагрузку в нашем организме – они стимулируют выработку иммуноглобулинов, а также активно подавляют патогенных бактерий типа сальмонелл, шигелл.
Среди представителей нормофлоры также есть микроорганизмы, способные вызывать дисфункции кишечника. То есть, собственно эти бактерии относят к условно-патогенным, но тем не менее, их полезные свойства преобладают над патогенными. Такими бактериями являются энтерококки фекалис и фециум.
Из представителей условно-патогенной микрофлоры желудочно-кишечного тракта есть и такие, которые весьма редко, но все же могут вызывать заболевания. К таким можно отнести вейлонелл и фузобактерий. Их локализация, преимущественно, ограничена ротовой полостью. Но при попадании в кишечник, по данным некоторых ученых, они могут вызывать разного рода воспаления. Сведения о роли этих микробов в возникновении заболеваний ЖКТ весьма разрозненные и поэтому врачи, в лабораторных исследованиях причин дисбактериозов, особого внимания на них не обращают.
В отличие от вейлонелл и фузобактерий, хеликобактер пилори изучен довольно неплохо. Ему было отведено большое внимание в последнее время в связи с тем, что средой обитания он избрал желудок. Гастриты, язвенная болезнь желудка инфекционной природы в первую очередь связывается именно с хеликобактером. Лечение и приведение концентрации этого микроба к норме – довольно сложный процесс. Основная сложность терапии – высокая устойчивость хеликобактера к антимикробным препаратам. Еще бы – ведь он обитает в среде с повышенной кислотностью и через него проходят все лекарственные препараты. Какие должны быть защитные механизмы у бактерии, чтобы не только выживать, но и прекрасно себя чувствовать в подобных условиях!
Для того чтобы сдерживать патогенные свойства УПМ организму необходима помощь. Человек должен понимать, что его здоровье – в его же руках. Какими бы замечательными антагонистическими свойствами ни обладали наши эшерихии, бифидобактерии и лактобактерии, им нужна наша помощь, которая заключается в разумном подходе к образу жизни, и в первую очередь – к питанию.