Чем лечить буллезный цистит
Буллезный цистит
Буллезный цистит – один из морфологических вариантов воспалительного поражения мочевого пузыря.
Чаще всего протекает с рецидивами.
Возникает в основном у маленьких детей, хотя может поражать и взрослых.
Буллезный цистит – это форма воспаления мочевого пузыря, когда на его слизистой появляются буллы.
Механизмы их формирования бывают различными.
Буллезный цистит – диагноз не клинический, а эндоскопический или патоморфологический.
Его нельзя диагностировать по симптомам или анализам.
Буллы можно обнаружить лишь в случае осмотра мочевого пузыря изнутри.
Делается это с помощью цистоскопии.
Внутрь мочевого пузыря через уретру вводится камера.
На мониторе врач видит стенку мочевого пузыря.
Если обнаруживаются буллы, это является основанием для установления соответствующего диагноза.
Хотя термин цистит подразумевает наличие воспалительного процесса, буллезная его форма может протекать без воспаления.
Часто в моче при этом не обнаруживается никаких изменений.
Код буллезного цистита по МКБ-10
Хронический буллезный цистит кода МКБ 10 не имеет.
В классификации воспалительных процессов мочевого пузыря хронических форм всего две.
Это интерстициальный или другой цистит.
Буллезный не является интерстициальным.
Соответственно, он попадает в категорию «другой».
Данное заболевание имеет код N30.2.
Сюда относятся любые хронические воспалительные процессы мочевого пузыря, за исключением интерстициального.
Чем лечить буллезный цистит у детей
В недавно родившихся детей нередко обнаруживается буллезный цистит.
Он носит рецидивирующий характер.
Эта патология обусловлена врожденными особенностями строения стенки мочевого пузыря.
Есть три заболевания, которые приводят к появлению булл:
Самой частой формой буллезного цистита у детей остается лимфангиоматоз.
В 62% случаев причиной являются пороки развития лимфоидной ткани.
Обнаруживается лимфангиоматоз у 28% детей с рецидивирующими циститами.
Патология тяжело поддается лечению.
Так как она возникает вследствие врожденных особенностей анатомического строения стенки мочевика.
Реже встречается лимфангиэктазия.
Буллы наблюдаются более крупные.
Данная форма диагностируется у 10% детей с рецидивирующими циститами.
Она лучше поддается лечению.
Буллы уменьшаются или исчезают после нормализации оттока лимфы.
Хорошие результаты терапии достигаются с помощью физиотерапевтического воздействия.
Буллезный цистит: причины у женщин
Мочевыделительная система и репродуктивные органы у женщин находятся в тесной взаимосвязи.
Поэтому воспаление в половой системе часто затрагивает мочевой пузырь.
Это возможно при возникновении патологического процесса в:
Буллезный цистит развивается вследствие двух механизмов.
Первый – это вовлечение в воспаление стенки мочевого пузыря.
Второй – нарушение уродинамики.
Отечные репродуктивные органы сдавливают мочевой пузырь, мочеточники, и препятствуют нормальному току мочи.
Поэтому на фоне воспалительного поражения органов репродуктивной системы нередко возникают признаки буллезного цистита.
Причем, нередко он развивается без воспалительных явлений в самом мочевом пузыре.
Выявляется патология на цистоскопии.
Несмотря на выраженные симптомы, воспалительные изменения в моче могут отсутствовать.
Хотя воспаление стенки пузыря имеет место.
К буллезному отеку также может привести бактериальное поражение уретры.
Оно имеет место при остром цистите.
Инфекционные причины буллезного цистита
Буллезное воспаление иногда возникает при острых инфекциях мочевого пузыря.
Но только в случае тяжелого инфекционного процесса.
Так как буллезный цистит предполагает поражение глубоких слоев стенки уретры.
Основными возбудителями остается кишечная палочка, стафилококки или энтерококки.
Эти бактерии живут в прямой кишке.
Обычно инфекционный цистит возникает как аутоинфекция.
Это не заражение от другого человека.
Микроорганизмы просто мигрируют из одной части тела в другую.
Но если в кишечнике они живут себе и никому не мешают, то в мочевом пузыре провоцируют воспалительный процесс.
До 80% всех случаев воспаления вызывает кишечная палочка.
Но она крайне редко дает осложненные формы цистита и обычно не ведет к его буллезной форме.
Другие неспецифические возбудители:
Всего в 10-20% случаев циститы развиваются при специфических инфекционных заболеваниях.
Но именно они могут спровоцировать буллезное воспаление с вовлечением глубоких слоев стенки мочевика.
Возможные возбудители:
В 95% случаев инфекция попадает в мочевой пузырь через уретру.
В 5% случаев – гематогенным или лимфогенным путем, из других очагов инфекции в организме.
Предрасполагающие факторы:
Насколько заразен буллезный цистит
Заразен ли буллезный цистит, можно узнать после сдачи анализов на ЗППП.
В подавляющем большинстве случаев он не заразен.
Редко воспаление стенки мочевого пузыря вызвано патогенными микроорганизмами.
В основном его провоцирует условно-патогенная флора.
После полового акта она не вызывает воспалительного процесса у партнера.
Гораздо реже ЗППП становятся причиной буллезного цистита.
Но даже в этом случае при передаче инфекции у партнера возникнет уретрит, а не цистит.
Буллезный цистит: симптомы и признаки
Симптомы поражения мочевого пузыря похожи при различных формах патологии.
Все они связаны с воспалением его стенки, нарушением функции, раздражением рецепторного аппарата.
Основные симптомы:
При буллезном цистите увеличивается возбудимость пузыря за счет раздражения нервов медиаторами воспаления.
Происходит увеличение чувствительности слизистой.
Повышается тонус мышечного слоя.
Поэтому размер в несколько раз уменьшается.
Этим объясняется малая вместимость органа и частые позывы к мочеиспусканию.
Иногда промежутки времени между ними составляют 10-15 минут, что связано также с раздражением нервов.
Позывы настолько сильные, что не контролируются усилием воли пациента.
Многие жалуются на ощущение переполненности пузыря.
Какие анализы сдать при буллезном цистите
При цистите нужно сдать мочу на анализ.
В ней выявляются признаки воспаления.
Обнаруживаются лейкоциты, эпителиальные клетки, слизь.
Для исключения или обнаружения ЗППП проводится ПЦР.
С помощью этого метода диагностики выявляется ДНК патогенных микроорганизмов, и таким образом проводится их идентификация.
Выполняется бактериологический посев мочи.
Таким способом можно выделить условно-патогенную флору.
После выявления возбудителя проводится оценка его чувствительности к антибиотикам.
Во многих случаях при буллезном цистите воспалительных изменений в моче нет.
Потому что патология может развиваться как осложнение воспалительных процессов репродуктивных органов.
В этом случае необходима диагностика основного заболевания.
Берутся мазки из цервикального канала.
Выполняется УЗИ органов малого таза.
Подтвердить буллезный цистит можно при помощи цистоскопии.
Внутрь мочевого пузыря вводят камеру.
С её помощью врач может видеть стенку мочевого пузыря.
При буллезном цистите наблюдается её покраснение, отечность, а также формирование пузырей.
Лечение буллезного цистита
Для лечения буллезного цистита назначают антибиотики.
Какие – зависит от выделенной флоры.
В большинстве случаев цистит вызван кишечной палочкой или сапрофитным стафилококком.
Поэтому в лечении заболевания предпочтение отдают фторхинолонам.
Назначается офлоксацин или левофлоксацин.
Пациенту рекомендуют обильное питьё – до 2 литров в день.
На некоторое время приходится отказаться от интимной жизни.
Антибиотики при острой форме заболевания назначают по одной из трех схем:
Длительная антибиотикотерапия нежелательна.
У них применение антибиотиков в течение 2-4 недель в будущем в 6 раз повышает риск воспалительных заболеваний мочеполовых органов.
Это связано с формированием дисбиоза влагалища.
Оптимальным считается семидневный курс антибиотиков.
Он дает меньше рецидивов, чем одно- и трехдневный.
При лечении фторхинолонами в течение 7 дней эрадикация возбудителя происходит в 98% случаев.
При хроническом буллезном цистите часто назначают инстилляции в мочевой пузырь растворов серебра.
Концентрацию раствора постепенно наращивают.
Если имеет место бактериальный компонент буллезного воспаления, при хронической форме могут назначаться длительные курсы антибиотиков.
Они применяются от 2 до 6 недель, в зависимости от клинической ситуации.
Когда исчезают симптомы?
Симптомы при лечении острой формы цистита исчезают достаточно быстро.
У 30% пациентов они уходят уже в первый день антибиотикотерапии.
У 50% больных через двое суток нет симптомов.
У остальных в случае успешной терапии клинические признаки исчезают в течение 3-5 дней.
Этот процесс можно ускорить.
При цистите назначается симптоматическая терапия.
Применяются нестероидные противовоспалительные средства.
Это ацетилсалициловая кислота, ибупрофен, диклофенак, нимесулид и другие.
Причины рецидива буллезного цистита
Иногда буллезный цистит рецидивирует.
Основные факторы риска рецидива:
Рецидивы чаще всего случаются в первые три месяца после лечения.
Они происходят у каждого третьего пациента молодого возраста.
После 55 лет частота рецидива после первого эпизода воспаления мочевого пузыря достигает 50%.
Как показывают исследования, большинство случаев рецидива на самом деле представляют собой реинфекцию.
Это повторное заражение тем же или другим возбудителем.
Народные средства в лечении буллезного цистита
Очень часто пациенты прибегают к самолечению.
Они используют народные средства, чтобы избавиться от буллезного цистита.
Применяются в основном травы.
Многие из них уменьшают симптомы заболевания, потому что:
Используются травы как в виде народных средств, так и в составе медицинских препаратов.
Но их есть смысл применять только при хронической форме цистита.
Целью лечения является уменьшение симптомов и предотвращение рецидивов.
При острой форме цистита эффективность каких-либо трав сомнительна.
Некоторые пациенты говорят, что вылечились с помощью того или иного растения.
Но это связано с тем, что при неосложненном цистите заболевание может пройти само по себе, без лечения.
Причем, это происходит в 60% случаев без всяких последствий.
Но у 40% пациентов возникают осложнения, либо происходит хронизация воспалительного процесса.
Поэтому использовать народные средства не рекомендуется.
Или, по крайней мере, их необходимо применять в дополнение к препаратам с подтвержденной клинической эффективностью.
Буллезный цистит: к какому врачу и куда обратиться
Обращаться с буллезным циститом нужно к урологу.
Врачи данного профиля принимают в нашей клинике.
Вы можете записаться к одному из них на прием, чтобы получить высококвалифицированную медицинскую помощь.
Наши услуги:
В нашей клинике вы получите качественную медицинскую помощь.
У нас применяются современные методы лечения.
Прием идет по предварительной записи.
Поэтому вам не нужно будет тратить время, ожидая приема врача в живой очереди.
При подозрении на буллезный цистит обращайтесь к автору этой статьи – урологу, венерологу в Москве с многолетним опытом работы.
Для врачей
Я.Б. Миркин, А.В. Карапетян, С.Ю. Шумов ММЦ «УРО-ПРО», г. Краснодар
Сведения об авторах:
Миркин Я.Б. – заведующий отделением урогинекологии и нейроурологии ММЦ «УРО-ПРО», г. Краснодар, mirkom@yandex.ru
Mirkin Ya.B. – the head of the department of urogynecology and neurourology MMC «URO-PRO», Krasnodar, mirkom@yandex.ru
Карапетян А.В. – генеральный директор ММЦ «УРО-ПРО», г. Краснодар, krasnodar1@upclinic.ru
Karapetyan A.V. – General Director of the MMC «URO-PRO», Krasnodar, krasnodar1@upclinic.ru
Шумов С.Ю. – директор МЦ «УРО-ПРО», г. Краснодар, krasnodar1@upclinic.ru
Shumov S.Yu. – Director of the MMC «URO-PRO», Krasnodar, krasnodar1@upclinic.ru
Интерстициальный цистит (ИЦ) или, согласно определениям ICS и ESSIC, – синдром болезненного мочевого пузыря (СБМП) – заболевание, которое крайне редко приводит к смертельному исходу (в основном, вследствие осложнений), однако его влияние на качество жизни трудно переоценить – оно служит причиной резкого снижения социальной адаптации и фактически инвалидности.
У 11% пациентов с ИЦ имеются суицидальные тенденции [1].Ранее считалось, что ИЦ/СБМП является достаточно редким заболеванием, однако в последние годы количество пациентов с симптомами ИЦ драматически увеличилось.
Исследование эпидемиологии ИЦ в США, выполненное J. Clemens и соавт. демонстрирует цифру 197 пациентов на 100 000 женщин [2]. C.A. Jones в 1997 опубликовал данные опроса женщин в США, согласно которым распространенность ИЦ в этой стране составляет 510/100 000 женщин [3].
Разумеется, невозможно поставить диагноз ИЦ всему количеству указанных пациентов, поскольку для этого требуется правильно выполненная цистоскопия и качественное патоморфологическое исследование биоптата, но диагноз «Синдром болезненного мочевого пузыря» будет вполне правомерен [4].
Продолжительное время ИЦ считался диагнозом исключения, т.е. для постановки диагноза требовалось исключить все возможные заболевания со схожей симптоматикой, и при их отсутствии установить диагноз ИЦ. Затем группа экспертов из ESSIC разработала диагностические критерии ИЦ, которые включали в себя наличие гломеруляций при цистоскопии с гидробужированием мочевого пузыря и/или Гуннеровского поражения, а также повышенного числа тучных клеток и/или подслизистого фиброза при патоморфологическом исследовании [4].
В дальнейшем было принято решение ввести термин «Синдром болезненного мочевого пузыря», диагностика которого основывалась на соответствующих симптомах – боль над лоном, связанная с наполнением мочевого пузыря, поллакиурия и ноктурия при отсутствии явной урологической патологии [5]. Отличие СБМП от ИЦ заключается в том, что диагноз СБМП может быть поставлен при отсутствие цистоскопических и морфологических исследований, на основании присущего ИЦ симптомокомплекса [6].
В настоящее время применимы оба термина – ИЦ и СБМП – однако диагноз ИЦ требует более строгих критериев. ИЦ/СБМП Патогенез ИЦ/СБМП все еще не вполне ясен, однако концепция, согласно которой вся цепь событий, приводящих к возникновению ИЦ, происходит только в уротелии, безвозвратно канула в прошлое. ИЦ/СБМП в большинстве случаев является полиорганным заболеванием, в патогенез которого вовлечены мочевой пузырь, органы малого таза, мышцы тазового дна и промежности, центральная нервная система (ЦНС). Процессы, протекающие в уротелии, играют значительную роль в патогенезе ИЦ. Представление о том, что уротелий является просто барьером между мочой и более глубокими слоями стенки мочевого пузыря, потеряло актуальность.
На данный момент известно, что уротелий представляет собой специализированную ткань, которая комплексно регулирует функции мочевого пузыря, обладает секреторной и рецепторной функциями и играет фундаментальную и активную роль в патогенезе различных форм цистита и симптомов нижних мочевых путей [7]. Тем не менее, барьерная функция уротелия является самой важной из всех. С анатомической точки зрения, мочевой пузырь представляет собой полый сферический орган, стенка которого состоит (снаружи кнутри) из серозного, мышечного, подслизстого, слизистого слоев и собственной пластинки. В эту структуру встроены кровеносные сосуды, нервные окончания (сенсорные и моторные), компоненты иммунной системы.
Слой эпителиальных клеток (уротелий) расположен поверх собственной пластинки и покрывает внутреннюю поверхность мочевого пузыря. В свою очередь, уротелий покрыт гликозаминогликановым слоем, позволяющим минимизировать повреждение мочевого пузыря вследствие воздействия компонентов мочи. Для выполнения этой функции, уротелий должен обладать следующими свойствами:
— накопление мочи: мочевой пузырь должен иметь возможность накопления и удержания различных объемов мочи, поддерживая при этом минимальное соотношение площади уротелия к объему мочи. Именно поэтому, наполненный мочевой пузырь представляет собой идеальную в геометрическом плане фигуру – сферу. Сфера обладает минимальной поверхностью, таким образом минимизируя возможность диффузии токсичных компонентов мочи в кровяное русло;
— пассивная проницаемость: за исключением активно транспортируемых молекул, уротелий должен быть непроницаем для всех, находящихся в моче веществ. Перемещение через эпителий происходит двумя параллельными путями – трансцеллюлярным и через межклеточное пространство (парацеллюлярный путь). Следовательно, клеточная мембрана и плотные контакты уротелия должны быть непроницаемы для всех компонентов мочи. Изменение свойств клеточной мембраны и/или плотных контактов может привести к изменению барьерной функции уротелия;
— активный транспорт: мочевой пузырь должен иметь возможность регулировать активный транспорт между полостью мочевого пузыря и кровотоком, а также в обратном направлении;
— инертность: вещества, в норме присутствующие в моче или крови не должны изменять пассивную проницаемость апикальной мембраны или плотных контактов.
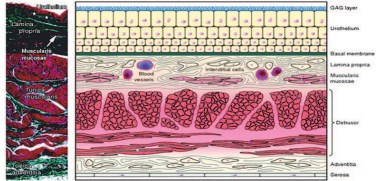
Перед тем, как рассмотреть уротелий в свете вышеуказанных свойств, будет полезно описать структуру уротелия. Он представляет собой переходный эпителий, который полностью возобновляется примерно за 3-6 месяцев, что было продемонстрировано в эксперименте на морских свинках. Интересен тот факт, что это самая низкая скорость возобновления среди всех эпителиальных тканей млекопитающих. В поперечном сечении уротелий состоит из трех слоев, причем у каждого есть свои особенности (рис.1).
Рис. 1. Поперечное сечение уротелия.
Базальный слой состоит из клеток диаметром 5-10 мкм, промежуточный слой – 20 мкм и поверхностный слой, представленный зонтичными клетками, размер которых колеблется, в зависимости от степени растяжения 50-120 мкм. Зонтичные клетки связаны между собой т.н. плотными сочленениями. Поверхность зонтичных клеток покрыта толстым слоем гликопротеи- нов и протеогликанов, вместе формирующих гликозаминогликановый слой (ГАГ), который входит в состав гидрофильной слизистой оболочки и является барьером против токсичных субстанций мочи.
Гликозаминогликаны также присутствуют в синовиальной жидкости сустава (гиалуроновая кислота) и в соединительной ткани (хондроитин). Между зонтичными клетками и гликозаминогликановым слоем расположен слой полигональных образований, выполненных из уроплакина [8]. Роль ГАГ-слоя активно изучается, так как экспериментальные данные показали, что его дефект может стать первым шагом к развитию хронического воспалительного процесса в мочевом пузыре [9].
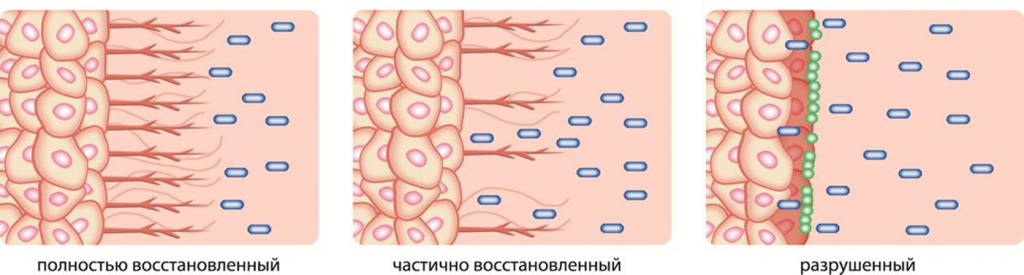
Несмотря на наличие определенных данных, этиология хронического цистита по-прежнему остается неясной. Повреждение уротелия на данный момент считается основной причиной возникновения приведенных нами патологий мочевого пузыря. Но что именно приводит к повреждению эпителия? Рассматривать в качестве фактора риска нужно не только бактериальную инфекцию, но и нейрогенное воспаление, дисфункцию тазового дна, лекарственные препараты (химиотерапия) и лучевую терапию. Также не стоит забывать и об аутоиммунном ответе, а при расспросе больного уточнить сведения о наличии травмы мочевого пузыря. Повреждение уротелия может иметь нейрогенную природу, что было продемонстрировано в эксперименте на мышах – при пересечении спинного мозга у них наблюдалось быстрое развитие повреждения уротелия (рис. 2) [10].
Рис. 2. Состояния глюкозамингликанового слоя мочевого пузыря.
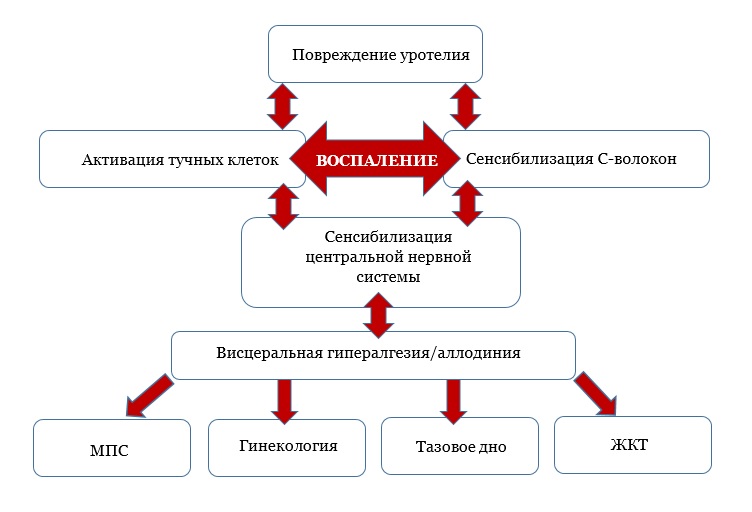
При утечке компонентов мочи через травмированный уротелий в интерстиций стенки мочевого пузыря активируется каскад реакций, включающий в себя активацию С-волокон, тучных клеток и высвобождение гистамина и других нейропептидов. Независимо от причины повреждения начинается воспалительный процесс, развивающийся всегда по одной и той же схеме.
Уротелий утрачивает барьерную функцию защиты от субстанций, выделяющихся с мочой. Эти вещества вступают в контакт с субэпителиальными слоями, вызывая воспаление в субуротелии. Поскольку в этом слое расположены нервные сплетения, они вовлекаются в воспалительный процесс, что приводит к развитию соответствующей симптоматики: боли, поллакиурии, ургентным позывам и ноктурии.
Кроме того, при длительном воздействии, происходит сенсибилизация нервных окончаний, то есть снижается порог их реагирования на различную стимуляцию (рис. 3).
Предполагается, что из-за снижения продукции ГАГ уротелий становится более проницаемым, усугуб- ляется первичное повреждение. Именно на это звено патогенеза направлена терапия, оказывающая влияние на восстановление ГАГ-слоя. В ответ на усугубляющееся повреждение уротелий запускает процесс репарации путем секреции различных факторов роста, но неразрешенное, не до конца вылеченное воспаление блокирует эту реакцию путем секреции антипролифера- тивного фактора, который повышен у больных ИЦ. Кроме того, секреция простагландина Е2, способствующего восстановлению уротелия, существенно снижается или даже отсутствует у пациентов с интерстициальным циститом и синдромом болезненного мочевого пузыря. Значительную роль в развитии воспаления играют тучные клетки, которые экскретируют цитокины (ФНО, ИЛ-4, ИЛ-15, ИЛ-8, ИЛ-6), факторы роста (ФРН и пр.) [11,12].
Рис 3. Предполагаемый патогенез интерстициального цистита.
СЕНСИБИЛИЗАЦИЯ ПЕРИФЕРИЧЕСКОЙ НЕРВНОЙ СИСТЕМЫ
Стоит обратить особое внимание на то, что в рецепторной активности периферических органов и нервной ткани происходят некоторые изменения, активирующие нейроны в центральной нервной системе (ЦНС), т.н. централизация боли, и при длительном течении процесса вероятность развития хронической нейропатической боли значительно возрастает. Такой ход событий вполне объясняет, почему несвоевременная терапия не работает и состояние переходит в хроническую форму, т. е. наступает момент, когда терапия, направленная на уротелий, перестает быть эффективной.
Повреждение уротелия вызывает активацию С-волокон, приводя к сокращению гладкой мускулатуры, нейрогенному воспалению и гиперчувствительности нервных окончаний. Клинически этот комплекс реакций проявляется частыми императивными позывами и хронической тазовой болью – отличительные особенности синдрома болезненного мочевого пузыря и/ или синдрома гиперактивного мочевого пузыря.
Нейрогенное воспаление – результат патологической активации первичных чувствительных нервов(С-волокон), которые подразделяются на афферентные и эфферентные. Афферентные волокна отвечают за передачу болевого сигнала, модуляцию кардиоваскулярного рефлекса и контролируют рефлекс мочеиспускания, в то время как эфферентные – напрямую связаны с высвобождением субстанции Р, кальцитонин ген связанного пептида и тахикининов, вызывающих характерное для синдрома гиперактивного мочевого пузыря сокращение гладких мышечных волокон.
Эфферентные волокна также отвечают за миграцию иммунных клеток, дегрануляцию тучных клеток и петехиальные кровоизлияния, способствующие усилению боли. Предполагают, что нейрогенное воспаление является источником той висцеральной гиперчувствительности, которая приводит к развитию хронической тазовой боли. Это позволяет сделать вывод о том, что чаще всего возникновение синдрома болезненного мочевого пузыря обусловлено не только воспалительным процессом, но и гиперчувствительностью, которая проявляется аллодинией (неадекватный болевой ответ на нормальную стимуляцию) и гипералгезией (аномальный увеличенный ответ на болевой стимул средней степени). В свою очередь, стимулированные периферические ноцицепторы посылают в ЦНС афферентную импульсацию приводя в действие центральные механизмы, которые усиливают и закрепляют эффект периферической сенсибилизации.
Функция афферентных нервных волокон реализуется через рецепторный аппарат уротелия. Роль различных типов нервных волокон и рецепторов представляется следующей: А-лямбда волокна ассоциированы с механорецепторами, при давлении вмочевом пузыре менее 5-15 мм рт. ст.они неактивны, т.е. позыв на мочеиспускание отсутствует, но при достижении определенного порога А-лямбдаволокна непрерывно генерируют импульсы, кодирующие ощущение давления в мочевом пузыре, они отвечают за ощущение позыва на мочеиспускание, однако при повышении давления более 30 мм рт.ст. они начинают генерировать импульсы, кодирующие ощущение боли [13].
Кроме того, А-лямбда волокна и ассоциированные рецепторы могут сенсибилизироваться и кодировать болевые импульсы. То есть в некоторых случаях, играть роль ноцицепторов.Лигандом этих пуринергических (P2X,P2Y) рецепторов является аденозин-трифосфат (АТФ). Чувство давления при наполнении мочевого пузыря прямо коррелирует с уровнем АТФ и наибольший уровень АТФ определяется в момент мочеиспускания. АТФ секретируется клетками уротелия, причем количество секретируемого АТФ зависит от степени растяжения уротелия – чем больше АТФ, тем сильнее позыв [14] (таб.1).
Таблица 1. Рецепторный аппарат уротелия
| Сенсорная функция или лиганд | Сенсорный рецептор в уротелии | Сенсорный рецептор в афферентном нерве |
| АТФ | Пуринергический рецептор P2X, P2Y | Пуринергический рецептор P2X, P2Y |
| Капсаицин | Ваниллоидный TRPV1 | Ваниллоидный TRPV1 |
| Тепло | TRPV1, TRPV2, TRPV4 | TRPV1,TRPV2,TRPV3,TRPV4 |
| Холод | TRPM8, TRPA1 | TRPM8, TRPA1 |
| pH | TRPV1 | TRPV1, ASIC, DRASIC |
| Осмолярность | TRPV4 | TRPV4 |
| Брадикинин | В1, В2 брадикининовые рецепторы | В1, В2 брадикининовые рецепторы |
| Ацетилхолин | Никотиновые и мускариновые рецепторы | Никотиновые и мускариновые рецепторы |
| Норадреналин | Альфаи бетаадренорецепторы | Альфаи бетаадренорецепторы |
| Фактор Роста Нервов | p-75, Trk-A | p-75, Trk-A |
| Механическая чувствительность | Амилорид-чувствительные натриевые каналы | Амилорид-чувствительные натриевые каналы |
С-волокна и ассоциированные с ними рецепторы (ванилоидные TRPV1, TRPV2, TRPV4) отвечают за температурную, химическую и болевую чувствительность, понижение рН мочи (TRPV1), повышение осмолярности мочи (TRPV4). При достижении критических параметров хеморецепторы могут генерировать болевые импульсы [16,17]. На этом осно ван тест с калия хлоридом, поскольку при ИЦ нарушается функция этих рецепторов и порог генерации болевых импульсов значительно снижается. А некоторые рецепторы извращают свою функцию, например, TRPM8 и TRPA1, отвечающие за холодовую чувствительность, при введении холодного раствора в мочевой пузырь они генерируют болевые импульсы и/или ургентные позывы на микцию. На этом основан соответствующий диагностический тест при уродинамическом исследовании [18].
ЭФФЕКТ CROSS-TALKING
Кроме мочевого пузыря, в малом тазу у женщин находится матка с придатками и нисходящие отделыкишечника. Афферентные и эфферентные нервные пути этих органов взаимосвязаны и патологический процесс в одном органе может отразиться на другом. Например, у 50% пациентов с ИЦ присутствует синдром раздраженного кишечника (СРК) и наоборот, пациенты с СРК часто страдают от синдрома болезненного мочевого пузыря.
Пациентки с аденомиозом демонстрируют поллакиурию и боль в области мочевого пузыря, у пациенток с ИЦ часто развивается вульводиния. Этот эффект называется «взаимонаведением» (в англоязычной литературе – cross-talking) и реализуется через феномен сенсибилизации ЦНС [19]. При хронической болевой афферентной импульсации от какого-либо из органов малого таза происходит сенсибилизация рецепторов в ЦНС [20].
Орган, генерирующий эти импульсы, считается первичным генератором боли [21], при ИЦ им является уротелий. Сенсибилизированные рецепторы, в свою очередь, генерируют эфферентные импульсы в уротелий, которые модулируют его рецепторный аппарат, вызывают нейрогенное воспаление, а поскольку афферентные и эфферентные пути органов малого таза тесно взаимосвязаны, нейрогенное воспаление и изменение функции рецепторного аппарата может произойти в соседнем органе малого таза, например, в кишечнике – с развитием СРК. В таком случае, кишечник называется вторичным генератором боли. Интересно то, что в некоторых случаях, патологический процесс в первичном генераторе боли давно купирован, а вторичный генератор продолжает портить жизнь пациенту и нервы врачам [22,23].
Мышцы тазового дна являются поперечно-полосатыми мышцами, и в ответ на болевую импульсацию от одного из органов малого таза может развиться рефлекторный спазм одной или нескольких мышц тазового дна.Например, при анальной трещине часто развивается спазм леваторов. При хроническом процессе спазм тоже становится хроническим. Это называется миофасциальным болевым синдромом (МФС). ИЦ может ассоциироваться с МФС леваторов, внутренней запирательной мышцы, наружного сфинктера уретры (синдром Фоулера), поверхностных мышц промежности.
В мышцах возникают триггерные точки, которые являются вторичными генераторами боли [24,25]. Сенсибилизация ЦНС реализуется через феномен нейропластичности, неразрывно связанный с НМДА-рецепторами – постоянное повторение одного и того же действия приводит к развитию привычки к этому действию, своего рода условному рефлексу, т.е.для выполнения нужного действия мозг расходует меньше ресурсов. Но когда речь идет о постоянной повторяющейся боли и выработке «привычки» к ней – нейропластичность начинает играть огромную роль в патогенезе синдрома хронической тазовой боли (СХТБ) вообще и ИЦ/СБМП в частности. Пациенту с централизацией боли можно вообще удалить пораженный орган – а боль останется, становясь проявлением разновидности фантомной боли [25,26].
ВЫВОДЫ
Подводя итоги обсуждения патогенеза интерстициального цистита/синдрома болезненного мочевого пузыря (ИЦ/СБМП), можно сделать вывод, что интерстициальный цистит начинается с повреждения гликозаминогликанового слоя уротелия и уже потом в процесс вовлекаются остальные звенья патогенеза (ЦНС, органы и мышцы малого таза). В этом случае, восстановление ГАГ-слоя уротелия становится первоочередной задачей. Что касается синдрома болезненного мочевого пузыря – в этом случае уротелий чаще всего является вторичным генератором боли, а первичным генератором может выступать другой орган малого таза или даже ЦНС, например, в случае хронического стресса. В таком случае, восстановление уротелия тоже необходимо, но при обязательных терапевтических мероприятиях, направленных на прекращение патологического процесса первичного генератора боли.
Резюме:
Интерстициальный цистит/Синдром болезненного мочевого пузыря является тяжелым заболеванием с выраженным влиянием на качество жизни. Существующие методы лечения не всегда эффективны, поскольку Интерстициальный цистит/Синдром болезненного мочевого пузыря имеет комплексный, мультифакторный патогенез. Современные представления о патогенезе интерстициального цистита складываются из взаимодействия таких факторов, как:
1. Повреждение уротелия с разрушением защитного гликозаминогликанового слоя.
2. Развитие абактериального воспаления в интерстиции с активизацией тучных клеток и миграцией их в очаг воспаления.
3. Сенсибилизация периферической нервной системы с увеличением количества ноцицепторов.
4. Взаимонаведение органов малого таза с развитием нейрогенного воспаления в кишечнике, матке, придатках.
5. Миофасциальные болевые синдромы тазового дна с развитием спастичности поперечнополосатой мускулатуры тазового дна и промежности.
6. Централизация боли (сенсибилизация ЦНС) с понижением болевого порога и возникновением стойкого болевого синдрома даже после прекращения поступления болевых импульсов от пораженного органа. Вследствие этого, успешная терапевтическая стратегия должна включать в себя воздействие на все факторы патогенеза интерстициального цистита. Авторы заявляют об отсутствии конфликта интересов.
Мы используем файлы cookie: это помогает сайту работать лучше. Если Вы продолжаете использовать сайт, то этим выражаете свое согласие с Пользовательским соглашением.
ТОП-15 препаратов при цистите
Цистит – воспаление мочевого пузыря. Сопровождается частыми позывами и наличием дискомфорта в процессе мочеиспускания. Как правило, возникает на фоне бактериальной инфекции, но может также быть следствием повреждения или раздражения мочевого пузыря. Страдают как мужчины, так и женщины, причем последние, в силу анатомического строения, обычно сталкиваются с данным заболеванием значительно чаще.
Функции мочевого пузыря полностью определяют его структуру и положение в организме. Орган расположен в нижней части таза в забрюшинном пространстве за лобковой областью.
Классификация препаратов
Причины развития
Многие считают цистит исключительно женской болезнью, но данное мнение ошибочно. В силу анатомических особенностей, у мужчин данное заболевание развивается гораздо реже – что составляет примерно 5% случаев.
Среди предрасполагающих факторов следует выделить общее снижение иммунитета, нарушение процессов кровоснабжения из-за малоподвижного образа жизни. Также не стоит забывать о соблюдении личной гигиены и о том, что опорожнять мочевой пузырь нужно вовремя. Чаще всего заболевание возникает в весенний период.
Рейтинг препаратов от цистита
Как правило, цистит, вызванный бактериальной инфекцией, лечится с помощью антибиотиков, назначенных врачом. При легких формах заболевания специалист может назначить симптоматическое лечение, направленное на улучшение общего самочувствия. Своевременная медикаментозная терапия помогает исключить развитие осложнений.
Мы предлагаем ТОП эффективных препаратов от цистита, которые отличаются спектром действия. Рейтинг основан на эффективности и безопасности лекарственных средств. За основу взяты проведенные исследования и отзывы покупателей.
№1 – «Канефрон Н» (Бионорика СЕ, Германия)
Фитопрепарат, который назначается при заболеваниях мочевыводящих путей и почек. Таблетки, покрытые оболочкой, разработаны на основе корней любистока лекарственного, листьев розмарина и травы золототысячника обыкновенного.
Лучший препарат от цистита оказывает мочегонное, противовоспалительное, спазмолитическое и противомикробное действие. Используется в комплексной терапии лечения хронических инфекций мочевого пузыря.
Для врачей
Я.Б. Миркин, А.В. Карапетян, С.Ю. Шумов ММЦ «УРО-ПРО», г. Краснодар
Сведения об авторах:
Миркин Я.Б. – заведующий отделением урогинекологии и нейроурологии ММЦ «УРО-ПРО», г. Краснодар, mirkom@yandex.ru
Mirkin Ya.B. – the head of the department of urogynecology and neurourology MMC «URO-PRO», Krasnodar, mirkom@yandex.ru
Карапетян А.В. – генеральный директор ММЦ «УРО-ПРО», г. Краснодар, krasnodar1@upclinic.ru
Karapetyan A.V. – General Director of the MMC «URO-PRO», Krasnodar, krasnodar1@upclinic.ru
Шумов С.Ю. – директор МЦ «УРО-ПРО», г. Краснодар, krasnodar1@upclinic.ru
Shumov S.Yu. – Director of the MMC «URO-PRO», Krasnodar, krasnodar1@upclinic.ru
Интерстициальный цистит (ИЦ) или, согласно определениям ICS и ESSIC, – синдром болезненного мочевого пузыря (СБМП) – заболевание, которое крайне редко приводит к смертельному исходу (в основном, вследствие осложнений), однако его влияние на качество жизни трудно переоценить – оно служит причиной резкого снижения социальной адаптации и фактически инвалидности.
У 11% пациентов с ИЦ имеются суицидальные тенденции [1].Ранее считалось, что ИЦ/СБМП является достаточно редким заболеванием, однако в последние годы количество пациентов с симптомами ИЦ драматически увеличилось.
Исследование эпидемиологии ИЦ в США, выполненное J. Clemens и соавт. демонстрирует цифру 197 пациентов на 100 000 женщин [2]. C.A. Jones в 1997 опубликовал данные опроса женщин в США, согласно которым распространенность ИЦ в этой стране составляет 510/100 000 женщин [3].
Разумеется, невозможно поставить диагноз ИЦ всему количеству указанных пациентов, поскольку для этого требуется правильно выполненная цистоскопия и качественное патоморфологическое исследование биоптата, но диагноз «Синдром болезненного мочевого пузыря» будет вполне правомерен [4].
Продолжительное время ИЦ считался диагнозом исключения, т.е. для постановки диагноза требовалось исключить все возможные заболевания со схожей симптоматикой, и при их отсутствии установить диагноз ИЦ. Затем группа экспертов из ESSIC разработала диагностические критерии ИЦ, которые включали в себя наличие гломеруляций при цистоскопии с гидробужированием мочевого пузыря и/или Гуннеровского поражения, а также повышенного числа тучных клеток и/или подслизистого фиброза при патоморфологическом исследовании [4].
В дальнейшем было принято решение ввести термин «Синдром болезненного мочевого пузыря», диагностика которого основывалась на соответствующих симптомах – боль над лоном, связанная с наполнением мочевого пузыря, поллакиурия и ноктурия при отсутствии явной урологической патологии [5]. Отличие СБМП от ИЦ заключается в том, что диагноз СБМП может быть поставлен при отсутствие цистоскопических и морфологических исследований, на основании присущего ИЦ симптомокомплекса [6].
В настоящее время применимы оба термина – ИЦ и СБМП – однако диагноз ИЦ требует более строгих критериев. ИЦ/СБМП Патогенез ИЦ/СБМП все еще не вполне ясен, однако концепция, согласно которой вся цепь событий, приводящих к возникновению ИЦ, происходит только в уротелии, безвозвратно канула в прошлое. ИЦ/СБМП в большинстве случаев является полиорганным заболеванием, в патогенез которого вовлечены мочевой пузырь, органы малого таза, мышцы тазового дна и промежности, центральная нервная система (ЦНС). Процессы, протекающие в уротелии, играют значительную роль в патогенезе ИЦ. Представление о том, что уротелий является просто барьером между мочой и более глубокими слоями стенки мочевого пузыря, потеряло актуальность.
На данный момент известно, что уротелий представляет собой специализированную ткань, которая комплексно регулирует функции мочевого пузыря, обладает секреторной и рецепторной функциями и играет фундаментальную и активную роль в патогенезе различных форм цистита и симптомов нижних мочевых путей [7]. Тем не менее, барьерная функция уротелия является самой важной из всех. С анатомической точки зрения, мочевой пузырь представляет собой полый сферический орган, стенка которого состоит (снаружи кнутри) из серозного, мышечного, подслизстого, слизистого слоев и собственной пластинки. В эту структуру встроены кровеносные сосуды, нервные окончания (сенсорные и моторные), компоненты иммунной системы.
Слой эпителиальных клеток (уротелий) расположен поверх собственной пластинки и покрывает внутреннюю поверхность мочевого пузыря. В свою очередь, уротелий покрыт гликозаминогликановым слоем, позволяющим минимизировать повреждение мочевого пузыря вследствие воздействия компонентов мочи. Для выполнения этой функции, уротелий должен обладать следующими свойствами:
— накопление мочи: мочевой пузырь должен иметь возможность накопления и удержания различных объемов мочи, поддерживая при этом минимальное соотношение площади уротелия к объему мочи. Именно поэтому, наполненный мочевой пузырь представляет собой идеальную в геометрическом плане фигуру – сферу. Сфера обладает минимальной поверхностью, таким образом минимизируя возможность диффузии токсичных компонентов мочи в кровяное русло;
— пассивная проницаемость: за исключением активно транспортируемых молекул, уротелий должен быть непроницаем для всех, находящихся в моче веществ. Перемещение через эпителий происходит двумя параллельными путями – трансцеллюлярным и через межклеточное пространство (парацеллюлярный путь). Следовательно, клеточная мембрана и плотные контакты уротелия должны быть непроницаемы для всех компонентов мочи. Изменение свойств клеточной мембраны и/или плотных контактов может привести к изменению барьерной функции уротелия;
— активный транспорт: мочевой пузырь должен иметь возможность регулировать активный транспорт между полостью мочевого пузыря и кровотоком, а также в обратном направлении;
— инертность: вещества, в норме присутствующие в моче или крови не должны изменять пассивную проницаемость апикальной мембраны или плотных контактов.
Перед тем, как рассмотреть уротелий в свете вышеуказанных свойств, будет полезно описать структуру уротелия. Он представляет собой переходный эпителий, который полностью возобновляется примерно за 3-6 месяцев, что было продемонстрировано в эксперименте на морских свинках. Интересен тот факт, что это самая низкая скорость возобновления среди всех эпителиальных тканей млекопитающих. В поперечном сечении уротелий состоит из трех слоев, причем у каждого есть свои особенности (рис.1).
Рис. 1. Поперечное сечение уротелия.
Базальный слой состоит из клеток диаметром 5-10 мкм, промежуточный слой – 20 мкм и поверхностный слой, представленный зонтичными клетками, размер которых колеблется, в зависимости от степени растяжения 50-120 мкм. Зонтичные клетки связаны между собой т.н. плотными сочленениями. Поверхность зонтичных клеток покрыта толстым слоем гликопротеи- нов и протеогликанов, вместе формирующих гликозаминогликановый слой (ГАГ), который входит в состав гидрофильной слизистой оболочки и является барьером против токсичных субстанций мочи.
Гликозаминогликаны также присутствуют в синовиальной жидкости сустава (гиалуроновая кислота) и в соединительной ткани (хондроитин). Между зонтичными клетками и гликозаминогликановым слоем расположен слой полигональных образований, выполненных из уроплакина [8]. Роль ГАГ-слоя активно изучается, так как экспериментальные данные показали, что его дефект может стать первым шагом к развитию хронического воспалительного процесса в мочевом пузыре [9].
Несмотря на наличие определенных данных, этиология хронического цистита по-прежнему остается неясной. Повреждение уротелия на данный момент считается основной причиной возникновения приведенных нами патологий мочевого пузыря. Но что именно приводит к повреждению эпителия? Рассматривать в качестве фактора риска нужно не только бактериальную инфекцию, но и нейрогенное воспаление, дисфункцию тазового дна, лекарственные препараты (химиотерапия) и лучевую терапию. Также не стоит забывать и об аутоиммунном ответе, а при расспросе больного уточнить сведения о наличии травмы мочевого пузыря. Повреждение уротелия может иметь нейрогенную природу, что было продемонстрировано в эксперименте на мышах – при пересечении спинного мозга у них наблюдалось быстрое развитие повреждения уротелия (рис. 2) [10].
Рис. 2. Состояния глюкозамингликанового слоя мочевого пузыря.
При утечке компонентов мочи через травмированный уротелий в интерстиций стенки мочевого пузыря активируется каскад реакций, включающий в себя активацию С-волокон, тучных клеток и высвобождение гистамина и других нейропептидов. Независимо от причины повреждения начинается воспалительный процесс, развивающийся всегда по одной и той же схеме.
Уротелий утрачивает барьерную функцию защиты от субстанций, выделяющихся с мочой. Эти вещества вступают в контакт с субэпителиальными слоями, вызывая воспаление в субуротелии. Поскольку в этом слое расположены нервные сплетения, они вовлекаются в воспалительный процесс, что приводит к развитию соответствующей симптоматики: боли, поллакиурии, ургентным позывам и ноктурии.
Кроме того, при длительном воздействии, происходит сенсибилизация нервных окончаний, то есть снижается порог их реагирования на различную стимуляцию (рис. 3).
Предполагается, что из-за снижения продукции ГАГ уротелий становится более проницаемым, усугуб- ляется первичное повреждение. Именно на это звено патогенеза направлена терапия, оказывающая влияние на восстановление ГАГ-слоя. В ответ на усугубляющееся повреждение уротелий запускает процесс репарации путем секреции различных факторов роста, но неразрешенное, не до конца вылеченное воспаление блокирует эту реакцию путем секреции антипролифера- тивного фактора, который повышен у больных ИЦ. Кроме того, секреция простагландина Е2, способствующего восстановлению уротелия, существенно снижается или даже отсутствует у пациентов с интерстициальным циститом и синдромом болезненного мочевого пузыря. Значительную роль в развитии воспаления играют тучные клетки, которые экскретируют цитокины (ФНО, ИЛ-4, ИЛ-15, ИЛ-8, ИЛ-6), факторы роста (ФРН и пр.) [11,12].
Рис 3. Предполагаемый патогенез интерстициального цистита.
СЕНСИБИЛИЗАЦИЯ ПЕРИФЕРИЧЕСКОЙ НЕРВНОЙ СИСТЕМЫ
Стоит обратить особое внимание на то, что в рецепторной активности периферических органов и нервной ткани происходят некоторые изменения, активирующие нейроны в центральной нервной системе (ЦНС), т.н. централизация боли, и при длительном течении процесса вероятность развития хронической нейропатической боли значительно возрастает. Такой ход событий вполне объясняет, почему несвоевременная терапия не работает и состояние переходит в хроническую форму, т. е. наступает момент, когда терапия, направленная на уротелий, перестает быть эффективной.
Повреждение уротелия вызывает активацию С-волокон, приводя к сокращению гладкой мускулатуры, нейрогенному воспалению и гиперчувствительности нервных окончаний. Клинически этот комплекс реакций проявляется частыми императивными позывами и хронической тазовой болью – отличительные особенности синдрома болезненного мочевого пузыря и/ или синдрома гиперактивного мочевого пузыря.
Нейрогенное воспаление – результат патологической активации первичных чувствительных нервов(С-волокон), которые подразделяются на афферентные и эфферентные. Афферентные волокна отвечают за передачу болевого сигнала, модуляцию кардиоваскулярного рефлекса и контролируют рефлекс мочеиспускания, в то время как эфферентные – напрямую связаны с высвобождением субстанции Р, кальцитонин ген связанного пептида и тахикининов, вызывающих характерное для синдрома гиперактивного мочевого пузыря сокращение гладких мышечных волокон.
Эфферентные волокна также отвечают за миграцию иммунных клеток, дегрануляцию тучных клеток и петехиальные кровоизлияния, способствующие усилению боли. Предполагают, что нейрогенное воспаление является источником той висцеральной гиперчувствительности, которая приводит к развитию хронической тазовой боли. Это позволяет сделать вывод о том, что чаще всего возникновение синдрома болезненного мочевого пузыря обусловлено не только воспалительным процессом, но и гиперчувствительностью, которая проявляется аллодинией (неадекватный болевой ответ на нормальную стимуляцию) и гипералгезией (аномальный увеличенный ответ на болевой стимул средней степени). В свою очередь, стимулированные периферические ноцицепторы посылают в ЦНС афферентную импульсацию приводя в действие центральные механизмы, которые усиливают и закрепляют эффект периферической сенсибилизации.
Функция афферентных нервных волокон реализуется через рецепторный аппарат уротелия. Роль различных типов нервных волокон и рецепторов представляется следующей: А-лямбда волокна ассоциированы с механорецепторами, при давлении вмочевом пузыре менее 5-15 мм рт. ст.они неактивны, т.е. позыв на мочеиспускание отсутствует, но при достижении определенного порога А-лямбдаволокна непрерывно генерируют импульсы, кодирующие ощущение давления в мочевом пузыре, они отвечают за ощущение позыва на мочеиспускание, однако при повышении давления более 30 мм рт.ст. они начинают генерировать импульсы, кодирующие ощущение боли [13].
Кроме того, А-лямбда волокна и ассоциированные рецепторы могут сенсибилизироваться и кодировать болевые импульсы. То есть в некоторых случаях, играть роль ноцицепторов.Лигандом этих пуринергических (P2X,P2Y) рецепторов является аденозин-трифосфат (АТФ). Чувство давления при наполнении мочевого пузыря прямо коррелирует с уровнем АТФ и наибольший уровень АТФ определяется в момент мочеиспускания. АТФ секретируется клетками уротелия, причем количество секретируемого АТФ зависит от степени растяжения уротелия – чем больше АТФ, тем сильнее позыв [14] (таб.1).
Таблица 1. Рецепторный аппарат уротелия
| Сенсорная функция или лиганд | Сенсорный рецептор в уротелии | Сенсорный рецептор в афферентном нерве |
| АТФ | Пуринергический рецептор P2X, P2Y | Пуринергический рецептор P2X, P2Y |
| Капсаицин | Ваниллоидный TRPV1 | Ваниллоидный TRPV1 |
| Тепло | TRPV1, TRPV2, TRPV4 | TRPV1,TRPV2,TRPV3,TRPV4 |
| Холод | TRPM8, TRPA1 | TRPM8, TRPA1 |
| pH | TRPV1 | TRPV1, ASIC, DRASIC |
| Осмолярность | TRPV4 | TRPV4 |
| Брадикинин | В1, В2 брадикининовые рецепторы | В1, В2 брадикининовые рецепторы |
| Ацетилхолин | Никотиновые и мускариновые рецепторы | Никотиновые и мускариновые рецепторы |
| Норадреналин | Альфаи бетаадренорецепторы | Альфаи бетаадренорецепторы |
| Фактор Роста Нервов | p-75, Trk-A | p-75, Trk-A |
| Механическая чувствительность | Амилорид-чувствительные натриевые каналы | Амилорид-чувствительные натриевые каналы |
С-волокна и ассоциированные с ними рецепторы (ванилоидные TRPV1, TRPV2, TRPV4) отвечают за температурную, химическую и болевую чувствительность, понижение рН мочи (TRPV1), повышение осмолярности мочи (TRPV4). При достижении критических параметров хеморецепторы могут генерировать болевые импульсы [16,17]. На этом осно ван тест с калия хлоридом, поскольку при ИЦ нарушается функция этих рецепторов и порог генерации болевых импульсов значительно снижается. А некоторые рецепторы извращают свою функцию, например, TRPM8 и TRPA1, отвечающие за холодовую чувствительность, при введении холодного раствора в мочевой пузырь они генерируют болевые импульсы и/или ургентные позывы на микцию. На этом основан соответствующий диагностический тест при уродинамическом исследовании [18].
ЭФФЕКТ CROSS-TALKING
Кроме мочевого пузыря, в малом тазу у женщин находится матка с придатками и нисходящие отделыкишечника. Афферентные и эфферентные нервные пути этих органов взаимосвязаны и патологический процесс в одном органе может отразиться на другом. Например, у 50% пациентов с ИЦ присутствует синдром раздраженного кишечника (СРК) и наоборот, пациенты с СРК часто страдают от синдрома болезненного мочевого пузыря.
Пациентки с аденомиозом демонстрируют поллакиурию и боль в области мочевого пузыря, у пациенток с ИЦ часто развивается вульводиния. Этот эффект называется «взаимонаведением» (в англоязычной литературе – cross-talking) и реализуется через феномен сенсибилизации ЦНС [19]. При хронической болевой афферентной импульсации от какого-либо из органов малого таза происходит сенсибилизация рецепторов в ЦНС [20].
Орган, генерирующий эти импульсы, считается первичным генератором боли [21], при ИЦ им является уротелий. Сенсибилизированные рецепторы, в свою очередь, генерируют эфферентные импульсы в уротелий, которые модулируют его рецепторный аппарат, вызывают нейрогенное воспаление, а поскольку афферентные и эфферентные пути органов малого таза тесно взаимосвязаны, нейрогенное воспаление и изменение функции рецепторного аппарата может произойти в соседнем органе малого таза, например, в кишечнике – с развитием СРК. В таком случае, кишечник называется вторичным генератором боли. Интересно то, что в некоторых случаях, патологический процесс в первичном генераторе боли давно купирован, а вторичный генератор продолжает портить жизнь пациенту и нервы врачам [22,23].
Мышцы тазового дна являются поперечно-полосатыми мышцами, и в ответ на болевую импульсацию от одного из органов малого таза может развиться рефлекторный спазм одной или нескольких мышц тазового дна.Например, при анальной трещине часто развивается спазм леваторов. При хроническом процессе спазм тоже становится хроническим. Это называется миофасциальным болевым синдромом (МФС). ИЦ может ассоциироваться с МФС леваторов, внутренней запирательной мышцы, наружного сфинктера уретры (синдром Фоулера), поверхностных мышц промежности.
В мышцах возникают триггерные точки, которые являются вторичными генераторами боли [24,25]. Сенсибилизация ЦНС реализуется через феномен нейропластичности, неразрывно связанный с НМДА-рецепторами – постоянное повторение одного и того же действия приводит к развитию привычки к этому действию, своего рода условному рефлексу, т.е.для выполнения нужного действия мозг расходует меньше ресурсов. Но когда речь идет о постоянной повторяющейся боли и выработке «привычки» к ней – нейропластичность начинает играть огромную роль в патогенезе синдрома хронической тазовой боли (СХТБ) вообще и ИЦ/СБМП в частности. Пациенту с централизацией боли можно вообще удалить пораженный орган – а боль останется, становясь проявлением разновидности фантомной боли [25,26].
ВЫВОДЫ
Подводя итоги обсуждения патогенеза интерстициального цистита/синдрома болезненного мочевого пузыря (ИЦ/СБМП), можно сделать вывод, что интерстициальный цистит начинается с повреждения гликозаминогликанового слоя уротелия и уже потом в процесс вовлекаются остальные звенья патогенеза (ЦНС, органы и мышцы малого таза). В этом случае, восстановление ГАГ-слоя уротелия становится первоочередной задачей. Что касается синдрома болезненного мочевого пузыря – в этом случае уротелий чаще всего является вторичным генератором боли, а первичным генератором может выступать другой орган малого таза или даже ЦНС, например, в случае хронического стресса. В таком случае, восстановление уротелия тоже необходимо, но при обязательных терапевтических мероприятиях, направленных на прекращение патологического процесса первичного генератора боли.
Резюме:
Интерстициальный цистит/Синдром болезненного мочевого пузыря является тяжелым заболеванием с выраженным влиянием на качество жизни. Существующие методы лечения не всегда эффективны, поскольку Интерстициальный цистит/Синдром болезненного мочевого пузыря имеет комплексный, мультифакторный патогенез. Современные представления о патогенезе интерстициального цистита складываются из взаимодействия таких факторов, как:
1. Повреждение уротелия с разрушением защитного гликозаминогликанового слоя.
2. Развитие абактериального воспаления в интерстиции с активизацией тучных клеток и миграцией их в очаг воспаления.
3. Сенсибилизация периферической нервной системы с увеличением количества ноцицепторов.
4. Взаимонаведение органов малого таза с развитием нейрогенного воспаления в кишечнике, матке, придатках.
5. Миофасциальные болевые синдромы тазового дна с развитием спастичности поперечнополосатой мускулатуры тазового дна и промежности.
6. Централизация боли (сенсибилизация ЦНС) с понижением болевого порога и возникновением стойкого болевого синдрома даже после прекращения поступления болевых импульсов от пораженного органа. Вследствие этого, успешная терапевтическая стратегия должна включать в себя воздействие на все факторы патогенеза интерстициального цистита. Авторы заявляют об отсутствии конфликта интересов.
Мы используем файлы cookie: это помогает сайту работать лучше. Если Вы продолжаете использовать сайт, то этим выражаете свое согласие с Пользовательским соглашением.
Бактериальный цистит: лечение неосложненных инфекций мочевыводящих путей
В клинической практике бактериальный цистит встречается достаточно часто, поэтому лечение заболевания является актуальной проблемой. Неосложненные инфекции мочевыводящих путей (ИМП) ежегодно поражают более 150 млн. человек. Причем в 20-30% случаев после успешного лечения они рецидивируют. [30]
Мужчины реже сталкиваются с такой проблемой, как цистит. У женщин же высокая распространенность заболевания связана с анатомическими особенностями организма. Малая протяженность мочеиспускательного канала и близкое расположение к естественным источникам инфекции ускоряет процесс проникновения бактерий в мочевой пузырь. [16, 30]
Причины возникновения болезни
Бактериальный цистит относится к неосложненным инфекциям нижних мочевых путей. Это заболевание, сопровождающееся воспалением слизистой оболочки мочевого пузыря. У женщин репродуктивного и предменопаузального возраста заболевание возникает по следующим причинам [30]:
Для женщин старшего возраста фактором риска является наличие перенесенных ранее ИМП, атрофический вагинит, катетеризация мочевого пузыря, недержание мочи. Риск развития воспаления мочевого пузыря значительно увеличивается в период беременности. [30]
У мужчин воспаление слизистой мочевого пузыря, как правило, не развивается самостоятельно. Обычно ему предшествуют осложненные формы ИМП. Для мужчин фактором риска может стать передача инфекции от зараженного полового партнера. Возбудителем неосложненной ИМП являются условно патогенные микроорганизмы, такие как Escherichia coli, Enterobacter, Klebsiella species, Staphylococcus saprophyticus, Proteus. [30]
Бактериальный цистит у женщин: симптомы, диагностика и лечение
Зачастую начинается болезнь с внезапных, сильных и частых позывов к мочеиспусканию, причем чаще всего они ложные. При мочеиспускании у больных присутствует жжение, рези, боль. Количество мочи уменьшается, а в конце акта мочеиспускания могут наблюдаться кровяные капли. [7]
Характерным признаком воспаления является дискомфорт в области малого таза. В некоторых случаях наблюдается повышение температуры тела, тошнота, рвота. Моча при цистите обычно становится мутной, приобретает резкий запах. Одними из типичных проявлений болезни также является недержание мочи и гематурия (присутствие эритроцитов в моче). [7, 30]
Наличие бактериального цистита можно заподозрить на основании жалоб пациента, а также данных анамнеза. Чтобы определить доминирующего возбудителя, проводится бактериологический посев мочи. [7]
Особенно целесообразно проводить такое исследование при подозрении на пиелонефрит, атипичной клинической картине и неэффективности лечения. Бактериологический посев необходим при осложненном и рецидивирующем воспалении слизистой мочевого пузыря. [7]
При обострениях болезни после полового акта также проводится исследование бактериологического содержимого влагалища. Это позволяет определить уропатогенов, исключить инфекции, передающиеся половым путем. [7]
Женщинам с рецидивирующими неосложненными инфекциями мочевыводящих путей дополнительно назначается УЗИ мочевого пузыря, чтобы исключить злокачественные новообразования, пролапс тазовых органов, нейрогенные расстройства мочевого пузыря. [30]
Одним из наиболее эффективных методов лечения бактериального цистита у женщин и мужчин является антибиотикотерапия. Неосложненный бактериальный цистит в большинстве случаев лечится в домашних условиях, при этом антибиотики назначаются эмпирически. Чтобы уменьшить интенсивность проявления симптоматики заболевания, дополнительно назначают обильное питье, обезболивающие препараты. [7]
В последнее время у возбудителей цистита увеличивается антибиотикорезистентность, что сильно затрудняет поиск эффективной терапии. Поэтому врачи вынуждены искать альтернативные методы лечения. [7]
Фитолизин ® растительный препарат для лечения цистита
Растительный диуретик широко применяется в составе комплексной терапии неосложненных инфекций мочевыводящих путей. Особенно актуально применение фитопрепаратов совместно с краткими курсами антибиотиков. [19]
Фитолизин® выпускается в удобной форме – паста для приготовления суспензии, которая намного быстрее, по сравнению с таблетками, усваивается и доставляет активные вещества в очаг воспаления [2]. В его составе присутствует 9 растительных экстрактов и 4 эфирных масла [6]. В компонентах лекарственного средства содержатся флавоноиды, сапонины, фитостеролы, микроэлементы, витамины. [26]
В лечении бактериальных циститов препарат демонстрирует высокую степень эффективности, благодаря выраженному противовоспалительному, спазмолитическому, мочегонному действиям [6]. Растительное лекарство от цистита Фитолизин® имеет несколько преимуществ: удобную форму выпуска, широкий спектр действия (купирует воспаление, уменьшает боль и спазмы) [2, 5]. Наличие международного сертификата GMP указывает на то, что препарат производится в соответствии с правилами надлежащей производственной практики [3].
Растительный диуретик увеличивает диурез (объем мочи), а это один из ключевых моментов при лечении неосложненных инфекций мочевыводящих путей. Исследования показывают, что применение растительных диуретиков, к которым относится Фитолизин®, с антибиотиками может быть эффективнее, чем антибактериальная монотерапия. [26]