Чем лечить гарднереллу и уреаплазму у женщин
Лечение уреаплазменной инфекции урогенитального тракта
Уреаплазменную инфекцию лишь условно можно отнести к инфекциям, передаваемым половым путем. Дело в том, что возбудителем при этом является Ureaplasma urealyticum из семейства микоплазм, которые действительно могут обитать в половых путях и передават
Уреаплазменную инфекцию лишь условно можно отнести к инфекциям, передаваемым половым путем. Дело в том, что возбудителем при этом является Ureaplasma urealyticum из семейства микоплазм, которые действительно могут обитать в половых путях и передаваться при половых контактах. Однако роль уреаплазм, как и других микоплазм, за исключением M. genitalium, в возникновении воспалительной реакции достаточно неоднозначна, вследствие чего этот возбудитель большинство авторов, особенно за рубежом, относят к условно-патогенным. И в МКБ-10, международно признанном списке болезней, такого заболевания, как уреаплазмоз или уреаплазменная инфекция, не приведено. Между тем ряд исследователей приводят достаточно убедительные доказательства, свидетельствующие в пользу патогенности этой инфекции. Не так давно в Москве даже была защищена докторская диссертация, автор которой отстаивал именно эту точку зрения.
Как уже говорилось выше, вопрос о роли уреаплазм в этиологии и патогенезе заболеваний урогенитального тракта до сих пор не решен. Слишком уж широко они распространены, и слишком часто эти микроорганизмы выявляются у лиц, не имеющих клинической симптоматики. Авторы, относящие уреаплазмы к облигатным патогенам, считают, что они вызывают уретриты, цервициты, простатиты, послеродовые эндометриты, пиелонефриты, бесплодие, различную патологию беременности (хориоамниониты) и плода (легочную патологию). Другие исследователи полагают, что уреаплазмы являются частью условно-патогенной флоры урогенитального тракта и способны вызывать инфекционно-воспалительные заболевания мочеполовых органов только при определенных условиях (в частности, при недостаточности иммунитета) или при соответствующих микробных ассоциациях.
Авторы некоторых работ утверждают, что именно уреаплазмы зачастую являются причиной неблагоприятных исходов беременности, усугубляют риск преждевременных родов и летального исхода при рождении детей с очень низкой массой тела.
Как и для большинства представителей условно-патогенной флоры, для уреаплазм выделяют ряд факторов, способствующих развитию инфекционно-воспалительных процессов. Наиболее важными из них являются иммунные нарушения, изменения гормонального статуса, массивность колонизации, ассоциации с другими бактериями. Все эти аспекты следует учитывать при выборе тактики ведения таких больных.
Методы диагностики
Как и проблема патогенности уреаплазм, вопрос о необходимости элиминации этих возбудителей из урогенитального тракта также остается открытым. Чаще всего авторы предлагают принимать меры по элиминации этих микроорганизмов при наличии у человека инфекционно-воспалительного процесса в месте их обнаружения (уретрите, простатите, цервиците, вагините), а также при бесплодии, невынашивании беременности, воспалительных заболеваниях органов малого таза, хориоамнионите, послеродовых лихорадочных состояниях при наличии уреаплазм в мочеполовом тракте.
Этиотропное лечение уреаплазменной инфекции основывается на применении антибактериальных препаратов различных групп. Активность препаратов в отношении любой инфекции определяется по минимальной подавляющей концентрации (МПК) в исследованиях in vitro. Показатели МПК, как правило, коррелируют с результатами клинического излечения. Казалось бы, оптимальными препаратами должны являться антибиотики с наименьшей МПК, но при этом нельзя сбрасывать со счетов важность таких параметров, как биодоступность, способность к созданию высоких внутритканевых и внутриклеточных концентраций, переносимость и комплаентность лечения.
Уреаплазмы устойчивы к β-лактамным антибиотикам (пенициллинам и цефалоспоринам), из-за того что у них отсутствует клеточная стенка, и сульфаниламидам, так как эти микроорганизмы не синтезируют кислоту. При лечении уреаплазменной инфекции могут быть эффективны те антибактериальные агенты, которые воздействуют на синтез белка и ДНК, т. е. обладающие бактериостатическим действием. Это препараты тетрациклинового ряда, макролиды, фторхинолоны, аминогликозиды, левомицетин и некоторые другие (см. табл. 1).
Как видно из таблицы, доксициклин и кларитромицин отличаются наилучшими показателями МПК, кроме того, они высокоактивны в отношении уреаплазм. Другие препараты обладают избирательной активностью и их выбор определяется в зависимости от результатов микробиологических исследований.
Тетрациклины
Из антибиотиков тетрациклинового ряда наиболее удобны в применении доксициклин и миноциклин, поскольку они, в отличие от других препаратов этой группы, могут применяться 1-2 раза в день. В настоящее время миноциклин в РФ не зарегистрирован.
Согласно методическим рекомендациям 1998 г. и Федеральному руководству по использованию лекарственных средств, при уреаплазменной инфекции рекомендуется назначение доксициклина (юнидокс солютаб, вибрамицин, медомицин). Препарат назначают по 100 мг 2 раза в день в течение 7-14 дней. Обычно при первом приеме антибиотика дозу удваивают. По рекомендациям Американского центра по контролю и профилактике заболеваний (CDC), доксициклин, наравне с эритромицином и офлоксацином, является препаратом выбора при лечении негонококковых уретритов (НГУ). Менее удобен для пациента курс тетрациклина, который применяют по 500 мг 4 раза в день в течение 7-10 дней.
Доксициклин используют в виде двух солей, в зависимости от того, применяют антибиотик в капсулах или в виде порошка. В капсулах используют доксициклина гидрохлорид или хиклат. Порошок для приготовления других пероральных форм представляет собой моногидрат доксициклина. Использование соли моногидрата вместо гидрохлорида исключает возникновение эзофагитов. Наиболее удобной в применении является лекарственная форма солютаб.
Благодаря своим особым фармакокинетическим свойствам, доксициклин переносится гораздо лучше, чем тетрациклин.
Хорошие результаты были получены при назначении доксициклина женщинам, инфицированным различными микоплазмами (в том числе уреаплазмами) и страдающим бесплодием или привычным невынашиванием беременности. После санации от микоплазм в ряде случаев наступала беременность, которая заканчивалась нормальными родами в срок и без осложнений.
Необходимо, однако, отметить, что от 2 до 33% штаммов уреаплазм могут быть устойчивы к тетрациклину. К другим существенным недостаткам препаратов тетрациклинового ряда можно отнести противопоказания к их назначению беременным и детям до 8 лет, высокую частоту побочных реакций со стороны желудочно-кишечного тракта, а также фотосенсибилизацию кожи во время их применения.
Макролиды, линкозамины, стрептограмины
Из препаратов группы макролидов, азалидов, линкозаминов и стрептограминов наиболее предпочтительны кларитромицин, джозамицин, азитромицин, мидекамицин и эритромицин.
Как уже упоминалось выше, наилучшие показатели МПК из всех макролидных антибиотиков имеет кларитромицин, обладающий всеми преимуществами современных антибиотиков, относящихся к этому классу: хорошей переносимостью, небольшой частотой побочных реакций и высоким комплайенсом.
Кларитромицин (клабакс, клацид) назначают по 250 мг 2 раза в сутки, а в пролонгированной форме СР по 500 мг 1 раз в сутки, в течение 7-14 дней.
Джозамицин (вильпрафен) по 500 мг 3 раза в сутки в течение 7-14 дней.
Азитромицин (азитрал, сумамед, хемомицин) назначают по 250 мг 1 раз в сутки в течение 6 дней или по 1 г однократно.
Мидекамицин (макроен)- по 400 мг 3 раза в сутки в течение 7-14 дней.
Эритромицин (эритромицин, эрифлюид) по 500 мг 4 раза в сутки 7-14 дней.
Рокситромицин (роксид, рокситромицин, рулид) по 150 мг 2 раза в сутки 7-14 дней.
Во время беременности нежелательно назначать азитромицин, рокситромицин, кларитромицин и мидекамицин. Для лечения беременных женщин с уреаплазменной инфекцией рекомендовано применять эритромицин внутрь по 500 мг каждые 6 ч в течение 7-10 дней. Показано, что после такого лечения уменьшаются угроза прерывания беременности, частота самопроизвольных абортов и явления многоводия.
Для лечения беременных рекомендован также джозамицин. Он обладает высокой эффективностью, не вызывая побочных реакций со стороны печени, не влияет на метаболизм других препаратов. При этом действие джозамицина на естественную бактериальную флору невелико.
При рождении детей, внутриутробно инфицированных уреаплазмами, также проводят терапию эритромицином. Предпочтительно внутривенное, капельное назначение препарата из расчета 20-40 мг на 1 кг массы тела.
Фторхинолоны
Все виды микоплазм высоко чувствительны к новым фторхинолонам, особенно офлоксацину. Его лидирующее положение в этой группе обусловлено широким антибактериальным спектром воздействия, высокой бактерицидной активностью, хорошими фармакокинетическими характеристиками (быстротой всасывания, высокими концентрациями препарата в тканях, клетках, биологических жидкостях), низкой токсичностью.
Следует отметить, что исследования антибиотикочувствительности уреаплазм показывают частую их резистентность в клинической практике к офлоксацину и другим фторхинолонам.
Как и в случае с тетрациклинами, препараты этой группы нежелательно применять у беременных, они также вызывают фотосенсибилизацию.
Уреаплазмы среднечувствительны к аминогликозидам и левомицетину. Из аминогликозидов наиболее эффективен гентамицин, который назначают парентерально по 40 мг каждые 8 ч в течение 5 дней. Стрептомицин и канамицин при уреаплазменной инфекции практически неэффективны.
В последние годы как в нашей стране, так и за рубежом участились случаи выявления микоплазм, генетически резистентных к тетрациклину (до 40%), эритромицину, спирамицину (до 30%) и ципрофлоксацину.
В ряде случаев этиотропная терапия может являться частью комбинированной терапии, в частности иммунотропной. В работе Hadson MMT et al. (1998) сообщается о важности иммунологического статуса больного при уреаплазменной инфекции. Так как антибиотики, активные в отношении уреаплазм, обладают бактериостатическим, а не бактерицидным действием, определяющую роль играет иммунный ответ больного. Использование иммунотропной терапии может быть особенно актуальным при неэффективности хотя бы одного курса противомикробного лечения.
Наши собственные исследования показали, что при выборе иммунотропной терапии особенно высокую эффективность демонстрировал препарат иммуномакс.
Этот препарат относится к группе иммуномодуляторов и показан для коррекции ослабленного иммунитета, лечения и профилактики вирусных и бактериальных инфекций.
Когда имеются показания для комбинированной терапии уреаплазменной инфекции, больным назначают антибиотик одновременно с внутримышечными инъекциями иммуномакса. Мы применяли одновременно с 10-дневным стандартным курсом антибактериальной терапии доксициклином или кларитромицином иммуномакс по 200 ЕД на 1- 3-й, 8- 10-й дни лечения. Инъекции выполняли 1 раз в сутки, на курс из 6 инъекций. У 20 из 23 (87%) больных при диагностике, проводившейся через 2 нед по окончании лечения и через 3 мес контрольного наблюдения, уреаплазм не выявлялось.
Наиболее удачной комбинацией при резистентных к стандартной этиотропной терапии случаях уреаплазменной инфекции, а также при рецидивирующем течении этой инфекции является применение антибиотиков в сочетании с иммунотропным лечением, что позволяет добиться элиминации возбудителя и избежать рецидивов инфекции.
М. А. Гомберг, доктор медицинских наук
А. М. Соловьев, кандидат медицинских наук
ЦИКВИ, МГМСУ, Москва
Комплексное лечение смешанных генитальных инфекций
КОМПЛЕКСНОЕ ЛЕЧЕНИЕ СМЕШАННЫХ ГЕНИТАЛЬНЫХ ИНФЕКЦИЙ.
А.Л. Тихомиров, С.И. Сарсания.
Введение.
Проблема роста инфекций, передаваемых половым путем и воспалительных заболеваний органов малого таза, является традиционно актуальной на протяжении последних лет.
В структуре гинекологических нозологий воспалительные заболевания половых органов занимают первое место и составляют 60-65% всех гинекологических больных. В свою очередь, в 60%, причиной ВЗОМТ являются инфекции, передаваемые половым путем. По данным ВОЗ (июнь 2000 г) – 60-70% всех ВЗОМТ за счет хламидиоза и гонореи
(C. trachomatis – 30%; N. gonorrheaе – 40-50%). Часто причиной ВЗОМТ является также Trichomonas vaginalis (частота выявления значительно варьирует), микоуреаплазменная инфекция (12-20%). Этиологическим фактором развития воспалительных заболеваний органов малого таза могут являться факультативная и облигатная анаэробная флора бактериального вагиноза и другие Гр+ и Гр- анаэробные и аэробные бактерии. В 20% случаев ВЗОМТ возбудителей выявить не удается.
Распространение ИППП в мире. (ВОЗ, 1999 г., Donovan B., Lancet, 2004 г.)
Трихомониаз – 174 млн., хламидиоз – 92 млн., гонорея – 62 млн., сифилис – 12 млн.
Отмечено, что U. urealyticum, также как и трихомониаз, была обнаружена у 174 млн.
Наибольший пик заболеваемости ВЗОМТ приходится на период с 15-24 лет.
После 20 лет, особенно после 30 лет, частота регистрации ВЗОМТ значительно уменьшается. Такая закономерность может быть обусловлена как изменением полового поведения, так и появлением защитных антител в цервикальном канале. Отмечена четкая связь между распространением случаев ВЗОМТ и ИППП. В тех странах или регионах, где удается снизить число заболевших гонореей, трихомониазом, хламидиозом, отмечено существенное снижение числа ВЗОМТ.
Состояние и функция верхних отделов репродуктивного тракта во многом зависит от механизмов защиты влагалища:
Слизистая пробка цервикального канала обеспечивает механическую преграду за счет вязкости, а также содержит антимикробные субстанции и антитела (секреторный Ig А, лизоцим).
Также важную защитную роль играет менструация (отторжение функционального слоя эндометрия, формирование на его месте лимфоцитарного вала, препятствует длительному пребыванию патогенных микроорганизмов).
Под действием эндогенных и экзогенных факторов нарушаются защитные механизмы, что приводит к развитию воспалительных процессов во влагалище. Их не эффективное лечение или не диагностирование является одной из причин ВЗОМТ.
Пути и механизмы проникновения инфекции:
— Отрицательный заряд сперматозоидов притягивает бактерии. Наибольшей тропностью к ним обладает кишечная палочка
— ВМК – риск развития ВЗОМТ зависит от времени использования ВМК, от его типа.
Риск наиболее высок в течение первого месяца использования:
— занос инфекции при введении спирали
— распространение бактерий по нитям ВМК
— нарушение процессов слущивания эндометрия
— подавление фагоцитоза и других факторов иммунной защиты
— ВМК способствует появлению микроэрозий и перифокальной
воспалительной реакции стромы.
Некоторые особенности возбудителей ИППП на современном этапе.
Chlamydia trachomatis
Причины внимания к урогенитальному трихомониазу
Trichomonas vaginalis
Клинические признаки трихомонадной инфекции в «классическом варианте» течения болезни достаточно патогномоничны и включают желто-зеленые пенистые выделения, зуд, дизурию, диспарению и «клубничный» вид шейки матки и вагины, представляющий собой точечные геморрагии. Тем не менее диагноз не может быть поставлен исключительно на основании клинической картины по нескольким причинам:
В связи с тем что клинические симптомы трихомонадной инфекции довольно часто не отражают реальной картины заболевания, необходимо применять лабораторные методы диагностики.
Современные особенности ВЗОМТ
Острое начало воспалительного процесса наблюдается редко,протекает с переходом в хроническую форму или выздоровление. Как правило, постепенное развитие, без клинических проявлений приводит к хроническому течению ВЗОМТ.
И все же клинические проявления могут быть в виде:
Диагностика ИППП при ВЗОМТ
ЛЦР Tbs, сифилис)
В нашей стране, согласно действующих нормативных документов, для подтверждения диагноза: трихомониаз используется в основном цитологический и культуральные методы. Другие методы диагностики, в настоящее время, не включены в действующие регламентирующие документы, в связи, с чем диагноз, установленный с их помощью, не будет считаться юридически правомочным со всеми вытекающими последствиями.
(Хламидиоз, микоуреаплазменная инфекции).
За рубежом, наиболее часто, применяются амплификационные методы диагностики. Помимо ПЦР и ЛЦР в эту группу входит рибосомальная РНК амплификация (ТМА – «transcription-mediated-amplification»). На основе амплификационных методик разработаны мочевые тесты, довольно удобные в амбулаторной практике, однако они не получили пока широко распространения в нашей стране.
Последствия генитальной инфекции.
Наиболее частыми и грозными последствиями генитальной инфекции являются бесплодие и внематочная беременность. Так бесплодие, при наличии хламидий, встречается у 50%, при наличии гонококка – 30-40%, уреаплазм – 30% и более, трихомонад – 45-50%.
Факторы, обусловливающие необходимость госпитализации.
В мировой врачебной практике 13 пациенткам из 1000 ежегодно ставится диагноз воспалительного заболевания органов малого таза. Только 10% из них госпитализируются.
Лечение смешанных генитальных инфекций
В настоящее время общепризнанно, что терапия должна быть прямо направлена против аэробного и анаэробного компонентов полимикробной флоры, которую чаще всего выделяют у больных с инфекциями малого таза.
В настоящее время стандартное лечение трихомониаза (рекомендации ВОЗ, CDC) включает прием метронидазола. Для лечения ВЗОМТ (офлоксацин, доксициклин).
Метронидазол поступает в клетку диффузией и активируется гидрогеносомах влагалищных трихомонад. Здесь нитрогруппа препарата отщепляется посредством пируват-ферродоксин-оксиредуктазы, в результатечего цитотоксические нитро-радикальные ионные интермедиаты расщепляют нити ДНК. Ответ возникает быстро. Клеточное деление и подвижность клетки прекращается в течение 1 часа, а сама клетка (по данным культурального исследования) погибает в течение примерно 8 часов. Препарат активен в отношении Trichomonas vaginalis, Gardnerella vaginalis, Giardia intestinalis, Entamoeba histolytica, облигатных анаэробных бактерий: Bacteroides spp. (в т.ч. Bacteroides fragilis, Bacteroides distasonis, Bacteroides ovatus, Bacteroides thetaiotaomicron, Bacteroides vulgatus), Fusobacterium spp., Veillonela spp.; некоторых грамположительных бактерий: Eubacterium spp., Clostridium spp., Peptococcus spp., Peptostreptococcus spp. Основной метаболит (2-оксиметронидазол) также оказывает противопротозойное и антибактериальное действие. T1/2 составляет 8 ч.
Метронидазол хорошо сорбируется на большинстве мембран слизистых; эффективность его поступления в клетки эпителия вагины при приеме внутрь доказана.
Учитывая все вышеперечисленное, в амбулаторной практике, мы использовали
Трихопол 250 мг – 2 раза в день + Трихопол (вагинальные таблетки) 500 мг 1 раз на ночь в течении 7 дней + Антибиотики различных групп (Офлоксацин или Доксициклин или Джозамицин) по 1 таб. или капсуле 2 раза в день, в течении 10 дней. Такая схема является наиболее оптимальным вариантом комбинированного комплексного лечения, учитывая, что пероральный прием трихопола является наиболее эффективным, а вагинальный – наиболее щадящим.
Активность современных антибактериальных препаратов в отношении возбудителей ВЗОМТ
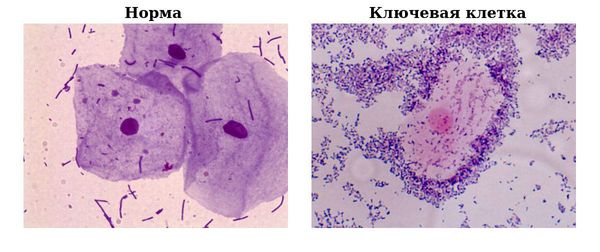
Что такое гарднереллез? Причины возникновения, диагностику и методы лечения разберем в статье доктора Григоренко Ю. А., гинеколога со стажем в 19 лет.
Определение болезни. Причины заболевания
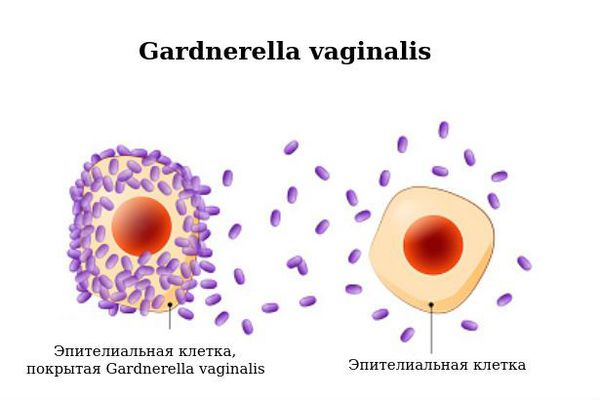
Gardnerella vaginalis — мелкие грамотрицательные (бактерии, которые не окрашиваются фиолетовым цветом при использовании метода Грама ) или грамвариабельные ( могут окрашиваться и не окрашиваться про использовании метода Грама) бескапсульные неподвижные палочки длиной 1,0—2,0 мкм, толщиной 0,3—0,6 мкм, часто обладающие полиморфизмом (разнообразием структуры и формы), вырабатывающие аминокислоты и уксусную кислоту.
Гарднереллёз относят к числу заболеваний, передающихся исключительно половым путём, тем не менее эпидемиология ( возникновение и распространение болезни) остаётся невыясненной. Наличие гарднерелл у здоровых женщин позволяет определять их как составляющую нормального биоценоза (уникальной и сбалансированной экосистемы) влагалища. Т. е. гарднерелла — факультативный (возможный, необязательный) анаэроб, который является условно-патогенным микроорганизмом и в незначительном количестве не оказывает существенного вреда человеческому организму.
Болеют гарднереллёзом как женщины, так и мужчины. В норме у женщин во влагалище преобладает кислая среда, которая создаётся и поддерживается лактобактериями, они составляют большую часть (95-98 %) от всей присутствующей там микрофлоры. При развитии гарднереллёза происходит рост и размножение бактерий, нормальная микрофлора влагалища при этом уничтожается.
Факторы развития гарднереллёза
Изменения в нормальной здоровой микрофлоре влагалища происходят под воздействием следующих факторов:
С одной стороны, данные говорят об эндогенном (внутреннем) происхождении гарднереллёза (длительное использование внутриматочной спирали или пероральных контрацептивов, беременность и послеродовый период, аборты и менопауза). С другой стороны, у заболевания есть и признаки половой инфекции:
Если рассматривать гарднереллёз, как половую инфекцию, то следует назвать пути её передачи.
Пути передачи гарднереллы:
Симптомы гарднереллеза
Выделяют два варианта клинического течения гарднереллёза: бессимптомное и с клиническими проявлениями.
При бессимптомном течении отсутствуют клинические проявления, т. е. у пациенток нет жалоб и никаких особых симптомов, при этом имеются лабораторные признаки заболевания.
Клиническая картина у мужчин
У лиц мужского пола чаще всего возникает уретрит, для которого характерно вялое течение. Субъективных симптомов обычно не бывает, но возможен зуд и скудные, серозно-слизистые выделение беловатого цвета из уретры. Гарднереллы могут обнаруживаться у лиц без признаков уретрита и самопроизвольно исчезать (транзиторное носительство).
Клиническая картина у женщин
Как правило, у женщин возникает вагинит (воспаление слизистой оболочки влагалища), при остром течении которого отмечаются дискомфорт в области половых органов, зуд и жжение вульвы, а также обильные выделения из влагалища и покраснение слизистых. Выделения с «рыбным» запахом обычно скапливаются в заднем своде влагалища и обволакивают плёнкой почти всю шейку матки. Гиперемированные (покрасневшие) и отёчные губки уретры вызывают цистит с частым и болезненным мочеиспусканием и резями.
При вялом течении гарднереллёза отмечается лишь кратковременный зуд, а выделения становятся скудными. В типичных случаях выделений бывает немного, они серовато-белые или водянистые.
Патогенез гарднереллеза
Лактобациллы, постоянно находящиеся во влагалищной среде, образуют устойчивый здоровый экологический барьер, который препятствует размножению условно-патогенных микроорганизмов. Устойчивость нормальной микрофлоры обусловлена выделением молочной кислоты (обеспечивает низкий pH), противомикробных веществ, адгезинов и пероксида водорода. При неблагоприятных условиях количество лактобацилл уменьшается, pH влагалища увеличивается, что приводит к размножению условно-патогенных микроорганизмов, включая гарднерелл, в мочеиспускательном канале и других анатомических структурах нашего организма [15]
Быстро размножающиеся анаэробы в организме человека способны выделять аминокислоты и жирные кислоты. Именно из-за этих веществ появляется неприятный запах, напоминающий протухшую рыбу. Также гарднереллы образуют защитную биологическую плёнку, которая не позволяет восстановиться естественной микрофлоре влагалища. Многие научные исследования доказывают, что такая биологическая плёнка может сохраняться даже после проведения медикаментозного лечения заболевания.
Классификация и стадии развития гарднереллеза
Свежий процесс (с давностью заражения до двух месяцев)
Хронический процесс (с давностью заражения более двух месяцев) симптомы заболевания слабо выражены или отсутствуют.
Инкубационный период — от 5 дней до 3 недель (в среднем 7—10 дней).
Для характеристики клинических признаков урогенитальных патологий, вызванных анаэробной инфекцией, ученые создали специальную научную классификацию, включающую различные формы гарднереллёза:
Осложнения гарднереллеза
Гарднереллёз у женщин может вызывть следующие осложнения:
Во время беременности иммунитет снижается физиологически и на фоне этого возрастает вероятность массивного поражения гарднереллами мочеполовой системы женщины. Гарденереллёз в этом случае может пивести к невынашиванию беременности на разных сроках, преждевременным родам, рождению маловесных детей, осложнённым патологическим родам.
В последнее время стало известно, что анаэробные микроорганизмы, такие как гарднереллы, способны выделять нитрозамины, которые служат коферментами канцерогенеза (зарождения и развития опухоли) и могут стать причиной возникновения диспластических и дистрофических процессов в шейке матки.
Гарднереллёз у мужчин может стать причиной:
Нередко возникают различные осложнения уретрита, например эпидидимит (воспаление придатка яичка). Его особенностью является внезапное острое начало с последующим вялым течением. Наблюдаются расстройства общего состояния: недомогание, слабость, субфебрильная температура (37,1—38,0 °C), нерезкий болевой синдром в области промежности.
Диагностика гарднереллеза
Диагностическими критериями гарднереллеза являются:
Наиболее актуальны в современной практической медицине микроскопические и микробиологические методы исследования:
При гарднереллёзе во влагалищном отделяемом отмечается резкое снижение количества лейкоцитов, тогда как в цервикальном канале наблюдается лейкоцитоз (повышение числа лейкоцитов). В отделяемом уретры содержание лейкоцитов, как правило, находится в пределах физиологической нормы. При наличии смешанной флоры во влагалище лейкоцитоз отмечается во всех очагах, а лактобактерии при этом единичны или полностью отсутствуют.
Также может применяться микроскопия с оценкой влагалищного биоценоза в баллах от 0 до 10 (баллы Nugent). Диагноз «бактериальный вагиноз» ставят при наборе более шести баллов. На данный момент оценка Nugent считается наиболее точным методом диагностики гарднереллёза.
Также может использоваться и шкала Хэй-Айсон, при которой результаты микроскопического исследования мазка записываются в виде пяти уровней дисбактериоза микрофлоры влагалища.
Лечение гарднереллеза
2. Восстановление нормального вагинального биомикроценоза путём назначения эубиотиков и про биотиков. Это полезные для каждого человека живые микроорганизмы, которые восстанавливают микрофлору кишечника и поддерживают её состояние. Их можно получить из продуктов, обогащённых бактериями, а также из биодобавок.
При лечении пациенток с нарушениями микрофлоры влагалища необходимо уделять внимание состоянию микробиоценоза кишечника, так как между кишечником и влагалищем имеется особая взаимосвязь (постоянное подселение условно-патогенных микроорганизмов из ануса). Поэтому при лечении гарднереллёза очень важно оценить состояние микрофлоры кишечника и включать в комплекс лечебных процедур назначение препаратов для одновременной коррекции микрофлоры как влагалища, так и кишечника.
Все препараты должен подбирать исключительно врач, исходя из данных заключения микробиологических исследований, наличия или отсутствия фоновых заболеваний и индивидуальных особенностей организма пациентки.
Лечиться должны одновременно оба партнёра (мужчина принимает препараты как перорально, так и местно) и в этот временной отрезок нужно либо воздерживаться от половых контактов, либо использовать метод барьерной контрацепции (презерватив).
Прогноз. Профилактика
Чтобы снизить риск заражения гарднереллёзом и предотвратить рецидив заболевания, следует соблюдать некоторые рекомендации:
До окончания лечения важно избегать половых контактов партнёров без презерватива. Лечение мужчин, к сожалению, не уменьшает частоту возникновения рецидивов гарднереллёза у женщин.
Что такое гарднереллез? Причины возникновения, диагностику и методы лечения разберем в статье доктора Григоренко Ю. А., гинеколога со стажем в 19 лет.
Определение болезни. Причины заболевания
Gardnerella vaginalis — мелкие грамотрицательные (бактерии, которые не окрашиваются фиолетовым цветом при использовании метода Грама ) или грамвариабельные ( могут окрашиваться и не окрашиваться про использовании метода Грама) бескапсульные неподвижные палочки длиной 1,0—2,0 мкм, толщиной 0,3—0,6 мкм, часто обладающие полиморфизмом (разнообразием структуры и формы), вырабатывающие аминокислоты и уксусную кислоту.
Гарднереллёз относят к числу заболеваний, передающихся исключительно половым путём, тем не менее эпидемиология ( возникновение и распространение болезни) остаётся невыясненной. Наличие гарднерелл у здоровых женщин позволяет определять их как составляющую нормального биоценоза (уникальной и сбалансированной экосистемы) влагалища. Т. е. гарднерелла — факультативный (возможный, необязательный) анаэроб, который является условно-патогенным микроорганизмом и в незначительном количестве не оказывает существенного вреда человеческому организму.
Болеют гарднереллёзом как женщины, так и мужчины. В норме у женщин во влагалище преобладает кислая среда, которая создаётся и поддерживается лактобактериями, они составляют большую часть (95-98 %) от всей присутствующей там микрофлоры. При развитии гарднереллёза происходит рост и размножение бактерий, нормальная микрофлора влагалища при этом уничтожается.
Факторы развития гарднереллёза
Изменения в нормальной здоровой микрофлоре влагалища происходят под воздействием следующих факторов:
С одной стороны, данные говорят об эндогенном (внутреннем) происхождении гарднереллёза (длительное использование внутриматочной спирали или пероральных контрацептивов, беременность и послеродовый период, аборты и менопауза). С другой стороны, у заболевания есть и признаки половой инфекции:
Если рассматривать гарднереллёз, как половую инфекцию, то следует назвать пути её передачи.
Пути передачи гарднереллы:
Симптомы гарднереллеза
Выделяют два варианта клинического течения гарднереллёза: бессимптомное и с клиническими проявлениями.
При бессимптомном течении отсутствуют клинические проявления, т. е. у пациенток нет жалоб и никаких особых симптомов, при этом имеются лабораторные признаки заболевания.
Клиническая картина у мужчин
У лиц мужского пола чаще всего возникает уретрит, для которого характерно вялое течение. Субъективных симптомов обычно не бывает, но возможен зуд и скудные, серозно-слизистые выделение беловатого цвета из уретры. Гарднереллы могут обнаруживаться у лиц без признаков уретрита и самопроизвольно исчезать (транзиторное носительство).
Клиническая картина у женщин
Как правило, у женщин возникает вагинит (воспаление слизистой оболочки влагалища), при остром течении которого отмечаются дискомфорт в области половых органов, зуд и жжение вульвы, а также обильные выделения из влагалища и покраснение слизистых. Выделения с «рыбным» запахом обычно скапливаются в заднем своде влагалища и обволакивают плёнкой почти всю шейку матки. Гиперемированные (покрасневшие) и отёчные губки уретры вызывают цистит с частым и болезненным мочеиспусканием и резями.
При вялом течении гарднереллёза отмечается лишь кратковременный зуд, а выделения становятся скудными. В типичных случаях выделений бывает немного, они серовато-белые или водянистые.
Патогенез гарднереллеза
Лактобациллы, постоянно находящиеся во влагалищной среде, образуют устойчивый здоровый экологический барьер, который препятствует размножению условно-патогенных микроорганизмов. Устойчивость нормальной микрофлоры обусловлена выделением молочной кислоты (обеспечивает низкий pH), противомикробных веществ, адгезинов и пероксида водорода. При неблагоприятных условиях количество лактобацилл уменьшается, pH влагалища увеличивается, что приводит к размножению условно-патогенных микроорганизмов, включая гарднерелл, в мочеиспускательном канале и других анатомических структурах нашего организма [15]
Быстро размножающиеся анаэробы в организме человека способны выделять аминокислоты и жирные кислоты. Именно из-за этих веществ появляется неприятный запах, напоминающий протухшую рыбу. Также гарднереллы образуют защитную биологическую плёнку, которая не позволяет восстановиться естественной микрофлоре влагалища. Многие научные исследования доказывают, что такая биологическая плёнка может сохраняться даже после проведения медикаментозного лечения заболевания.
Классификация и стадии развития гарднереллеза
Свежий процесс (с давностью заражения до двух месяцев)
Хронический процесс (с давностью заражения более двух месяцев) симптомы заболевания слабо выражены или отсутствуют.
Инкубационный период — от 5 дней до 3 недель (в среднем 7—10 дней).
Для характеристики клинических признаков урогенитальных патологий, вызванных анаэробной инфекцией, ученые создали специальную научную классификацию, включающую различные формы гарднереллёза:
Осложнения гарднереллеза
Гарднереллёз у женщин может вызывть следующие осложнения:
Во время беременности иммунитет снижается физиологически и на фоне этого возрастает вероятность массивного поражения гарднереллами мочеполовой системы женщины. Гарденереллёз в этом случае может пивести к невынашиванию беременности на разных сроках, преждевременным родам, рождению маловесных детей, осложнённым патологическим родам.
В последнее время стало известно, что анаэробные микроорганизмы, такие как гарднереллы, способны выделять нитрозамины, которые служат коферментами канцерогенеза (зарождения и развития опухоли) и могут стать причиной возникновения диспластических и дистрофических процессов в шейке матки.
Гарднереллёз у мужчин может стать причиной:
Нередко возникают различные осложнения уретрита, например эпидидимит (воспаление придатка яичка). Его особенностью является внезапное острое начало с последующим вялым течением. Наблюдаются расстройства общего состояния: недомогание, слабость, субфебрильная температура (37,1—38,0 °C), нерезкий болевой синдром в области промежности.
Диагностика гарднереллеза
Диагностическими критериями гарднереллеза являются:
Наиболее актуальны в современной практической медицине микроскопические и микробиологические методы исследования:
При гарднереллёзе во влагалищном отделяемом отмечается резкое снижение количества лейкоцитов, тогда как в цервикальном канале наблюдается лейкоцитоз (повышение числа лейкоцитов). В отделяемом уретры содержание лейкоцитов, как правило, находится в пределах физиологической нормы. При наличии смешанной флоры во влагалище лейкоцитоз отмечается во всех очагах, а лактобактерии при этом единичны или полностью отсутствуют.
Также может применяться микроскопия с оценкой влагалищного биоценоза в баллах от 0 до 10 (баллы Nugent). Диагноз «бактериальный вагиноз» ставят при наборе более шести баллов. На данный момент оценка Nugent считается наиболее точным методом диагностики гарднереллёза.
Также может использоваться и шкала Хэй-Айсон, при которой результаты микроскопического исследования мазка записываются в виде пяти уровней дисбактериоза микрофлоры влагалища.
Лечение гарднереллеза
2. Восстановление нормального вагинального биомикроценоза путём назначения эубиотиков и про биотиков. Это полезные для каждого человека живые микроорганизмы, которые восстанавливают микрофлору кишечника и поддерживают её состояние. Их можно получить из продуктов, обогащённых бактериями, а также из биодобавок.
При лечении пациенток с нарушениями микрофлоры влагалища необходимо уделять внимание состоянию микробиоценоза кишечника, так как между кишечником и влагалищем имеется особая взаимосвязь (постоянное подселение условно-патогенных микроорганизмов из ануса). Поэтому при лечении гарднереллёза очень важно оценить состояние микрофлоры кишечника и включать в комплекс лечебных процедур назначение препаратов для одновременной коррекции микрофлоры как влагалища, так и кишечника.
Все препараты должен подбирать исключительно врач, исходя из данных заключения микробиологических исследований, наличия или отсутствия фоновых заболеваний и индивидуальных особенностей организма пациентки.
Лечиться должны одновременно оба партнёра (мужчина принимает препараты как перорально, так и местно) и в этот временной отрезок нужно либо воздерживаться от половых контактов, либо использовать метод барьерной контрацепции (презерватив).
Прогноз. Профилактика
Чтобы снизить риск заражения гарднереллёзом и предотвратить рецидив заболевания, следует соблюдать некоторые рекомендации:
До окончания лечения важно избегать половых контактов партнёров без презерватива. Лечение мужчин, к сожалению, не уменьшает частоту возникновения рецидивов гарднереллёза у женщин.
Инфекции гарднерелла уреаплазма
Гарднерелла 1.1 10 6
Уреаплазма 4.9 10 4
В микроскопии V
Лейкоциты V 0-1
Микрофлора смешанная, количество м обильное, плоский эпител умеренно
В цервикальном канале:
Лейкоциты 6-8
Микрофлора обильная
Количество микрофлоры умеренное.
Остальное в норме или не обнаружено.
Тянущие боли внизу живота, дискомфорт во влагалище.
Нужно ли лечить женщине, как, мужу только антибиотики? Верное от лечение назначено? Через какое время После лечения пересдать анализ?
На сервисе СпросиВрача доступна консультация гинеколога онлайн по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно и бесплатно. Задайте свой вопрос и получите ответ сразу же!
Анна,
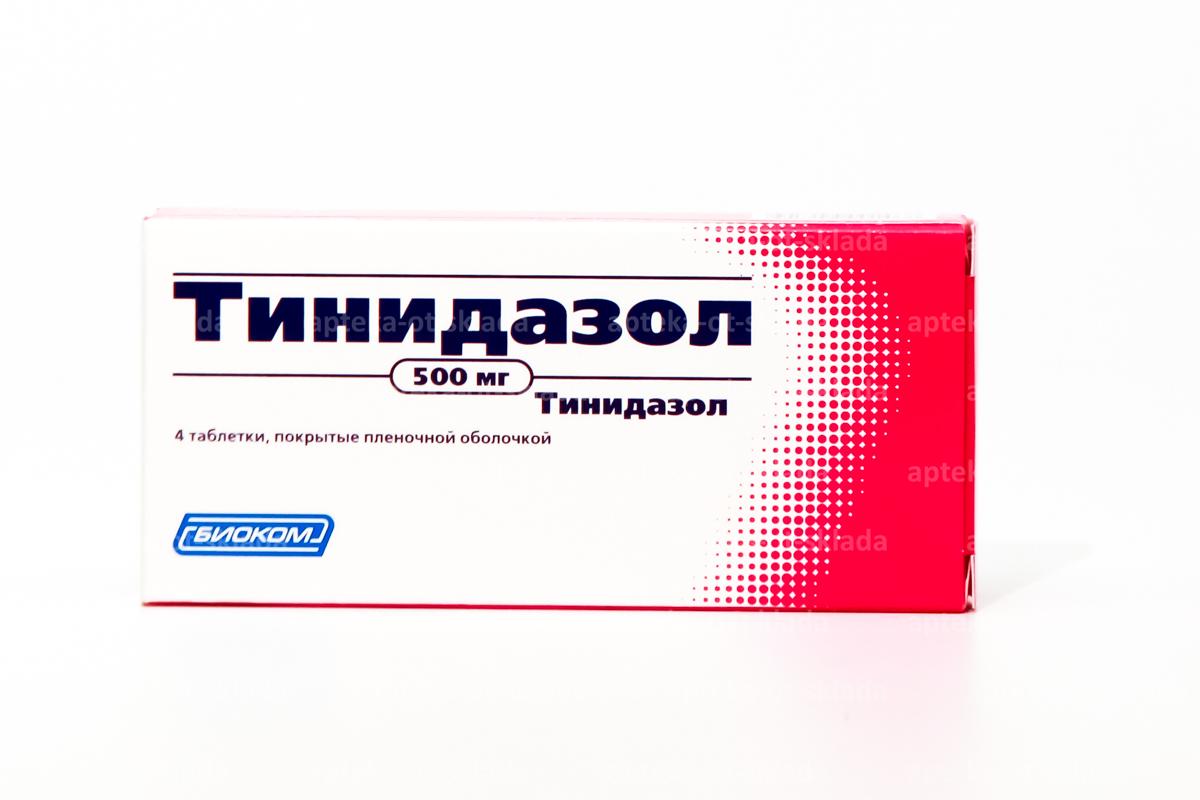
1. Метронидазол по 500 мг 2 раза в день 7 дней
2. Аципол 1 к 2 раза в день 10 дней
3. Эльжина вагин тб 9 дней перед сном вагин
4. Лактожиналь по 1к 2 раза в день 7 дней вагин
Партнер сидит попить Метронидазол плюс Аципол.
Пересдать анализ нужно через месяц после окончания лечения.
Уреаплазма и гарднерелла
Уреаплазмоз и гарднереллез – два совершенно разных заболевания половой сферы.
Каждое имеет своего возбудителя и клиническую картину, отличается в видах диагностики и лечения.
Тем не менее, при проведении обследования на ИППП в результатах анализа уреаплазма и гарднерелла часто выявляются вместе.
Поэтому есть необходимость рассмотреть общую симптоматику и возможные варианты лечения этих инфекций.
Гарднерелла – условно-патогенный микроорганизм.
В небольшом количестве присутствует в микрофлоре любой здоровой женщины.
При увеличении количества этих бактерий и сниженном содержании палочковых лактобактерий может развиться дисбиотическое состояние.
Его называют гарднереллезом, или бактериальным вагинозом.
Уреаплазма – условно-патогенный микроорганизм, который в большом количестве приводит к уреаплазмозу.
Заболевание может иметь неприятные последствия в виде выкидыша, неразвивающейся беременности.
Также вызывает существенный дискомфорт своими проявлениями.
Причины уреаплазмоза и гарднереллеза
Ureaplasma urealyticum может попасть в организм женщины половым путем.
Именно поэтому инфекцию ранее относили к категории ЗППП.
Но после более детального изучения женской микрофлоры и обнаружения этих бактерий у здоровых пациенток уреаплазмоз перестали причислять к половым инфекциям.
Как и гарднереллез, уреаплазменную инфекцию на сегодняшний день относят к дисбиотическому состоянию.
Важную роль в развитии обоих заболеваний отводят факторам, способствующим уменьшению нормальных палочковых лактобактерий.
Среди этих состояний:
Симптомы уреаплазмы и гарднереллы
Сразу стоит сказать, что проявления гарднереллеза выражены гораздо сильнее, чем уреаплазмы.
Так что эти бактерии и будут определять клинические проявления.
Основные симптомы:
Беременность, уреаплазма и гарднерелла
Часто бывает и так, что на фоне имеющихся инфекций беременность наступает достаточно легко.
И тогда возникает новый страх: как будут вместе уживаться уреаплазма, гарднерелла и беременность.
Среди наиболее частых осложнений:
Уреаплазма и гарднерелла у мужчин
Проявления дисбиоза и уреаплазмоза у мужчин довольно скудные.
До 90% случаев инфицирования болезни протекают в форме бессимптомного носительства.
И лишь в небольшом проценте случаев возникает клиническая симптоматика в виде небольшого жжения, болезненности при мочеиспускании, мелких очагов покраснения и патологических выделений.
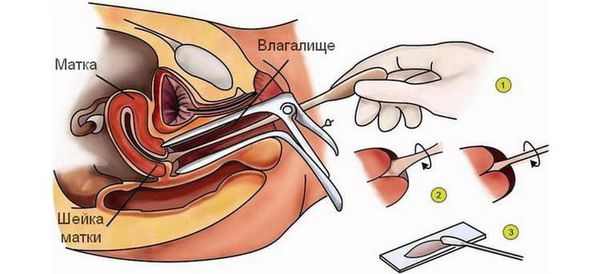
Уреаплазма и гарднерелла в анализах
Для диагностики заболеваний могут быть назначены следующие анализы.
Простой мазок на состав микрофлоры
Это обследование – одно из самых быстрых.
По результату мазка можно увидеть:
Измерение рН вагинального отделяемого
При гарднереллезе эта цифра обычно выше 4.5.
Взятие крови методом ИФА для определения титра антител к уреаплазме.
Диагностически значимым считается количество бактерий больше 10 в четвертой степени.
Молекулярно-биологическое исследование с помощью ПЦР
Этим методом можно обнаружить генетический материал и гарднереллы, и уреаплазмы.
Это один из самых точных методов исследования, помогающий в постановке правильного диагноза.
Уреаплазма и гарднерелла: комплексное лечение
При наличии в организме уреаплазмы и гарднереллы лечение обязательно должно быть комплексным.
Если назначить только антибиотик от уреаплазмы, это приведет к еще большему размножению гарднерелл.
В схему лечения уреаплазмоза и гарднереллеза при их выявлении входят следующие препараты:
К сожалению, некоторые антибиотики оставляют после себя «выжженную землю».
Т.е. наряду с патогенными микробами, они убивают всю влагалищную флору.
В этом случае назначаются препараты, способствующие восстановлению нормального биоценоза половых путей:
Помните, что лечение должны проходить оба половых партнера, на время терапии исключается половая жизнь.
Курс лечения обычно не превышает 14 дней.
Уреаплазма и гарднерелла: отзывы
Существуют форумы, где пациентки делятся информацией по лечению уреаплазмы и гарднереллы.
Из их просмотра становится понятно, что только комплексный подход к лечению приводит в большинстве случаев к полной элиминации бактерий из организма.
В некоторых случаях происходит повторное развитие гарднереллеза, если не устранен основной провоцирующий фактор.
Например, пациентка не готова отказаться от курения или использования ежедневных прокладок.
В нашем КВД можно за один день пройти диагностику уреаплазмоза и гарднереллеза и получить консультацию по вопросам лечения.
Эффективная антибактериальная терапия микоплазменной инфекции у женщин репродуктивного возраста
Вопросы антибиотикотерапии урогенитальной микоплазменной инфекции активно дискутируются. Многочисленные исследования посвящены разработке рекомендаций по терапии микоплазменной инфекции. Но по-прежнему наиболее сложным и актуальным на сегодняшний день ост
В последние десятилетия наряду с ростом заболеваемости урогенитальной патологией отмечаются значительные изменения в ее структуре. По данным эпидемиологических исследований, более чем у 40% больных с воспалительными заболеваниями урогенитального тракта выявляется микоплазменная инфекция [1].
Урогенитальная микоплазменная инфекция довольно широко распространена в популяции. Человек является естественным хозяином, по крайней мере, одиннадцати видов микоплазм, из них три вида (Mycoplasma genitalium, Mycoplasma hominis, Ureaplasma urealyticum) способны вызывать воспалительные заболевания урогенитального тракта. Носительство М. hominis и U. urealyticum среди населения варьирует от 10% до 50% [1].
Исследователями из США предложен термин «негонококковые нехламидийные уретриты». Этиологическими агентами при таких уретритах могут являться генитальные микоплазмы (U. urealyticum, M. genitalium). При рецидивирующем уретрите была продемонстрирована роль M. genitalium, определяемой с помощью полимеразной цепной реакции в режиме реального времени (PCR-Real time) [2]. Кроме того, показана роль других генитальных микоплазм, в частности U. urealyticum, в развитии этого заболевания.
В настоящее время все большее внимание в отечественной и зарубежной литературе уделяется виду U. urealyticum. Данный вид включает в себя два биовара: PARVO (серотипы 1, 3, 6 и 14) и T-960 (серотипы 2, 4, 5, 7, 8, 9, 10, 11, 12, 13). Оба биовара способны инициировать патологические проявления. Так, с биоваром PARVO связывают выраженную лейкоцитарную реакцию при микроскопии мазка, кольпит, пиелонефрит, дистрофические изменения плаценты, а также рождение детей с массой тела менее 3 кг.
Биовар Т-960 считается ответственным за проявления негонококкового уретрита у мужчин, патологические выделения из влагалища у женщин и, в редких случаях, внутриутробную гибель плода [3].
Отличительными особенностями микоплазм и уреаплазм являются отсутствие клеточной стенки и способность паразитировать на мембране клеток хозяина.
Учитывая высокую распространенность микоплазм, в особенности у беременных женщин, их клиническая роль зависит от степени колонизации ими урогенитального тракта [4]. Так, статистически выявлена значительная связь между уровнем колонизации U. urealyticum и M. hominis мочеполовых путей женщин и преждевременными родами, а также дородовым излитием околоплодных вод [4]. В литературе появляется все больше сообщений о внутриутробной микоплазменной инфекции, которая реализуется у новорожденных чаще всего в виде пневмоний, но может носить и генерализованный характер [4].
Основной путь передачи микоплазменной инфекции — половой. Чаще всего микоплазмы обнаруживаются у лиц с повышенной половой активностью. Для развития инфекционного процесса важное значение имеет не столько сам факт наличия или отсутствия микоплазм, сколько широта и массивность их диссеминации. К факторам, провоцирующим развитие инфекционного процесса, относятся: присоединившаяся инфекция другой природы, изменение гормонального фона, беременность и роды; нарушения иммунного и интерферонового статусов организма. Немаловажную роль в развитии инфекции играет и вирулентность конкретного штамма.
Кроме того, широко распространено бессимптомное носительство микоплазм. Во многих случаях они вызывают латентную инфекцию, которая под влиянием различных стрессовых факторов может перейти в хроническую рецидивирующую или острую форму.
Клиническая картина мико- и уреаплазменной инфекции неспецифична и, как правило, не отличается от клинических проявлений инфекций, вызванных другими возбудителями урогенитальных инфекций.
Таким образом, воспалительные заболевания мочеполовых органов, обусловленные патогенными и условно-патогенными микоплазмами, продолжают оставаться серьезной проблемой в связи с возможностью развития тяжелых осложнений, связанных с репродуктивной функцией. Несмотря на неоднозначность мнений исследователей в отношении патогенной роли мико- и уреаплазменной инфекции, в этиологической классификации Всемирной организации здравоохранения (ВОЗ) 2006 г. и синдромальной классификации CDC (Centers for Disease Control and Prevention, центры по контролю и профилактике заболеваний США) эти микроорганизмы выделены как возможные этиологические агенты неспецифических негоноккоковых уретритов, воспалительных заболеваний органов малого таза и бактериального вагиноза [2].
Современные международные и российские рекомендации по лечению микоплазменной инфекции
Одним из наиболее сложных на сегодняшний день остается вопрос эффективности терапии урогенитальных инфекций.
Многочисленные исследования посвящены разработке схем и методик применения тех или иных антимикробных препаратов. Оптимизируют антибактериальную терапию с помощью иммуномодуляторов, ферментных и других лекарственных средств. В целом, терапия инфекций, передаваемых половым путем, должна быть комплексной, а применяемые препараты — обладать широким спектром действия. К препаратам, используемым для лечения инфекций, передаваемых половым путем, ВОЗ выдвинуты следующие требования:
Основные принципы медикаментозной терапии:
Рациональный выбор антибиотиков для эмпирической терапии следует осуществлять с учетом следующих критериев:
Вопросы антибиотикотерапии урогенитальной микоплазменной и уреаплазменной инфекции также активно дискутируются. В то же время адекватная антибиотикотерапия должна проводиться лишь с учетом чувствительности конкретного штамма возбудителя [5–6].
С учетом вышеуказанных пунктов можно выделить следующие перспективные группы антибиотиков для лечения мико- и уреаплазменной инфекции: тетрациклины, макролиды, фторхинолоны, азалиды.
Критериями назначения этиотропной терапии при выявлении генитальных микоплазм, по мнению большинства исследователей, являются:
1) клинические и лабораторные признаки воспалительного процесса в органах мочеполовой системы;
2) результаты комплексного микробиологического обследования на наличие патогенных и условно-патогенных микроорганизмов с количественным обнаружением генитальных микоплазм более 104 КОЕ/мл;
3) предстоящие оперативные или другие инвазивные мероприятия на органах мочеполовой системы;
4) бесплодие;
5) беременность (оценка акушерско-гинекологического анамнеза).
Среди наиболее часто применяемых антибиотиков сохраняется стабильно высокая чувствительность мико- и уреплазменной инфекции к джозамицину (94,8% 5 лет назад и 94,4% в настоящее время) и отмечается увеличение числа штаммов, чувствительных к доксициклину, с 93,2% до 97,2%. Вместе с тем чувствительность к другому антибиотику этой же группы, тетрациклину, снизилась с 92,5% до 83,3%.
Препараты, указанные в альтернативных схемах, не имеют каких-либо преимуществ между собой и рассматриваются как равнозначные.
Рекомендованными препаратами в соответствии с Европейским руководством по ведению беременных женщин, инфицированных микоплазмами [7], являются: эритромицин по 500 мг 4 раза в день в течение 7 дней; или амоксициллин 500 мг внутрь 3 раза в день 7 дней; или джозамицин 500 мг 2 раза в день 7 дней.
Для лечения беременных [2] применяется следующая схема: джозамицин по 500 мг внутрь 3 раза в сутки в течение 10 дней (табл. 1 и 2).
Эффективность и безопасность отдельных препаратов, используемых для терапии микоплазменной инфекции
Тетрациклины
Одним из основных препаратов для лечения инфекций, передаваемых половым путем, остается представитель группы тетрациклинов — доксициклин. При этом эталоном эффективности различных режимов терапии является пероральный прием доксициклина (100 мг 2 раза в день в течение 10 дней). Доксициклин отличается от тетрациклина лучшими фармакокинетическими свойствами и большей безопасностью. В основе механизма антибактериального действия доксициклина, как и других тетрациклинов, лежит подавление им биосинтеза белка микробной клетки на уровне рибосом [8]. Среди солей доксициклина предпочтение следует отдавать моногидрату, который, в отличие от гидрохлорида, не вызывает развития эзофагита и оказывает минимальное воздействие на микрофлору кишечника [4]. Наиболее удобной в применении является форма доксициклина моногидрата в виде таблеток диспергируемых, которая позволяет применять препарат как в форме таблеток, так и суспензии или раствора. Кроме того, лекарственная форма диспергируемой таблетки обеспечивает стабильное всасывание доксициклина и равномерное нарастание его концентрации в крови. При негонококковом уретрите, вызванном U. urealyticum, M. hominis или M. genitalium, доксициклин применяют в дозе 100 мг 2 раза в день в течение 7–14 дней [4]. Хорошие результаты были получены при применении доксициклина у женщин, инфицированных различными видами микоплазм и страдающих бесплодием или привычным невынашиванием беременности. В ряде случаев после применения доксициклина наступала беременность, которая заканчивалась нормальными родами в срок и без осложнений [4].
С клинической точки зрения наиболее актуальным представляется выбор тех препаратов, к которым U. urealyticum демонстрирует наивысшую чувствительность. Выделение устойчивых к действию доксициклина инфектов отмечается крайне редко. Рост числа штаммов, чувствительных к доксициклину, можно объяснить тем, что в последние годы этот препарат несколько потеснили макролиды (кларитромицин, рокситромицин, азитромицин), активно применяемые в терапии урогенитальной инфекции.
Сохранение высокой чувствительности возбудителя к доксициклину доказывает обоснованность его применения в лечении микоплазмозов. При его применении могут наблюдаться отдельные побочные эффекты, чаще со стороны желудочно-кишечного тракта (ЖКТ). К недостаткам доксициклина относится невозможность его назначения детям до 8 лет и беременным женщинам, а также женщинам в период лактации.
Макролиды
Другие группы антибиотиков, применяемые для лечения микоплазмозов, представлены, в частности, макролидами. Для макролидов в целом характерны более низкие минимальные подавляющие концентрации (МПК), чем для фторхинолонов. По мнению ряда исследователей, при мико- и уреаплазменной инфекции макролиды должны использоваться в качестве препаратов первого ряда [9].
Препарат группы макролидов эритромицин в течение длительного времени применялся в качестве альтернативы тетрациклинам, однако этот препарат часто плохо переносится больными. Согласно опубликованным результатам терапия эритромицином остается достаточно эффективной — 83–95%. Тем не менее многие авторы отмечают, что выраженные побочные эффекты со стороны ЖКТ, а также высокая курсовая доза и необходимость многократного приема (4 раза в день по 500 мг) снижают целесообразность выбора этого антибиотика.
В группе макролидов самые низкие МПК для уреаплазм имеют кларитромицин и джозамицин. Прием 250 мг кларитромицина 2 раза в день в течение 7 дней, как правило, приводит к исчезновению M. hominis, U. urealyticum из половых путей мужчин и женщин. Применение рокситромицина (300 мг 1 раз в день) не уступает по эффективности стандартному режиму приема доксициклина.
Джозамицин обладает широким спектром антибактериального действия, включающим не только все клинически значимые возбудители микоплазмоза (M. hominis, M. genitalium, U. urealyticum), но и другие частые этиологические агенты при урогенитальных инфекциях — хламидии и Neisseria gonorrhoeae.
Преимуществом 16-членных макролидов, к которым относится джозамицин, перед эритромицином и другими препаратами этой группы является более редкое развитие к ним устойчивости у ряда микроорганизмов, например S. pneumoniae [10]. Аналогичная тенденция прослеживается и в отношении внутриклеточных возбудителей. Несмотря на широкое применение джозамицина, клинические штаммы микоплазм и уреаплазм сохраняют высокую чувствительность к нему как за рубежом [11], так и в России [3]. Например, в период с 2001 по 2003 г. был отмечен рост количества устойчивых штаммов к рокситромицину, кларитромицину, левофлоксацину и клиндамицину, в то время как уровень антибиотикорезистентности к джозамицину за это время не изменился [7]. Аналогичные данные были получены и в исследовании, проведенном в Красноярске, где было показано сохранение стабильно высокой чувствительности U. urealyticum к джозамицину на протяжении последних 5 лет [12]. Более высокая активность джозамицина в отношении уреаплазм по сравнению с другими макролидами продемонстрирована и в других отечественных исследованиях [4].
В зарубежном сравнительном исследовании чувствительности к семи антибактериальным препаратам (джозамицин, доксициклин, миноциклин, спарфлоксацин, рокситромицин, офлоксацин и азитромицин) возбудителей смешанной инфекции U. urealyticum и M. hominis, выделенных у больных негонококковым уретритом, также была показана их высокая чувствительность к джозамицину, превышающая таковую к препаратам сравнения [13]. При подобных инфекциях уровень резистентности возбудителей особенно высок, в связи с чем выбор препаратов для их лечения должен проводиться наиболее тщательно. Например, резистентность к азитромицину в данном исследовании составила 90,48%.
Джозамицин накапливается в лимфатических узлах и половых органах, причем его концентрации в этих органах при воспалительных процессах повышаются, т. к. он способен проникать внутрь фагоцитарных клеток (макрофагов, фибробластов, полиморфноядерных гранулоцитов) и переноситься ими в очаг воспаления [14]. Концентрация препарата в полиморфноядерных лейкоцитах человека, моноцитах и альвеолярных макрофагах приблизительно в 20 раз выше, чем во внеклеточном пространстве [15].
В отличие от большинства других макролидов, джозамицин наряду с хорошим проникновением внутрь клеток создает и высокие концентрации в сыворотке крови, что имеет важное значение при системном проявлении инфекции [16]. Препарат не связывается с изоферментами цитохрома Р-450 и не влияет на НАДФ-цитохром-С-редуктазу, поэтому обладает значительно более низким риском лекарственных взаимодействий, чем эритромицин и кларитромицин, и не оказывает отрицательного влияния на функцию печени. Для джозамицина характерны выраженные иммуномодулирующие свойства, которые могут способствовать усилению терапевтического эффекта у больных с воспалительными заболеваниями [17].
После приема внутрь джозамицин быстро абсорбируется из ЖКТ. Сmax достигается через 1–2 ч после приема. Через 45 мин после приема дозы 1 г средняя концентрация джозамицина в плазме составляет 2,41 мг/л. Связывание с белками плазмы не превышает 15%. Прием препарата с интервалом в 12 ч обеспечивает сохранение эффективной концентрации джозамицина в тканях в течение суток. Равновесное состояние достигается через 2–4 дня регулярного приема.
Одним из преимуществ джозамицина является быстрое создание высокой концентрации препарата в клетках и тканях за счет его высокой липофильности. При пероральном применении концентрация препарата в лейкоцитах, моноцитах, фагоцитах, макрофагах и клетках эпителия приблизительно в 20 раз выше, чем в межклеточном пространстве.
Поскольку микоплазмы и уреаплазмы являются внутриклеточными паразитами, вышеуказанные свойства джозамицина делают его идеальным препаратом для лечения инфекций, вызванных этими патогенами.
Доказана также высокая клиническая эффективность джозамицина. По данным Института исследования инфекционных кожно-венерических заболеваний (Австрия), степень излечения микоуреаплазмоза при применении джозамицина составляет 97% (для сравнения: эффективность применения доксициклина при данной патологии составляет 50%, азитромицина — 55,5%) [1].
Достаточно широкий спектр антимикробного действия антибиотика делает его эффективным при лечении смешанных инфекций, включающих анаэробные, к которым женщины особенно восприимчивы. Для лечения урогенитального микоуреаплазмоза рекомендуемая доза препарата — по 500 мг 2 раза в сутки в течение 7–10 дней.
Азитромицин является полусинтетическим антибиотиком широкого спектра действия, первым представителем подкласса азалидов. Подобно другим макролидам, обладает в основном бактериостатическим эффектом, но благодаря способности создавать очень большие внутриклеточные концентрации может действовать бактерицидно. К достоинствам азитромицина следует отнести его хорошую переносимость. Результаты клинических исследований показали, что азитромицин и доксициклин обладают практически одинаковой эффективностью при уреа- и микоплазменной инфекциях (94,9% и 95,9% соответственно).
Фторхинолоны
Фторхинолоны в лечении микоплазмозов относятся к альтернативным препаратам. Среди них предпочтение стоит отдавать офлоксацину и его левовращающему изомеру — левофлоксацину.
Амоксициллин
Согласно рекомендациям американского Центра по профилактике и контролю за заболеваниями, к альтернативным препаратам, применяемым при урогенитальных инфекциях (табл. 1), относится амоксициллин. Однако несмотря на приводимые относительно высокие показатели излечения амоксициллином — 82–94%, нельзя забывать, что in vitro пенициллины оказывают неполный ингибирующий эффект по отношению к внутриклеточным возбудителям, в частности, M. hominis, U. urealyticum.
Резюмируя вышесказанное, необходимо отметить, что на сегодняшний день существует множество рекомендаций и схем лечения микоплазменной инфекции. Эффект лечения зависит от многих причин, поэтому обязательным условием успеха лечения является комплексное обследование пациента до назначения лекарственного препарата с обязательным определением чувствительности выявленного патогена к антибактериальным препаратам. Установление клинико-микробиологических критериев излеченности урогенитальных инфекций, вызванных микоплазмами, проводится через 1 месяц после окончания лечения. При отсутствии клинических проявлений заболевания и выявлении возбудителя в количестве менее 104 КОЕ/мл осуществляется динамическое наблюдение за больными, в больших количествах — повторное лечение с заменой антибиотика [18].
С учетом общих принципов лечения инфекционных больных, терапия микоплазменной инфекции должна быть комплексной, этиологически, патогенетически и симптоматически обоснованной и дифференцированной в соответствии с видом возбудителя, клинической формой и характером болезни, наличием осложнений и остаточных явлений.
Литература
ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
Abstract. The questions of antimicrobial therapy of urogenital mycoplasma infections are actively discussed. Numerous studies devoted to the development of recommendations for mycoplasma infections treatment. But one of the most difficult and up-to-date questions is the choice of effective therapy.










_575.gif)