Чем лечить гломерулонефрит если преднизолон не помогает
Лечение хронического гломерулонефрита
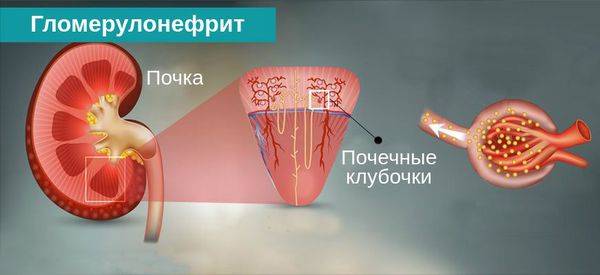
Хронический гломерулонефрит – это болезнь, поражающая почки человека. Патологический процесс приводит к поражению почечных клубочков, развитию почечной недостаточности, а также появлению артериальной гипертонии. Гломерулонефрит развивается в организме как самостоятельная болезнь, и как следствие вовремя не предупрежденного нефрита.
Недуг большую часть времени проходит в скрытой форме, не доставляя беспокойство организму. Во избежание осложнений необходимо до конца пролечивать все приобретенные заболевания и обязательно проводить медицинское обследование. Скрытая форма длится много лет (от 10 лет до 20 лет)
Осложнения хронического гломерулонефрита:
Хронический гломерулонефрит почек присущ всем возрастным группам.
Причины и симптомы хронического гломерулонефрита
Причины заболевания следующие:
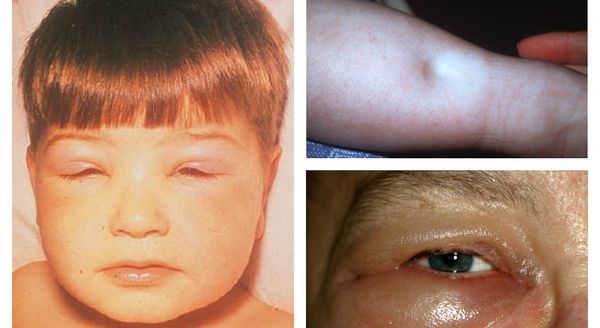
Основные симптомы хронического гломерулонефрита:
Отеки тела не всегда подлежат диагностике при визуальном осмотре. Отечность определяется при регулярном контроле веса, при скорректированном питании постоянная прибавка в весе говорит о скрытой отечности.
Вылечить хронический гломерулонефрит поможет квалифицированный специалист, расписав схему лечения, исходя из особенностей течения болезни и индивидуальных предпочтений пациента.
Диагностика гломерулонефрита
Диагностика хронического гломерулонефрита включает в себя ряд исследований:
Биопсия назначается выборочно, так как имеет ряд противопоказаний:
При исследовании мочи во внимание берется количественные показатели белка, отдельные виды исследования предполагают сбор мочи не разовый, а суточный.
Все исследования проводятся квалифицированными и опытными специалистами. Любой вид исследования назначает врач, после консультативного приема.
Как проходит лечение
Лечение хронического гломерулонефрита включает в себя комплекс мероприятий:
Медикаментозное лечение включает в себя:
При тяжелом течении болезни желательна госпитализация больного. Постоянное наблюдение у специалиста.
В первую очередь во время лечения пациента устраняется источник воспалительного процесса. При соблюдении всех рекомендации и точном лечении, возможно, достичь положительных результатов.
Выбор квалифицированного специалиста и хорошей клиники поможет быстрее и эффективнее предупредить развитие заболевания.
Уход и рекомендации
Профилактика хронического гломерулонефрита зависит от источника воспалительного процесса и образа жизни человека:
Оздоровление в стенах клиники пойдет на пользу при таком заболевании. Так как постоянное наблюдение специалиста поможет своевременно изменять схему лечения для достижения эффективности. Разрешены оздоровительная гимнастика и лечебная физкультура
Противопоказания
При хроническом гломерулонефрите больному следует отказаться от следующего:
Комплексный подход к лечению заболевание, соблюдение всех рекомендаций и поддержание здорового образа жизни помогут облегчить состояние и добить положительных результатов в борьбе с заболеванием.
Что такое гломерулонефрит хронический? Причины возникновения, диагностику и методы лечения разберем в статье доктора Болгарова О. Г., педиатра со стажем в 11 лет.
Определение болезни. Причины заболевания
Гломерулонефрит — это двустороннее диффузное иммунное воспалительное заболевание почек, при котором в первую очередь поражаются их клубочки — гломерулы.
Хронический гломерулонефрит включает в себя группу различных заболеваний почек, отличных по своей причине, морфологической структуре и подходам к лечению, но объединённых первичным поражением гломерулов. [3]
В России заболеваемость хроническим гломерулонефритом достигает 13–50 случаев на 10 000 населения. Данные патологии чаще наблюдаются у мужчин. Они могут развиться в любом возрасте, однако наиболее часто возникают у детей 3–7 лет и взрослых 20–40 лет. [17]
На заболеваемость гломерулонефритом влияют популяционные, климатические и социально-экономические факторы. Так, фокально-сегментарный гломерулосклероз чаще встречается у афроамериканцев, ИГА-нефропатия более распространена на азиатском континенте, инфекционно-зависимые гломерулонефриты — в тропиках и развивающихся странах. [16]
Причины возникновения хронического гломерулонефрита зачастую неизвестны. В развитии части болезней установлена роль бактериальной и вирусой инфекции, в частности вирусов гепатита В и С, ВИЧ-инфекции, вирусов кори и Эпштейна — Барра. По существу, каждая редкая и новая инфекция может вызвать гломерулонефрит. [3] Также на появление хронического гломерулонефрита оказывают влияние лекарственные препараты, опухоли и другие внешние и внутренние факторы. [2]
Симптомы хронического гломерулонефрита
Первые клинические проявления хронического гломерулонефрита могут быть скудными, поэтому зачастую болезнь подкрадывается незаметно. В этом случае заподозрить заболевание можно только по изменению состава мочи: появление в ней белка (протеинурия) и изменение мочевого осадка — появление эритроцитов и лейкоцитов в моче.
Иногда болезнь дебютирует как острый нефрит. В таком случае она проявляется несколькими синдромами:
Сочетание нефротического и нефритического синдрома является наиболее неблагоприятным вариантом.
Помимо данных проявлений для гломерулонефрита характерны следующие симптомы:
Все формы хронического гломерулонефрита способны периодически обостряться, при этом клиническая картина напоминает или полностью повторяет проявления острой формы заболевания. При подостром или быстро прогрессирующем гломерулонефрите функции почек снижаются на 50% меньше чем за три месяца.
Патогенез хронического гломерулонефрита
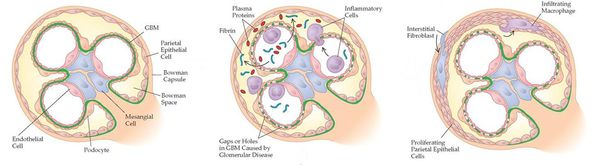
Инфекционные и другие стимулы способствуют появлению иммунного ответа с формированием и отложением антител и/или иммунных комплексов в клубочках почек (или их образованием сразу в клубочках), а также усилению клеточно-опосредованной иммунной реакции. В ответ на возникающие иммунные нарушения в почечных клубочках развиваются изменения, претерпевающие ряд стадий. Сегодня с достаточной уверенностью можно говорить о конкретных механизмах только некоторых из них.
Начало иммуновоспалительного процесса связано с активацией медиаторов тканевого повреждения, прежде всего с активацией хемотаксических факторов, способствующих миграции лейкоцитов. Одновременно активируются факторы коагуляции (сгущения), в результате чего образуются депозиты фибрина и происходит выброс факторов роста и цитокинов — гормоноподобных веществ, вырабатываемых клетками иммунной системы.
На первых этапах заболевания иммунное воспаление преобладает. Поэтому чем раньше начато иммуносупрессивное лечение, тем лучше прогноз заболевания. При стихании воспалительного процесса на первый план выходят неиммунные механизмы прогрессирования болезни:
При дальнейшем прогрессировании заболевания происходят вторичные изменения: процесс распространяется на другие структуры почки — канальцы и интерстиций (вид соединительной ткани).
Исход воспаления — фиброз и склероз почечной ткани, т. е. потеря почечной функции.
Классификация и стадии развития хронического гломерулонефрита
По причинам возникновения гломерулонефриты делятся на две группы:
По клиническим проявлениям выделяют пять форм заболевания:
По морфологическим изменениям выделяют три хронических гломерулонефритов:
Осложнения хронического гломерулонефрита
Гломерулонефрит может осложниться инфекцией, в том числе связанной с иммунодепрессивной терапией (пиелонефрит, туберкулёз), нарушениями фосфорнокальциевого гомеостаза и остеопорозом. Причиной тому — острый воспалительный процесс или же осложнения иммунносупрессивной терапии.
Осложнения нефротической формы хронического гломерулонефрита:
Нефротический криз возникает внезапно. Его развитие может спровоцировать активная диуретическая терапия. К характерным проявлениям относятся интенсивные боли в животе, перитонитоподобный синдром, повышенная температура тела. В дальнейшем это осложнение может привести к развитию гиповолемического шока и смерти. [15]
Частые осложнения гипертонической форм связаны с гипертрофией миокарда левого желудочка (сердечная астма, отёк лёгких). Также может возникнуть острая сердечная недостаточность. [1]
Диагностика хронического гломерулонефрита
Для диагностики гломерулонефритов прежде нужно исключить целый ряд заболеваний со схожими симптомами:
Лабораторное или визуальное наличие крови в моче требует исключения других урологических проблем, опухолей, феномена сдавления левой почечной вены у детей, наследственных заболеваний почек — болезни тонких мембран, синдрома Альпорта (наследственного нефрита).
Для дифференциальной диагностики с системными заболеваниями необходимо исследовать их маркеры в крови:
При обострении любой формы хронического нефрита скорость оседания эритроцитов увеличивается, а также уровень иммунологических показателей, сиаловых кислот, фибрина и серомукоида в крови. При развитии хронической почечной недостаточности независимо от формы хронического нефрита уровень креатинина и мочевины в крови увеличивается. [1] [11]
Основные аспекты диагностики гломерулонефритов:
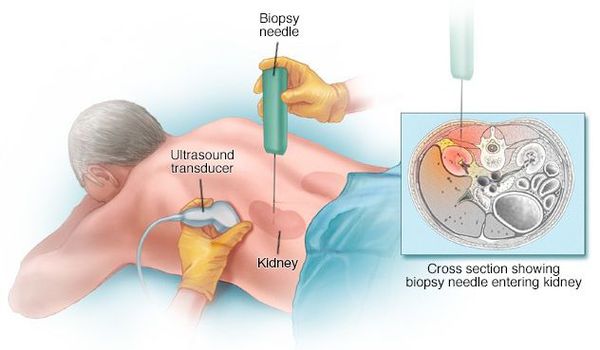
Постановка диагноза многих гломерулярных заболеваний невозможна без пункционной биопсии почки.
Показания к биопсии:
Противопоказания к биопсии:
Биопсию проводит опытный нефролог или хирург в условиях стационара. Сама процедура длится примерно 15-20 минут. Осложнения при биопсии возникают редко, кровотечение возможно всего в 5-10% случаев. [5]
Проведение биопсии почки и верификация морфологического варианта поражения почек показаны даже в тех случаях, когда имеется связь макро- гематурии с ангиной и напрашивается диагноз «острый гломерулонефрит». Исследования показали, что под маской острого «постстрептококкового» гломерулонефрита могут скрываться такие тяжёлые поражения почек, как экстракапиллярный гломерулонефрит, исход и прогноз которого зависят от своевременного начала лечения. [6]
Лечение хронического гломерулонефрита
Лечение хронических гломерулонефритов сводится к трём целям:
Этиотропная терапия проводится только при выявленной причине хронического гломерулонефрита, например, при лептоспирозе, БГСА-инфекции, вирусных гепатитах, ВИЧ-инфекции и других). В подобных случаях применяются антибиотики и противовирусные препараты.
Иммуносупрессивная терапия включает применение следующих лекарств:
Однако ГКС имеют множество побочных эффектов. Поэтому их стараются назначать коротким курсом в больших дозах, постепенно переходя на поддерживающую терапию минимальными дозам.
У пациентов со стероидрезистентным фокально-сегментарным гломерулосклерозом и непереносимостью циклоспорина предлагается применение другого цитостатика — микофенолата мофетила в комбинации с высокими дозами дексаметазона. [2]
Одна из методик лечения резистентных к стандартной терапии форм является пульс-терапия — высокодозное введение лекарств коротким курсом. [12] Такой способ эффективно купирует обострения гломерулонефритов и относительно хорошо переносится пациентами.
Как правило, пульс-терапия проводится с использованием метилпреднизолонома, циклофосфамида или обоих препаратов:
В последние десятилетия для торможения прогрессирования хронического гломерулонефрита применяется нефропротективная стратегия лечения. Так как при стихании иммунно-воспалительного процесса на первый план выходят неиммунные факторы прогрессирования заболевания (прежде всего гемодинамические), а также обменные (гиперлипидемия, дислипидемия, гиперурикемия) и коагуляционные, применяются ингибиторы АПФ и блокаторы рецепторов ангиотензина. Эти препараты восстанавливают системную и внутриклубочковую микроциркуляцию, обладают противовоспалительным и цитопротективным действием (защита клеток от вредных факторов). Они применяются для лечения всех форм гломерулонефритов и замедляют прогрессирование болезни. При некоторых формах латентных и гематурических вариантов заболевания, когда не показано иммуносупрессивное лечение, они являются препаратами выбора.
Плазмаферез (способ очищения крови) применяется для лечения быстро прогрессирующего гломерулонефрита, а также нефритов, протекающих на фоне системных заболеваний.
Гемосорбция и гемодиализ (способы внепочечного очищения крови) относятся к методам заместительной почечной терапии. К ним прибегают во время острого периода почечной недостаточности.
Посиндромная терапия диуретиками, антикоагулянтами, дезагрегантами, антигипертензивными препаратами, статинами, гиперлипидемическими и другими средствами проводится по показаниям. Также уделяется внимание устранению очагов хронической инфекции, лечению кариеса, профилактике вирусных инфекций, на фоне которых чаще всего возникают обострения заболевания.
При лечении нефротического синдрома у детей показана инициальная терапия в течение 4-6 недель, а также приём преднизолона, доза которого со временем снижается до поддерживающей. При благоприятном течении болезни преднизолон постепенно отменяют. В случае выявления стероидзависимости (когда на фоне снижения дозы преднизолона возникает рецидив заболевания) используются алкилирующие препараты — циклофосфамид или хлорамбуцил, а также применяется левамизол, микофенолат мофетил или такролимус.
Прогноз. Профилактика
Течение хронического гломерулонефрита зависит от причины заболевания и морфологической формы. Наиболее неблагоприятным является подострый быстро прогрессирующий вариант.
Без лечения все формы гломерулонефрита заканчиваются хронической почечной недостаточностью, разница заключается лишь в срок её наступления. А осложенения ухудшают и без того тяжёлый прогноз заболевания.
Смерть при гломерулонефрите может наступить в результате развития отёка легких, нефротического синдрома, инсульта, острой почечной недостаточности, гиповолемического шока и венозных тромбозов. Летальность при хроническом гломерулонефрите на III-V стадиях хронической болезни почек связана с сердечно-сосудистыми патологиями. [17]
Всем пациентам с хроническим гломерулонефритом важно помнить о следующих мерах профилактики обострения заболевания:
Достижения и проблемы лечения гломерулонефрита
Последняя четверть прошедшего века принесла с собой ряд важных достижений в лечении прогрессирующих почечных заболеваний, в том числе гломерулонефрита, остающегося одной из главных причин хронической почечной недостаточности (ХПН). Это касается
Последняя четверть прошедшего века принесла с собой ряд важных достижений в лечении прогрессирующих почечных заболеваний, в том числе гломерулонефрита, остающегося одной из главных причин хронической почечной недостаточности (ХПН). Это касается методов воздействия на начальные иммунно-воспалительные механизмы повреждения почечной ткани и еще в большей степени — на механизмы дальнейшего прогрессирования (развития склероза), так называемые неиммунные, часто уже не связанные с начальными путями повреждения. В связи с этим было создано новое направление в нефрологии, получившее название ренопротективной терапии.
Особенность этого периода — внедрение новых требований к качеству результатов исследований, касающихся разработки и оценки новых направлений и методов лечения (это характерно и для других областей медицины — кардиологии, гепатологии, онкологии, гематологии и т. д.), создание так называемой доказательной медицины (evidence-based medicine) — медицины, основанной на доказательствах. Суть этого подхода — организация исследований в соответствии с принципами клинической эпидемиологии. В ходе таких исследований, проводимых с использованием методов математической статистики, планируются и осуществляются клинические и экспериментальные работы, в первую очередь — контролируемые клинические исследования, посвященные роли этиологических и патогенетических факторов или эффективности лекарственной терапии.
Этот подход позволил отобрать и обобщить наиболее убедительные данные, касающиеся иммунодепрессивной и «неиммунной» (ренопротективной) терапии различных клинико-морфологических вариантов гломерулонефрита, а также дать научно обоснованные рекомендации.
Сегодня уже частично выявлены клинические и морфологические признаки, определяющие неблагоприятный прогноз, среди них быстрое развитие ХПН или тяжелые осложнения основных проявлений гломерулонефрита — нефротический синдром и артериальная гипертензия. Это позволило определить, каким пациентам в первую очередь следует проводить иммунодепрессивную терапию активными (агрессивными) методами.
Хотя арсенал иммунодепрессивных препаратов, применяемых для лечения гломерулонефрита, с начала 70-х годов практически не изменился (это по-прежнему глюкокортикоиды и две группы цитостатических препаратов: алкилирующие соединения — циклофосфамид и хлорбутин — и антиметаболиты — азатиоприн), появились новые методы и схемы их применения — так называемая ударная или пульс-терапия (pulse-therapy) — периодическое внутривенное введение сверхвысоких доз глюкокортикоидов или циклофосфамида. Одно из преимуществ этих методов — снижение частоты тяжелых осложнений, характерных для длительной пероральной терапии этими препаратами (гиперкортицизм, инфекции, токсическое повреждение гонад и т. д.).
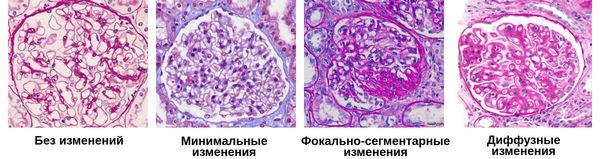
Новые возможности лечения резистентных к иммунодепрессантам или стероидозависимых форм гломерулонефрита появились благодаря созданию циклоспорина — первого препарата из нового поколения так называемых селективных иммунодепрессантов, действующих в отличие от традиционных неселективных только на строго ограниченные звенья (точки) и молекулярные механизмы в сложных многоэтапных процессах клеточной активации, формирования и реализации иммунного ответа и воспаления. Основная область применения циклоспорина — лечение трех морфологических вариантов гломерулонефрита — «минимальных изменений» (липоидный нефроз), фокально-сегментарного гломерулосклероза и мембранозной нефропатии.
Минимальные изменения. Это заболевание исключительно редко приводит к развитию ХПН, тем не менее пациенты с таким диагнозом подвержены высокому риску тяжелых осложнений нефротического синдрома, которые могут стать причиной смерти. Это — гипергидратация (с анасаркой, водянкой полостей, отеком мозга и легких), тромбозы, белковая дистрофия, инфекции
(в том числе пневмококковый перитонит), от которых больные в прошлом нередко погибали, и, наконец, особое осложнение тяжелого нефротического синдрома — так называемый нефротический (или кининовый) криз у больных с выраженной гипоальбуминемией (с альбумином сыворотки менее 1,9 — 1,5 г%). Нефротический криз заканчивается быстронарастающей гиповолемией, приводящей к коллапсу (часто летальному) и развитию острой почечной недостаточности. Последняя также может быть следствием отека интерстиция почек, нередкого при любом тяжелом нефротическом (отечном) синдроме. Именно тяжестью и опасностью этих осложнений и обусловлена необходимость быстрой ликвидации (достижения ремиссии) нефротического синдрома.
Одна из главных проблем лечения «минимальных изменений» — единственной формы нефрита, высокочувствительной к глюкокортикоидам и столь же склонной к рецидивированию и стероидной зависимости (до 2/3 случаев у детей) — достижение длительной стойкой ремиссии нефротического синдрома. Стероидная зависимость (развитие рецидива при всякой попытке отмены, а иногда даже снижения дозы глюкокортикоидов) ведет к тяжелым проявлениям стероидной токсичности: у взрослых — к ожирению, остеопорозу, тромбозам, диабету, инфекциям, стероидной гипертонии, а у детей помимо того — к инфантилизму, задержке роста и полового созревания.
У детей «минимальные изменения» представляют собой самый распространенный вариант гломерулонефрита (до 80 — 85% случаев), что явилось основанием для проведения ряда крупных контролируемых клинических испытаний, в ходе которых были получены данные, позволяющие сформулировать четкие лечебные рекомендации. Накопленный опыт и клинические испытания позволили предложить, что существует несколько путей достижения стойкой ремиссии у этих больных. При частом рецидивировании снизить частоту обострений позволяет лечение алкилирующими препаратами в течение 8 недель. При стероидной зависимости стойкая ремиссия может быть получена после 8 — 12 недель лечения циклофосфамидом. При истинной стероидной резистентности вызвать ремиссию и восстановить чувствительность к стероидам позволяет терапия циклоспорином.
Фокально-сегментарный гломеруло-склероз (ФСГС). Разработке методов лечения этой формы нефрита в последнее 10-летие уделялось особое внимание, что позволило несколько изменить традиционное представление о неизбежно плохом прогнозе у этих больных.
ФСГС встречается не так уж редко — 7 — 20% случаев, в половине из них проявляется нефротическим синдромом (в том числе в сочетании с артериальной гипертензией и гематурией), который при отсутствии лечения у 2/3 больных приводит к развитию ХПН. Такой же исход ожидает больных, не ответивших на лечение. Отличительная особенность ФСГС — высокая частота (до 50%) рецидивов болезни в пересаженной, донорской почке, что еще раз подчеркивает необходимость достижения ремиссии уже в самом начале заболевания.
В прошлом (в 70-е годы) в результате первых попыток оценить возможности лечения ФСГС это заболевание стали классифицировать как форму нефрита, плохо поддающуюся терапии. И даже сейчас, несмотря на определенные достижения, ФСГС по-прежнему рассматривается как один из наиболее резистентных к лечению и прогностически неблагоприятных вариантов гломерулонефрита.
Результаты большого числа клинических исследований 1980 — 1990-х годов, которые включают и контролируемые клинические испытания, позволили сформулировать ряд требований к лечению больных ФСГС.
Наши собственные исследования подтверждают необходимость длительной терапии большими дозами иммунодепрессантов у пациентов с ФСГС: назначение высоких кумулятивных доз различных иммунодепрессантов (кортикостероидов, циклофосфамида, азатиоприна) сопровождалось увеличением частоты ремиссий (Шилов Е. М., Тареева И. Е. и др. // Терапевтический архив, 2000, № 6, в печати). Важно подчеркнуть, что высокие кумулятивные дозы иммунодепрессантов позволяли достичь ремиссии даже у больных с факторами резистентности к лечению (выраженной гематурией, высокой морфологической активностью почечного воспалительного процесса и склеротическими изменениями). В ходе ретроспективного исследования, в котором приняли участие 72 пациента с первичным ФСГС, было получено еще одно подтверждение преимуществ применения с самого начала болезни комбинированной терапии кортикостероидами и цитостатическими препаратами. Положительный ответ (полные или частичные ремиссии) при лечении только кортикостероидами наблюдался у 32% больных, а при комбинированном лечении — у 72% пациентов. Еще более впечатляющими оказались отдаленные результаты лечения: «почечная выживаемость» больных (креатинин
Гломерулонефрит: причины, симптомы, диагностика, лечение
Гломерулонефрит занимает третье место среди заболеваний почек и чаще всего встречается у людей в возрасте 30-40 лет. Это иммуновоспалительное заболевание почечных клубочков протекает в острой, хронической или быстропрогрессирующей форме с поражением обеих почек.
Чаще всего причины гломерулонефрита и его патогенез неизвестны. Из-за поражения клубочков почки теряют способность фильтровать кровь, в организме задерживаются вода и токсины. На конечной стадии заболевания наступает почечная недостаточность, которая требует пожизненного диализа или пересадки почки, поэтому очень важно выявить гломерулонефрит на ранних стадиях.
Причины гломерулонефрита
Причины острого гломерунефрита
Причины хронического гломерунефрита
Симптомы гломерулонефрита
Диагностика гломерулонефрита
Клинические признаки гломерулонефрита в большинстве случаев не позволяют определить характер изменений в клубочках, а при латентной форме у пациента нет никаких жалоб, и заболевание выявляется случайно при обращении в клинику по другим причинам. Также учитываются ранее перенесенные и хронические инфекции и системные заболевания.
Для определения степени поражения почек и оценки течения гломерулонефрита используют лабораторные анализы и инструментальные исследования.
Общий анализ мочи при гломерулонефрите проводится для обнаружения крови (эритроцитов), белка, цилиндров, которые указывают на поражение почечных клубочков, а также учитывается снижение удельного веса мочи [3].
Проба Зимницкого используется для оценки суточного объема мочеиспускания и концентрации мочи. Этот метод помогает определить способность почек концентрировать и выделять мочу.
Общий анализ крови помогает выявить наличие воспалительного процесса в организме.
Биохимический анализ крови показывает повышенный уровень мочевины, креатинина, электролитов. Эти параметры характеризуют фильтрационную способность почек и степень их поражения [4].
Иммунологическое исследование крови на наличие антистрептококковых антител выявляет перенесенную стрептококковую инфекцию и, следовательно, риск развития постинфекционного гломерулонефрита.
Биопсия (микроскопическое исследование образца почечной ткани) проводится, когда диагностика и классификация гломерулонефрита затруднены.
Ультразвуковое исследование почек выявляет участки воспаления, расширение и сужение почечных клубочков и сосудов, изменения положения и размеров почек. Также проводится доплерографическое исследование сосудов почек для оценки кровотока в органе.
Рентгенограмма и КТ почек (получение изображения тонких срезов почек) используются для выявления участков воспаления и других изменений структуры почек.
Нефросцинтиграфия за счет накопления в тканях почек специального препарата, введенного внутривенно, позволяет оценить состояние тканей почек, локализацию и особенности патологических процессов.
Экскреторная урография выявляет патологии почек и мочевыводящих путей. На рентгеновских снимках можно выявить нарушения при выведении почками контрастного вещества.
Измерение артериального давления систематически в течения дня имеет значение при гипертензивной форме гломерулонефрита.
ЭКГ и ЭхоКГ позволяют оценить работу сердца.
УЗИ грудной клетки (легкие и плевральные полости) проводят при одышке.
Дифференциальная диагностика проводится для исключения нефротического синдрома, пиелонефрита, почечно- и мочекаменной болезней, поликистоза почек, артериальной гипертензии [3].
Гломерулонефрит у детей часто протекает вяло или атипично и требует наблюдения у нефролога.
Лечение и профилактика гломерулонефрита
Из-за тяжести заболевания лечение проводится в условиях стационара. Это особенно касается случаев выраженной симптоматики или почечной недостаточности.
Пациентам с гломерулонефритом противопоказаны физические нагрузки, в частности работа на открытом воздухе и в условиях низкой температуры или высокой влажности.
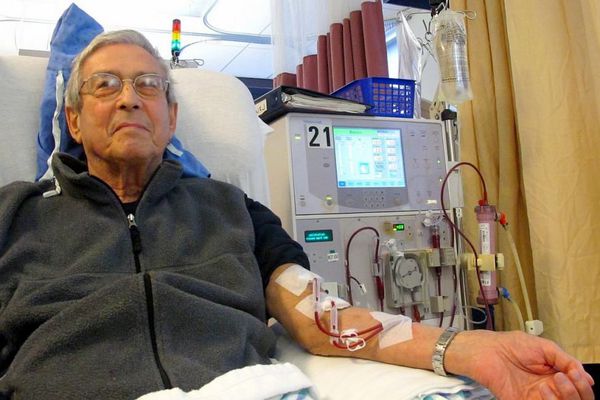
При почечной недостаточности назначают диализное лечение. С его помощью заменяют две основные функции почек: выведение избыточной воды из организма и удаление токсинов из крови. При тяжелом гломерулонефрите проводят пересадку почки.
Острая фаза гломерулонефрита купируется в течение 1-3 недель с возможными рецидивами. Показатели мочи нормализуются более года. Наблюдение пациентов, перенесших острый гломерулонефрит, ведется в течение 2 лет, а при хронической форме рекомендовано проходить регулярное обследование 2-3 раза в год.
Клинические рекомендации направлены на снижение риска гломерулонефрита, а также его рецидивов. Они включают обязательное полное излечение стрептококковых, бактериальных и других инфекций, избегание переохлаждения и высокой влажности, ограничение потребления соли, соблюдение здорового образа жизни, а также регулярное медицинское наблюдение у специалистов.
Гломерулонефрит: причины, симптомы, диагностика, лечение
Гломерулонефрит занимает третье место среди заболеваний почек и чаще всего встречается у людей в возрасте 30-40 лет. Это иммуновоспалительное заболевание почечных клубочков протекает в острой, хронической или быстропрогрессирующей форме с поражением обеих почек.
Чаще всего причины гломерулонефрита и его патогенез неизвестны. Из-за поражения клубочков почки теряют способность фильтровать кровь, в организме задерживаются вода и токсины. На конечной стадии заболевания наступает почечная недостаточность, которая требует пожизненного диализа или пересадки почки, поэтому очень важно выявить гломерулонефрит на ранних стадиях.
Причины гломерулонефрита
Причины острого гломерунефрита
Причины хронического гломерунефрита
Симптомы гломерулонефрита
Диагностика гломерулонефрита
Клинические признаки гломерулонефрита в большинстве случаев не позволяют определить характер изменений в клубочках, а при латентной форме у пациента нет никаких жалоб, и заболевание выявляется случайно при обращении в клинику по другим причинам. Также учитываются ранее перенесенные и хронические инфекции и системные заболевания.
Для определения степени поражения почек и оценки течения гломерулонефрита используют лабораторные анализы и инструментальные исследования.
Общий анализ мочи при гломерулонефрите проводится для обнаружения крови (эритроцитов), белка, цилиндров, которые указывают на поражение почечных клубочков, а также учитывается снижение удельного веса мочи [3].
Проба Зимницкого используется для оценки суточного объема мочеиспускания и концентрации мочи. Этот метод помогает определить способность почек концентрировать и выделять мочу.
Общий анализ крови помогает выявить наличие воспалительного процесса в организме.
Биохимический анализ крови показывает повышенный уровень мочевины, креатинина, электролитов. Эти параметры характеризуют фильтрационную способность почек и степень их поражения [4].
Иммунологическое исследование крови на наличие антистрептококковых антител выявляет перенесенную стрептококковую инфекцию и, следовательно, риск развития постинфекционного гломерулонефрита.
Биопсия (микроскопическое исследование образца почечной ткани) проводится, когда диагностика и классификация гломерулонефрита затруднены.
Ультразвуковое исследование почек выявляет участки воспаления, расширение и сужение почечных клубочков и сосудов, изменения положения и размеров почек. Также проводится доплерографическое исследование сосудов почек для оценки кровотока в органе.
Рентгенограмма и КТ почек (получение изображения тонких срезов почек) используются для выявления участков воспаления и других изменений структуры почек.
Нефросцинтиграфия за счет накопления в тканях почек специального препарата, введенного внутривенно, позволяет оценить состояние тканей почек, локализацию и особенности патологических процессов.
Экскреторная урография выявляет патологии почек и мочевыводящих путей. На рентгеновских снимках можно выявить нарушения при выведении почками контрастного вещества.
Измерение артериального давления систематически в течения дня имеет значение при гипертензивной форме гломерулонефрита.
ЭКГ и ЭхоКГ позволяют оценить работу сердца.
УЗИ грудной клетки (легкие и плевральные полости) проводят при одышке.
Дифференциальная диагностика проводится для исключения нефротического синдрома, пиелонефрита, почечно- и мочекаменной болезней, поликистоза почек, артериальной гипертензии [3].
Гломерулонефрит у детей часто протекает вяло или атипично и требует наблюдения у нефролога.
Лечение и профилактика гломерулонефрита
Из-за тяжести заболевания лечение проводится в условиях стационара. Это особенно касается случаев выраженной симптоматики или почечной недостаточности.
Пациентам с гломерулонефритом противопоказаны физические нагрузки, в частности работа на открытом воздухе и в условиях низкой температуры или высокой влажности.
При почечной недостаточности назначают диализное лечение. С его помощью заменяют две основные функции почек: выведение избыточной воды из организма и удаление токсинов из крови. При тяжелом гломерулонефрите проводят пересадку почки.
Острая фаза гломерулонефрита купируется в течение 1-3 недель с возможными рецидивами. Показатели мочи нормализуются более года. Наблюдение пациентов, перенесших острый гломерулонефрит, ведется в течение 2 лет, а при хронической форме рекомендовано проходить регулярное обследование 2-3 раза в год.
Клинические рекомендации направлены на снижение риска гломерулонефрита, а также его рецидивов. Они включают обязательное полное излечение стрептококковых, бактериальных и других инфекций, избегание переохлаждения и высокой влажности, ограничение потребления соли, соблюдение здорового образа жизни, а также регулярное медицинское наблюдение у специалистов.
Лечение хронического гломерулонефрита
Хронический гломерулонефрит – это болезнь, поражающая почки человека. Патологический процесс приводит к поражению почечных клубочков, развитию почечной недостаточности, а также появлению артериальной гипертонии. Гломерулонефрит развивается в организме как самостоятельная болезнь, и как следствие вовремя не предупрежденного нефрита.
Недуг большую часть времени проходит в скрытой форме, не доставляя беспокойство организму. Во избежание осложнений необходимо до конца пролечивать все приобретенные заболевания и обязательно проводить медицинское обследование. Скрытая форма длится много лет (от 10 лет до 20 лет)
Осложнения хронического гломерулонефрита:
Хронический гломерулонефрит почек присущ всем возрастным группам.
Причины и симптомы хронического гломерулонефрита
Причины заболевания следующие:
Основные симптомы хронического гломерулонефрита:
Отеки тела не всегда подлежат диагностике при визуальном осмотре. Отечность определяется при регулярном контроле веса, при скорректированном питании постоянная прибавка в весе говорит о скрытой отечности.
Вылечить хронический гломерулонефрит поможет квалифицированный специалист, расписав схему лечения, исходя из особенностей течения болезни и индивидуальных предпочтений пациента.
Диагностика гломерулонефрита
Диагностика хронического гломерулонефрита включает в себя ряд исследований:
Биопсия назначается выборочно, так как имеет ряд противопоказаний:
При исследовании мочи во внимание берется количественные показатели белка, отдельные виды исследования предполагают сбор мочи не разовый, а суточный.
Все исследования проводятся квалифицированными и опытными специалистами. Любой вид исследования назначает врач, после консультативного приема.
Как проходит лечение
Лечение хронического гломерулонефрита включает в себя комплекс мероприятий:
Медикаментозное лечение включает в себя:
При тяжелом течении болезни желательна госпитализация больного. Постоянное наблюдение у специалиста.
В первую очередь во время лечения пациента устраняется источник воспалительного процесса. При соблюдении всех рекомендации и точном лечении, возможно, достичь положительных результатов.
Выбор квалифицированного специалиста и хорошей клиники поможет быстрее и эффективнее предупредить развитие заболевания.
Уход и рекомендации
Профилактика хронического гломерулонефрита зависит от источника воспалительного процесса и образа жизни человека:
Оздоровление в стенах клиники пойдет на пользу при таком заболевании. Так как постоянное наблюдение специалиста поможет своевременно изменять схему лечения для достижения эффективности. Разрешены оздоровительная гимнастика и лечебная физкультура
Противопоказания
При хроническом гломерулонефрите больному следует отказаться от следующего:
Комплексный подход к лечению заболевание, соблюдение всех рекомендаций и поддержание здорового образа жизни помогут облегчить состояние и добить положительных результатов в борьбе с заболеванием.
Достижения и проблемы лечения гломерулонефрита
Последняя четверть прошедшего века принесла с собой ряд важных достижений в лечении прогрессирующих почечных заболеваний, в том числе гломерулонефрита, остающегося одной из главных причин хронической почечной недостаточности (ХПН). Это касается
Последняя четверть прошедшего века принесла с собой ряд важных достижений в лечении прогрессирующих почечных заболеваний, в том числе гломерулонефрита, остающегося одной из главных причин хронической почечной недостаточности (ХПН). Это касается методов воздействия на начальные иммунно-воспалительные механизмы повреждения почечной ткани и еще в большей степени — на механизмы дальнейшего прогрессирования (развития склероза), так называемые неиммунные, часто уже не связанные с начальными путями повреждения. В связи с этим было создано новое направление в нефрологии, получившее название ренопротективной терапии.
Особенность этого периода — внедрение новых требований к качеству результатов исследований, касающихся разработки и оценки новых направлений и методов лечения (это характерно и для других областей медицины — кардиологии, гепатологии, онкологии, гематологии и т. д.), создание так называемой доказательной медицины (evidence-based medicine) — медицины, основанной на доказательствах. Суть этого подхода — организация исследований в соответствии с принципами клинической эпидемиологии. В ходе таких исследований, проводимых с использованием методов математической статистики, планируются и осуществляются клинические и экспериментальные работы, в первую очередь — контролируемые клинические исследования, посвященные роли этиологических и патогенетических факторов или эффективности лекарственной терапии.
Этот подход позволил отобрать и обобщить наиболее убедительные данные, касающиеся иммунодепрессивной и «неиммунной» (ренопротективной) терапии различных клинико-морфологических вариантов гломерулонефрита, а также дать научно обоснованные рекомендации.
Сегодня уже частично выявлены клинические и морфологические признаки, определяющие неблагоприятный прогноз, среди них быстрое развитие ХПН или тяжелые осложнения основных проявлений гломерулонефрита — нефротический синдром и артериальная гипертензия. Это позволило определить, каким пациентам в первую очередь следует проводить иммунодепрессивную терапию активными (агрессивными) методами.
Хотя арсенал иммунодепрессивных препаратов, применяемых для лечения гломерулонефрита, с начала 70-х годов практически не изменился (это по-прежнему глюкокортикоиды и две группы цитостатических препаратов: алкилирующие соединения — циклофосфамид и хлорбутин — и антиметаболиты — азатиоприн), появились новые методы и схемы их применения — так называемая ударная или пульс-терапия (pulse-therapy) — периодическое внутривенное введение сверхвысоких доз глюкокортикоидов или циклофосфамида. Одно из преимуществ этих методов — снижение частоты тяжелых осложнений, характерных для длительной пероральной терапии этими препаратами (гиперкортицизм, инфекции, токсическое повреждение гонад и т. д.).
Новые возможности лечения резистентных к иммунодепрессантам или стероидозависимых форм гломерулонефрита появились благодаря созданию циклоспорина — первого препарата из нового поколения так называемых селективных иммунодепрессантов, действующих в отличие от традиционных неселективных только на строго ограниченные звенья (точки) и молекулярные механизмы в сложных многоэтапных процессах клеточной активации, формирования и реализации иммунного ответа и воспаления. Основная область применения циклоспорина — лечение трех морфологических вариантов гломерулонефрита — «минимальных изменений» (липоидный нефроз), фокально-сегментарного гломерулосклероза и мембранозной нефропатии.
Минимальные изменения. Это заболевание исключительно редко приводит к развитию ХПН, тем не менее пациенты с таким диагнозом подвержены высокому риску тяжелых осложнений нефротического синдрома, которые могут стать причиной смерти. Это — гипергидратация (с анасаркой, водянкой полостей, отеком мозга и легких), тромбозы, белковая дистрофия, инфекции
(в том числе пневмококковый перитонит), от которых больные в прошлом нередко погибали, и, наконец, особое осложнение тяжелого нефротического синдрома — так называемый нефротический (или кининовый) криз у больных с выраженной гипоальбуминемией (с альбумином сыворотки менее 1,9 — 1,5 г%). Нефротический криз заканчивается быстронарастающей гиповолемией, приводящей к коллапсу (часто летальному) и развитию острой почечной недостаточности. Последняя также может быть следствием отека интерстиция почек, нередкого при любом тяжелом нефротическом (отечном) синдроме. Именно тяжестью и опасностью этих осложнений и обусловлена необходимость быстрой ликвидации (достижения ремиссии) нефротического синдрома.
Одна из главных проблем лечения «минимальных изменений» — единственной формы нефрита, высокочувствительной к глюкокортикоидам и столь же склонной к рецидивированию и стероидной зависимости (до 2/3 случаев у детей) — достижение длительной стойкой ремиссии нефротического синдрома. Стероидная зависимость (развитие рецидива при всякой попытке отмены, а иногда даже снижения дозы глюкокортикоидов) ведет к тяжелым проявлениям стероидной токсичности: у взрослых — к ожирению, остеопорозу, тромбозам, диабету, инфекциям, стероидной гипертонии, а у детей помимо того — к инфантилизму, задержке роста и полового созревания.
У детей «минимальные изменения» представляют собой самый распространенный вариант гломерулонефрита (до 80 — 85% случаев), что явилось основанием для проведения ряда крупных контролируемых клинических испытаний, в ходе которых были получены данные, позволяющие сформулировать четкие лечебные рекомендации. Накопленный опыт и клинические испытания позволили предложить, что существует несколько путей достижения стойкой ремиссии у этих больных. При частом рецидивировании снизить частоту обострений позволяет лечение алкилирующими препаратами в течение 8 недель. При стероидной зависимости стойкая ремиссия может быть получена после 8 — 12 недель лечения циклофосфамидом. При истинной стероидной резистентности вызвать ремиссию и восстановить чувствительность к стероидам позволяет терапия циклоспорином.
Фокально-сегментарный гломеруло-склероз (ФСГС). Разработке методов лечения этой формы нефрита в последнее 10-летие уделялось особое внимание, что позволило несколько изменить традиционное представление о неизбежно плохом прогнозе у этих больных.
ФСГС встречается не так уж редко — 7 — 20% случаев, в половине из них проявляется нефротическим синдромом (в том числе в сочетании с артериальной гипертензией и гематурией), который при отсутствии лечения у 2/3 больных приводит к развитию ХПН. Такой же исход ожидает больных, не ответивших на лечение. Отличительная особенность ФСГС — высокая частота (до 50%) рецидивов болезни в пересаженной, донорской почке, что еще раз подчеркивает необходимость достижения ремиссии уже в самом начале заболевания.
В прошлом (в 70-е годы) в результате первых попыток оценить возможности лечения ФСГС это заболевание стали классифицировать как форму нефрита, плохо поддающуюся терапии. И даже сейчас, несмотря на определенные достижения, ФСГС по-прежнему рассматривается как один из наиболее резистентных к лечению и прогностически неблагоприятных вариантов гломерулонефрита.
Результаты большого числа клинических исследований 1980 — 1990-х годов, которые включают и контролируемые клинические испытания, позволили сформулировать ряд требований к лечению больных ФСГС.
Наши собственные исследования подтверждают необходимость длительной терапии большими дозами иммунодепрессантов у пациентов с ФСГС: назначение высоких кумулятивных доз различных иммунодепрессантов (кортикостероидов, циклофосфамида, азатиоприна) сопровождалось увеличением частоты ремиссий (Шилов Е. М., Тареева И. Е. и др. // Терапевтический архив, 2000, № 6, в печати). Важно подчеркнуть, что высокие кумулятивные дозы иммунодепрессантов позволяли достичь ремиссии даже у больных с факторами резистентности к лечению (выраженной гематурией, высокой морфологической активностью почечного воспалительного процесса и склеротическими изменениями). В ходе ретроспективного исследования, в котором приняли участие 72 пациента с первичным ФСГС, было получено еще одно подтверждение преимуществ применения с самого начала болезни комбинированной терапии кортикостероидами и цитостатическими препаратами. Положительный ответ (полные или частичные ремиссии) при лечении только кортикостероидами наблюдался у 32% больных, а при комбинированном лечении — у 72% пациентов. Еще более впечатляющими оказались отдаленные результаты лечения: «почечная выживаемость» больных (креатинин
Болезнь Берже

В нашей стране одной из главных причин хронической почечной недостаточности является гломерулонефрит, течение и прогноз которого, согласно современным представлениям, зависят от иммуновоспалительных механизмов повреждения почечной ткани. При преимущественном отложении иммунных комплексов, содержащих иммуноглобулины А (IgA) в мезангии клубочков развивается так называемая IgA-нефропатия (IgAN), или болезнь Берже. Этот вид гломерулонефрита является самым распространенным в мире: заболеваемость оценивается как 5 случаев на 100 000 населения [1]. В европейской, североамериканской и австралийской популяциях его частота достигает 10–12% всех гломерулонефритов, а в азиатской — до 30%. IgA-нефропатия лидирует по распространенности в Японии, где ее частота составляет до 50% всех случаев гломерулонефрита.
Впервые IgA-нефропатия была описана в 1968 г. Berger и Hinglais под названием «межкапиллярные отложения IgA-IgG» на основании 55 случаев нефропатии с «идиопатическим отложением IgA в мезангии» [2]. Описанные в этом исследовании случаи отличались относительно благоприятным течением с редким развитием артериальной гипертензии и почечной недостаточности. Дальнейшее изучение выделенной Berger и соавт. патологии показало разнородность этой группы нефритов и возможность тяжелого и быстропрогрессирующего течения заболевания.
Дебют заболевания отмечается чаще в молодом возрасте. Соотношение мужчин и женщин среди заболевших расценивается как 2:1, в Японии до 6:1.
Патогенез
Известно, что при IgA-нефропатии происходит увеличение концентрации иммунных комплексов, содержащих IgA, как в результате повышения продукции антител, так и в результате нарушения их клиренса. Основная гипотеза патогенеза, распространенная в настоящее время, предполагает аномальное гликозилирование и полимеризацию IgA с отложением иммунных комплексов, содержащих аномальный IgA в клубочках, с активацией лейкоцитов и каскада воспаления. В норме в сыворотке человека циркулирует преимущественно мономерный IgA, полимерные же формы, секретируемые слизистыми оболочками, практически не попадают в циркуляцию. Эта гипотеза подтверждается рядом исследований. В 2003 г. Haddad E. и соавт. показали снижение синтеза мономерного IgA в слизистых и увеличение продукции полимерного IgA в костном мозге при IgA-нефропатии [4]. На основании исследования Kar Neng Lai и соавт. предположено, что дефектный по галактозе и сиаловым кислотам IgAl сыворотки, вероятно, продуцируется лимфоидными клетками слизистых [5], однако механизм переноса его в кровь остается неизвестным.
В результате изменения структуры молекулы IgA происходит нарушение его клиренса клетками печени — на клетках печени экспрессируется асиалогликопротеиновый рецептор — ASGPR, распознающий конечные остатки галактозы и катаболизирующий IgA. Кроме того, страдает процесс образования комплекса антиген–антитело, в т. ч. и за счет взаимодействия с Fc-рецептором. Дегликозилированный IgA полимеризуется и приобретает сродство к внеклеточным белкам — фибронектину, ламинину, коллагену IV типа. В результате изменения С3-связывающего сайта на молекуле IgAl нарушается процесс активации системы комплемента. Недостаточно гликозилированный IgA начинает выступать как антиген — увеличивается продукция IgA и IgG против недостаточно гликозилированного IgA. Кроме того, было показано, что недостаточно галактозилированный IgA больных IgA-нефропатией значительно увеличивает апоптоз и синтез N0 мезангиальными клетками в сравнении с IgA здоровых [6]. Связывание иммунных комплексов мезангиальными клетками почечного клубочка с образованием депозитов IgA приводит к активации системы комплемента, запускает синтез различных цитокинов и факторов роста клетками почек и циркулирующими клетками, что приводит к характерным гистопатологическим признакам.
IgA-нефропатия относится к мезангиопролиферативным гломерулонефритам, т. е. нефритам, при которых провоспалительные и профибротические изменения, вызываемые активацией системы комплемента и продукцией цитокинов, локализуются преимущественно в мезангии клубочков. Эти изменения характеризуются пролиферацией мезангиальных клеток почечных клубочков, расширением мезангия, отложением иммунных комплексов в мезангии клубочка и субэндотелиально. Это самая распространенная морфологическая форма хронического гломерулонефрита, объединяющая целую группу вариантов заболевания.
Клинические проявления
Клинические проявления болезни Берже примерно у 50% больных заключаются в синфарингитной макрогематурии, т. е. макрогематурии (часто видимой невооруженным глазом), возникающей на фоне лихорадочных респираторных заболеваний. Известно, что УФ-облучение усиливает гематурию, возможно также появление ее после вакцинаций, кишечных инфекций или тяжелой физической нагрузки. Некоторые пациенты отмечают при этом тупые боли в поясничной области. Возможно стойкое или транзиторное повышение артериального давления (АД). Преходящая острая почечная недостаточность (ОПН) наблюдается редко и, вероятно, вызывается обструкцией канальцев эритроцитарными цилиндрами. Чаще всего со временем функция почек полностью восстанавливается.
При латентном течении IgA-нефропатии, которое встречается гораздо чаще, наблюдается микрогематурия (т. е. эритроцитурия более 3–4 эритроцитов в поле зрения), часто сопровождаемая небольшой (менее 0,5 грамма в сутки) протеинурией (ПУ). У части больных отмечаются артралгии, миалгии, синдром Рейно, полинейропатии, гиперурикемия.
При развитии нефротического синдрома (ПУ выше 3 г/сут, гипоальбуминурия, гиперлипидемия) отмечаются нарастающие гипоонкотические отеки, иногда вплоть до развития асцита и анасарки, гиповолемия. В таких ситуациях на первый план выходит профилактика осложнений — нефротического (кининового) криза с болями в животе и рожеподобной кожной эритемой, гиповолемического шока, тромбозов, тяжелых инфекций, недостаточности кровообращения.
Диагноз и дифференциальный диагноз
Диагноз ставится на основании клинических проявлений и результатов лабораторной диагностики (прежде всего — наличие макро- или микрогематурии). У существенной части больных повышено содержание IgA в сыворотке крови с преобладанием его полимерных форм. По мнению большинства исследователей, степень его повышения не отражает степени активности нефропатии и не влияет на прогноз. Однако в отсутствии данных биопсии при латентном течении заболевания диагностическим критерием IgA-нефропатии считают повышение уровня IgА в сыворотке крови выше 3,15 г/л [6]. Наблюдаются также высокие титры IgA, содержащих иммунные комплексы. Уровень комплемента обычно в норме.
.jpg) |
| Рис. Мезангиопролиферативный гломерулонефрит. Окраска гематоксилином и эозином. Х400 (В.А. Варшавский и соавт.) |
Основным методом диагностики является биопсия почки с морфологическим исследованием биоптата. При световой микроскопии препарата обнаруживается увеличение количества клеток в мезангиуме и увеличение количества мезангиального внеклеточного матрикса. При иммуногистохимическом исследовании обнаруживается накопление IgA в мезангиуме в виде сливающихся между собой отдельных гранул, часто в сочетании с C3 и IgG (рис.) [7].
Дифференциальный диагноз проводят в первую очередь с урологической патологией, сопровождающейся гематурией: мочекаменной болезнью, опухолями почек и мочевыводящих путей, туберкулезом органов мочевыводящей системы и др. Цистоскопия для данной категории пациентов по-прежнему остается «золотым стандартом» диагностики, хотя ее диагностическая ценность у молодых пациентов (до 40 лет) невысока, так как риск возникновения рака мочевого пузыря в данной возрастной группе незначителен. Современные методы лучевой диагностики — ультразвуковое сканирование, рентгеновская или магнитно-резонансная компьютерная томография позволяют хорошо визуализировать не только верхние мочевые пути, но и мочевой пузырь и обладают несомненными преимуществами перед цистоскопией с точки зрения переносимости и риска повреждения нижних мочевых путей. Однако они не позволяют полностью исключить опухоль мочевого пузыря и у больных с высоким риском ее развития должны быть дополнены цистоскопией.
Наличие ПУ (более 0,3 г/л), наряду с появлением в осадке эритроцитарных цилиндров, свидетельствует в пользу гломерулярных, тубулярных или непочечных заболеваний. Отличить IgA-нефропатию от других нефропатий (болезнь тонких базальных мембран, синдром Альпорта и пр.), протекающих со сходными проявлениями, иногда возможно лишь морфологически. Так, при болезни тонких базальных мембран, наследуемой по аутосомно-доминантному типу, при отсутствии IgA-депозитов в почечной ткани, отмечается существенное истончение базальной мембраны клубочка, измеряемой при электронной микроскопии. В пользу наследственного, сцепленного с Х-хромосомой синдромом Альпорта может свидетельствовать нейросенсорная тугоухость, деформация хрусталика, лейомиоматоз.
Принято выделять две основные формы IgA-нефропатии: первичная IgA-нефропатия, или болезнь Берже, и вторичная IgA-нефропатия, которая является следствием других заболеваний. Неясна связь IgA-нефропатии с геморрагическим васкулитом (пурпурой Шенлейна–Геноха), при котором наблюдается сходная морфологическая картина в почках в сочетании с повышением в сыворотке IgA-нефропатии, в связи с чем некоторыми авторами допускается, что IgA-нефропатии является моноорганной формой геморрагического васкулита.
Известно около 30 заболеваний, сопряженных с отложением IgA в почках:
Ведение больных с IgA-нефропатией
Течение и прогноз вторичных форм IgA-нефропатии чаще всего зависят от активности основного заболевания, и контроль над ним позволяет добиться контроля над течением нефропатии.
Прогноз идиопатической IgA-нефропатии относительно благоприятный. Почечная недостаточность, которая развивается у 15–30% больных в течение 15 лет, прогрессирует медленно. Факторами, ухудшающими прогноз, являются:
Старший возраст на момент дебюта заболевания ассоциирован с более выраженными склеротическими и тубулоинтерстициальными изменениями. Описаны также ухудшающие прогноз факторы при семейных случаях болезни Берже (аутосомно-доминантные мутации 6q22-23, полиморфизм генов бета2-гликопротеина 1, ICAM-1, развитие нефропатии в одном поколении) [8, 9].
В 20–50% случаев она может рецидивировать после трансплантации почки [11]. При этом отмечается лучшая выживаемость трансплантата, чем при других нефропатиях. При болезни Берже не рекомендуется пересадка от близких родственников.
Вариабельность клинических и патофизиологических проявлений IgAN до сих пор не позволяет найти общепринятый подход к лечению заболевания. Прогноз у каждого отдельного больного, даже с учетом установленных клинических и морфологических прогностических факторов, далеко не всегда очевиден.
Единого подхода нет даже в отношении целесообразности устранения очагов инфекции (тонзилэктомия, аппендэктомия). Традиционно считается, что тонзилэктомия снижает число эпизодов макрогематурии, а иногда даже уровень ПУ и уровень IgA в сыворотке. Однако многие авторитетные исследователи ставят под сомнение результаты старых работ, утверждающих эффективность тонзилэктомии, поскольку они имеют серьезные методологические погрешности и не соответствуют современным принципам доказательной медицины [11]. Большинство авторов сходится на мнении, что данные о возможном положительном влиянии тонзилэктомии на прогрессирование болезни Берже требуют всестороннего изучения и проверки на современном уровне.
Если острые респираторные или желудочно-кишечные инфекции провоцируют возникновение или усугубление гематурии, считают целесообразным проведение курса антибактериальной терапии, желательно с учетом чувствительности вероятного патогенного микроорганизма.
Необходимость полного контроля артериальной гипертензии, предпочтительно с использованием ингибиторов АПФ (иАПФ) или антагонистов рецепторов к ангиотензину II (БРА) на сегодня не вызывает сомнений [13]. Необходимо поддерживать уровень АД ниже 130/80 мм рт. ст. Помимо контроля артериальной гипертензии иАПФ и блокаторы рецепторов ангиотензина II (БРА) оказывают также антипротеинурическое и антифибротическое действие. Для усиления гипотензивного и антипротеинурического действия возможна сочетанная терапия иАПФ и БРА.
При изолированной или синфарингитной гематурии в сочетании с небольшой ПУ и стабильной функцией почек иммуносупрессивная терапия не показана. С нефропротективной целью могут применяться иАПФ, БРА и дипиридамол. Дипиридамол был предложен для лечения нефрологических больных с учетом его антиагрегантного, антитромбоцитарного действия. В дальнейшем была показана способность дипиридамола умеренно снижать ПУ и гематурию, а также тормозить ухудшение функции почек. В последние годы объектом изучения стали новые нефропротективные свойства дипиридамола, в том числе его антиоксидантное действие.
При более выраженном прогрессировании, ПУ более 1 г/сут, АГ, нормальной или умеренно сниженной функции почек наряду с этим могут быть назначены глюкокортикостероиды (ГКС): преднизолон 60 мг/сут по альтернирующей схеме на 3 месяца с последующей оценкой активности и постепенным снижением дозы при эффективности. Однако влияние иммунодепрессантов на течение медленно прогрессирующих форм заболевания не доказано [9]. В идеале, ГКС должны назначаться при доказанном сочетании клинических и гистологических признаков активного воспаления (например, выраженная гематурия в сочетании с пролиферативными и некротизирующими изменениями в клубочках почек).
Только при высоком риске прогрессирования (ПУ выше 1–3,5 г/сут) назначение ГКС в альтернирующем режиме вызывало снижение ПУ и стабилизацию функции почек. Доказана эффективность цитостатической терапии для лечения этих типов болезни Берже. Пульс-терапия циклофосфамидом (ЦФА) сверхвысокими дозами показала значимо меньшую токсичность, чем прием внутрь при одинаковой эффективности обеих схем в отношении активности заболевания.
При ПУ более 3,5 г/сут или развернутом нефротическом синдроме необходима активная терапия преднизолоном в сочетании с цитостатиками, в т. ч. в сверхвысоких дозах — проводится пульс-терапия ЦФА в дозе 1 г/м 2 поверхности тела 1 раз в 3 недели на 2 г и более в сочетании с преднизолоном 0,5–1 мг/кг/сут с динамическим контролем за эффективностью лечения.
Циклоспорин может использоваться при неэффективности предыдущего протокола в дозе 5 мг/кг м.т./сут. Его использование в большинстве случаев позволяет снижать ПУ, сывороточную концентрацию IgA и эффективно в достижении ремиссии при резистентном к ГКС или зависимом от них гломерулонефрите с нефротическим синдромом [10].
Микофенолата мофетил не нашел пока широкого применения при лечении пациентов с болезнью Берже, поэтому на сегодняшний день еще не накоплено достаточного количества данных для суждения о его эффективности при индукционной и монотерапии, а также при лечении пациентов со значительным снижением функции почек. Однако при невозможности продолжения лечения ГКС и/или ЦФА этот препарат при применении его в течение 1–2 лет в стартовой дозе 2000 мг в сутки и поддерживающей 1000 мг в сутки в 2 приема продемонстрировал хорошую переносимость с выраженным антипротеинурическим действием и стабилизацией функционального состояния почек [14].
Эффективность рыбьего жира до сих пор не доказана, хотя многие именитые клиники (Mayo Сlinic и др.) включают высокие дозы полиненасыщенных жирных кислот в курсы лечения своих пациентов на длительный период. Доказано, что омега-3 жирные кислоты не могут уменьшить ПУ, однако пока не определено, способны ли они замедлить прогрессирование IgAN.
Для снижения повышенного у больных хроническими заболеваниями почек сердечно-сосудистого риска, а также с нефропротективной целью широко применяются статины. Их воздействие на прогрессирование почечного процесса осуществляется не только за счет гиполипидемического действия с уменьшением инфильтрации интерстиция почки модифицированными липидами и торможения склеротических процессов, но и за счет множественных плейотропных эффектов (антиагрегантное, противовоспалительное, цитостатическое, антипротеинурическое и др.).
Диетические рекомендации разрабатываются индивидуально с учетом особенностей течения нефропатии у конкретного человека. Универсальными являются рекомендации строгого ограничения потребления соли (до 3–5 г/сут) и экстрактивных веществ. При снижении фильтрационной функции (скорость клубочковой фильтрации (СКФ) менее 60 мл/мин/1,73 м2) показано умеренное ограничение белка — до 0,8–0,6 г/кг в.т./сут, при нефротическом синдроме потребление белка должно составлять 1 г/кг в.т./сут. Больным с ожирением, снижением толерантности к углеводам, гиперлипидемией необходимо ограничивать легкодоступные углеводы и животные жиры. Не обсуждается отказ от курения. Физическая активность предполагает ограничение занятий травмоопасными видами спорта, а в остальном при отсутствии неконтролируемой гипертонии, нефротического синдрома или быстропрогрессирующего снижения фильтрационной функции не ограничена.
Об эффективности проводимой терапии свидетельствуют:
Даже по достижении ремиссии заболевания больные должны находиться под наблюдением нефролога и терапевта с контролем основных показателей не реже 2–4 раз в год и при возникновении интеркуррентных заболеваний.
Литература
И. Б. Колина, кандидат медицинских наук
Первый МГМУ им. И. М. Сеченова, Москва