Чем лечить хилорибактер в желудке таблетки
Схема лечения хеликобактер пилори: все современные методы эрадикационной терапии
Для выявления Хеликобактер пилори используется дыхательный уреазный тест, не требующий много времени, безвредный и не вызывающий никаких неприятных ощущений и представляющий собой золотой стандарт диагностики инфекции. Симптомы и лечение Хеликобактер пилори индивидуальны. Факт присутствия возбудителя в организме далеко не всегда сопровождается патологическими процессами и требует приема лекарственных препаратов.
Для выяснения и согласования лучших подходов к выявлению и лечению хеликобактерной инфекции в Европе была сформирована группа из ведущих специалистов гастроэнтерологов. Периодически на основании проводимых конференций и совещаний они публикуют протоколы – Маастрихтские консенсусы, по названию города, где проходили первые встречи.
Всего их на данный момент существует пять:
По результатам консенсуса «Маастрихт 2» было установлено, что, к сожалению, ни одна из проводимых схем эрадикации, несмотря на одновременное применение нескольких препаратов, не гарантирует полное уничтожение инфекции. В связи с этим было рекомендовано лечить пациентов сначала по схеме «первой линии», а затем при отсутствии терапевтического эффекта – по схеме «второй линии».
Необходимость проведения повторных курсов антихеликобактерной терапии объясняется повышением резистентности H. pylori к назначаемым антибиотикам, что является главной проблемой современной гастроэнтерологии при лечении ассоциированных с возбудителем заболеваний.
Применяемые сегодня, чтобы вылечить хеликобактерную инфекцию, эрадикационные схемы были утверждены на «Маастрихт 4».
Основными требованиями для них являются:
Интересно: Исторически первой успешно апробированной схемой эрадикации Хеликобактер пилори было применение субсалицилата висмута и Метронидазола. Испытал ее на себе ученый Барри Маршалл, обнаруживший совместно с коллегой Helicobacter pylori в слизистой желудка. В 1984 гг. он преднамеренно выпил содержимое чашки Петри с культурой бактерий, а затем вскоре после появления характерных симптомов спровоцированного гастрита провел указанное лечение. После 14 дней терапии по результатам биопсии возбудителя в желудке обнаружено не было.
Препараты I линии
Задачей эрадикационной терапии первой линии является уничтожение H. pylori у максимально возможного числа пациентов.
Согласно рекомендациям Маастрихт 3, назначают так называемую трехкомпонентную схему (тройная терапия), которая включает следующие препараты и дозировки в день:
Как ИПП, снижающие секрецию желудочного сока и выделение соляной кислоты, больных лечат следующими препаратами в указанных дозировках на один прием:
Минимальная продолжительность курса лечения составляет 7 дней. По ряду проведенных клинических исследований оказывается, что более эффективно принимать указанные препараты 10 или 14 дней. Чтобы была достигнута максимальная эрадикация Хеликобактер пилори и исключена вероятность рецидивов, тройную терапию при отсутствии противопоказаний и других ограничений нужно назначать в полном объеме и по дозировкам, и по срокам лечения.
Трехкомпонентную схему можно применять как первую линию терапии в странах, где частота устойчивых к действию кларитромицина штаммов H. pylori составляет менее 15–20%. Развитие устойчивости возбудителя к Кларитромицину объясняется частым назначением антибиотиков из группы макролидов при бактериальных осложнениях ОРВИ и респираторных заболеваниях у детей и взрослых. Если резистентность к Кларитромицину обнаруживается в среднем у 10% населения, то для Метронидазола этот показатель гораздо выше и составляет от 20 до 40%, что значительно ограничивает возможность применения этого антибактериального средства.
Как альтернатива трехкомпонентной эрадикационной терапии может использоваться четырехкомпонентная схема, дополнительно включающая висмута трикалия дицитрат (препарат Де-Нол) по 120 мг 4 раза в день. Если у больного с диагностированной хеликобактерной инфекцией имеется атрофия слизистой желудка, сопровождающаяся отсутствием продукции соляной кислоты, то назначать ИПП в данном случае не надо, поэтому их исключают, оставляя висмута трикалия дицитрат.
Для пациентов пожилого возраста, у которых ввиду высокого риска осложнений при назначении сразу двух антибиотиков, проведение полноценной антихеликобактерной терапии первой линии невозможно, рекомендуется следующая сокращенная схема лечения на 14 дней:
При наличии показаний у пожилых пациентов антибиотик может быть вообще отменен. При этом прием препаратов висмута назначают на 28 дней, при болевых ощущениях дополнительно выписывают короткий курс ИПП.
Как лечить хеликобактер пилори: ликбез для пациентов
Язва – это больно, гадко и опасно. В недавнем прошлом врачи не могли найти первопричину этой патологии. Списывали на стрессы, неправильное питание и лечили практически вслепую экспериментальным путем.
В конце XIX века немецкие ученые обнаружили спиралевидную бактерию, которая обитала в желудке и двенадцатиперстной кишке. Ей дали название Хеликобактер Пилори. В 1981 г. была научно доказана связь между этим микроорганизмом и появлением язв в желудке и кишечнике, за что в 2005 году первооткрыватели медицинского значения бактерии Робин Уоррен и Барри Маршалл были удостоены Нобелевской премии по медицине.
Что это за бактерия? Как уничтожить патогенный микроорганизм и вылечить эрозии слизистой желудка раз и навсегда? Как лечить хеликобактер пилори?
Хеликобактер пилори: общие сведенья о микроорганизме и пути заражения
Хеликобактер колонизирует участки слизистой оболочки.
Хеликобактер – это грамотрицательный микроорганизм спиралевидной формы. Ее размеры всего 3 мкм. Это единственный микроорганизм способный выжить и размножаться в условиях кислой среды желудочного сока.
При благоприятных условиях Хеликобактер колонизирует участки слизистой оболочки. Негативное действие на желудок происходит благодаря комплексу свойств этого микроорганизма:
Учеными доказано, что штаммы Хеликобактера у больных с язвой более агрессивны, чем у пациентов с гастритом и прочими воспалительными процессами в желудке или кишечнике.
Заражение этим микроорганизмом происходит в 70% случаев бессимптомно. Возможные путями инфицирования врачи называют орально-фекальный или орально-оральный – при поцелуях, пользовании одной посудой, в столовых и кафе, во время медицинских процедур.
Хеликобактер: диагностические мероприятия
Для диагностики Хеликобактер нужно пройти тесты.
Диагностические процедуры начинаются с опроса и осмотра пациента. Затем проводятся специальные исследования, подтверждающие или опровергающие предварительный диагноз. Тесты на Хеликобактер пилори:
Наиболее точные результаты дают только инвазивные методики обследования.
Как уничтожить бактерию? Рекомендации ВОЗ
Лечением Хеликобактер пилори занимается гастроэнтеролог.
Лечением заболеваний, связанных с Хеликобактером пилори занимается гастроэнтеролог.
Если воспалительных процессов на слизистой оболочке желудка не обнаружено, а тесты подтверждают наличие микроорганизма, лечение не проводится.
Проводить антибактериальную терапию следует при наличии или обострении следующих заболеваний:
Как лечить хеликобактер пилори, расскажет тематическое видео:
Длительные курсы лечения препаратами группы НПВС
Есть 2 методики лечения хеликобактерной инфекции.
Лечение проводится комплексно. По методике ВОЗ любая медикаментозная схема должна соответствовать следующим критериям:
В настоящее время приняты 2 методики лечение хеликобактерной инфекции. Их не рекомендуется использовать одновременно. Если 1 схема не дала положительного результата, то используется вторая и наоборот. Это не дает возможности хеликобактеру выработать иммунитет к лекарственным препаратам. Схемы лечения:
Существует 3-я схема лечения борьбы с микроорганизмом. Она используется, когда первые 2 не оказали нужного действия. В том случае говорят об устойчивом штамме Хеликобактера.
В этом случае предварительно проводят эндоскопическое обследование с забором материала для биопсии. В лаборатории индивидуально подбирают препараты для лечения Хеликобактера пилори. И только после этого врач разрабатывает индивидуальный курс.
Антибиотики при Хеликобактере пилори
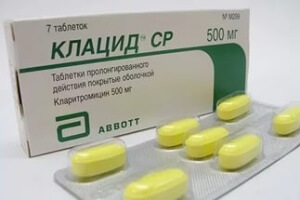
Клацид — антибиотик для борьбы с бактериями.
Казалось бы, существует бактерия, которую можно уничтожить антибиотиками. В лабораторных условиях все проходило идеально, но в испытаниях на добровольцах препараты абсолютно не работали.
Причиной было изменение свойств антибиотиков в условиях кислой среды желудка. Выбор антибиотиков для борьбы с Хеликобактером невелик:
Длительность курса рассчитывается врачом и зависит от длительности заболевания, возраста и диагноза пациента. Рекомендованная длительность лечения составляет не менее 7 дней.
Антибактериальные препараты
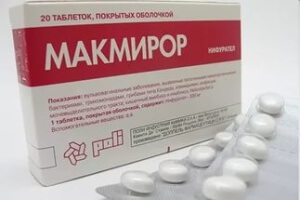
Макмирор разрушает генетический материал паразита.
Выбор антибактериальных лекарственных средств, способных справиться с Хеликобактером невелик. Это «Трихопол» или «Метронидазол», или «Макмирор».
Трихопол и Метронидазол являются полными аналогами. Основное действующее вещество препарата – метронидазол – проникает в микроорганизм и распадается, выделяя токсические вещества.
Они разрушают генетический материал паразита. Основным действующим веществом «Макмирора» является нифурател. Он одновременно угнетает рост бактерий и препятствует размножению микроорганизмов.
Особенность этого препарата является то, что нифурател не снижает общий иммунитет у пациента, а наоборот, улучшает защитные силы организма. Макмирор является препаратом второй линии. Его назначают, если лечение метронидазолом не дало ожидаемого результата. Это лекарственное средство используется при лечении язвенной болезни у детей.
Препараты висмута и ингибиторы протонной помпы при лечении Хеликобактера
Де-нол — лекарственное средство на основе висмута.
Лекарственное средство на основе висмута – Де-нол – использовали еще до открытия патогенного микроорганизма. Он обладает обволакивающим действием, образуя на слизистой оболочке желудка пленку.
Она защищает стенки от агрессивного воздействия соляной кислоты. После открытия Хеликобактера выяснилось, что субцитрат висмута оказывает угнетающее действие на бактерию. Он способен проникать в глубокие слои слизистой оболочки, где любит обосноваться патоген.
Ингибиторы протонной помпы – Омез, Омепразол, Париет – блокирует участки слизистой, ответственные за выработку соляной кислоты. Это способствует заживлению эрозий, снижает кислотность желудочного сока и позволяет сохранить молекулы антибиотика в кислой среде.
Хеликобактер пилори. Как обойтись без антибиотиков?
Эффективной схемы лечения заболеваний, связанных с хеликобактером, без использования антибиотиков не существует. Лишь в некоторых случаях без симптомов воспалительного процесса в ЖКТ и при малой обсемененности бактериями возможно убрать хеликобактер пилори из организма.
Все схемы лечения дают серьезную нагрузку на организм. Если выявлено носительство без признаков воспаления рекомендуется использовать более щадящие методики.
Народная медицина и Хеликобактер
Рецепты народной медицины не следует применять без консультации врача.
Что предлагает народная медицина для лечения хеликобактера? Рецепты зачастую противоречивы:
Использование рецептов народной медицины следует начинать, только проконсультировавшись с гастроэнтерологом. Иначе за месяц лечения вы рискуете получить прободную язву со всеми вытекающими последствиями.
Диета при лечении хеликобактерной инфекции
Современные методики позволяют вылечится за считанные недели.
Специализированного питания для борьбы с Хеликобактером не существует. Во время лечения следует придерживаться рациона, рекомендованного для больных гастритом, язвой и прочими заболеваниями желудка и кишечника.
Пища должна быть легкой, протертой и не раздражать слизистые оболочки. Запрещены тяжелые, острые, жареные и жирные блюда.
Язва – это опасное заболевание. В настоящее время выявлена причина этой патологии. Лечить Хеликобактер пилори следует под руководством гастроэнтеролога. Современные методики позволяют избавиться от этого микроорганизма за считаные недели.
Новые возможности адъювантной антихеликобактерной терапии
Терапевтические варианты лечения инфекции, вызванной бактерией H. pylori, включают в себя различные сочетания ингибиторов протонной помпы совместно с двумя или тремя антибиотиками. Введение безопасных пробиотиков в качестве адъюванта антихеликобактерной т
Therapeutic variants of treating the infection caused by H. pylori bacteria, comprise various combinations of proton pump inhibitors, along with two or three antibiotics. Injection of safe probiotics as an adjuvant of anti-helicobacter therapy seems rather prospective.
Несмотря на то, что Helicobacter pylori (H. pylori) был обнаружен более 30 лет назад и что за определение взаимосвязи данного возбудителя с рядом заболеваний желудочно-кишечного тракта (ЖКТ) австралийцам Маршаллу и Уоррену была присуждена Нобелевская премия по физиологии и медицине, инфекция, вызванная H. pylori (Нр-инфекция), по-прежнему остается сложной проблемой для многих исследователей и врачей, особенно когда речь идет о ее лечении. Нр-инфекция имеет глобальное значение. Профессор D. Graham называет ее наиболее частой инфекцией человека [1]. Примерно 60% населения земного шара инфицировано H. pylori [2]. В настоящее время имеются однозначные научные доказательства связи Нp-инфекции с хроническим гастритом, язвенной болезнью желудка и двенадцатиперстной кишки, злокачественными опухолями желудка — аденокарциномой и экстранодальной В-клеточной лимфомой. Развитие и рецидивирование язвы желудка и двенадцатиперстной кишки в 99,9% случаев и хронического гастрита в 75–85% случаев связаны с Hp-инфекцией [3–5]. Эрадикация H. pylori предотвращает осложнения и рецидивы язвенной болезни и является экономически эффективным методом выбора по сравнению с длительной кислотоподавляющей терапией.
Современные стандартные методы эрадикации H. pylori основаны на использовании ингибитора протонной помпы (ИПП) плюс два или более антибиотиков в течение одной-двух недель [6], схемы лечения подбираются индивидуально и зависят от многих факторов [7–9]. Эффективность лечения в последние годы снизилась до 80% [10, 11], в основном за счет увеличения резистентности к антибиотикам, а также нежелательных лекарственных реакций (НЛР), таких как тошнота, рвота, диарея, запор, лихорадка, головная боль [12]. Эти проблемы могут привести к ухудшению качества жизни пациентов и самостоятельному прекращению лечения.
Альтернативным подходом к преодолению существующих проблем с антибактериальной терапией может быть вакцинация. Было опубликовано большое количество доклинических исследований по эффективности «вакцин-кандидатов» против H. pylori, которые имели ограниченное количество клинических испытаний [13]. К сожалению, в ходе испытаний необходимой эффективности этих вакцин не удалось выявить. Поэтому в настоящее время не существует лицензированных антихеликобактерных вакцин.
В настоящее время усиливается интерес к альтернативной терапии (например, нацеленной на уреазу как на известный фактор вирулентности) или адъювантной антихеликобактерной терапии [14], направленной на уменьшение эффектов, связанных с употреблением антибиотиков. Для этих целей в качестве «возможных» инструментов были предложены пробиотики [15]. На сегодняшний день проведено значительное количество исследований по их возможной роли в лечении и профилактике Нр-инфекции [16].
Пробиотики включают в себя ряд микроорганизмов и их метаболитов, в основном различных видов Lactobacillus или Bifidobacterium, которые при приеме внутрь в определенных количествах оказывают определенную пользу для здоровья человека [17, 18]. Благотворное влияние пробиотиков на желудочно-кишечные заболевания, в том числе на профилактику и лечение антибиотик-ассоциированной диареи (ААД), многократно описаны в различных работах [19, 21–24].
Многочисленные исследования in vitro продемонстрировали бактерицидные или бактериостатические эффекты пробиотиков в отношении H. pylori, которые позже были изучены в доклинических и клинических исследованиях [25]. Эти исследования показали некоторую эффективность антихеликобактерной активности пробиотиков в монотерапии и увеличение эффективности и/или уменьшение НЛР при их включении в стандартную эрадикационную терапию [26, 27].
Возможные механизмы эффективности пробиотиков по уменьшению НЛР и/или улучшению эффективности антихеликобактерной терапии
ААД является наиболее распространенным НЛР эрадикационной терапии H. pylori. Антибиотики, изменяя микрофлору кишечника, вызывают диарею, что приводит к распространению устойчивых штаммов бактерий и к усилению бродильных процессов патогенными и условно-патогенными бактериями [22]. Некоторые авторы уже продемонстрировали значительное снижение возникновения ААД, а также острой диареи с помощью пробиотических средств [21, 24]. Пробиотики могут стимулировать усиление иммунных механизмов слизистой оболочки кишечника, например, активировать локальные макрофаги и модулировать профили цитокинов. Введение пробиотиков при Нр-инфекции у детей восстанавливает нормальное соотношение Bifidobacterium spp./Е. coli, увеличивает сывороточный IgA, а также уменьшает сывороточный интерлейкин-6 (ИЛ-6) [28]. Пробиотический эффект может осуществляться не только через иммунные механизмы, но и через антагонизм и конкуренцию с потенциальными патогенами. В частности, пробиотики способны синтезировать антиоксиданты и противомикробные вещества, изменять значения рН, стимулировать выработку муцина, повышать барьерные функции кишечника, уменьшать выработку токсинов патогенной микрофлорой, влиять на колонизацию, конкурируя с патогенными микроорганизмами за питательные вещества и привязке к клетке-хозяину на поверхности кишечного эпителия [24, 29]. Наконец, микрофлора, через дугу «кишка — мозг», предположительно вовлечена в патофизиологию формирования депрессивных и тревожных расстройств, а также играет возможную роль в модуляции абдоминальных болей [23, 30]. Все эти эффекты пробиотиков были предложены для повышения эффективности эрадикационной антихеликобактерной терапии [31, 32].
Вырабатываемая H. pylori уреаза катализирует превращение мочевины до диоксида углерода и аммиака, а аммиак, в свою очередь, образует гидроксид аммония, который нейтрализует локальную кислотность в пользу выживания H. pylori. Ряд исследований сообщили о возможности Lactobacillus сasei ингибировать вырабатываемую H. pylori уреазу [33], этот эффект может быть связан с повышением активности молочной и других органических кислот, производимых этими бактериями [29, 34].
J. B. Ewaschuk и соавт. определили, что B. infantis формируют более плотные соединения с эпителием, что имеет особое значение в лечении воспалительных заболеваний кишечника, таких как болезнь Крона или язвенный колит. Кроме того, он может участвовать в эпителиальной защите слизистой оболочки желудка и уменьшать повреждение H. pylori слизистой оболочки и последующее воспаление. Кроме того, B. infantis в сочетании с антибиотиками в терапии H. pylori-инфекции более эффективен [35].
A. I. Dajani и соавт. выявили альтернативу стандартной тройной терапии для эрадикации H. pylori, эффективность которой значительно снизилась в последние годы до 68,9%, в сравнении с результатами десятилетней давности — 95%. Пробиотик, содержащий B. infantis, при добавлении в качестве адъюванта к тройной терапии в течение 2 недель одновременно или последовательно приводил к успешной эрадикации в 83–90,8% случаев (p 3 колониеобразующих единиц/г (КОЕ) [38]. Подвергаясь воздействию кислоты, они сохраняются в желудке дольше, чем другие бактерии. О возможной роли местной микрофлоры в защите желудочного эпителия от хеликобактерных поражений можно судить по исследованию Elliott и соавт. [39], которые обнаружили, что уровень общего количества аэробов в желудке у здоровых крыс находится в диапазоне от 10 3 до 10 4 КОЕ/г. Они представлены автохтонной желудочной флорой Lactobacilli, а грамотрицательные микроорганизмы составляют лишь 5%. Тем не менее, на следующий день после индукции у этих крыс язв желудка, общее количество аэробов достигло 10 9 –10 10 КОЕ/г и оставалось высоким в течение 1 недели. При этом грамотрицательные бактерии стали доминирующими в общем количестве аэробов, а Lactobacilli исчезли совсем. Колонизация грамотрицательных бактерий происходила преимущественно на месте язвы. Эти результаты показывают, что гастродуоденальная микрофлора, хоть и в малом количестве, может представлять собой первую линию обороны против патогенных бактерий. Таким образом, потребление экзогенных молочнокислых бактерий, в частности, с пробиотическими свойствами, может усилить эти защитные функции в желудке, поддерживая местный микробиологический гомеостаз, препятствуя колонизации H. pylori и/или уменьшая воспалительные процессы [40, 41].
Некоторые штаммы Lactobacillus (L. gasseri и L. plantarum), по данным X. Chen и соавт., способны конкурентно подавлять рост H. pylori на эпителиальных клетках желудка [42]. Аналогичные результаты были описаны для некоторых штаммов Lactobacillus (в том числе L. acidophilus, L. johnsonii и L. salivarius, подвид salicinius), которые уменьшали адгезию H. pylori в желудке человека. Этот эффект был более значительным при использовании культуральной жидкости лактобактерий, а не самих бактериальных клеток L. salivarius для ингибирования увеличения ИЛ-8, вызванного адгезией H. pylori к клеткам аденокарциномы желудка (AGS). Применение L. johnsonii или L. salivarius у крыс, инфицированных H. pylori, показало снижение бактериальной нагрузки, местного синтеза ИЛ-8 и проявлений воспаления желудка [43]. Кроме того, культуральный супернатант L. johnsonii La1 уменьшает подвижность и колонизацию H. pylori в желудке человека [44]. У животных моделей длительное применение йогурта с добавлением пробиотиков (L. acidophilus, L. bulgaricus, B. lactis, S. thermophilus) приводит к снижению колонизации H. pylori, снижает уровень ФНО-α, уменьшает воспаление желудка и уровень кишечной метаплазии, по сравнению с инфицированными сородичами, не получающими пробиотики [45].
Уменьшение воспаления слизистой желудка у инфицированных H. pylori больных после применения пробиотиков было продемонстрировано Pantoflikova и соавт., как непосредственно на желудочных биоптатах, так и косвенно по снижению сывороточного гастрина-17 (L. jonhsonii LJ1, L. rhamnosus GG, L. rhamnosus LC705, Propionibacterium freudenreichii JS, Bifidobacterium lactis BB12) [46, 47].
Дальнейшие исследования показали, что L. acidophilus может ингибировать активацию белка Smad7, что приводит к уменьшению воспалительных явлений [48].
В рандомизированном двойном слепом контролируемом исследовании, проведенном в Италии, при симптоматическом лечении детей с инфекцией H. pylori применяли штамм L. reuteri АТСС55730 или плацебо в течение 20 дней. Для оценки тяжести и частоты симптомов была использована шкала оценки тяжести симптомов со стороны ЖКТ (Gastrointestinal Symptom Rating Scale, GSRS), которая включает опросник по следующим симптомам: боль в животе, кислая отрыжка, изжога, ощущение подсасывания в эпигастрии, тошнота, рвота, вздутие живота, повышенное газообразование, нарушения дефекации, отсутствие аппетита, неприятный запах изо рта, нарушение вкуса и крапивница. Интенсивность проявления симптоматики регистрировалась по четырем уровням: слабые (не мешают повседневной деятельности), умеренные (немного мешают повседневной деятельности), тяжелые (мешают повседневной деятельности), очень тяжелые (непрерывные, приводящие к прерыванию лечения). Данные получали до (за 1 неделю до вмешательства), в течение (5-й и 10-й день) и после завершения терапии (15-й и 20-й день). Статистически значимых различий между исследуемой и контрольной группами в эрадикации H. pylori не было обнаружено. Тем не менее, у всех детей, получающих пробиотики, по сравнению с теми, кто получал плацебо, было значительное снижение баллов по шкале GSRS за время эрадикационной терапии, которые уменьшались к концу периода наблюдения. Дети, получавшие L. reuteri, отмечали меньше НЛР эрадикационного лечения, чем те, кто получал плацебо [49].
Целью проведенного китайскими учеными метаанализа было оценить влияние добавления лактобактерий в стандартные режимы эрадикации H. pylori на частоту достижения эрадикации H. pylori и частоту возникновения НЛР на фоне антихеликобактериального лечения. В метаанализ включались исследования, в которых сравнивалось добавление лактобактерий или плацебо к стандартным режимам эрадикации H. pylori. Было идентифицировано 8 рандомизированных исследований с общим числом пациентов 1372. При проведении анализа у всех пациентов, подлежащих лечению, объединенная частота эрадикации H. pylori составила 82,26% (95% ДИ 78,01–86,51%) и 76,97% (95% ДИ 73,11–80,83%) в группе применения лактобактерий и плацебо соответственно, а отношение шансов составило 1,78 (95% ДИ 1,21–2,62). Общая частота нежелательных явлений между сравниваемыми группами не отличалась и составила 30,84% (95% ДИ 24,82–36,86%) на фоне добавления пробиотиков к эрадикационной терапии и 42,24% (95% ДИ 35,89–48,59%) при использовании плацебо, при этом отношение шансов было равно 0,49 (95% ДИ 0,24–1,02). В то же время на фоне применения лактобактерий отмечалась меньшая частота возникновения диареи, вздутия живота и нарушений вкуса. Таким образом, результаты данного метаанализа продемонстрировали, что добавление лактобактерий к стандартной схеме эрадикации H. pylori может способствовать увеличению частоты эрадикации у пациентов, лечение которым проводится впервые, а также оказывать положительное влияние на некоторые НЛР, возникающие на фоне эрадикационной терапии [50].
Недавний метаанализ 14 рандомизированных исследований показал, что добавление в антихеликобактерные схемы антибиотикотерапии определенных пробиотиков может быть эффективным в повышении процента эрадикации и полезным для пациентов с недостигнутой эрадикацией H. pylori [51].
M. P. Dore и соавт. изучили эффективность L. reuteri в эрадикационной терапии H. pylori. Хеликобактерная инфекция диагностировалась с помощью гистологического и С 13 уреазного дыхательного тестов (С 13 УДТ). Пациентам назначали штамм L. reuteri DSM 17938 10 8 КОЕ с пантопразолом 20 мг два раза в день в течение 8 недель. Контроль эрадикации проводился через 4–6 недель после терапии. Комбинация L. reuteri с пантопразолом была эффективна у 13,6–14,2% в зависимости от метода диагностики. Также оценивали активность уреазы до и через 4–6 недели после терапии, в итоге отмечалось значительное снижение данного показателя от 38,8% до 25,4‰ (p = 0,002). Таким образом, L. reuteri может иметь потенциальную роль в эрадикации H. pylori [52].
R. Francavilla и соавт. в проспективном двойном слепом рандомизированном плацебо-контролируемом исследовании с участием 100 H. pylori+-пациентов (3-я фаза) кроме стандартной тройной терапии получали дополнительно L. reuteri 2 × 10 8 КОЕ или плацебо. Всем пациентам назначалось: C 13 УДТ, определение уровня гастрина-17 (G17) в сыворотке крови, фиброгастродуоденоскопия (ФГДС) по шкале GSRS. Эффективность эрацикации оценивалась с помощью C 13 УДТ через 8 недель после завершения терапии. Показатели C 13 УДТ в группе с L. reuteri снизились на 13% по сравнению с повышением на 4% в группе плацебо (–13,2 ± 34% против 4,3 ± 27%; p 13 УДТ выше порога 12‰, что указывало на умеренно высокую колонизацию H. pylori. Уровень обсеменения H. pylori в динамике определялся с помощью С 13 УДТ после 14 дней приема препарата, а также через 6, 12 и 24 недели после окончания приема препарата. Всем пациентам назначались Lactobacillus reuteri DSMZ17648 Pylopass в суточной дозе 2 × 10 10 КОЕ, контрольную группу составили H. pylori+-волонтеры, которые получали плацебо. В опытной группе наблюдалось значительное снижение концентрации H. pylori (р 13 УДТ. Назначение плацебо не привело к сильному изменению С 13 УДТ (Dplacebo –0,6 ± 5,3), в то время как прием L. reuteri DSMZ17648 Pylopass привел к выраженному снижению показателей С 13 УДТ (Dverum –4,9 ± 7,8, р = 0,026 по сравнению с плацебо), что показало значительное уменьшение колонии H. pylori в желудке. С увеличением уровня колонизации эффект уменьшения КОЕ H. pylori, вызванный приемом L. reuteri DSMZ17648 Pylopass, оказывался сильнее. Этот эффект снижения количества H. pylori продолжался и по окончанию лечения. Потенциальный эффект плацебо был значительно ниже, чем действие L. reuteri DSMZ17648 Pylopass. В ходе исследования не было зарегистрировано каких-либо изменений в качестве жизни, например, в физической деятельности, питании или здоровье, о которых обследуемые сообщали в анкете. Никаких НЛР не было отмечено ни в одной группе исследования [56].
С конца 2014 г. в России появился препарат L. reuteri DSMZ17648 Pylopass под коммерческим названием Хелинорм в капсулах по 200 мг. Один грамм этого препарата содержит около 1 трлн специально обработанных микробных клеток. Продолжительность курса Хелинорма составляет 4 недели. В день достаточно принимать всего 1 капсулу, которую рекомендуется проглатывать, не вскрывая, во время еды, запивая небольшим количеством воды. Благодаря высокой безопасности Хелинорм может назначаться детям старше 6 лет. Препарат можно назначать в виде монотерапии или в комплексной схеме антихеликобактерного лечения для повышения его эффективности, особенно сегодня, когда резко растет резистентнось к применяемым в этой схеме антибиотикам.
Заключение
Пробиотики, как правило, считаются безопасными агентами для применения, а ряд штаммов уже получили признание для использования при различных заболеваниях. Введение безопасных пробиотиков в качестве адъюванта антихеликобактерной терапии представляется весьма перспективным. Дальнейшие исследования механизмов прямых и косвенных эффектов влияния пробиотиков на H. pylori может помочь не только улучшить лечение, но также способствовать новому пониманию некоторых аспектов патогенеза «взаимоотношений» H. pylori с человеком. Новый препарат Хелинорм предлагает альтернативное лечение, не способствует увеличению резистентности H. pylori к антибиотикам и снижает уровень колонизации этого вредоносного агента.
Литература
* ГБОУ ВПО КемГМА МЗ РФ, Кемерово
** МБУЗ ГКБ № 2, Кемерово