Чем лечить кишечник ребенку
Профилактика и лечение острых кишечных инфекций
Поделиться:
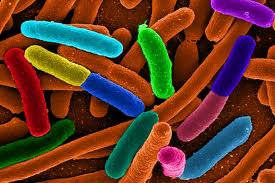
Во время купания мы волей-неволей (а маленькие дети даже специально) заглатываем воду вместе с живыми организмами. В подавляющем большинстве случаев такое вторжение остается незамеченным, поскольку наш организм обладает несколькими степенями защиты, помощнее, чем у банковского билета. Но иногда защитная система дает сбой, что провоцирует острую кишечную инфекцию.
Упоминая опасности таящиеся в водоемах, нельзя обойти тему жителей этих водоемов. Речь пойдет о самых опасных существах населяющих наши реки, — пираньях. А, не, шутка — пираньи чуть южнее.
На самом деле мой рассказ, конечно же, о бактериях, о профилактике и лечении кишечных инфекций. Иной раз удивляешься когда мы, такие большие и сильные, обжившие все уголки планеты и даже частичку космоса, погибаем от микроскопических существ. Вспоминается фильм «Война миров» по Уэллсу, где даже самые здоровые инопланетяне спасовали перед микробами.
Впрочем, за инопланетян не поручусь, но людям есть что противопоставить вредным микроорганизмам. В нашей слюне находится вещество (лизоцим), осложняющее жизнь бактерии уже при попадании в рот. Лимфатическое кольцо в ротовой полости, являясь периферическим органом иммунной системы, также надежно защищает от проникновения агрессивных существ. А желудочный сок агрессивен практически к любой флоре. Но при определенных условиях (незрелость иммунной системы у малышей, иммунодефицит, пожилые люди, алкоголики) бактерии берут верх, вызывая острые кишечные инфекции.
Откуда берется инфекция
В водоемах бурлит жизнь, невидимая нашему глазу, и эта жизнь с удовольствием воспользуется телами беспечных купальщиков. Кишечная инфекция — самая обычная проблема летнего сезона. Строго говоря, острая кишечная инфекция возникает не только от купания. Это проблема немытых рук, овощей, фруктов, некачественно обработанной пищи. Причиной кишечной инфекции являются патогенные бактерии (изредка вирусы и грибы).
К слову, в нашем пищеварительном тракте есть и полезные бактерии (бифидобактерии, лактобактерии и др.), иначе говоря, облигатная флора. Они участвуют в пищеварении, выработке ферментов, витаминов, конкурируют с патогенной флорой подавляя ее развитие.
Условно патогенные микроорганизмы (стрептококки, протей, кишечная палочка и пр.), тоже живут внутри организма, и при сохраненном иммунном статусе для нас безвредны. Но способны вызвать заболевание при снижении иммунитета.
А вот бактерии, попадающие извне, — это патогенная флора. Вызванные ими заболевания — иерсиниоз, сальмонеллез, брюшной тиф, холера и т.д. — могут представлять серьезную угрозу жизни.
Как проявляется заболевание
Вначале микробная инвазия проявляется себя… а ничем не проявляет. Инкубационный период длится около двух суток, время, которое есть у пострадавшего, чтобы решить последние дела, пока зловредные микробы множатся, накапливают яды. Дальше интоксикация, температура, ломота в суставах — сутки непонятное состояние, которое можно спутать с гриппом или еще чем-нибудь.
Далее следует расцвет кишечной инфекции. Это, как правило, спастические боли в разных отделах живота, многократная рвота и, конечно, многократный жидкий стул. Иногда жидкость льет как из трубы — как при холере. Иногда с примесью крови — как при дизентерии. Степень обезвоживания достигает крайних величин, угрожая жизни пациента.
Особенно тяжело протекает обезвоживание у маленьких детей. Очень часто таких малышей привозят в наше отделение. Глаза запавшие, крик слабый, кожный покров сухой как ботинок. Тут не до шуток, жизнь висит на волоске.
Факторы, определяющие степень тяжести состояния:
Вам нужно прекращать заниматься самолечением и травоедением и незамедлительно обратиться к врачу, если: — Вышеперечисленные симптомы наблюдаются у детей дошкольного возраста, пожилых людей старше 60 лет и у лиц с хроническими заболеваниями сердечно-сосудистой и дыхательной систем. — Частый, жидкий стул более 5 раз у взрослых. — В стуле, рвотных массах — примесь крови. — Высокая лихорадка с диареей и рвотой. — Схваткообразные боли в животе любой локализации, длящиеся более часа. — Рвота после любого приема пищи и воды. — Выраженная слабость и жажда.
Что делать в домашних условиях?
И в заключение, пусть это банально, повторюсь: мойте руки перед едой, мойте овощи и фрукты, готовьте пищу из качественных продуктов. Это так просто, но необычайно эффективно. Будьте здоровы.
Товары по теме: [product](регидрон), [product](активированный уголь), [product](энтереодез), [product](церукал), [product](фуразолидон), [product](имодиум), [product](лоперамид)
Причины и характер проблем со стороны ЖКТ у детей различного возраста
В период новорожденности и в детском возрасте, острые и хронические заболевания желудочно-кишечного тракта не являются редкостью. Существуют отдельные заболевания, которые чаще возникают у детей определенной возрастной категории, что связано с незрелостью иммунной системы, нерациональным питанием, неправильным введением прикорма у детей первого года жизни, а также наличием врожденных структурных изменений в органах пищеварительной системы.
Любые расстройства пищеварительной деятельности в детском возрасте, при несвоевременном лечении, с возрастом могут привести к развитию тяжелых патологий. Родителям важно знать, как правильно ребенку восстановить микрофлору после антибиотиков, а также с какими патологиями ЖКТ можно столкнуться в детском возрасте.
Дети первого года жизни
Дети грудного возраста, чаще всего сталкиваются с такими функциональными расстройствами ЖКТ, как острая и хроническая диарея, дисбактериоз кишечника, острый и хронический энтероколит. Подобные нарушения могут быть обусловлены врожденными аномалиями развития толстого и тонкого кишечника, искусственным вскармливанием с использованием молочные смеси, которая не подходит ребенку, ранним введением прикорма, а также проникновением инфекционных возбудителей бактериальной или вирусной природы. Лечение симптомов энтероколита у детей проводится только после установления точной причины развития патологии.
Хроническая и острая диарея, обусловленная нарушением баланса кишечной микрофлоры или инфекцией, несет прямую угрозу не только здоровью, но и жизни младенца. Если говорить о том, как восстановить микрофлору кишечника ребенка, то в данной ситуации не обойтись без пробиотиков и пребиотиков.
Дети дошкольного возраста
Организм дошкольника продолжает находиться на этапе становления, а иммунная система всё ещё остается незрелой. Кроме того, рацион детей дошкольного возраста значительно расширен по сравнению с грудничками, что может послужить причиной развития пищевой аллергии, а также таких заболеваний органов ЖКТ:
Дети младшего школьного возраста и подростки
С момента начала посещения дошкольного или школьного учреждения, ребёнок ежедневно находится в коллективных условиях. Учащиеся младших классов и подростки, чаще сталкиваются с такими нарушениями со стороны пищеварительного тракта:
В отличие от взрослых, при лечении детей необходимо соблюдать особый подход. Для лечения симптомов дисбактериоза кишечника у детей, назначаются средства, содержащие бифидум и лактобактерии. При выборе лекарственных средств отдается предпочтение медикаментам щадящего действия, которые имеют минимальный список побочных эффектов. Одним из главных звеньев лечения инфекционных и неинфекционных патологий желудочно-кишечного тракта у детей являются пробиотики и пребиотики, которые восстанавливают нормальный баланс кишечной и желудочной микрофлоры.
Особенности применения пробиотиков и пребиотиков у детей
Препараты из группы пробиотиков и пребиотиков очень часто назначаются детям разного возраста с лечебно-профилактической целью. Препараты, сочетающие в себе пробиотический и пребиотический компоненты, являются незаменимой составляющие комплексной терапии инфекционного и неинфекционного гастроэнтерита, энтерита и кишечного дисбиоза в периоде новорожденности. Для восстановления микрофлоры после антибиотиков, ребенку назначают пробиотики и пребиотики с первого дня начала антибактериального лечения.
С точки зрения эффективности, комбинированный прием антибиотиков и пробиотиков малоэффективен, так как от общего количества принимаемых бактерий, жизнеспособными остаются не более 25%. Решить эту проблему позволило изобретение метапребиотика, который содержит комбинацию из фруктоолигосахаридов и фруктополисахаридов, а также лактат кальция. Метапребиотик Стимбифид Плюс для детей не нормализует кишечную микрофлору за счёт содержания бифидум и лактобактерий, но при попадании в просвет желудочно-кишечного тракта, компоненты Стимбифид Плюс создают максимально благоприятные условия для размножения нормальной микрофлоры.
При контакте с антибиотиками, эффективность метапребиотика не снижается, поэтому Стимбифид для детей одинаково совместим с любыми антибактериальными препаратами. Восстанавливая нормальную микробиоту желудка и кишечника, Стимбифид Плюс повышает иммунитет и помогает гармонизировать все процессы в организме ребенка. Компоненты метапребиотика благоприятно влияют на интеллектуальное развитие детей, и помогают улучшить школьную успеваемость. Метапребиотик для детей полностью безопасен, поэтому может быть использован с лечебно-профилактической целью уже с первых дней жизни. В инструкции по применению Симбифид Плюс, для детей обозначена дозировка и кратность приёма.
Дисбактериоз у детей
Формирование микрофлоры у детей
Рождение ребенка всегда радостное долгожданное событие в жизни женщины и её близких, родных. А для малыша это встреча с новым окружающим миром, населенным миллиардами микроорганизмов. По данным литературы, уже во второй половине беременности у плода начинается формирование его микрофлоры кишечника, при помощи феномена транслокации. Поэтому состояние микрофлоры кишечника, а перед родами слизистой влагалища будущей мамы играет ведущую роль в динамике становления микрофлоры кишечника новорожденного. После родов кишечник малыша продолжает заселяться микробами от матери, персонала и внешней среды.
Если ребенок в первые полчаса после рождения прикладывается к груди и далее находится на естественном вскармливании, то у него формируется нормальная микрофлора кишечника. Женское молоко содержит вещества — пребиотики, способствующие заселению кишечника ребенка определенными видами нормофлоры, со стабильными характеристиками для роста бифидобактерий (B. bifidum, B.infantis, B. breve). Иммунные факторы в молоке матери (в т.ч. в молозиве): лактоферрин, лизоцим, секреторный IgA, лимфоциты, макрофаги, бифидус-фактор, бета-лактоза блокируют колонизацию условно-патогенными микроорганизмами.
У детей на искусственных смесях микрофлора более разнообразна по составу: из бифидобактерий — больше В.longum, лактобактерии в большем количестве, клостридии могут превышать допустимые показатели, появляются бактероиды и вейлонеллы. В этот период на фоне изменения состава питания могут появляться различные диспептические расстройства.
Выделяют фазы формирования микрофлоры:
Становление нормального состава микрофлоры кишечника продолжается в первое полугодие жизни малыша. В этот период жизни ребенка даже незначительное неблагополучие в состоянии здоровья, в работе желудочно-кишечного тракта способны вызвать тяжелые, трудно восстанавливаемые нарушения микрофлоры кишечника. Тем более простудные заболевания, прием антибиотиков, ухудшающие усвоение питательных веществ и работу кишечника – нарушают соотношение полезных и враждебных бактерий в сторону агрессии последних.
Расширение рациона питания в первый год жизни ребенка, добавление твердой пищи приводит к исчезновению преобладания бифидобактерий у детей, получающих грудное молоко. К 12 месяцам состав микрофлоры в толстом кишечнике детей, находящихся на грудном или на искусственном вскармливании по составу приближается к микрофлоре взрослого человека.
Причины дисбактериоза у детей
Основные причинные факторы нарушения соотношения микрофлоры, с количественным и качественным преобладанием патогенной флоры и развитием дисбактериоза кишечника:
Симптомы дисбактериоза у детей.
Дисбиоз кишечника имеет различную клиническую картину, причем выраженность симптомов не всегда соответствует степени дисбиотических нарушений. Бывает, что при значительных нарушениях состава микрофлоры клинические проявления отсутствуют, но они сразу появляются при снижении иммунитета, нарушении защитных свойств слизистой кишечника (после антибиотиков, отравлении). А при наличии заболеваний желудочно-кишечного тракта уже небольшие отклонения микрофлоры от нормы могут сопровождаться значительными клиническими проявлениями:
При нарушении состава микрофлоры кишечника состояние и поведение грудного ребенка заметно меняется. У малыша наблюдается повышенное газообразование, вздувается животик, отмечается урчание по ходу кишечника и появляются кишечные колики, малыш проявляет беспокойство, плачет, сучит ножками. У него нарушается привычный режим сна и бодрствования. Подобные приступы кишечных колик могут возникать через полтора – два часа после кормления малыша. Иногда появляются срыгивания и даже рвота. Если дисбактериоз у малыша выраженный, возможно возникновение такого явления, как мальабсорбация. Это может привести к нарушению всасывания в кишечнике питательных веществ, а малыша появляется понос. Стул ребенка становится пенистый и имеет резкий гнилостный запах. Потом поносы у крохи могут смениться на упорные запоры. Это связано со снижением в кишечнике малыша в значительной степени количества бифидобактерий, отвечающих за правильную перистальтику кишечника и необходимых для нормального стула ребенка.
Варианты течения дисбактериоза у детей могут быть:
Так, стафилококковый дисбактериоз у детей до 3-х месяцев часто протекает по типу энтероколита. Стул жидкий, может быть с примесью крови, с умеренно выраженным интоксикационным синдромом, но при этом с затяжным течением. Если присоединяется острая кишечная инфекция и назначаются антибиотики, то может быть неблагоприятное течение.
Кандидозный дисбактериоз (Candida, чаще С. albicans) в титрах выше 10 4 КОЕ/г фекалий проявляется бродильной диспепсией, непостоянными болями в кишечнике, метеоризмом. Данные клинические симптомы могут встречаются у детей всех возрастных групп.
Дисбактериоз кишечника напрямую связан с аллергией. У 77-100% детей, больных с крапивницей, атопическим дерматитом, бронхиальной астмой выявляется дисбактериоз кишечника. Наиболее часто, при этом определяют дефицит лакто-бифидобактерий, избыточный рост золотистого стафилококка и грибов рода Candida. К этим микроорганизмам, вырабатываются специфические иммуноглобулины класса Е, развивается повышенная чувствительность.
Токсин золотистого стафилококка обладает свойствами «суперантигена», способного одновременно активизировать до 10% лимфоцитов. А при обычном иммунном ответе, участвует лишь небольшая часть специфических лимфоцитов. Этот «супериммунный» ответ на превышение количества стафилококка на коже или в дыхательных путях и может проявиться аллергией. Токсин нарушает защитную биопленки слизистой кишечника, повышает проницаемость кишечной стенки для больших белковых молекул (чужеродных агентов или аллергенов), что и сопровождается развитием пищевой сенсибилизации (повышенной чувствительности), усиливает проявления пищевой аллергии. Вот почему существует афоризм: «кожа — зеркало кишечника».
По литературным данным зарубежных авторов, в странах с низкой распространенностью аллергических заболеваний (в Эстонии) состав кишечных бактерий значительно отличается от его показателей в странах с более высокой встречаемостью аллергии (в Швеции). Назначение пробиотиков с лактобациллами новорожденным приводило к снижению частоты атопического дерматита в два раза, по сравнению с не получавшими лактобактерий.
Lactobacillus rhamnosus усиливает синтез факторов, препятствующих развитию атопии и аллергии у больных с атопическим дерматитом и аллергией к коровьему молоку.
Профилактика дисбактериоза у детей:
Лечение дисбактериоза у детей.
Лечение дисбактериоза у ребенка обязательно должно проводиться при участии и под контролем педиатра, гастроэнтеролога, желательно аллерголога-иммунолога и дерматолога с применением новых, достоверно эффективных пробиотиков и пребиотиков, до полного восстановления нормального состава микрофлоры кишечника.
>Нормофлорины — биокомплексы, состоящие из живых пробиотиков — лактобактерий и бифидобактерий, незаменимы при лечении дисбактериозов у детей любого возраста (разрешены детям с рождения).
1. Действие Нормофлоринов на организм:
2. Показания для детей:
Функциональные нарушения желудочно-кишечного тракта у детей грудного возраста: роль диетотерапии
Функциональные нарушения желудочно-кишечного тракта (ЖКТ) представляют одну из наиболее широко распространенных проблем среди детей первых месяцев жизни [1].
Функциональные нарушения желудочно-кишечного тракта (ЖКТ) представляют одну из наиболее широко распространенных проблем среди детей первых месяцев жизни [1]. Отличительной особенностью данных состояний является появление клинических симптомов при отсутствии каких-либо органических изменений со стороны ЖКТ (структурных аномалий, воспалительных изменений, инфекций или опухолей) и метаболических отклонений. При функциональных нарушениях ЖКТ могут изменяться моторная функция, переваривание и всасывание пищевых веществ, а также состав кишечной микробиоты и активность иммунной системы [2–4]. Причины функциональных расстройств часто лежат вне пораженного органа и обусловлены нарушением нервной и гуморальной регуляции деятельности пищеварительного тракта.
В соответствии с Римскими критериями III, предложенными Комитетом по изучению функциональных расстройств у детей и Международной рабочей группой по разработке критериев функциональных расстройств в 2006 г. [5], к функциональным нарушениям ЖКТ у младенцев и детей второго года жизни относят:
У детей грудного возраста, особенно первых 6 месяцев жизни, наиболее часто встречаются такие состояния, как срыгивания, кишечные колики и функциональные запоры. Более чем у половины детей они наблюдаются в различных комбинациях, реже — как один изолированный симптом. Поскольку причины, приводящие к функциональным нарушениям, оказывают влияние на различные процессы в ЖКТ, сочетание симптомов у одного ребенка представляется вполне закономерным. Так, после перенесенной гипоксии могут возникнуть вегетовисцеральные нарушения с изменением моторики по гипер- или гипотоническому типу и нарушения активности регуляторных пептидов, приводящие одновременно к срыгиваниям (в результате спазма или зияния сфинктеров), коликам (нарушения моторики ЖКТ при повышенном газообразовании) и запорам (гипотоническим или вследствие спазма кишки). Клиническую картину усугубляют симптомы, связанные с нарушением переваривания нутриентов, обусловленным снижением ферментативной активности пораженного энтероцита, и приводящие к изменению микробиоценоза кишечника [6].
Причины функциональных нарушений ЖКТ можно разделить на две группы: связанные с матерью и связанные с ребенком.
К первой группе причин относятся:
Причины, связанные с ребенком, заключаются в:
Частыми и наиболее серьезными причинами, приводящими к возникновению срыгиваний, колик и нарушений характера стула, являются перенесенная гипоксия (вегетовисцеральные проявления церебральной ишемии), частичная лактазная недостаточность и гастроинтестинальная форма пищевой аллергии. Нередко в той или иной степени выраженности они наблюдаются у одного ребенка, поскольку последствиями гипоксии являются снижение активности ферментов и повышение проницаемости тонкой кишки.
Под срыгиваниями (регургитацией) понимают самопроизвольный заброс желудочного содержимого в пищевод и ротовую полость.
Частота синдрома срыгиваний у детей первого года жизни, по данным ряда исследователей, составляет от 18% до 50% [7, 8]. Преимущественно срыгивания отмечаются в первые 4–5 месяцев жизни, значительно реже наблюдаются в возрасте 6–7 месяцев, после введения более густой пищи — продуктов прикорма, практически исчезая к концу первого года жизни, когда ребенок значительную часть времени проводит в вертикальном положении (сидя или стоя).
Степень выраженности синдрома срыгиваний, согласно рекомендациям группы экспертов ESPGHAN, предложено оценивать по пятибалльной шкале, отражающей совокупную характеристику частоты и объема регургитаций (табл. 1).
Нечастые и необильные срыгивания не расцениваются как заболевание, поскольку они не вызывают изменений в состоянии здоровья детей. У детей с упорными срыгиваниями (оценка от 3 до 5 баллов) нередко отмечаются осложнения, такие как эзофагит, отставание в физическом развитии, железодефицитная анемия, заболевания ЛОР-органов. Клиническими проявлениями эзофагита являются снижение аппетита, дисфагия и осиплость голоса.
Следующим, часто встречающимся функциональным расстройством ЖКТ у детей грудного возраста являются кишечные колики — это эпизоды болезненного плача и беспокойства ребенка, которые занимают не менее 3 часов в день, возникают не реже 3 раз в неделю. Обычно их дебют приходится на 2–3 недели жизни, достигают кульминации на втором месяце, постепенно исчезая после 3–4 месяцев. Наиболее типичное время для кишечных колик — вечерние часы. Приступы плача возникают и заканчиваются внезапно, без каких-либо внешних провоцирующих причин [9].
Частота кишечных колик, по разным данным, составляет от 20% до 70% [9, 10]. Несмотря на длительный период изучения, этиология кишечных колик остается не вполне ясной.
Для кишечных колик характерен резкий болезненный плач, сопровождающийся покраснением лица, ребенок принимает вынужденное положение, прижав ножки к животу, возникают трудности с отхождением газов и стула. Заметное облегчение наступает после дефекации.
Эпизоды кишечных колик вызывают серьезное беспокойство родителей, даже если аппетит ребенка не нарушен, он имеет нормальные показатели весовой кривой, хорошо растет и развивается.
Кишечные колики практически с одинаковой частотой встречаются как на естественном, так и на искусственном вскармливании. Отмечено, что чем меньше масса тела при рождении и гестационный возраст ребенка, тем выше риск развития данного состояния.
В последние годы большое внимание уделяется роли микрофлоры кишечника в возникновении колик. Так, у детей с данными функциональными расстройствами выявляются изменения состава кишечной микробиоты, характеризующиеся увеличением количества условно-патогенных микроорганизмов и снижением защитной флоры — бифидобактерий и особенно лактобацилл [11, 12]. Повышенный рост протеолитической анаэробной микрофлоры сопровождается продукцией газов, обладающих потенциальной цитотоксичностью. У детей с выраженными кишечными коликами нередко повышается уровень воспалительного белка — кальпротектина [13].
Функциональные запоры относятся к числу распространенных нарушений функции кишечника и выявляются у 20–35% детей первого года жизни [14, 15].
Под запорами понимают увеличение интервалов между актами дефекации по сравнению с индивидуальной физиологической нормой более 36 часов и/или систематически неполное опорожнение кишечника.
Частота стула у детей считается нормальной, если в возрасте от 0 до 4 месяцев происходит от 7 до 1 акта дефекации в сутки, от 4 месяцев до 2 лет от 3 до 1 опорожнения кишечника. К расстройствам дефекации у младенцев также относятся дисхезия — болезненная дефекация, обусловленная диссинергией мышц дна малого таза, и функциональная задержка стула, для которой характерно увеличение интервалов между актами дефекации, сочетающихся с калом мягкой консистенции, большого диаметра и объема.
В механизме развития запоров у грудных детей велика роль дискинезии толстой кишки. Наиболее частой причиной возникновения запоров у детей первого года жизни являются алиментарные нарушения.
Отсутствие четко очерченной границы между функциональными нарушениями и патологическими состояниями, а также наличие отдаленных последствий (хронические воспалительные гастроэнтерологические заболевания, хронические запоры, аллергические заболевания, расстройства сна, нарушения в психоэмоциональной сфере и др.) диктуют необходимость внимательного подхода к диагностике и терапии данных состояний.
Лечение детей грудного возраста с функциональными нарушениями ЖКТ является комплексным [3, 16] и включает ряд последовательных этапов, которыми являются:
Наличие срыгиваний диктует необходимость использования симптоматической позиционной (постуральной) терапии — изменение положения тела ребенка, направленного на уменьшение степени рефлюкса и способствующего очищению пищевода от желудочного содержимого, тем самым снижается риск возникновения эзофагита и аспирационной пневмонии. Кормить ребенка следует в положении сидя, при положении тела младенца под углом 45–60°. После кормления рекомендуется удерживание ребенка в вертикальном положении, причем достаточно продолжительно, до отхождения воздуха, не менее 20–30 минут. Постуральное лечение необходимо проводить не только на протяжении всего дня, но и ночью, когда нарушается очищение нижнего отдела пищевода от аспирата вследствие отсутствия перистальтических волн (вызванных актом глотания) и нейтрализующего эффекта слюны.
Ведущая роль в лечении функциональных нарушений ЖКТ у детей принадлежит лечебному питанию. Назначение диетотерапии, прежде всего, зависит от вида вскармливания ребенка.
При естественном вскармливании в первую очередь необходимо создать спокойную обстановку для кормящей матери, направленную на сохранение лактации, нормализовать режим кормления ребенка, исключающий перекорм и аэрофагию. Из питания матери исключают продукты, повышающие газообразование в кишечнике (сладкие: кондитерские изделия, чай с молоком, виноград, творожные пасты и сырки, безалкогольные сладкие напитки) и богатые экстрактивными веществами (мясные и рыбные бульоны, лук, чеснок, консервы, маринады, соленья, колбасные изделия).
По мнению ряда авторов, функциональные расстройства ЖКТ могут возникать в результате пищевой непереносимости, чаще всего аллергии к белкам коровьего молока. В таких случаях матери назначается гипоаллергенная диета, из ее рациона исключаются цельное коровье молоко и продукты, обладающие высоким аллергизирующим потенциалом.
В процессе организации диетотерапии необходимо исключить перекорм ребенка, особенно при свободном вскармливании.
При отсутствии эффекта от вышеописанных мероприятий, при упорных срыгиваниях используют «загустители» (например, Био-рисовый отвар), которые разводят грудным молоком и дают с ложечки перед кормлением грудью.
Необходимо помнить, что даже выраженные функциональные расстройства ЖКТ не являются показанием для перевода ребенка на смешанное или искусственное вскармливание. Сохранение симптоматики является показанием к дополнительному углубленному обследованию ребенка.
При искусственном вскармливании необходимо обратить внимание на режим кормления ребенка, на адекватность выбора молочной смеси, соответствующей функциональным особенностям его пищеварительной системы, а также ее объем. Целесообразно введение в рацион адаптированных молочных продуктов, обогащенных пре- и пробиотиками, а также кисломолочных смесей: Агуша кисломолочная 1 и 2, NAN Кисломолочный 1 и 2, Нутрилон кисломолочный, Нутрилак кисломолочный. При отсутствии эффекта используются продукты, специально созданные для детей с функциональными нарушениями ЖКТ: NAN Комфорт, Нутрилон Комфорт 1 и 2, Фрисовом 1 и 2, Хумана АР и др.
Если нарушения обусловлены лактазной недостаточностью, ребенку постепенно вводят безлактозные смеси. При пищевой аллергии могут быть рекомендованы специализированные продукты на основе высокогидролизованного молочного белка. Поскольку одной из причин срыгиваний, колик и нарушений характера стула являются неврологические нарушения вследствие перенесенного перинатального поражения центральной нервной системы, диетологическая коррекция должна сочетаться с медикаментозным лечением, которое назначается детским неврологом.
Как при искусственном, так и при естественном вскармливании между кормлениями целесообразно предлагать ребенку детскую питьевую воду, особенно при склонности к запорам.
Особого внимания заслуживают дети с синдромом срыгиваний. При отсутствии эффекта от использования стандартных молочных смесей целесообразно назначать антирефлюксные продукты (АР-смеси), вязкость которых повышается за счет введения в их состав специализированных загустителей [17, 18]. С этой целью используются два вида полисахаридов:
КРД, безусловно, является интересным компонентом в составе продуктов детского питания, и на ее свойствах хотелось бы остановиться подробнее. Основным физиологически активным компонентом КРД является полисахарид — галактоманнан. Он относится к группе пищевых волокон и выполняет две взаимосвязанные функции. В полости желудка КРД обеспечивает более вязкую консистенцию смеси и препятствует возникновению срыгиваний. Вместе с тем КРД относится к нерасщепляемым, но ферментируемым пищевым волокнам, что и придает этому соединению классические пребиотические свойства.
Под термином «нерасщепляемые пищевые волокна» понимается их устойчивость к воздействию панкреатической амилазы и дисахидаз тонкой кишки. Понятие «ферментируемые пищевые волокна» отражает их активную ферментацию полезной микрофлорой толстой кишки, прежде всего — бифидобактериями. В результате такой ферментации происходит ряд важных для организма физиологических эффектов, а именно:
Положительное влияние КРД на состав кишечной микрофлоры у детей первого года жизни описано в ряде исследований [19]. Это является одним из важных аспектов применения современных АР-смесей в педиатрической практике.
Смеси, включающие КРД (камедь), обладают доказанным клиническим эффектом и при функциональных запорах. Увеличение объема кишечного содержимого за счет развития полезной кишечной микрофлоры, изменение рН среды в кислую сторону и увлажнение химуса способствуют усилению перистальтики кишечника. Примером таких смесей являются Фрисовом 1 и Фрисовом 2. Первая предназначена для детей с рождения до 6 месяцев, вторая — с 6 до 12 месяцев [20]. Эти смеси могут быть рекомендованы как в полном объеме, так и частично, в количестве 1/3–1/2 от необходимого объема в каждое кормление, в сочетании с обычной адаптированной молочной смесью, до достижения стойкого терапевтического эффекта.
Другая группа АР-смесей — продукты, включающие в качестве загустителя крахмалы, которые действуют только в верхних отделах ЖКТ, причем положительный эффект наступает при использовании их в полном объеме. Эти смеси показаны детям с менее выраженными срыгиваниями (1–3 балла), как при нормальном стуле, так и при склонности к разжиженному. Среди продуктов этой группы выделяется смесь NAN Антирефлюкс, обладающая двойной защитой против срыгиваний: за счет загустителя (картофельного крахмала), увеличивающего вязкость желудочного содержимого и умеренно гидролизованного белка, повышающего скорость опорожнения желудка и дополнительно профилактирующего запоры.
В настоящее время на Российском потребительском рынке появилась обновленная антирефлюксная смесь Хумана АР, в состав которой одновременно введены камедь рожкового дерева (0,5 г) и крахмал (0,3 г), что позволяет усилить функциональное действие продукта.
Несмотря на то, что АР-смеси являются полноценными по составу и призваны обеспечить физиологические потребности ребенка в пищевых веществах и энергии, согласно международным рекомендациям они относятся к группе продуктов детского питания «для специального медицинского назначения» (Food for special medical purpose). Поэтому продукты данной группы следует использовать строго при наличии клинических показаний, по рекомендации врача и под медицинским контролем. Продолжительность применения АР-смесей должна определяться индивидуально и может быть достаточно длительной, около 2–3 месяцев. Перевод на адаптированную молочную смесь осуществляется после достижения стойкого терапевтического эффекта.
Литература
*НЦЗД РАМН, **РМАПО, Москва
Кишечная инфекция у детей
Симптомы и лечение кишечных инфекций у взрослых отличаются от диагностики и терапии детских отравлений. Ребенок – не уменьшенная копия взрослого. Поскольку работа всех систем организма имеет свои особенности, подход к обследованию и лечению должен быть индивидуальный.
В первый год жизни ребенка его организм поддерживается материнским иммунитетом, который он получает с молоком матери. В молоке содержатся не только питательные вещества, но и антитела, которые буквально охраняют детский организм, пока его собственный иммунитет не сформирован.
У детей существует календарь прививок и вакцин, который крайне желательно соблюдать. Но прививок от кишечных инфекций не существует.
Еще один негативный аспект детских инфекций – самолечение, которым занимаются взрослые. Когда родители, не вызвав педиатра, начинают бесконтрольно давать ребенку антибиотики, последствия могут быть катастрофичны. Нужно обязательно обращаться за помощью к специалисту! Во-первых, невозможно самостоятельно адекватно оценить тяжесть состояния ребенка. Во-вторых, к антибиотикам может выработаться устойчивость, а без идентифицирования возбудителя крайне тяжело правильно подобрать нужный препарат.
Виды и особенности кишечных инфекций
Основной механизм передачи кишечных инфекций – фекально-оральный. Это означает, что возбудитель, который попал во внешнюю среду с фекалиями зараженного человека или животного, оставаясь в пище, воде, почве, или даже на бытовых предметах, попадая в рот ребенка, способен вызвать отравление.
Возбудители инфекций
Микроорганизмы, вызывающие кишечные инфекции, бывают трех видов:
Бактерии
Их более 30. Сальмонеллы, шигеллы, ишерихии, золотистый стафилококк (пищевая токсикоинфекция), клостридии – лишь некоторые из них.
Вирусы
Наиболее грозный и распространенный в педиатрии – ротавирус.
Протозойные (простейшие)
Амебы, лямблии и другие одноклеточные также способны вызвать отравление. Но протозойные кишечные инфекции больше характерны для взрослых, особенно путешественников.
Симптомы кишечной инфекции у детей
Кишечные инфекции у детей начинаются остро, с яркими клиническими проявлениями и, к сожалению, быстрым обезвоживанием.
Основные симптомы сходны с диспепсическими проявлениями у взрослых:
1) Диарея – частый и жидкий стул. Данный симптом не следует лечить препаратами замедляющими перистальтику кишечника, так как это не только основной признак кишечной инфекции, но и мощная защитная реакция организма на патогенный возбудитель или токсин.
2) Интоксикация действует на ребенка намного серьезнее, чем на взрослого– из-за небольшой массы, слабого иммунитета и незрелости внутренних органов.
3) Боли в животе – связано со спазмами желудочно-кишечного тракта.
4) Рвота – многие кишечные инфекции проявляются рвотой. Она, как и диарея, помогает малышу избавиться от токсинов. Цель взрослого до приезда врача – поить ребенка жидкостью.
Данные симптомы комбинируются в зависимости от вида возбудителя и течения заболевания. Возможны следующие варианты:
1) Гастрит – основное проявление пищевых токсикоинфекций, проявляется болями в области живота, кратковременной диареей и рвотой.
2) Энтерит – при данной форме поражается только тонкий кишечник. Характеризуется болями в области живота, и выраженной обильной диареей.
3) Колит – воспаление толстой кишки, при этом диарея не так выражена, но кал содержит примеси слизи и даже крови.
4) Сочетанные формы: гастроэнтерит, энтероколит, гастроэнтероколит.
Отдельно от симптомов и клинических форм заболеваний необходимо отдельно выделить обезвоживание. У взрослых оно является осложнением, проявляющимся при запоздалой терапии, в то время как у детей оно возникает намного быстрее, и, как следствие, развивается интоксикация.
В первую очередь, необходимо вызвать врача-педиатра!
Пока едет врач, нужно как можно скорее приступить к восполнению потери жидкости в организме ребенка. Согласно статистике, при своевременной регидратации потребность в госпитализации снижается более чем в 2 раза! (6) Это значительно снижает и количество летальных исходов, статистика которых неутешительна.
При оказании первой помощи полезно дать малышу энтеросорбент, который разрешен детям. Для этих целей подходит Фильтрум. Но принимать его следует в определенной дозировке, в зависимости от возраста (см. таблицу) 3 раза в день:
| Возраст | Количество таблеток Фильтрум на 1 приём |
| До 1 года | 0,5 таблетки |
| 1-3 года | 0,5 – 1 таблетка |
| 4-7 лет | 1 таблетка |
| 7-12 лет | 1-2 таблетки |
| Дети старше 12 лет | 2-3 таблетки |
Диагностика кишечной инфекции у детей
Врач диагностирует кишечную инфекцию на основании:
1) Эпидемиологического анамнеза. Он расспросит взрослых, что ел ребенок, где, из какой посуды и как её дезинфицировали. Спросит, с кем общался, пребывал ли в городе, за городом или заграницей. Любая деталь – не мелочь, каждая крупица информации поможет врачу быстрее поставить предварительный диагноз, и быстрее назначить лечение или госпитализацию, если она потребуется.
2) Анализы при подозрении на кишечную инфекцию – неотъемлемая часть диагностики. Стандартными обследованиями являются:
Лечение кишечной инфекции у детей
У детей, как и у взрослых, лечение состоит из трех компонентов:
1) Этиологическое лечение, нацеленное на причину болезни – уничтожение возбудителя.
Важно отметить, что в случае вирусного поражения (ротавирусная инфекция) антибиотики неэффективны, и лечение направлено на поддержание детского организма.
2) Симптоматическое лечение
Лечение симптомов облегчает состояние ребенка. Не нужно блокировать рвоту и диарею – достаточно снять боль спазмолитиками, добавить энтеросорбенты и пробиотики.
Пробиотики – полезные бактерии, которыми искусственно заселяют кишечник ребенка после того, как они «вымылись» при отравлении при диарее.
3) Патогенетическое лечение
Основной патогенетический механизм, угрожающий жизни детей – обезвоживание. Лучшим лечением будет являться коррекция водно-электролитного баланса. Необходимо давать ребенку как можно больше жидкости. В условиях стационара врач при необходимости назначит внутривенное введение физиологического раствора и электролитов.
[h2] Профилактика кишечной инфекции у детей
Лучшая профилактика – стерилизация принадлежностей для кормления, соблюдение личной гигиены и чистоты дома. Не забывайте вовремя стерилизовать игрушки, проводить своевременную уборку и тщательно обрабатывать руки и пищу.
И еще один важный совет: отправляйте гостей мыть руки перед тем, как они пойдут нянчить малыша. К сожалению, далеко не все взрослые знают об этом элементарном правиле.
[h2] Диета при кишечной инфекции у детей
Диета является обязательным звеном лечения и восстановления при отравлениях. Основные аспекты диеты при лечении кишечных отравлений у детей:
1) Восполнение потерь ослабленного детского организма с учетом сбившейся функции желудочно-кишечного тракта. В первую очередь это щадящая диета, основанная на небольших порциях и частых приемах пищи. Если малыш младше 1 года, необходимо грудное кормление. Не стоит забывать и о восполнении жидкостных потерь – нужно продолжать поить ребенка водой, предназначенной для малышей.
2) Детям на искусственном кормлении нужно постепенно добавлять смеси с высоким содержанием белка.
3) У детей более старшего возраста питание следует ограничить: исключить «тяжелую» для кишечника пищу, такую как черный хлеб, коровье молоко и каши на его основе, квашеную капусту, жирные сорта мяса и рыбы.
Таким образом, лечение кишечных инфекций у детей – крайне сложный процесс, который в полной мере может обеспечить только специалист. Учитывая все отличия маленького организма от взрослого и разнообразие патогенных возбудителей, не нужно рисковать здоровьем малыша, жизнь которого зависит только от родителей. Единственное, что будет правильным при подозрении на отравление – вызов врача, симптоматическая терапия, регулярное поступление жидкости и постоянный контроль за состоянием малыша.
Список литературы
1. Л.И. Агеева, Г.А. Александрова, Н.М. Зайченко и др. Здравоохранение в России. Официальное издание. Федеральная служба государственной статистики. 2017.
2. Кузьменко, Л. Г. Детские инфекционные болезни: учеб. для студ. высш. учеб. заведений / Л. Г. Кузьменко, Д. Ю. Овсянников, Н. М. Киселёва. — М.: Издательский центр «Академия», 2009. — 528 с.
3. РОССИЙСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ ФЕДЕРАЛЬНОГО АГЕНТСТВА ПО ЗДРАВООХРАНЕНИЮ И СОЦИАЛЬНОМУ РАЗВИТИЮ» НАУЧНО-ИНФОРМАЦИОННЫЙ МАТЕРИАЛ «ОСТРЫЕ ОТРАВЛЕНИЯ»;
4. А.А. Баранов, Л.С. Намазова-Баранова, В.К. Таточенко. Ротавирусная инфкекция у детей – нерешенная проблема. Обзор рекомендаций по вакцинопрофилактике. Педиатрическая фармакология 2017. Т14, №4, с. 248-257.
5. Халиуллина, С. В. Обезвоживание у детей при острых диареях. / С. В. Халиуллина, В. А. Анохин, Ю. Р. Урманчеева // Детские инфекции. – 2014. – Т13. – №3. – С. 40-44.
6. Плоскирева, А. А. Тактика регидратационной терапии при острых кишечных инфекциях у детей / А. А. Плоскирева, А. В. Горелов // Лечащий врач. — № 6. — 2017. – С. 7.
7. А.К. Токмалев. Применение энтеросорбентов в лечении острых кишечных инфекций. Лечащий врач 05/11.
8. Р. А. Файзуллина. Сорбенты в педиатрической практике: дифференцированный подход к назначению. «ПЕДИАТРИЯ/НЕОНАТОЛОГИЯ»; № 4(4); 2016; стр. 24-29.
Краевое государственное бюджетное учреждение здравоохранения
ДЕТСКАЯ ГОРОДСКАЯ БОЛЬНИЦА
министерства здравоохранения Хабаровского края
Лечение дисбактериоза кишечника у детей
Какая мама согласится во время болезни своего малыша на то, чтобы ему антимикробные препараты кололи внутримышечно, а не просто давали бы микстуру или таблетку? Далеко не каждая. Абсолютно точно. А почему?
Преобладающее с огромным перевесом большинство скажет: «Чего я буду его травмировать, уколы делать. когда так удобно – в ложечке микстуру дать». И не задумываются мамы, насколько серьезными могут быть последствия таких необдуманных поступков. Хотя, почему сразу антибиотики? Есть масса других заболеваний, состояний и лекарств, вызывающих эту проблему. И не только у детей.
Дисбактериоз. О нем и стоит поговорить в виду множественных эпидемий различных заболеваний, а также в связи с огромным ростом фармацевтической промышленности.
Что же такое «микрофлора» и «дисбактериоз»?
Кишечник Ни для кого из читателей не секрет, что в нашем организме «проживает» огромное количество микроорганизмов, их более 490 видов. Но далеко не все они способны и будут вызывать различные заболевания. Поэтому существует патогенная и условно-патогенная микрофлора. Вообще, у каждого человека есть свое «население», свои микроорганизмы, которые поддерживают в свою очередь сам организм. То есть это своеобразный симбиоз: «ты – мне, я – тебе».
В разных отделах пищеварительной системы находятся разные «поселенцы». Так, например, во рту (между прочим, самом «густонаселенном» месте нашего организма) и в толстом кишечнике преобладают анаэробы (кишечная палочка, энтеробактерии, дрожжеподобные грибы); а желудок вообще «беден», т.к. в соляной кислоте многие не выживают.
Зачем они нужны? Пища, которую мы употребляем, может быть очень полезной, но в той форме, в которой она попадает в желудок, наш организм ее не усвоит. Значит, нужно как-то ее «обработать» и «подать». Для этого и нужен весь состав микрофлоры. И здесь главную роль играют облигатные микроорганизмы.
Облигатные микроорганизмы – это главная, постоянная микрофлора. Она начинает формироваться с первого в жизни кормления малыша и стабилизируется к 2 месяцам.
Далее в течение жизни происходит постепенное заселение кишечника условно-патогенной микрофлорой. Ее необходимость до конца не доказана. Одни врачи считают, что при наличии их в кишечнике снижается риск общей заболеваемости кишечными инфекциями, повышается иммунитет. Другие считают наоборот, что это вызывает большую заболеваемость. В любом случае – условно-патогенные микроорганизмы есть, есть всегда.
Условно-патогенная микрофлора – это второстепенные «поселенцы», которые могут находиться в организме длительное время, не причиняя никакого вреда. Но если в кишечник попадает большое количество бактерий такого же рода, либо резко снижается иммунитет, заболевание манифестирует в тяжелой форме. В здоровом организме же рост этой микрофлоры сдерживают облигатные микроорганизмы.
И третья, наиболее опасная группа микроорганизмов – это патогенные, т.е. болезнетворные.
Патогенная флора в организме человека не существует постоянно. А, поступая из вне, вызывает заболевание либо путем разрушения нормальной микрофлоры, либо очень быстрой персистенцией (размножением и заселением). Почти сразу или на фоне сниженного иммунитета и угнетенных защитных сил организма.
Таким образом, первые две группы существовать в кишечнике могут и существуют. Появление же представителей третьей группы микроорганизмов вызывает разбалансировку, дисбаланс всей микрофлоры. Облигаты погибают, что усиливает рост патогенных штаммов. появляются клинические признаки этого дисбаланса. Это и называется дисбактериозом.
Факторы, влияющие на состав микрофлоры кишечника
Так как речь пойдет о нарушении самой микрофлоры у ранее здорового малыша, рассматривать случаи попадания патогенных микроорганизмов извне мы не будем.
Итак, причины такого нарушения, дисбаланса микрофлоры можно разделить на внешние и внутренние.
Внешние причины:
Внутренние причины:
Итак, разобравшись с основными большими группами причин возникновения дисбактериоза, можно попытаться распознать дисбактериоз.
Как понять, что нужна помощь?
Самым простым способом выявления дисбактериоза у детей является копрология – исследование кала Важно помнить, что у маленьких детей дисбактериоз отличить от физиологически нормально протекающих процессов довольно сложно. Поэтому важную роль играют «предшественники». Допустим, мама знает, что ее малыш недавно переболел пневмонией, при которой применялись антибиотики, но профилактику дисбактериоза в виде далее описанных препаратов не проводили. Конечно, в этом случае, будем думать именно о дисбактериозе. То же самое касается любых выше названных состояний, при которых возможно его возникновение.
Итак, самым простым способом является копрология – исследование кала. Здесь в первую очередь смотрим, насколько поступившая пища усвоилась организмом. Если в анализе много непереваренных мышечных волокон, жирных кислот, клетчатки, крахмала, значит, пищу организм усваивает плохо. И одной из причин является нарушение в микрофлоре и что-то, что не позволяет ей «работать». Это и возможно при дисбактериозе, когда патогенные микроорганизмы подавляют облигатную флору. Также в анализе зачастую встречается большое количество лейкоцитов и клеток кишечного эпителия, которые появляются в нем за счет воспаления кишечной стенки, оставшейся без своих микроорганизмов. Ну и конечно, цвет и консистенция каловых масс сами дадут знать о нарушениях в организме – стул жидкий, обильный, частый, с большим количеством воды, чаще светлого цвета. При этом малыш будет постоянно просить пить, и в тяжелых случаях может развиваться эксикоз – обезвоживание. Самые маленькие детки перестанут прибавлять в весе, даже начнут худеть. Кожа становится сухой, теряется ее эластичность.
Конечно, в таких случаях дети нуждаются в госпитализации и срочной коррекции состояния. Мы же поговорим о нетяжелых вариантах дисбактериоза кишечника после, например, приема антибиотиков.
Лечение дисбактериоза
Ключевым моментом в лечении дисбактериоза является коррекция питания Первым и ключевым моментом в лечении дисбактериоза является коррекция питания. Итак, обращаю внимание читателей на продукты, которые следует исключить из рациона во избежание раздражения слизистой оболочки желудочно-кишечного тракта и усиления перистальтики. Это делается с целью сохранить воду в организме.
А именно, прекращаем употреблять в пищу сырые овощи, фрукты, за исключением бананов и печеных яблок. Из мясного допускается нежирная курица, кролик, крупы – рисовая, манная (если нет аллергии), пшенная. Причем все каши употребляем в протертом виде. Хорошо пить просто рисовый отвар. Из овощей оставляем только картошку. Молочные продукты исключаем полностью. Из напитков позволительны чай крепкий, сладкий, вода, компот из сухофруктов (причем только сам компот без ягод), отвар ромашки, кисели. Соки и газированные напитки – категорически нельзя.
Часто для лечения дисбактериозов у детей применяют бактериофаги. Это вирусы бактерий, которые избирательно убивают причину возникновения дисбактериоза. Но их применение возможно лишь после доподлинно известного возбудителя.
Пробиотики. На сегодняшний день это самая разнообразная и часто используемая группа препаратов для лечения дисбактериозов у детей. Название говорит само за себя – «для жизни» (антибиотики – «против жизни»). Принцип их действия заложен в них самих – молочнокислые бактерии «встают на защиту» кишечника и подавляют микроорганизмы, вызывающие процессы гниения.
Пребиотики являются стимуляторами пробиотиков. Ну а симбиотики – это комплексные препараты, включающие в себя как пре-, так и пробиотики. Рассмотрим наиболее часто применяемые из них:
Аципол обладает многофакторным действием, высокоактивен, а также повышает иммунологическую резистентность организма.
Применяют: у детей до 6 месяцев 5 доз в сутки, старше 6 месяцев 10-15 доз в сутки в 2-3 приема за 30-40 минут до еды. Препарат растворяют в воде комнатной температуры из расчета одна чайная ложка на одну дозу препарата.
Линекс стабилизирует мембраны клеток кишечного эпителия и регулирует всасывание электролитов.
Применяют: у детей до 2 лет по 1 капсуле 3 раза в сутки; старше 2 лет по 1-2 капсуле 3 раза в сутки. Детям раннего возраста капсулу вскрывают и смешивают с небольшим количеством жидкости. Курс 5-7 дней.
Энтерол, активным компонентом которого являются лечебные дрожжи, устойчивые ко всем видам антибиотиков.
Применяют: у детей до года по пол пакетика 2 раза в сутки, у детей от 1 до 3 лет по 1 капсуле или 1 пакетику 1-2 раза в сутки, старше 3 лет по 2 капсулы или 2 пакетика 1-2 раза в сутки за 30 минут до еды.
Бифидумбактерин восстанавливает активность ЖКТ, подавляет рост патогенной микрофлоры, повышает иммунный статус.
Применяют: у детей до 6 месяцев по 5-10 доз в сутки; с 6 месяцев до 3 лет – по 1-15 доз в сутки; старше 3 лет – по 15-20 доз в сутки на 2-3 приема за 30 минут до еды.
Бифилин имеет более широкий спектр ферментативной активности по сравнению с бифидумбактерином.
Применяют: у детей старше 3 лет по 10-12 доз в сутки в 2-3 приема за 30 минут до еды. Для растворения препарата используют кипяченую воду из расчета 1 доза препарата на 1 чайную ложку.
Бифиформ Малыш содержит помимо лакто- и бифидобактерий витамины В1 и В6.
Применяют: у детей от 1 года до 3 лет по 1 порошку 2-3 раза в сутки, таблетки жевательные детям 2-3 лет по 1 таблетке, с 3 лет по 2 таблетке 2-3 раза в сутки независимо от приема пищи. Курс 5 дней.
Бифиформ выпускается в капсулах, которые устойчивы к желудочному соку, благодаря которым бактерии доходят до кишечника в неизмененном виде.
Применяют: у детей старше 2 лет по 1-2 капсуле 2 раза в сутки независимо от приема пищи. Курс 10-14 дней.
В настоящее время широко используются продукты, содержащие бифидо- и лактобактерии. Наиболее широко используются: Бифидок, Бифилин, кисломолочный бифидумбактерин, Биолакт обогащенный, Имунеле, Активиа, Актимель и т.д.
Единственный их минус – сроки хранения некоторых продуктов напрямую зависят от содержания полезных бактерий. То есть чем больше срок их хранения, тем меньшее количество бактерий в них содержится.
Оглавление
Синдром раздраженного кишечника (СРК) – общее название функциональных расстройств желудочно-кишечного тракта, не вызванных органной патологией. Встречается у взрослых и детей, на планете болеют порядка 30% людей.
Характеристика недуга
Под СРК подразумевают нарушения пищеварения в толстой кишке, связанные с этим изменения перистальтики и эвакуации переработанной пищи. Заболевание часто носит хронический характер, но протекает доброкачественно, легко поддается коррекции с помощью диеты и здорового образа жизни.
Причины возникновения
Таким образом, лечение синдрома раздраженного кишечника у детей будет направлено против причины, его вызвавшей.
Классификация
Симптомы и признаки
Лечение синдрома раздраженного кишечника у ребенка обязательно будет включать симптоматическую терапию.
Осложнения и последствия
Если при наличии синдрома раздраженного кишечника у ребенка лечение не было доведено до конца, болезнь становится хронической. В более взрослом возрасте могут появиться такие осложнения, как:
Диагностика и анализы
Учитывая схожесть СРК с другими заболеваниями желудочно-кишечного тракта и возможность осложнений, рекомендуется провести обследование ребенка, которое будет включать:
Лечение
При установленном синдроме раздраженного кишечника лечение детей ведется по трем направлениям:
Детям назначают легкие седативные препараты, родителям советуют меньше нагружать детей учебой, избегать стрессов дома, составить распорядок дня, следить за сном (не менее 9 часов в день), прогулками (не меньше 2 часов в день), физической нагрузкой (пресс, плаванье).
Для снятия болей назначают спазмолитики, для улучшения перистальтики (движений кишечника) – прокинетики.
При дисбактериозе – пробиотики (полезные бактерии, кисломолочные продукты).
Прогноз
Течение болезни и прогноз благоприятные: своевременное медицинское вмешательство и последующее наблюдение у детского гастроэнтеролога поможет избежать последствий во взрослом возрасте – как правило, при соблюдении врачебных рекомендаций, симптомы СРК исчезают после полового созревания.
Меры профилактики
Чтобы не допустить функциональных нарушений пищеварения у детей, особенно склонных к заболеванию СРК, нужно:
Преимущества процедуры в МЕДСИ
Нарушения микробиоценоза кишечника у детей и его коррекция
Рассмотрена проблема дисбиоза кишечника и подходы к восстановлению микроэкологической структуры кишечника после агрессивных воздействий, используя пробиотики и средства, способствующие адаптации колоний симбионтных бактерий на слизистой оболочке кишечника
The article represents the issue of intestinal dysbiosis and approaches to restoration of intestinal microbiological structure after aggressive exposures using probiotics and preparations which contribute to adaptation of symbiont bacteria colonies at the intestinal mucous membrane — the products of natural metabolism of microorganisms.
Важнейшую роль в жизнедеятельности организма человека играет микробиоценоз кишечника — микроэкологическая система организма, которая сложилась в процессе филогенетического развития в пищеварительном канале человека. На значение микробной флоры для здорового человека впервые обратил внимание в 1907 году И. И. Мечников. Процесс взаимодействия микроорганизмов, обитающих в кишечнике, и собственно слизистой оболочки достаточно сложен и его изучению посвящено немало монографий и научных работ.
Всю микрофлору кишечника можно разделить на три группы: основная флора, среди которой наибольший интерес представляют бифидобактерии (Bifidobacterium bifidum, Bifidobacterium brevis, Bifidobacterium longum, Bifidobacterium adolescentis и др.) и лактобациллы (Lactobacillus acidophilus, Lactobacillus fermentum, Lactobacillus brevis, Lactobacillus lactis и др.), сопутствующая флора, представленная в основном кишечными палочками с типичными биологическими свойствами и энтерококками (Enterococcus fecalis, Enterococcus faecium), и остаточная флора, которая представлена условно-патогенными бактериями семейства энтеробактерий: клебсиеллами, цитробактерами, протеями и др., стафилококками (Staphylococcus epidermidis, Staphylococcus saprophyticus) и дрожжеподобными грибами.
Одна из основных функций нормальной микрофлоры — защитная, так как бактерии-симбионты человека обладают выраженной антагонистической активностью по отношению к патогенным и условно-патогенным микроорганизмам. Так, например, бифидобактерии образуют в процессе своей жизнедеятельности молочную, уксусную, муравьиную и янтарную кислоты, что снижает рН среды кишечника и препятствует колонизации его посторонними микроорганизмами, попавшими сюда извне. Лактобациллы в процессе брожения молочной кислоты образуют антибиотические вещества — лактолин, лактоцидин, ацидофилин. Полноценная кишечная палочка способна к синтезу колицинов и микроцинов — специфических белков, обладающих антибактериальной активностью. Таким образом, представители основной и сопутствующей микрофлоры кишечника тормозят рост и размножение гнилостных и патогенных микроорганизмов — кишечных палочек с атипичными биологическими свойствами, клебсиелл, протеев, некоторых видов сальмонелл и шигелл, золотистого стафилококка.
Присутствие микробных ассоциаций в кишечнике определяет состояние синтетической функции печеночных клеток путем участия в печеночно-кишечной циркуляции важнейших компонентов желчи — солей желчных кислот, холестерина и желчных пигментов.
Еще одной из важнейших функций микрофлоры организма человека является участие в формировании иммунобиологической реактивности макроорганизма. Показано, что в результате антигенной стимуляции аутофлорой иммунной системы в организме человека создается и поддерживается общий пул иммуноглобулинов.
Известно, что энтероциты кишечника, основная функция которых всасывать питательные вещества из просвета кишки, не всегда получают полноценное питание от самого организма, через базальную мембрану, к которой они фиксированы. Это объясняется тем, что процессы инфузии в клетках эпителия кишечника протекают как бы только в одну сторону — от верхушки энтероцитов к базальной мембране, а не наоборот. Вот и приходится энтероцитам «добывать пропитание» для себя также из просвета кишки. Эта питательная субстанция для клеток эпителия, называемая бутиратом, состоит из различных продуктов жизнедеятельности симбионтной флоры, обитающей в просвете кишки, которая представляет собой смесь короткоцепочечных жирных и летучих кислот, моносахаров и липидов.
При подавлении симбионтной флоры условно-патогенными и патогенными бактериями, выработка бутирата снижается или прекращается вовсе, энтероциты в состоянии дефицита питания атрофируются и процессы пищеварения нарушаются. Известны работы, описывающие механическое повреждение условно-патогенной кишечной палочкой в таких условиях кишечных ворсинок. Эшерихии буквально «обгрызают» энтероциты, ослабленные из-за дефицита питания.
Таким образом, нормальная микрофлора с ее специфическими функциями — защитной, обменной и иммуноиндуцирующей, питательной — определяет микробную экологию пищеварительного тракта и участвует в поддержании гомеостаза макроорганизма. Нарушение любой из функций приводит к нарушению различных видов метаболизма, возникновению дефицита микронутриентов: витаминов, микроэлементов, минеральных веществ в организме человека, снижению его иммунного статуса.
Нарушения состава и количественного соотношения в микробиоценозе кишечника возникают от разнообразных причин: характера питания, возраста, проведения антибактериальной, гормональной или лучевой терапии, наличия хронических заболеваний желудочно-кишечного тракта, измененной иммунобиологической реактивности организма и состояния окружающей среды и наступают задолго до клинических проявлений — они служат предвестником отклонений в клинико-физиологическом статусе организма. Эти изменения нормальной микрофлоры получили название дисбактериоза или дисбиоза, который со временем проявляет себя клиническими местными симптомами, а затем и общими нарушениями, которые отягощают течение различных заболеваний человека и затрудняют его лечение. Преобладание роста каких-либо представителей микробной флоры кишечника, происходящее в силу перечисленных выше обстоятельств, получило название синдрома избыточного бактериального роста (СИБР) и является одним из вариантов проявления дисбактериоза. Следовательно, вместе с лечением человека от той или иной болезни надо оздоровить и его кишечник.
Для характеристики дисбактериоза кишечника в разные годы были предложены различные классификации, учитывающие вид микробной флоры, тип нарушений, тяжесть течения и клинические формы и т. д., но ни одна из известных на сегодня классификаций не может полностью удовлетворить врача при решении практических задач нормализации и коррекции микробиоценоза кишечника и рационально построить лечение и профилактику дисбактериоза у пациентов. Мы использовали классификацию, С. Д. Митрохина (1998), которая позволяет охарактеризовать степени тяжести дисбактериоза толстой кишки с позиций оптимизации современных подходов к лечению и профилактике дисбактериозов.
Микроэкологическая классификация степеней тяжести дисбиоза кишечника (С. Д. Митрохин, 1998)
I степень тяжести — увеличено или уменьшено общее количество кишечных палочек. Кишечные палочки с атипичными биологическими свойствами отсутствуют. Количество бифидобактерий и лактобацилл не изменено. Изменения в общих показателях микробного метаболитного паспорта фекалий характерны лишь в отношении пула летучих жирных кислот, содержания фенилпропионовой кислоты, скатола и метиламина. Общее содержание летучих жирных кислот у больных с I степенью тяжести дисбактериоза может быть меньшим или большим аналогичного у здоровых лиц. Будет снижено содержание скатола. Напротив, содержание фенилуксусной кислоты и метиламина будет повышено. Будут отмечатся изменения удельного веса щавелевоуксусной кислоты в профиле других карбоновых кислот (ДКК). Дисбактериоз латентный, компенсированный, кишечные дисфункции не регистрируются.
II степень тяжести — незначительно снижено количество бифидобактерий и лактобацилл. Наблюдаются количественные и качественные (появление форм с атипичными биологическими свойствами) изменения кишечных палочек. Высеваются в умеренном количестве условно-патогеннные кишечные микроорганизмы. Отмечаются изменения как в общих, так и в специфических показателях микробного метаболитного паспорта фекалий. Что выражается в снижении величины экскреции с фекалиями фенольных соединений: п-крезола и индола. В десятки раз уменьшается количество скатола в испражнениях. Обратная картина наблюдается в отношении фенилпропионовой кислоты, количество которой на порядок превышает таковое у здоровых лиц. Профиль фенольных соединений (ФС) также меняется: удельный вес индола возрастает более чем в 2 раза, несколько снижался удельный вес п-крезола и более чем в десять раз снижен удельный вес скатола. В целом экскреция с фекалиями карбоновых и ароматических аминокислот, фенольных и индольных соединений (за исключением фенилаланина) при II степени тяжести дисбиоза снижена. Снижается экскреция с фекалиями гистамина и серотонина. Изменен аминный профиль: удельный вес гистамина и серотонина ниже, удельный вес представителя простых аминов — метиламина выше. Дисбактериоз локальный (местный), субкомпенсированный, кишечные дисфункции, как правило, не наблюдаются.
III степень тяжести — существенное снижение количества бифидобактерий (10 5 –10 6 ) в сочетании со снижением количества лактобацилл и резким изменением типичных свойств кишечных палочек (значительное преобладание гемолитических, лактозонегативных форм). Значительное увеличение количества условно-патогенных бактерий с патогенными свойствами (гемолитических форм) и патогенных дрожжеподобных грибов (родов Candida, Geotrichum и др.). Характерны еще более выраженные изменения как в общих, так и в специфических показателях микробного метаболитного паспорта фекалий. Снижена величина экскреции с фекалиями фенольных соединений: п-крезола и индола. В фекалиях практически отсутствует скатол. Напротив, содержание фенилпропионовой кислоты в каловых массах резко увеличивается. Профиль ФС меняется таким образом, что существенно увеличивается удельный вес индола и значительно снижается удельный вес п-крезола. Существенно изменяется величина экскреции аминов: содержание в фекалиях гистамина и серотонина может быть выше или ниже по сравнению с нормой (зависит от нозологической формы основного заболевания). Содержание карбоновых кислот в фекалиях больных с III степенью дисбиоза меняется следующим образом: резко уменьшается пул летучих жирных кислот, практически не обнаруживается щавелевоуксусная кислота и значительно возрастает экскреция с каловыми массами альфа-кетоглутаровой кислоты. Изменен профиль летучих жирных кислот. При нарушениях стула по типу диареи удельный вес уксусной кислоты ниже, удельный вес пропионовой и масляной кислот, наоборот, повышен, при констипации наблюдается противоположная картина. Отмечается снижение или увеличение удельного веса молочной и аналогичные изменения удельного веса альфа-кетоглутаровой кислот в профиле ДКК. Дисбактериоз локальный (местный), декомпенсированный, кишечные дисфункции, как правило, наблюдаются.
IV степень тяжести — резкое снижение или отсутствие бифидобактерий, значительное уменьшение количества лактобацилл, резкое уменьшение количества или отсутствие кишечных палочек с типичными свойствами, значительное возрастание количества как облигатных, так и факультативных видов (в норме не встречающихся) кишечных бактерий и дрожжеподобных грибов с патогенными свойствами. Выявляются патогенные кишечные бактерии (сальмонеллы, шигеллы, йерсинии). Качественные изменения в микробном метаболитном паспорте остаются такими же, как и при третьей степени, но их количественные характеристики еще более изменены, характерна глубокая разбалансировка биохимических регуляторных механизмов микробной экосистемы, сочетающаяся с аналогичной разбалансировкой микробной инфраструктуры кишечника. Дисбактериоз распространенный (с бактериемией), декомпенсированный (с угрозой генерализации инфекции, сепсиса или септикопиемии), наблюдаются выраженные кишечные дисфункции.
Лечением дисбиоза врачи всех уголков мира занимаются давно. В результате многолетнего кропотливого поиска наиболее действенных мер и способов к настоящему времени образовалось большое количество лекарственных препаратов и биологических активных добавок, которые в той или иной степени влияют на состояние микрофлоры и используются для восстановления нарушенного равновесия кишечной экоструктуры.
Большое разнообразие на российском рынке лекарственных средств, необходимость рационального выбора лечебных воздействий и их сочетаний убедительно свидетельствуют о необходимости некоторой систематизации и схематизации лечения дисбактериоза кишечника, не исключая при этом опыта и творческого характера в работе лечащего врача и индивидуального подхода к коррекции и профилактике дисбактериоза кишечника.
В настоящее время разработаны следующие основные принципы комбинированной коррекции микроэкологического дисбаланса кишечника:
Чрезвычайно важными элементами лечения и профилактики дисбактериоза кишечника также являются следующие моменты:
При построении тактики рационального, индивидуального лечения и профилактики дисбактериоза кишечника, особенно у детей различного возраста, у которых процессы формирования собственной экосистемы продолжаются до 10–12 летнего возраста, врачу необходимо решить следующие задачи:
Для нормализации работы кишечника используются и индивидуально подбираются средства с учетом нарушений функций толстой кишки и особенностей действия препаратов с наиболее вероятным воздействием на причину имеющегося нарушения работы кишечника (констипация, диарея) и адсорбирующих свойств, а также ферментативной недостаточности. В последнее время уделяется много внимания проблемам дисбиоза, избыточному бактериальному росту, обусловленному самыми разными факторами, — нарушение макро- и микроэкологии кишечника на фоне антибиотикотерапии, химиотерапии, пищевых отравлений и пр. В этих работах довольно подробно останавливаются и на этиопатогенетических механизмах развития дисбиоза и его последствий и на методах лечения с использованием кишечных антисептиков, антибиотиков и различных моно- или мультиштаммовых пробиотиков. К пробиотикам относятся биологические активные средства, содержащие колонии живых или лиофилизированных микроорганизмов, основная функция которых заместительная, то есть при их приеме необходимо заместить патогенную и условно-патогенную флору штаммами специально выведенных культур бифидо-, лакто- и других бактерий, сходных по своим свойствам со штаммами, обитающими в кишечнике человека. Особенно актуально звучит тема заместительной терапии именно для детей различного возраста. Как уже было сказано, кишечная микрофлора начинает формироваться с первого дня жизни ребенка и заканчивается, по данным разных авторов, к 10–12 годам. Сформированные к этому возрасту соотношения различных групп бактерий индивидуальны для каждого человека и сохраняются в его кишечнике на протяжении практически всей жизни с небольшими колебаниями, зависящими от внешних и внутренних (возрастных) факторов. И если у взрослого человека происходит, по каким-либо причинам, нарушение экосистемы, то в этом случае можно с меньшей оглядкой назначать больным людям антибиотики широкого спектра действия, с последующим курсом пробиотиков. Смысл такого лечения заключается в уничтожении с поверхности кишечника болезнетворных микроорганизмов. Конечно же, в этот период значительно страдает и симбионтная микрофлора. Однако под прикрытием пробиотиков, которые, как правило, назначаются после окончания антибиотикотерапии (а современные виды пробиотиков, имеющих устойчивые к некоторым антибиотикам штаммы, — и во время проведения антибиотикотерапии) в кишке раньше или позже, в зависимости от индивидуальных особенностей организма, поверхность слизистой оболочки кишки вновь заселят те первые «родные» штаммы симбионтов, которые заселились в организме человека при формировании биоценоза в первое десятилетие жизни макроорганизма. Отдельные их представители в любом случае выживут, даже под воздействием антибиотикотерапии, и дадут впоследствии рост новым колониям, которые под «прикрытием» пробиотических штаммов разовьются, и колонизируют всю поверхность слизистой оболочки. А штаммы пробиотиков, являющиеся проходной флорой, покинут организм. Транзиторность нахождения пробиотических микроорганизмов в кишечнике подтверждена исследованиями, которые оценивали длительность их выявления в стуле. По результатам этих работ, уже через 1–4 недели после окончания приема пробиотического средства данные штаммы не определялись в стуле (Ciorba, 2010). Другое дело обстоит с детьми, у которых собственная экосистема кишечника еще не сформировалась окончательно, хотя, конечно, основное соотношение микрофлоры уже определяется к концу первого года жизни. Назначение детям антибиотиков для санации кишечника может пагубно сказаться на дальнейшем формировании нормальной микрофлоры, и в этом случае пробиотики, пусть даже и содержащие нормальные бифидо- и лактобактерии и симбионтные энтерококки, могут создать конкуренцию «родным» штаммам кишечника. Назначение антибактериальной терапии чревато, особенно у детей, возможным быстрым развитием псевдомембранозного колита с преобладанием развития Clostridium difficile. В таком случае, по возможности, детям лучше назначать не антибиотики, а кишечные антисептики, например, нитрофуранового ряда, которые «мягче» действуют на микрофлору, подавляя рост преимущественно аэробных условно-патогенных и патогенных штаммов микроорганизмов. Но для скорейшего восстановления микроэкосферы не всегда бывает достаточно этих антисептиков, пусть даже и неагрессивных и мягко действующих. В настоящее время для детского возраста разработаны специальные наборы штаммов, вошедшие в прописи различных препаратов, которые направлены на скорейшее восстановление естественной микрофлоры ребенка. Однако и они не являются идеальным средством для стимуляции роста собственных, еще не окрепших колоний симбионтных микроорганизмов. В этом случае как раз для стимуляции роста симбионтной флоры бифидо- и лактобактерий и энтерококков и в первую очередь для стимуляции роста первичных, «естественно» заселенных штаммов рекомендуется использовать средства, являющиеся экстрактом жизнедеятельности симбионтной флоры. Т. е. по сути дела прообразом того бутирата, который является питательной средой для энтероцитов. К таким препаратам относится Хилак форте, являющийся метаболическим пробиотиком. Препарат представляет собой прозрачную светло-желтую или желто-коричневую жидкость с характерным кисловатым запахом. В состав препарата входят беззародышевые водные субстраты биосинтетических продуктов бактериального метаболизма четырех видов микроорганизмов, присутствующих в нормальной микрофлоре кишечника: Escherichia coli, Enterococcus faecalis, Lactobacillus acidophilus и Lactobacillus helveticus. Благодаря наличию в препарате естественных продуктов жизнедеятельности бактерий, аналогичных тем, которые имеются в просвете кишки при нормальной микрофлоре, он способствует поддержанию физиологических функций слизистой оболочки кишечника и его микробной экологии. Создает благоприятные условия, обеспечивающие питание ослабленных или поврежденных энтероцитов, восстанавливая тем самым цитомукопротективную способность слизистой оболочки. Ускоряет развитие нормальной кишечной микрофлоры, создавая оптимальную экологическую среду с определенным соотношением кислот. Препарат назначается детям в виде приема 20–40 капель 3 раза в день до или во время еды. Для младенцев дозировка составляет 15–30 капель 3 раза в день. Рекомендуется интермиттирующий ритм по 10–15 дней с перерывами 1–2 месяца.
Возможно, что при приеме препарата не только и не столько восстанавливается кислотность среды в тонкой кишке (так как доза приема препарата очень небольшая), но запускаются некоторые триггерные механизмы, регулирующие процесс цитомукопротекции и влияющие на микроэкологическую систему в кишечнике. Это одно из предположений, научные исследования над которым продолжаются до последнего времени. Однако налицо клиническая эффективность при приеме Хилака форте в случае развития дисбиоза у взрослых и детей различного возраста. На фоне приема этого препарата происходит скорейшее восстановление микроэкологического баланса в кишечнике и исчезают клинические проявления, сопровождающие дисбактериоз, — боли в животе, метеоризм и констипация, о чем свидетельствуют проведенные клинические исследования в разных странах.
Известно, что важную роль в положительном действии пробиотических микроорганизмов выполняют не сами бактериальные клетки, а их метаболиты (Н. И. Урсова, 2013). В этом отношении Хилак форте может быть более предпочтителен, чем лиофилизированные формы различных пробиотических препаратов, которым требуется 8–10 часов для активации и начала выработки продуктов метаболизма (С. К. Аджигайтканова, 2007). Этот вопрос приобретает особенную важность в случае диареи, которая часто сопровождает нарушения микрофлоры. Дело в том, что время нормального транзита содержимого по кишечнику как у взрослых, так и у детей позволяет лиофилизированным пробиотикам пройти активацию. Однако общекишечный транзит при диарее может быть значительно ускорен. Так, по результатам исследования у детей 3–18 месяцев с диареей время общекишечного транзита (Total gut transit time) составляло всего лишь 5 часов (Roy, 1991).
Важным вопросом является коррекция нарушений микрофлоры при приеме антибактериальной терапии. Препараты на основе метаболитов полезных бактерий, таких как Хилак форте, не содержат живых микроорганизмов. Поэтому их применение совместно с антибиотиками может быть более предпочтительным, т. к. последние никоим образом напрямую не уменьшают их эффективность.
В любом случае, для того чтобы не нарушить хрупкую микроэкологическую структуру кишечника или восстанавливать ее после каких-либо агрессивных воздействий, необходимо использовать весь арсенал средств, доступных в настоящее время в медицине в целом и в детской гастроэнтерологии в частности, сочетающий использование наряду с пробиотиками средств, способствующих скорейшей адаптации колоний симбионтных бактерий на слизистой оболочке кишечника, — продуктов естественного метаболизма микроорганизмов, к которым относится и Хилак форте.
В таблице приводятся биохимические критерии состояния микробной экологии кишечника, полученные при обследовании практически здоровых людей — доноров крови [37].
Литература
П. Л. Щербаков, доктор медицинских наук, профессор
ГБУЗ МКНЦ ДЗМ, Москва





.gif)
.gif)





_575.gif)