Чем лечить кишечную палочку в моче у женщин
Кишечная палочка — Escherichia coli (эшерихия коли). Две стороны одной медали
Кишечная палочка (Escherichia coli, E. coli, эшерихия коли)
Наряду с большим количеством полезных для организма сероваров Escherichia coli существует около полутора сотен патогенных, которые могут вызывать заболевания. Мы говорим, что они «могут вызывать», поскольку их вредное влияние нейтрализуется иммунной системой и микрофлорой, если эти патогенные эшерихии находятся в кишечнике в небольших количествах. Человек может быть носителем патогенных эшерихий и даже не подозревать об этом, «награждая» инфекцией окружающих. Поэтому у нас принято перед приемом на работу и после приема, с определенной периодичностью, проверять работников отдельных коммунальных сфер на патогенные энтеробактерии, в том числе и на кишечную палочку. Делается это в целях профилактики вспышек эшерихиозов.
Патогенные E. coli подразделяют на 4 группы: энтеропатогенные (английское сокращение –EPEC), энетротоксигенные (ETEC), энтероинвазивные (EIEC) и энтерогеморрагические (EHECилиVTEC).
Энтеротоксигенные эшерихии колонизируют тонкий кишечник и вызывают холероподобные заболевания. Носительство после выздоровления не формируется. Чаще всего встречаются в Индии. У нас – в южных регионах. Источники заражения – пища и вода. Пик заболеваемости приходится на детей от года до трех лет. Заражающая доза – 10 8 — 10 9 бактерий, или иначе — колониеобразующих единиц (КОЕ), в 1г кала.

Энтероинвазивные Escherichia coli, такие как О136, О159, О167, О28, О29, О112, О124 : Н30, О124 : Н32, имеют такой же фактор патогенности как у шигелл — бактерий, вызывающих дизентерию. Поэтому симптоматика заболевания напоминает дизентерию. У больного наблюдается непродолжительная водянистая диарея, которая к концу первых суток заканчивается «дизентерийным плевком» — комком слизи. В отличие от предыдущей группы, заболевание, вызванное энтероинвазивными E. coli характеризуется очень высокой температурой и продолжительностью (острый период – до двух недель). Встречаются EIEC повсеместно, заражение происходит также в основном через пищу и воду. Колонизируют толстый кишечник. Чаще всего болеют дети до 2-ух лет. Заражающая доза – 10 5 КОЕ в 1г кала.
Энтеропатогенные эшерихии вызывают инфекции, по симптоматике заболевания сходные с сальмонеллезом. Заражающая концентрация – от 10 5 до 10 10 КОЕ/г. Дети чаще всего получают внутрибольничные штаммы EPEC, либо заражаются контактно-бытовым путем (полотенца, постельное белье). Взрослые приобретают энтеропатогенных эшерихий через продукты. В Соединенных Штатах Америки энтеропатогенные E. Coli стоят на первом месте среди кишечных заболеваний детей. Симптомы: водянистая диарея, тошнота, рвота. Заболевание длительное – до 15 дней. Может формироваться носительство после выздоровления.
Самая опасная, но, к счастью, наиболее редкая группа – энтерогеморрагические или веротоксические эшерихии. К ним относится пока одна серогруппа – О157:Н7. Открыты они были впервые в 80-ых годах и первая вспышка произошла в США (в доме престарелых, через плохо прожаренные гамбургеры). Потом – в Японии. Причем в одном офисном здании заболели практически 1000 человек (ели каракатиц, которые были выловлены в прибрежной зоне). На 30 лет человечество забыло об этом кошмаре, но в 2011 году Европу всколыхнула весть об эпидемии энтерогеморрагической Escherichia coli. Ходят слухи, что происхождение EHEC имеет искусственный характер (бакоружие или неудачные опыты по генной модификации), но это – всего лишь предположение. Фактор патогенности – шигеллоподобный токсин, который превосходит по токсичности шигеллезный в сотни раз. «Ареал обитания» — толстый кишечник. Клиническая картина при заболевании следующая: боли в животе, холероподобная диарея, которая в течение нескольких часов переходит в кровавый понос. Если нет острой почечной недостаточности, в комплексе с низким содержанием тромбоцитов и анемией (все это называется гемолитико-уремическим синдромом, или ГУС), то в течение одной — двух недель больного лечат детоксическими препаратами. Лечение антибиотиками категорически не рекомендуется!
Профилактика всех эшерихиозов: соблюдение гигиенических норм, таких как мытье рук, овощей и фруктов, причем желательно их термически обрабатывать (хотя бы ошпаривать); не есть из одной посуды с несколькими людьми; иметь личные предметы гигиены. Желательно также периодически принимать пробиотики (с предварительной консультацией у врача-гастроэнтеролога) для укрепления защитных сил организма.
Рецидивирующий цистит
Рецидивирующий цистит — это цистит, который возникает не менее 3 раз в год или не менее 2 раз в течение полугода.
Самым частым возбудителем рецидивирующего цистита, как и острого цистита, является кишечная палочка E.coli. Причем, если высеяна кишечная палочка, вероятность развития повторного эпизода заболевания в течение последующих 6 месяцев намного выше, чем при цистите, возбудителем которого является другая бактерия.
Механизм развития рецидивирующего цистита аналогичен развитию спорадической инфекции, то есть единичных эпизодов острого цистита.
Предрасполагающие факторы
Современные данные показывают, что предрасполагающим фактором к колонизации E.coli во влагалище является нарушение его нормальной флоры и уменьшение количества H2O2-продуцирующих лактобацилл.
Также возможную роль в развитии рецидивирующих циститов играет генетическая предрасположенность к колонизации влагалища такими уропатогенами, как кишечная палочка.
Причины
Основную роль в возникновении рецидивирующего цистита играют поведенческие факторы:
Вероятному развитию рецидивирующего цистита подвержены:
Возможные причины рецидивирующего цистита:
Диагностика
Диагноз подтверждается бактериологическим исследованием мочи и выявлением в анализе патогенных возбудителей.
УЗИ и цистоскопия для постановки диагноза не используются, поскольку обладают низкой диагностической ценностью. Однако эти исследования желательно проводить при атипичных симптомах и проявлениях цистита, наличии повторяющихся эпизодов гематурии (примеси крови в моче) — с целью исключения других патологий мочевого пузыря, таких как опухоль и камни мочевого пузыря.
Лечение рецидивирующего цистита и профилактические меры
Лечение и профилактика рецидивирующих инфекций мочевыделительной системы основываются на возможном устранении негативных факторов, которые являются причинами рецидивов заболеваний, а также включают изменение образа жизни, адекватную антибактериальную терапию и антибактериальную профилактику.
К понятию «изменение образа жизни» относятся:
У женщин постменопаузального возраста эффективно применение местной заместительной терапии эстрогенами. Использование свечей с эстрогенами позволяет восстановить количество лактобактерий во влагалище, что способствует ликвидации роста патогенов. Поскольку частой причиной рецидивов у данной категории женщин является наличие пролапса гениталий (опущение или выпадение органов малого таза через влагалище), необходима коррекция пролапса — консервативная или оперативная.
Доказана эффективность профилактики иммуноактивными препаратами (Уро-Ваксом, StroVac). Уро-Ваксом является зарегистрированным в России лекарством. Активное действующие вещество — лиофилизированный лизат бактерий Escherichiacoli. Препарат используется при рецидивирующих циститах, может назначаться совместно с антибактериальными препаратами, имеет небольшое количество побочных эффектов. Курсовой прием — до 3 месяцев.
Возможно применение антибиотикопрофилактики, различающейся по схемам приема: непрерывной и посткоитальной. Обе схемы доказали свою эффективность в лечении рецидивирующего цистита. Многочисленные исследования показали, что непрерывная профилактика уменьшает рецидивы до 95% по сравнению с плацебо. В качестве препарата для профилактики возможно использование Фосфомицина, Нитрофурантоина, Ципрофлоксацина.
Посткоитальная профилактика может быть методом выбора у пациенток с обострениями, четко связанными с половым актом. Это также относится и к женщинам, желающим предотвратить эпизоды цистита во время беременности. Однако в этом случае выбор лекарственных препаратов ограничен, возможен прием Нитрофурантоина и антибиотика цефалоспоринового ряда.
В последнее время популярность набирает D-манноза — натуральный вид сахара, представляющий собой соединение, имитирующее рецепторы стенки мочевого пузыря. Она может конкурентно связываться с бактериями и уменьшать количество бактерий, прикрепляющихся к слизистой оболочке мочевого пузыря. Таким образом снижается вероятность развития цистита. Однако существующие данные, касающиеся эффективности препарата, пока недостаточно убедительны и малочисленны. Также не очень понятно, какие именно дозы D-маннозы эффективны, как и в каком количестве они должны использоваться. В ряде исследований показано, что D-манноза в ежедневной дозе 2 г превосходит плацебо и сопоставима по действию с 50 мг Нитрофурантоина (Фурамага). Выпускается в виде БАДа, в России официально не производится. Может служить альтернативой для пациенток с посткоитальным циститом наряду с посткоитальной антибактериальной профилактикой.
В случае неэффективности консервативного лечения и выявления четкой связи симптомов цистита с половой активностью возможно выполнение оперативного лечения — хирургической коррекции анатомического расположения наружного отверстия уретры (транспозиция дистального отверстия уретры). Суть операции — в выделении конечного отдела уретры и его перемещении выше входа во влагалище.
Внутрипузырные инстилляции гиалуроновой кислоты (Уро-гиал, Уролайф) используются для восстановления защитного гликозаминогликанового слоя и эффективны при лечении интерстициального, постлучевого цистита, а также могут быть использованы для лечения и профилактики рецидивирующего цистита. Существуют методики подслизистого введения гиалуроновой кислоты в уретру и мочевой пузырь, эффективность которых еще изучается.
Как происходит лечение рецидивирующего цистита в клинике Рассвет?
Лечение рецидивирующего цистита в Рассвете проводится в соответствии с рекомендациями ведущих зарубежных урологических ассоциаций и медицинских сообществ. Для диагностики урологических заболеваний наши специалисты используют цифровую урографию последнего поколения, компьютерную урофлоуметрию, УЗИ экспертного уровня. Урологи Рассвета придерживаются принципов доказательной медицины, не назначают ненужных обследований и неэффективных препаратов, проводят развернутые консультации, направленные на профилактику заболеваний мочеполовой системы.
Эшерихиозы
Эшерихиозы ( ЮEscherichioses ) — коли-инфекция, коли-энтерит, диарея путешественников — группа бактериальных антропонозных инфекционных болезней, вызываемых патогенными (диареегенными) штаммами кишечных палочек, протекающих с симптомами общей интоксика
Эшерихиозы (ЮEscherichioses) — коли-инфекция, коли-энтерит, диарея путешественников — группа бактериальных антропонозных инфекционных болезней, вызываемых патогенными (диареегенными) штаммами кишечных палочек, протекающих с симптомами общей интоксикации и поражением желудочно-кишечного тракта (ЖКТ) с развитием гастроэнтерита или энтероколита, в редких случаях — как генерализованная форма болезни с внекишечными проявлениями.
Согласно Международной классификации болезней 10-го пересмотра (МКБ-10, 1997) регистрация эшерихиозов проводится под шифрами:
А04,0 — энтеропатогенный эшерихиоз;
А04,1 — энтеротоксигенный эшерихиоз;
А04,2 — энтероинвазивный эшерихиоз;
А04,3 — энтерогеморрагический эшерихиоз;
А04,4 — эшерихиоз других патогенных серогрупп.
История и распространение. Возбудитель открыт немецким педиатром T. Эшерихом в 1886 г. Он выделил его из кишечника детей и определил как Bacterium coli commune, предположив, что она может быть причиной поносов у детей. В его честь микроб назван Еscherichia coli.
Эшерихии — постоянные обитатели кишечника человека, но некоторые из них могут вызывать поражения ЖКТ, что доказано экспериментально Г. Н. Габричевским в 1894 г. и подтверждено клинически в 1922 г. А. Адамом. Различие по антигенной структуре патогенных и непатогенных кишечных палочек, выявленное Ф. Кауфманном в 1942–1945 гг., легло в основу классификации патогенных эшерихий. По рекомендации ВОЗ эшерихии, вызывающие поражение ЖКТ, называются диареегенными.
Эшерихиоз — повсеместно распространенное заболевание, чаще диагностируемое у детей до 1 года; у взрослых оно регистрируется как диарея путешественников. Групповые вспышки зарегистрированы в последние годы в Канаде, США, Японии, России и других странах. Показатель заболеваемости эшерихиозом остается высоким в Калининграде, Санкт-Петербурге, Ненецком автономном округе. Так, в Калининграде с 1999 по 2002 г. зарегистрировано более 1000 случаев заболевания на 100 тыс. населения. В Москве выявлено около 1000 случаев заболевания эшерихиозом на 100 тыс. населения за последние 10 лет; летальных исходов нет.
Этиология. Эшерихии — подвижные грамотрицательные палочки, аэробы, относящиеся к виду Еscherichia (Е.) coli, роду Escherichia, семейству Enterobacteriaceae. Растут на обычных питательных средах, выделяют бактерицидные вещества — колицины. Серовары не имеют морфологических отличий. Эшерихии содержат соматические антигены (О-Аг) 173 серотипов, капсульные (К-Аг) — 80 сероваров и жгутиковые (Н-Аг) — 56 серотипов. Диареегенные кишечные палочки подразделяются на пять типов: энтеротоксигенные (ЭТКП, ETEC), энтеропатогенные (ЭПКП, EPEC), энтероинвазивные (ЭИКП, EIEC), энтерогеморрагические (ЭГКП, EHEC), энтероадгезивные (ЭАКП, EAEC).
Фактор патогенности ЭТКП — пили (разновидность ворсинок), или фимбриальные факторы, которые определяют способность к адгезии и колонизации нижних отделов тонкого кишечника, а также к токсинообразованию. Термолабильный и термостабильный энтеротоксины ответственны за повышенную экскрецию жидкости в просвет кишки. ЭИКП, имеющие плазмиды, способны проникать в клетки кишечного эпителия и размножаться в них. Патогенность ЭПКП обусловлена способностью к адгезии. ЭГКП выделяют цитотоксин, шигоподобные токсины 1-го и 2-го типов, содержат плазмиды, которые облегчают адгезию к энтероцитам. Факторы патогенности энтероадгезивных кишечных палочек изучены недостаточно.
Эшерихии устойчивы в окружающей среде, могут месяцами сохраняться в воде, почве, испражнениях. Сохраняют жизнеспособность в молоке до 34 дней, в детских питательных смесях — до 92 дней, на игрушках — до 3–5 мес. Хорошо переносят высушивание, обладают способностью размножаться в пищевых продуктах, особенно в молоке. Быстро погибают при воздействии дезинфицирующих средств и при кипячении. У многих штаммов Е. соli отмечается резистентность к ряду антибиотиков (неомицин, ампициллин, цефалотин и др.). Устойчивость к антибиотикам выявлена у 13–35,1% штаммов патогенных эшерихий.
Эпидемиология. Основной источник эшерихиозов — больные со стертыми формами заболевания; меньшую роль играют реконвалесценты и носители. Значимость последних возрастает, если они работают на предприятиях по приготовлению и реализации пищевых продуктов. Однако, по мнению W. Robson et al. (1993), B. Bell et al. (1994), источник инфекции при энтерогеморрагических эшерихиозах (О157) — крупный рогатый скот. Инфицирование людей происходит при употреблении продуктов, которые были недостаточно термически обработаны. Зарегистрированы групповые вспышки заболеваний эшерихиозом О157 в США, Канаде, Японии — странах, где распространено употребление в пищу гамбургеров. Это и дало основание данным исследователям рассматривать эшерихиоз О157 как антропозоонозное заболевание. Механизм передачи — фекально-оральный, который реализуется пищевым путем, реже — водным и бытовым. По данным ВОЗ, пищевой путь характерен для энтеротоксигенных и энтероинвазивных эшерихий, бытовой — для энтеропатогенных.
Из пищевых продуктов фактором передачи чаще являются молочные изделия, готовые мясные продукты, напитки (квас, компот и др.).
В детских коллективах распространение инфекции может происходить через игрушки, загрязненные предметы обихода, через руки больных матерей и персонала. Реже регистрируется водный путь передачи эшерихиозов. Наиболее опасно загрязнение открытых водоемов, которое происходит в результате сброса необезвреженных хозяйственно-бытовых сточных вод, особенно из детских учреждений и инфекционных больниц.
Восприимчивость к эшерихиозам высокая, особенно среди новорожденных и ослабленных детей. Около 35% детей, которые общались с источником инфекции, становятся носителями. У взрослых восприимчивость повышается в связи с переездом в другую климатическую зону, изменением характера питания и т. д. (диарея путешественников).
Эпидемический процесс, вызванный разными возбудителями Е. соli, может различаться. Заболевания, вызванные эшерихиями ЕТЕС, чаще регистрируются в развивающихся странах тропических и субтропических зон в виде спорадических случаев, а групповые случаи — среди детей 1–3 лет. Эшерихиозы, вызванные ЕIЕС, хотя и регистрируются во всех климатических зонах, преобладают в развивающихся странах. Заболевания носят групповой характер среди детей 1–2 лет в летне-осенний период. ЕРЕС вызывает спорадическую заболеваемость во всех климатических зонах, чаще всего среди детей до 1 года, которые находились на искусственном вскармливании. Эшерихиозы, вызванные ЕНЕС и ЕАЕС, выявлены в странах Северной Америки и Европы среди взрослых и детей старше 1 года; для них характерна летне-осенняя сезонность. Вспышки среди взрослых чаще регистрировались в домах для престарелых.
Патоморфологические данные определяются локализацией патологического процесса и малохарактерны.
Патогенез. Эшерихии проникают через рот, минуя желудочный барьер, и, в зависимости от типовой принадлежности, оказывают свое патогенное действие.
Энтеротоксигенные штаммы способны к выработке энтеротоксинов и фактора колонизации, с помощью которого осуществляется прикрепление и колонизация тонкой кишки.
Энтеротоксины — это термолабильные или термостабильные вещества, воздействующие на биохимические функции эпителия крипт, не вызывая видимых морфологических изменений. Энтеротоксины усиливают активность аденилатциклазы и гуанилатциклазы. При их участии и под стимулирующим влиянием простагландинов увеличивается образование циклического аденозинмонофосфата. В результате в просвет кишки секретируется большое количество воды и электролитов, которые не успевают реабсорбироваться в толстой кишке, и развивается диарея с последующими нарушениями водно-электролитного баланса.
Заражающая доза ЭТКП составляет 108–1010 микробных клеток.
ЭИКП обладают способностью внедряться в клетки эпителия толстой кишки. Проникновение ЭИКП в слизистую оболочку приводит к развитию воспалительной реакции и образованию эрозий кишечной стенки. Повреждение эпителия способствует увеличению всасывания в кровь эндотоксинов. У больных в испражнениях появляются слизь, кровь и полиморфноядерные лейкоциты. Заражающая доза ЭИКП — 5х105 микробных клеток.
Механизм патогенности ЭПКП малоизучен. У штаммов 055, 086, 0111 и др. выявлен фактор адгезии к клеткам Нер-2, за счет которого обеспечивается колонизация тонкого кишечника. У других штаммов (018, 044, 0112 и др.) этот фактор не обнаружен. Видимо, они имеют иные факторы патогенности, которые пока неизвестны. Заражающая доза ЭПКП — 10х1010 микробных клеток.
ЭГКП выделяют цитотоксин SLT (Shiga-like toxin), который вызывает разрушение клеток эндотелия мелких кровеносных сосудов кишечной стенки проксимальных отделов толстой кишки. Сгустки крови и фибрин приводят к нарушению кровоснабжения кишки, появлению в кале крови. Происходит развитие ишемии кишечной стенки вплоть до некроза. У некоторых больных наблюдаются осложнения с развитием синдрома диссеменированного сосудистого свертывания, инфекционного токсического шока и острой почечной недостаточности (ОПН).
ЭАКП способны к колонизации эпителия тонкой кишки. Вызванные ими заболевания взрослых и детей протекают длительно, но легко. Это связано с тем, что бактерии прочно закрепляются на поверхности эпителиальных клеток.
После перенесенного заболевания формируется кратковременный непрочный типоспецифический иммунитет.
Клиника. Клинические проявления эшерихиозов зависят от типа возбудителя, возраста больного, иммунного статуса.
Принята следующая клиническая классификация эшерихиозов (Н. Д. Ющук, Ю. Я. Венгеров, 1999).
По этиологическим признакам:
По форме заболевания:
По тяжести течения:
При эшерихиозе, вызванном энтеротоксигенными штаммами, инкубационный период продолжается от 16 до 72 ч. Характерно холероподобное течение болезни, протекающее с поражением тонкой кишки без выраженного синдрома интоксикации (диарея путешественников).
Заболевание начинается остро; больных беспокоят слабость, головокружение, температура нормальная или субфебрильная. Появляются тошнота, повторная рвота, разлитые боли в животе схваткообразного характера, стул частый (до 10–15 раз в сутки), жидкий, обильный, водянистый, нередко напоминающий рисовый отвар. Живот вздут, при пальпации определяется урчание, небольшая разлитая болезненность.
Заболевание может иметь как легкое, так и тяжелое течение. Тяжесть течения определяется степенью дегидратации. Возможна молниеносная форма заболевания с быстрым развитием эксикоза. Длительность болезни — 5–10 дней.
Энтероинвазивные эшерихии вызывают дизентериеподобное заболевание, которое протекает с симптомами общей интоксикации и преимущественным поражением толстой кишки. Инкубационный период длится 6–48 ч. Начало острое, характеризуется повышением температуры до 38–39 °С, ознобом, слабостью, головной болью, болью в мышцах, снижением аппетита. У части больных температура нормальная или субфебрильная. Через несколько часов присоединяются симптомы поражения ЖКТ (боли схваткообразного характера, преимущественно в нижней части живота, ложные позывы на дефекацию, тенезмы, жидкий стул — обычно калового характера с примесью слизи и крови до 10 и более раз в сутки. При более тяжелом течении заболевания — стул в виде «ректального плевка». Сигмовидная кишка — спазмированная, уплотненная и болезненная. Печень и селезенка не увеличены. При ректороманоскопии — катаральный, реже — катарально-геморрагический или катарально-эрозивный проктосигмоидит.
Течение болезни доброкачественное. Лихорадка длится 1–2, реже — 3–4 дня; длительность заболевания — 5–7 дней. Через 1–2 дня стул нормализуется, спазм и болезненность толстой кишки сохраняются в течение 5–7 дней болезни. Восстановление слизистой оболочки толстой кишки наступает к 7–10-му дню болезни.
У детей энтеропатогенный эшерихиоз, вызываемый Е. соli 1-го класса, протекает в виде различной тяжести энтеритов, энтероколитов, а у новорожденных и недоношенных детей — в септической форме. Для кишечной формы у детей характерно острое начало болезни, температура — 38–39 °С, слабость, рвота, водянистая диарея, стул желтого или оранжевого цвета. Быстро развивается токсикоз и эксикоз, масса тела снижается. Септическая форма заболевания протекает с выраженными симптомами интоксикации (повышение температуры, анорексия, срыгивание, рвота). Возникают множественные гнойные очаги.
Энтеропатогенный эшерихиоз, вызываемый Е. соli 2-го класса, регистрируется у взрослых и детей. Инкубационный период — 1–5 дней. Характерно острое начало заболевания (температура — 38–38,5 °С, озноб, нечастая рвота, боли в животе, стул без патологических примесей, жидкий, до 5–8 раз в сутки), течение доброкачественное. У некоторых больных отмечаются гипотония, тахикардия.
При эшерихиозе, вызванном энтерогеморрагическими штаммами, заболевание характеризуется синдромом общей интоксикации и поражением проксимального отдела толстой кишки. Инкубационый период составляет 1–7 дней. Заболевание начинается остро с болей в животе, тошноты, рвоты. Температура субфебрильная или нормальная, стул жидкий, до 4–5 раз в день, без примеси крови. Состояние больных ухудшается на 2–4-й день болезни, когда стул учащается, появляются примесь крови, тенезмы. При эндоскопическом исследовании выявляется катарально-геморрагический или фибринозно-язвенный колит. Более выраженные патоморфологические изменения обнаруживаются в слепой кишке. Наиболее тяжело протекает заболевание, вызванное штаммом 0157.Н 7. У 3–5% больных через 6–8 дней от начала заболевания развивается гемолитико-уремический синдром (синдром Гассера), который проявляется гемолитической анемией, тромбоцитопенией и развитием ОПН и токсической энцефалопатии (судороги, парезы, сопор, кома). Летальность в этих случаях может составлять 3–7%. Синдром Гассера чаще регистрируется у детей до 5 лет.
Особенности эшерихиоза, вызванные энтероадгезивными штаммами, изучены мало. Заболевание регистрируется у пациентов с ослабленной иммунной системой. Чаще выявляются внекишечные формы — поражение мочевыводящих (пиелонефрит, цистит) и желчевыводящих (холецистит, холангит) путей. Возможны септические формы (коли-сепсис, менингит).
Чаще эшерихиозы протекают доброкачественно, но возможны осложнения — такие как инфекционный токсический шок, гиповолемический шок с дегидратацией 3–4-й степени, ОПН, сепсис, пневмония, пиелоцистит, пиелонефрит, холецистит, холангит, менингит, менингоэнцефалит.
Диагностика. Клиническая картина эшерихиозов сходна с другими кишечными инфекциями, поэтому основу подтверждения диагноза составляют бактериологические методы исследования. Материал (испражнения, рвотные массы, промывные воды желудка, кровь, мочу, ликвор, желчь) следует брать в первые дни болезни до назначения больным этиотропной терапии. Посевы производят на среды Эндо, Левина, Плоскирева, а также на среду обогащения Мюллера.
Применяются серологические методы исследования — реакция агглютинации, реакция непрямой гемагглютинации — в парных сыворотках, но они неубедительны, так как возможны ложно-положительные результаты из-за антигенного сходства с другими энтеробактериями, и используются для ретроспективной диагностики, особенно во время вспышки.
Перспективным методом диагностики является полимеразная цепная реакция (ПЦР). Инструментальные методы обследования (ректороманоскопия, колоноскопия) при эшерихиозах малоинформативны.
Дифференциальный диагноз эшерихиозов проводят с другими острыми диарейными инфекциями: холерой, шигеллезом, сальмонеллезом, кампилобактериозом, пищевыми токсикоинфекциями стафилококковой этиологии и вирусными диареями: ротавирусной, энтеровирусной, Норволк-вирусной инфекцией и др.
В отличие от эшерихиозов, холера характеризуется отсутствием интоксикации, лихорадки, болевого синдрома, наличием многократной рвоты, быстрым развитием дегидратации 3–4-й степени. Помогает в постановке диагноза эпидемиологический анамнез — пребывание в эндемичных регионах холеры.
Шигеллезу, в отличие от эшерихиозов, свойственна высокая лихорадка; боли локализуются в левой подвздошной области; пальпируется спазмированная, болезненная сигмовидная кишка; стул скудный, в виде «ректального плевка».
Сальмонеллез, в отличие от эшерихиозов, характеризуется более выраженной интоксикацией, разлитыми болями в животе, болезненностью при пальпации в эпигастральной и околопупочной областях, урчанием. Характерен зловонный стул зеленоватого цвета.
При проведении дифференциальной диагностики эшерихиозов с кампилобактериозом также выявляются определенные различия. Для кампилобактериоза более характерно начало заболевания с продромального периода (артралгий, слабости, озноба). Боли в животе, диарея присоединяются на 2–3-й день болезни. Боль в животе локализуется чаще в левой подвздошной области. Возможны сыпь, увеличение печени. Заражение чаще всего происходит при употреблении в пищу инфицированного мяса (свинины, говядины, мяса птиц).
Для пищевых токсикоинфекций стафилококковой этиологии, в отличие от эшерихиозов, характерно острое, бурное начало заболевания, короткий инкубационный период (30–60 мин). Более выражены симптомы интоксикации — рвота неукротимая, боли в животе режущего характера с локализацией в эпигастральной и околопупочной областях. Характерен групповой характер заболевания, связь заболевания с пищевым фактором, быстрый регресс болезни.
Для ротавирусного гастроэнтерита, в отличие от эшерихиозов, характерны катаральные явления, изменения слизистой ротоглотки (гиперемия, зернистость), слабость, адинамия. Боли в животе диффузные, стул жидкий, «пенистый», с резким кислым запахом, позывы на дефекацию носят императивный характер. При пальпации отмечается «крупнокалиберное» урчание в области слепой (реже — сигмовидной) кишки.
При проведении дифференциального диагноза эшерихиозов с энтеровирусной инфекцией также можно выявить определенные отличия. Для энтеровирусной инфекции характерны катаральные явления, субфебрильная температура (до недели), многократная мучительная рвота, продолжительность диареи до 2 нед, увеличение печени и селезенки.
Для Норволк-вирусной инфекции, в отличие от эшерихиозов, характерны короткий инкубационный период от 10 ч до 2 сут, ломота в мышцах, головокружение, боли в эпигастральной и околопупочной областях. Продолжительность заболевания короткая — от нескольких часов до 3 сут.
Лечение. Госпитализация больных с эшерихиозами проводится по клиническим и эпидемиологическим показаниям. Больные при среднетяжелом и тяжелом течении заболевания госпитализируются в инфекционные больницы. В легких случаях заболевания больные могут лечиться амбулаторно при наличии благоприятных бытовых санитарно-гигиенических условий.
По эпидемиологическим показаниям госпитализации подлежат лица из декретированных групп, больные из организованных коллективов, а также пациенты, проживающие в коммунальных квартирах, общежитиях.
Госпитализируются больные, если в семье есть лица, относящиеся к декретированным группам.
В остром периоде болезни больным рекомендуется щадящая диета (стол № 4, при нормализации стула — № 2, в период реконвалесценции — стол № 13).
В легких случаях заболевания достаточно назначения пероральной регидратационной терапии (Глюкосалан, Цитроглюкосалан, Регидрон и др.), количество которых должно в 1,5 раза превышать потери воды с испражнениями.
Показаны ферменты (Панзинорм форте, Фестал, Мезим форте, Креон), энтеросорбенты (Энтеросгель, Энтеродез, Полифепан, Полисорб — в течение 1–3 дней). При легком течении болезни целесообразно использование кишечных антисептиков (Интетрикс по 2 капсулы 3 раза в день, Неоинтестопан после каждого акта дефекации по 2 таблетки — до 14 в сутки, Энтерол по 2 капсулы 2 раза в день) в течение 5–7 дней. Легкие и стертые формы эшерихиозов не требуют назначения этиотропных препаратов.
При лечении больных в условиях стационара показан постельный режим в первые 2–3 дня. Назначается этиотропная терапия. С этой целью при среднетяжелых формах используется один из следующих препаратов: ко-тримоксазол (Бактрим, Бисептол, Септрин) по 2 таблетки 2 раза в день. Из препаратов фторхинолонового ряда назначается ципрофлоксацин — Ципролет — фторхинолон для широкого клинического применения, сочетающий мощное бактерицидное действие, широкий антимикробный спектр и благоприятную фармакокинетику. Механизм действия препарата, связанный с ингибированием ДНК-гиразы и топоизомеразы, обусловливает отсутствие перекрестной резистентности. Максимальные концентрации ципрофлоксацина (Ципролета) в плазме крови достигаются через 60–90 мин. Для препарата характерно быстрое начало действия. Биодоступность препарата более 63–77% и высокий показатель проникновения в ткани, жидкости и клетки обеспечивают его эффективность при назначении в небольших дозировках. Препарат отличается хорошим профилем безопасности и положительной динамикой, проявляющейся в короткие сроки. Также рекомендуются Ципробай, Ципросол по 500 мг 2 раза в сутки перорально, пефлоксацин (Абактал) по 400 мг 2 раза в сутки, офлоксацин (Таривид) по 200 мг 2 раза в сутки, длительность терапии — 5–7 дней.
В тяжелых случаях фторхинолоны применяются вместе с цефалоспоринами II поколения (цефуроксим 750 мг 4 раза в сутки внутривенно или внутримышечно; цефаклор 750 мг 3 раза в сутки внутримышечно; цефтриаксон 1 г 1 раз в сутки внутривенно) и III поколения (цефоперазон 1 г 2 раза в сутки внутривенно или внутримышечно; цефтазидим 2 г 2 раза в сутки внутривенно или внутримышечно).
При дегидратации 2–3-й степени назначают регидратационную терапию внутривенно кристаллоидными растворами (Хлосоль, Ацесоль, Лактосоль, Квартасоль).
Объем регидратационной терапии определяется на основании учета степени обезвоживания и массы тела больного. Лечение проводят в два этапа: ликвидация имеющегося обезвоживания и коррекция продолжающихся потерь жидкости.
Скорость введения полиионных растворов составляет от 60 до 80 мл/мин в зависимости от степени дегидратации. При выраженных симптомах интоксикации используются коллоидные растворы (Гемодез, Реополиглюкин и др.) в объеме 400–800 мл в сутки.
Особое внимание должно быть уделено терапии больных эшерихиозом 0157, так как у них возможно появление тяжелых осложнений.
После приема антибактериальных препаратов при продолжающейся диарее используют эубиотики для коррекции дисбактериозов (Бифиформ, Бифистим, Бифидумбактерин форте, Аципол, Хилак форте, Пробифор и др.) в течение 7–10 дней.
Выписка реконвалесцентов проводится после полного клинического выздоровления при отрицательных результатах бактериологического исследования. Для больных из декретированных групп необходимо наличие двукратного отрицательного бактериологического исследования кала, проведенного через 2 дня после окончания этиотропной терапии.
После выписки из стационара больные находятся на диспансерном наблюдении в кабинете инфекционных заболеваний поликлиник в течение 1 мес. В конце срока наблюдения проводят двукратное бактериологическое исследование кала с интервалом в 2–3 дня (лицам, относящимся к декретированным группам).
Коли-инфекция у взрослых протекает благоприятно, перехода в хронические формы не наблюдается.
Профилактические мероприятия. Основу профилактики эшерихиозов составляют меры по пресечению путей передачи возбудителя. Особенно важно соблюдение санитарно-гигиенических требований на объектах общественного питания, водоснабжения, предупреждение контактно-бытового пути заражения в детских учреждениях, родильных домах, стационарах (использование индивидуальных стерильных пеленок, обработка рук дезинфицирующими растворами после работы с каждым ребенком, дезинфекция посуды, пастеризация, кипячение молока, молочных смесей). Готовые к употреблению и сырые продукты должны разделываться на разных разделочных досках разными ножами. Посуду, в которой транспортируют пищу, необходимо обработать кипятком.
При подозрении на эшерихиоз необходимо обследовать беременных до родов, рожениц, родильниц и новорожденных. Специфической профилактики эшерихиозов нет.
Мероприятия в очаге. Контактировавших с больными в очаге заболевания наблюдают в течение 7 дней. Дети, контактировавшие с больным эшерихиозом по месту жительства, допускаются в детские учреждения после разобщения с больным и трехкратных отрицательных результатов бактериологического исследования кала.
При выявлении больных эшерихиозом в детских учреждениях и родильных домах прекращается прием поступающих детей и рожениц. Персонал, матери, дети, бывшие в контакте с больным, а также дети, выписанные домой незадолго до заболевания, обследуются трехкратно (проводится бактериологическое исследование кала). При выявлении лиц с положительными результатами обследования их изолируют.
Литература
Г. К. Аликеева, кандидат медицинских наук
Н. Д. Ющук, доктор медицинских наук, профессор, академик РАМН
Г. М. Кожевникова, профессор
МГМСУ, Москва
Кишечная палочка
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli).
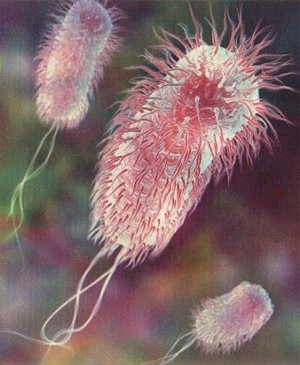
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli).
Актуальность обсуждения данного микроорганизма состоит в том, что кишечная палочка – это чемпион по созданию проблем как для пациентов, так и для медицинского персонала стационаров и в амбулаторной службе. Хуже нее только клебсиелла, но о ней поговорим попозже. При этом E.coli не летает по воздуху и не имеет ножек для самостоятельного перемещения и инфицирование ею – это почти всегда «болезнь грязных рук». С патологией, вызванной этим возбудителем, пациент может прийти к любому врачу, а медицинский персонал может принести уже на своих руках кишечную палочку любому пациенту с одной лишь разницей – это будет не дикий и симпатичный зверек, убиваемый обычным амоксицилином, а вооруженная до зубов особь, умеющая очень эффективно убивать сама. То есть это один из тех врагов, которых совершенно точно надо знать в лицо.
Микробиологические аспекты
E.coli относится к типичным представителям семейства Enterobacteriaceae, являясь грамотрицательной бактерией, факультативным анаэробом в составе нормальной кишечной микрофлоры человека. Но тут же становится патогеном, выбравшись из среды нормального обитания, хотя отдельные штаммы являются патогенными и для желудочно-кишечного тракта. То есть кишечная палочка относится к кишечным комменсалам, кишечным патогенам и внекишечным патогенам, каждый из которых мы кратко разберем.
К штаммам E.coli, действующим как кишечные патогены и встречающимся чаще других, относятся:
Затем тот же штамм обнаружился при вспышке ПТИ в Финляндии, но к тому времени пациентов с диареями до появления микробиологических результатов перестали лечить бактерицидными антибиотиками и ситуация была купирована в зародыше.
И третий громкий (для нашей страны) случай – это массовое заболевание питерских школьников в Грузии, где так же был выявлен этот штамм (пресс-релиз Роспотребнадзора по данному случаю лежит здесь).
Когда кишечная палочка выступает внекишечным патогенном? Почти всегда, когда обнаруживается вне места своего нормального обитания.
Этот факт объясняется близким анатомическим расположением двух систем и огрехами в личной гигиене, что позволяет на этапе эмпирической терапии вышеперечисленных заболеваний сразу же назначать препараты, активные в отношении кишечной палочки.
(часть вторая) Практические вопросы диагностики и лечения.
Когда мы можем заподозрить, что перед нами пациент с инфекцией, вызванной кишечной палочкой?
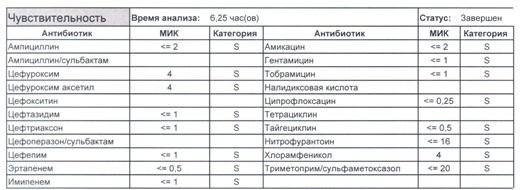
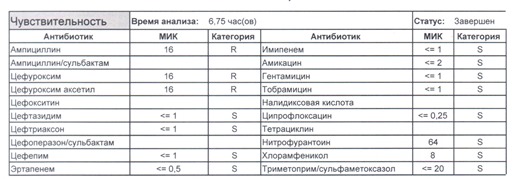
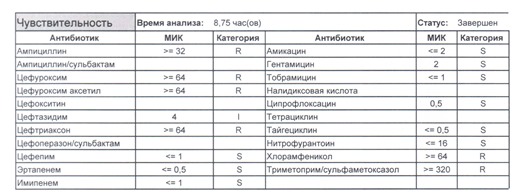
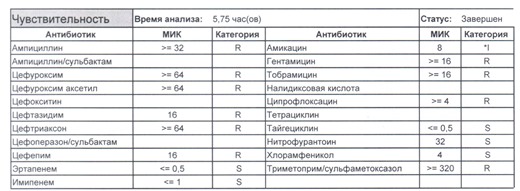
Подтвердить или полностью исключить кишечную палочку из возбудителей может только микробиологическое исследование. Конечно, в современных условиях микробиология уже становится практически эксклюзивом, но мы пришли учиться, а учится надо на правильных примерах, поэтому далее будет рассмотрен ряд антибиотикограмм, выполненных автоматизированными системами тестирования. Вдруг вам повезет, и в вашем лечебном учреждении все уже есть или в ближайшее время будет, а вы уже умеете с этим всем работать?
Если вы читаете данный цикл по порядку, то в базовом разделе по микробиологии был выложен ряд антибиотикограмм некоего микроорганизма в контексте нарастания антибиотикорезистентности, и это была наша сегодняшняя героиня – кишечная палочка.
Если такая кишечная палочка окажется внекишечным патогенном, и перед вами будет беременная и ИМП (самый частый случай), то нам необходимо преодолеть резистентность к пенициллинам, то есть подавить деятельность пенициллиназ. Соответственно высокую эффективность продемонстрируют препараты с ингибиторами бета-лактамаз, чаще всего амоксициллина/клавуланат, как наиболее безопасный и эффективный. Единственное, пациентку необходимо предупредить, что в результате стимуляции рецепторов кишечника может развиться антибиотик-ассоциированная диарея.
В каких ситуациях мы можем увидеть (или подумать) о таком звере:
Подобный пациент не придет к вам своими ногами, его не увидит амбулаторная служба, это абсолютно стационарные больные, и если их привезут, то только из другого лечебного учреждения. Чаще всего это пациенты палат интенсивной терапии или реанимации, и такой возбудитель носит на 100% нозокомиальный характер.
Когда можем его обнаружить:
И всегда это будет ятрогенное поражение как следствие неправильной гигиены рук персонала либо обработки инструментария. Можно возразить «но как же тяжелые перитониты?». Отвечу тем, что для тяжелых перитонитов без дефектов ухода наиболее характерен штамм на третьем рисунке, так как для того, чтобы вырастить такую зверюгу, тяжелому перитониту здоровья не хватит, он от осложнений погибнуть успеет, а сама кишечная палочка ножками ходить не умеет, мы ее исключительно неправильно мытыми ручками разносим, и доказать это элементарно, так как точно такие же штаммы будут высеваться при плановых проверках эпидемиологической службы.
А теперь подведем небольшой итог нашего непростого разговора:
Резюмируя вышесказанное, и как бы обидно это ни прозвучало, но почти всегда инфекции, вызванные кишечной палочкой, – это «болезни грязных рук» и показатель микробиологического неблагополучия. И одна из серьезных проблем медико-профилактических служб, так как при всем желании они не смогут полностью изъять источник инфицирования, так как он в прямом смысле находится во всех нас, и только соблюдение санитарных правил и санпросвет. работа могут значительно поспособствовать в сдерживании развития вышеуказанных заболеваний.
Кишечная палочка
Все слышали о таком понятии как микробиота человека (микробиом). Это огромное количество бактерий и других микроорганизмов, постоянно живущие в пищеварительном тракте и играющие важнейшую роль в поддержании жизни и здоровья человека. Количество бактерий в кишечнике близко к общему количеству клеток организма, а вес может достигать 1,5-3 кг!
Помимо поддержания полезной микрофлоры, кишечные палочки E. coli вырабатывают ряд необходимых для человека витаминов: В1, В2, В3, В5, В6, биотин, В9, B12, К, жирные кислоты (уксусную, муравьиную, а ряд штаммов также молочную, янтарную и другие), участвуют в обмене холестерина, билирубина, холина, желчных кислот, оказывают влияние на всасывание железа и кальция.
Существуют разные виды кишечных палочек: полезные выполняют те важные функции, о которых рассказано выше, и есть патогенные штаммы E.coli. Патогенная кишечная палочка вызывает разнообразные болезни под общим название эшерихиозы, или в просторечии эти болезни называют просто «кишечная палочка».
Полезные и патогенные кишечные палочки не отличаются по морфологическим признакам ( по форме, окрасу и т.п.), поэтому при анализе отличить их невозможно.
Вероятно, те палочки, которые живут в кишечнике в симбиозе у человека, не патогенны, т.е. организм к ним приспособлен. Болезнь вызывают попавшие извне E.coli.
Откуда берется патогенная кишечная палочка и какие симптомы она взывает? Как можно заразиться кишечной палочкой?
При потреблении зараженной пищи или заглатывании воды при купании, палочка проникает в организм и начинает активно размножаться в кишечнике, вытесняя полезные микроорганизмы и приводя к болезни.
Разновидности кишечной палочки и симптомы
Патогенные палочки бывают разных видов, и симптомы, ими вызываемые, могут отличаться.
Однако не только эти симптомы кишечной палочки опасны.
Кишечная палочка является самой частой причиной заболеваний мочеполовой сферы у женщин и у мужчин.
У женщин кишечная палочка вызывает циститы, пиелонефриты, и является причиной острого кольпита, вульвовагинита.
Как происходит заражение?
Инфицирование кишечными палочками (а также другими уропатогенными микробами, обитающими в кишечнике) мочеполовых органов, и у мужчин, и особенно у женщин, часто происходит непосредственно из желудочно-кишечного тракта при недостаточном соблюдении гигиены или применении специфических сексуальных практик.
У мужчин кишечные палочки являются причиной:
Именно поэтому задача адекватной терапии кишечной палочки приобретает особую остроту.
Как лечить кишечную палочку?
При более тяжелых состояниях, а также при инфицировании кишечной палочкой мочеполовых путей, назначают антибактериальную терапию. В этих случаях важно выбрать препарат, к которому отмечается наибольшая чувствительность возбудителя.
Макмирор является противомикробным средством, востребованным при заражении E.coli, сальмонеллами, шигеллами, амебами, хеликобактером и многими другими возбудителями.
Поскольку энтерит, вызываемый кишечной палочкой, часто встречается у детей, и он особенно опасен у детей до 1 года и чуть старше, при назначении лечения необходим препарат, который разрешен детям уже с самого раннего возраста. По инструкции, Макмирор может использоваться в лечении детей любого возраста. При этом грудному ребенку выписывать этот препарат обязательно должен врач, определяя нужную дозировку индивидуально. Также Макмирор разрешен к применению у беременных женщин.
Эти свойства препарата Макмирор делают его препаратом выбора в терапии кишечной палочки.
Лечение мочеполовых заболеваний, вызванных кишечной палочкой.
Лечение диареи у детей и диареи путешественников, вызванной кишечной палочкой, помимо антибактериальной терапии, включает:
При инфицировании кишечной палочкой мочевых путей, вместе с препаратом Макмирор, рекомендуется обильное питье для усиления диуреза, применение препаратов для коррекции гормонального статуса и иммунной системы, симптоматическая терапия (НПВС и т.п.).
Инфекции мочевыводящих путей у взрослых — почему возникают, какие болезни вызывают и как лечатся
Инфекции мочевыводящих путей у взрослых — почему возникают, какие болезни вызывают и как лечатся
Инфекции мочевыводящих путей — частое заболевание в повседневной урологической практике. Значительный прогресс в лечении инфекций мочевыводящих путей наблюдается за последние двадцать лет. В статье затрагиваются такие важные проблемы, как этиология, патогенез и лечение инфекций мочевыводящих путей у взрослых.
Инфекции мочевыводящих путей (ИМП) представляют собой серьезную проблему из-за их распространенности и связанной с ними заболеваемости. По статистике на них приходится примерно 20% всех внебольничных и примерно 50% нозокомиальных инфекций. Достижения последних десятилетий способствовали лучшему пониманию патогенеза инфекций мочевыводящих путей и выяснили важную роль как бактериальных, так и зависимых от пациентов факторов в развитии или предотвращении инфекции.
Динамичное развитие антибактериальной терапии значительно облегчило правильное лечение ИМП, но неправильное и широкое злоупотребление антибактериальными препаратами привело к увеличению лекарственной устойчивости микроорганизмов.
Эпидемиология ИМП
Инфекции мочевыводящих путей — одно из самых распространенных инфекционных заболеваний человека.
Частота возникновения ИМП зависит от пола и возраста обследуемых, а также от конкретных характеристик исследуемой популяции.
Доброкачественная гиперплазия простаты
» data-medium-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Доброкачественная-гиперплазия-простаты.jpg?fit=450%2C294&ssl=1″ data-large-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Доброкачественная-гиперплазия-простаты.jpg?fit=843%2C550&ssl=1″ loading=»lazy» src=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/%D0%94%D0%BE%D0%B1%D1%80%D0%BE%D0%BA%D0%B0%D1%87%D0%B5%D1%81%D1%82%D0%B2%D0%B5%D0%BD%D0%BD%D0%B0%D1%8F-%D0%B3%D0%B8%D0%BF%D0%B5%D1%80%D0%BF%D0%BB%D0%B0%D0%B7%D0%B8%D1%8F-%D0%BF%D1%80%D0%BE%D1%81%D1%82%D0%B0%D1%82%D1%8B.jpg?resize=900%2C587&ssl=1″ alt=»Доброкачественная гиперплазия простаты» width=»900″ height=»587″ srcset=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Доброкачественная-гиперплазия-простаты.jpg?w=900&ssl=1 900w, https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Доброкачественная-гиперплазия-простаты.jpg?resize=450%2C294&ssl=1 450w, https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Доброкачественная-гиперплазия-простаты.jpg?resize=843%2C550&ssl=1 843w, https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Доброкачественная-гиперплазия-простаты.jpg?resize=768%2C501&ssl=1 768w» sizes=»(max-width: 900px) 100vw, 900px» data-recalc-dims=»1″ /> Доброкачественная гиперплазия простаты
Риск ИМП возрастает, когда существует препятствие для оттока мочи или когда обстоятельства способствуют колонизации и росту бактерий. К физиологическим факторам, предрасполагающим к ИМП, относятся беременность, пожилой возраст и такие заболевания, как диабет и мочекаменная болезнь.
Этиология и патогенез ИМП
Наиболее частыми факторами, вызывающими ИМП, являются бактерии, реже вирусы, грибки или паразиты. Распространенность определенных типов бактерий, выделенных из мочи пациентов, во многом зависит от изучаемой популяции. Совершенно иначе обстоит дело у пациентов, находящихся на амбулаторном лечении, чем в больницах.
» data-medium-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Кишечная-палочка.jpg?fit=450%2C300&ssl=1″ data-large-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Кишечная-палочка.jpg?fit=826%2C550&ssl=1″ loading=»lazy» src=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/%D0%9A%D0%B8%D1%88%D0%B5%D1%87%D0%BD%D0%B0%D1%8F-%D0%BF%D0%B0%D0%BB%D0%BE%D1%87%D0%BA%D0%B0.jpg?resize=900%2C599&ssl=1″ alt=»Кишечная палочка» width=»900″ height=»599″ srcset=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Кишечная-палочка.jpg?w=900&ssl=1 900w, https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Кишечная-палочка.jpg?resize=450%2C300&ssl=1 450w, https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Кишечная-палочка.jpg?resize=826%2C550&ssl=1 826w, https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Кишечная-палочка.jpg?resize=768%2C511&ssl=1 768w» sizes=»(max-width: 900px) 100vw, 900px» data-recalc-dims=»1″ /> Кишечная палочка
У 95% пациентов ИМП является результатом заражения одним штаммом бактерий. Заражение несколькими штаммами наблюдается у 5% пациентов, преимущественно у катетеризованных больных, с ослабленным иммунитетом, нейрогенными нарушениями мочевого пузыря или дефектами мочевыделительной системы.
Инфекция мочевыделительной системы может происходить восходящим путем (урогенные инфекции), кровотоком (гематогенные инфекции — очень редко вызваны, главным образом, золотистым стафилококком), лимфатическим путем или непрерывно (при наличии урогенитального или урогенитального свища).
ИМП почти всегда вызывается попаданием бактерий через уретру. В физиологических условиях бактерии часто попадают в мочевыводящие пути, однако из-за защитных механизмов организма развитие ИМП происходит редко.
Наиболее важные естественные механизмы защиты от ИМП:
» data-medium-file=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Подагра.jpg?fit=450%2C300&ssl=1″ data-large-file=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Подагра.jpg?fit=825%2C550&ssl=1″ loading=»lazy» src=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/%D0%9F%D0%BE%D0%B4%D0%B0%D0%B3%D1%80%D0%B0.jpg?resize=900%2C600&ssl=1″ alt=»Подагра» width=»900″ height=»600″ srcset=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Подагра.jpg?w=900&ssl=1 900w, https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Подагра.jpg?resize=450%2C300&ssl=1 450w, https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Подагра.jpg?resize=825%2C550&ssl=1 825w, https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Подагра.jpg?resize=768%2C512&ssl=1 768w» sizes=»(max-width: 900px) 100vw, 900px» data-recalc-dims=»1″ /> Подагра
К наиболее частым факторам, способствующим развитию инфекции мочевыводящих путей, относятся:
Моча в мочевыводящих путях здорового человека стерильна. Наличие в нем бактерий свидетельствует об инфицировании.
Основным симптомом, позволяющим диагностировать ИМП, является так называемая значительная бактериурия, когда количество бактерий в 1 мл свежей, собранной в асептических условиях мочи превышает 100000.
Возникновение значительной бактериурии по полу и возрасту представлено ниже:
Лечение инфекционного цистита у женщин
Получить квалифицированную помощь специалистов и пройти исследования на наличие признаков бактериального цистита можно в медсервисе «Клиника ABC». Медицинская организация располагает всем необходимым для этого новейшим оборудованием и штатом специалистов, которые имеют многолетнюю практику по данному заболеванию.
Крымкин Юрий Михайлович
Заведующий урологическим отделением, врач-уролог, хирург-андролог
Кармолиев Рустам Рафикович
Корнеева Лариса Николаевна
Врач-уролог высшей категории, кандидат медицинских наук
Характеристика патологии
При попадании возбудителей в мочевой пузырь происходит развитие воспалительного патологического процесса. Заболевание может развиваться на фоне ослабленной иммунной системы или других предрасполагающих факторов – переохлаждения, стрессовых ситуаций.
Причины возникновения
Главной причиной развития бактериального цистита у женщин является проникновение патогенной микрофлоры на слизистые оболочки через уретральный канал.
Мужчины подвергаются заболеванию в крайне редких случаях. В пожилом возрасте процентное соотношение у обоих полов практически одинаковое.
Признаки бактериального цистита
Инкубационный период болезни составляет от 3-х до 4-х суток. При этом симптомы и лечение инфекционного цистита у женщин могут отличаться, исходя из возбудителя, спровоцировавшего патологию.
Как можно заразиться
Заболевание не представляет угрозы для жизни пациента, однако провокаторы воспалительных реакций могут привести к тяжелым последствиям.
Диагностические мероприятия
Диагностика включает в себя консультацию у специалиста, а также лабораторные и инструментальные исследования. Это позволить определить симптомы и лечение бактериального цистита у женщин на ранней стадии развития болезни.
В первую очередь назначается анализ мочи, помогающий выявить признаки заболевания. В дополнении необходимо пройти общее исследование крови на наличие повышенного содержания лейкоцитов и эритроцитов.
При необходимости может назначаться биохимическое исследование крови, помогающее установить уровень СОЭ. Женщинам дополнительно назначается мазок на микрофлору.
Для выявления проблем с почечной системой необходимо сдать анализ мочи по Ничепоренко.
Хроническое воспаление
Заболевание может развиваться как в острой, так и хронической форме. Острый бактериальный цистит характеризуется внезапными болевыми ощущениями, проблемами с мочеиспусканием, наличием примесей в моче.
При хроническом протекании болезни симптоматика менее выражена, не вызывая у пациента при этом дискомфортных ощущений.
Бактерии, провоцирующие цистит
Патология развивается при попадании болезнетворных микроорганизмов в мочевой пузырь. Процесс приводит к развитию воспаления и сопровождается неприятными симптомами. На фоне поражения бактериями возникает острый бактериальный цистит.
Кишечная палочка (E. coli)
Данный тип бактерий является полезным и обитает в кишечнике, помогая усваивать и расщеплять пищу. При отсутствии личной гигиены микроорганизм попадает в уретру и приводит к острому воспалительному процессу.
При поражении кишечной палочкой происходит разрушение слизистых оболочек мочевого пузыря. При этом образуются мелкие язвы, провоцирующие болевые приступы.
При отсутствии лечения инфекция может распространяться на другие отделы мочеполовой системы.
Протей
Снижение иммунных реакций, злоупотребление медикаментами могут спровоцировать чрезмерную активность протеи – условно-патогенного возбудителя.
При поражении бактерией развивается инфекционное заболевание (цистит). При этом пациент чувствует общее недомогание, наблюдаются проблемы с мочеиспусканием, происходит отложение песка.
Терапия проводиться намного дольше, так как микроорганизм быстро вырабатывает устойчивость к препаратам. В конечном итоге заболевание может привести к развитию пиелонефрита.
Клебсиелла
Главными местами обитания микроорганизма являются кожные покровы, каловые массы, а также кишечник. Патология может развиваться как в тяжелой, так и легкой форме в зависимости от иммунной системы.
Данный тип воспалительного процесса наблюдается всего в 5% всех случаев.
Стафилококк
Главным провокатором инфекционного цистита у женщин является сапрофитная или золотистая форма стафилококка. Микроорганизм обитает в мочеполовой системе и не вызывает каких-либо нарушений. Однако при сбоях в иммунной системе бактерия начинает активно размножаться, вызывая воспалительный процесс.
При этом бактериальная форма цистита развивается только в случаях повреждений на слизистой оболочке мочевого органа.
Стрептококк
Инфекционный цистит у женщин может развиваться на фоне поражения стрептококком. Данный микроорганизм может проникать в мочевыводящий орган при несоблюдении правил применения катетеризации, недостаточной личной гигиене.
В тяжелых случаях стрептококковый возбудитель может привести к дополнительным осложнениям в виде уретрита, пиелонефрита, простатита.
Энтеробактер
Инфекционное заболевание цистит может возникать на фоне поражения энтеробактерией. данный тип возбудителей относится к сапрофитам и обитает в слизистых оболочка толстой и тонкой кишки. Способ заражения – орально-фекальный.
При попадании в мочевыводящие пути микроорганизм приводит к развитию воспалительных реакций. Главным фактором развития болезни является снижение иммунитета.
Методы лечения
Лечение бактериального цистита у женщин необходимо проходить комплексно.
Антибактериальная терапия
В медицинском сервисе «Клиника ABC» можно пройти квалифицированную диагностику на наличие признаков болезни. Медперсонал имеет для этого необходимый многолетний опыт и располагает всем необходимым для проведения процедуры современным оборудованием. Квалифицированные врачи помогут назначить эффективную терапию, которая поможет навсегда забыть о заболевании.
Неосложненная и осложненная инфекция нижних мочевыводящих путей
Среди инфекций нижних мочевых путей (ИНМП) ведущее место занимает воспаление мочевого пузыря. Это самая частая урологическая инфекция, которая встречается как в амбулаторной, так и в стационарной практике. Распространенность инфекций мочевыводящих
Среди инфекций нижних мочевых путей (ИНМП) ведущее место занимает воспаление мочевого пузыря. Это самая частая урологическая инфекция, которая встречается как в амбулаторной, так и в стационарной практике.
Распространенность инфекций мочевыводящих путей (ИМП) в России составляет около 1000 случаев на 100 000 населения в год. Ежегодно регистрируется около 26–36 млн случаев острого цистита [1]. Можно предположить, что истинная распространенность заболевания значительно выше, поскольку многие пациенты не обращаются к врачу и лечатся сами. Мужчины чаще болеют циститом в пожилом возрасте, женщины — в молодом. Только в пожилом и старческом возрасте (к 70–75 годам) заболеваемость мужчин и женщин становится приблизительно одинаковой.
По числу случаев временной нетрудоспособности среди урологических заболеваний цистит занимает первое место [2, 3].
Согласно современной классификации ИНМП принято подразделять на неосложненную и осложненную. Наиболее частым проявлением неосложненной ИНМП является острый цистит. Он возникает при отсутствии обструктивных уропатий и структурных изменений в почках и мочевыводящих путях, без серьезных сопутствующих заболеваний и неврологических нарушений. Неосложненная ИНМП чаще выявляется у женщин с анатомически и функционально нормальным мочевым пузырем. Однако у 15–50% женщин с симптомами цистита выявляется клинически скрытая инфекция почек. В таком случае мы имеем дело с осложненным циститом, что нужно учитывать при диагностике и лечении.
В отличие от неосложненной ИНМП, осложненная инфекция возникает на фоне органических и функциональных изменений мочевого пузыря, нейрогенной патологии или серьезных сопутствующих заболеваний (сахарный диабет, нейтропения, иммуносупрессия) после применения инструментальных методов обследования и лечения. Проявлением осложненной инфекции мочевого пузыря является хронический цистит.
Европейская ассоциация урологов (Париж, 2006) предлагает использовать для распознавания осложненной ИМП так называемые факторы риска развития осложнений или неудач лечения. К ним относятся: мужской пол, пожилой возраст, госпитальная инфекция, беременность, функциональные или анатомические нарушения мочевых путей, камни в мочевых путях, недавнее вмешательство на мочевых путях, наличие катетера в мочевых путях, недавнее применение антибиотика, наличие симптомов заболевания более 7 дней на момент обращения, сахарный диабет, иммуносупрессия.
Следует помнить и учитывать некоторые клинические особенности цистита.
Источником бактериального неосложненного и осложненного цистита является нормальная микрофлора, колонизирующая периуретральную область и дистальную часть уретры. Инфицирование мочевого пузыря в 95% случаев происходит восходящим путем. Воспаление мочевого пузыря чаще всего вызывает неспецифическая микробная флора. Прежде всего это грамотрицательные энтеробактерии: кишечная палочка, протей, клебсиелла, синегнойная палочка, энтеробактер. Из грамположительных встречаются стафилококк, стрептококк, энтерококк. Как правило, неосложненная ИМП вызывается одним микроорганизмом, при осложненном цистите нередко определяется смешанная микрофлора [4].
У 0,4–30% больных с неосложненной ИМП в моче не выявляется патогенная микрофлора [5]. В таких случаях причиной заболевания могут быть вирусы, хламидии, микоплазмы, анаэробные микроорганизмы, для подтверждения этиологической роли которых нужно использовать специальные диагностические среды и методы исследования. Благодаря наличию у кишечной палочки уникальных факторов вирулентности (адгезины, уропатогенный специфический протеин, гемолизин, аэробактин) она играет ведущую роль в патогенезе неосложненной ИМП, при осложненной ИМП факторы вирулентности являются менее значимым условием возникновения инфекции.
Развитие цистита есть результат преобладания вирулентности этиологического инфекционного фактора над защитными механизмами мочевого пузыря. Необходимым условием развития бактериального неосложненного и осложненного цистита является адгезия значительного количества уропатогенных бактерий к уроэпителиальным клеткам с последующей инвазией их в стенку мочевого пузыря. Развитие и персистенция инфекции в стенке мочевого пузыря зависят от размера и интенсивности роста микробной колонии, обьема остаточной мочи, степени эксфолиации уретральных клеток с адгезированными уропатогенами, скорости потока мочи и частоты мочеиспусканий. После адгезии нормальный ток мочи или слизи не смывает бактерии. В результате происходит колонизация микроорганизмов. Адгезированные микроорганизмы не создают колоний на питательных микробиологических средах: этим объясняются трудности их выявления и недооценка в диагностике рецидивов. Уропатогенные штаммы E. coli способны формировать биопленки (микроколонии) на слизистой оболочке мочевого пузыря и внутри эпителиальных клеток, а также на некротических, рубцово-измененных тканях, катетерах. Микроорганизмы, образующие биопленку, обладают устойчивостью к антимикробной терапии. Бактерии в составе биопленки могут выживать при использовании антибиотиков в концентрациях, в 100–150 раз превышающих бактерицидные концентрации для планктонных форм бактерий того же вида [6].
Нарушение защитных механизмов мочевого пузыря повышает возможность адгезии и размножения в нем кишечной микрофлоры, вероятность развития инфекционно-воспалительного процесса и его рецидивирования.
Согласно современным представлениям, развитие инфекционно-воспалительного процесса в мочевом пузыре независимо от этиологии протекает по следующему «сценарию»: адгезия — инвазия — колонизация — пролиферация — повреждение тканей хозяина [7]. При неосложненных циститах поражается только слизистая оболочка мочевого пузыря. Иначе говоря, острый цистит — это поверхностная инфекция мочевого пузыря. В случае осложненной инфекции воспалительный процесс переходит на более глубокие слои (подслизистый, мышечный, серозный) стенки мочевого пузыря. Замещение гладкомышечных волокон соединительно-тканными в стенке мочевого пузыря ведет к его фиброзу, уменьшению емкости мочевого пузыря (микроцистит). Такие изменения наблюдаются при лучевом и интерстициальном цистите.
Развитию воспаления в мочевом пузыре способствуют следующие факторы:
Как в любом инфекционном процессе, взаимодействие факторов вирулентности возбудителя и целостность защитных механизмов макроорганизма во многом определяют развитие и течение инфекции. Уропатогенные штаммы E. coli имеют целый набор факторов вирулентности, с помощью которых они могут преодолевать даже ненарушенные защитные механизмы мочевого пузыря у женщин, обладают потенциальной способностью к восходящему распространению по мочевым путям. Установлено, что бактерии могут передавать друг другу различные факторы вирулентности: устойчивость к антибиотикам, выработку фактора колонизации, выработку токсинов, мембранных белков и др.
В настоящее время появляется все больше данных о значении в развитии бактериального неосложненного цистита наследственной предрасположенности (отсутствие секреции некоторых групп антигенов крови, дефекты муцинового слоя, повышенное содержание рецепторов для бактериальной адгезии на мембранах эпителиальных клеток) и поведенческих особенностей пациентов (сексуальная активность, использование влагалищных диафрагм, вибраторов и спермицидов, отсутствие мочеиспускания после полового акта, произвольное задерживание мочеиспускания, несоблюдение правил личной гигиены или неправильное их выполнение, недостаточный питьевой режим, ношение плотно облегающей одежды).
Цистит у женщин практически всегда связан с кольпитом или бактериальным вагинозом. Анатомо-физиологические особенности женского организма и его зависимость от состояния гормональной системы предопределяют выделение чисто женских клинических форм воспаления мочевого пузыря: цистит у девочек, дефлорационный цистит, цистит медового месяца, посткоитусный цистит, цистит у беременных, послеродовой, постклимактерический, инволюционный цистит.
Несмотря на легкость купирования острого неосложненного бактериального цистита при анатомически нормальных мочевых путях, цистит часто рецидивирует. У 50% больных склонность к рецидивам наблюдается в течение года, причем чаще у пациенток старше 55 лет [1, 8]. Принято различать рецидивирующий цистит и реинфекцию. Цистит считают рецидивирующим, если наблюдается три и более рецидива в год. Это сохраняющаяся инфекция, при которой определяется один и тот же микробный возбудитель из неликвидированного очага инфекции. Реинфекция — это инфекция, вызванная другим микробным возбудителем из кишечника и перианальной области. Современными исследованиями установлено, что повторные рецидивы цистита в 90% случаев представляют собой новое заболевание, а не рецидив предшествующего.
Высокая частота рецидивирования цистита обьясняется следующими причинами (наряду с перечисленными ранее причинами возникновения цистита):
Диагностика
Диагноз острого неосложненного цистита ставят с учетом анамнеза и клинических симптомов. Если данные анамнеза и жалоб не совпадают с клиникой цистита, то показано исследование мочи. Микроскопическое исследование мочи позволяет верифицировать острый цистит только у 50% больных, имеющих бактериальный показатель выше 100 000 КОЕ/мл.
Наличие лейкоцитов в моче является обязательным признаком цистита. О лейкоцитурии принято говорить, если в осадке мочи содержится 6 и более лейкоцитов в поле зрения микроскопа. Исследование нецентрифугированной мочи из средней порции с помощью простого гематоцитометра обладает высокой чувствительностью и позволяет выявить лейкоцитурию у больных с нормальными показателями общего анализа мочи, обнаружить инфекцию или колонизацию. В ряде случаев приходится исключать острый уретрит (хламидийный, гонорейный, герпетический) и вагинит (кандидозный, трихомонадный).
Если распознавание острого цистита не вызывает затруднений, то диагностика осложненного цистита представляет определенные трудности, особенно при интерстициальном цистите. При осложненной ИНМП необходимо диагностировать основное урологическое заболевание, особенно это касается пиелонефрита (первичного и вторичного). В связи с этим каждый больной с осложненным циститом подлежит общему и урологическому обследованию.
Мероприятия, проводимые для диагностики хронического цистита:
Дифференциальную диагностику осложненного цистита следует проводить со следующими заболеваниями: туберкулез мочевой системы, рак мочевого пузыря, уретральный синдром, вульвовагинит, уретрит.
Лечение
Лечение циститов должно быть комплексным и в первую очередь направлено на санацию очагов инфекции, быструю элиминацию микробного возбудителя, устранение причин частого рецидивирования и восстановление естественных защитных антибактериальных механизмов мочевого пузыря. Комплексное лечение включает в себя следующие виды терапии:
При неосложненной ИМП (острый цистит) лечение не представляет трудностей, оно проводится обычно в амбулаторных условиях и в основном заключается:
Больные, не получающие антибактериальные препараты, имеют повышенный риск развития осложнений и хронизации процесса. Нередко в повседневной практике применяются неадекватные методы лечения цистита. Одной из наиболее частых ошибок является назначение препаратов с низкой антимикробной активностью в отношении возбудителей неосложненной ИМП или с недоказанной их эффективностью. Повторное назначение антибиотиков одной группы способствует возникновению резистентных к ним штаммов.
Существенное влияние на результат лечения оказывает правильный первоначальный выбор антибактериального препарата.
В настоящее время при неосложненном остром цистите доказана эффективность терапии одной дозой и трехдневного курса, а более длительная не имеет никаких преимуществ. Такое лечение имеет свои достоинства: высокая клиническая и микробиологическая эффективность, снижение селекции резистентных штаммов, низкая частота нежелательных реакций, хорошая переносимость и более низкая стоимость лечения.
На сегодняшний день для лечения одной дозой лучшим препаратом является фосфомицина трометамол (Монурал) — антибиотик широкого спектра действия, активный в отношении большинства аэробных грамотрицательных (включая протей, клебсиеллу, энтеробактер, синегнойную палочку) и грамположительных бактерий, стафилококков (золотистого, эпидермального), стрептококков (сапрофитного, фекального). Препарат оказывает быстрое бактерицидное и длительное антиадгезивное действие, уменьшает коагрегацию бактерий, характеризуется отсутствием аллергии и перекрестной резистентности с другими антибиотиками.
Однократный прием Монурала (в дозе 3 г) по эффективности сопоставим с семидневным курсом терапии нитрофурантоином.
Считается, что если уровень резистентности уропатогенных штаммов E. coli к антибиотику составляет в регионе более 10–20%, то это является предпосылкой ограничения его использования как препарата выбора.
Наибольшее распространение при лечении неосложненной ИНМП получил трехдневный курс терапии фторхинолонами, обладающими широким спектром высокой микробиологической активности против основных возбудителей острого цистита, способными создавать высокие и длительно сохраняющиеся концентрации в моче после однократного приема. Наиболее эффективны и безопасны из них норфлоксацин, офлоксацин, ципрофлоксацин, левофлоксацин. Альтернативой фторхинолонам при остром цистите являются ингибиторозащищенные пенициллины (Аугментин, Амоксиклав), оральные цефалоспорины III и IV поколений.
Препараты выбора для трехдневного курса лечения неосложненного цистита:
У беременных женщин при неосложненном цистите рекомендуется использовать цефалоспорины I–III поколений, фосфомицина трометамол (однократно), альтернативные препараты: амоксициллин/клавуланат, нитрофурантоин.
Залогом успеха терапии острого цистита является своевременное и адекватное назначение антибиотиков буквально с момента появления клинических симптомов заболевания. Не нужно ждать результата бактериологического исследования, а лечить не откладывая. При неэффективности применения короткого курса терапии его нужно рассматривать как диагностический показатель, указывающий на наличие осложненной инфекции мочевого пузыря. В таких случаях пациенты должны быть подвергнуты тщательному урологическому обследованию для выявления сопутствующей патологии или осложненной уроинфекции.
При рецидиве воспаления мочевого пузыря, возникающего во время курса или через 2 нед после его окончания, можно думать об обострении воспалительного процесса; в этом случае его нужно лечить фторхинолонами в течение 7–14 дней. Лечение реинфекции проводится трехдневным курсом терапии и тем же препаратом, который был эффективен при первом эпизоде инфекции. Пациентам с часто рецидивирующим циститом (более трех обострений в течение года) должна проводиться превентивная терапия (прием небольших доз антибиотика каждый день на ночь). Превентивное лечение может проводиться от нескольких месяцев (6–12) до нескольких лет и более. Длительная регулярная профилактическая терапия приводит к стойкой ремиссии, а у ряда больных — к выздоровлению.
При осложненной инфекции мочевого пузыря терапия короткими курсами, а тем более одной дозой препарата противопоказана; назначаются длительные курсы антимикробной терапии — от 7 до 14 дней, а иногда в течение 4–6 нед. У больных с хроническим циститом необходимо устранение патогенетических факторов развития рецидивирующей хронической инфекции мочевого пузыря: инфравезикальной обструкции органического (стеноз уретры, парауретральный фиброз и др.) или функционального (гипертонус детрузора, детрузорно-сфинктерная диссинергия) характера.
При детрузорно-сфинктерной диссинергии необходимо назначать транквилизаторы с миорелаксирующим действием — Реланиум, Феназепам, Баклофен. В лечении гиперактивного мочевого пузыря широко применяются М-холинолитики, которые приводят к уменьшению тонуса детрузора, способствуют урежению позывов к мочеиспусканию, снижению имперактивности, облегчению удержания мочи. С этой целью применяют Дриптан (оксибутинина хлорид) — по 5 мг 3 раза в сутки, Детрузитол — по 2 мг 2 раза в сутки, Спазмекс (троспия хлорид) — по 5 мг 3 раза в сутки. Курс лечения — 3–6 мес. У больных с гипертонусом уретрального сфинктера и шейки мочевого пузыря следует назначать a-адреноблокаторы: Сетегис — по 2–5 мг на ночь, Корнам — 2–5 мг перед сном.
Инфекция нижних мочевых путей может быть обусловлена нейромышечными нарушениями гладкомышечных элементов мочевыводящего тракта и органов малого таза (чаще по гиперспастическому типу) или сочетаться с ними. Этому способствуют травмы и операции в анамнезе, занятия определенными видами спорта, патологические изменения в нижних конечностях, повышенная нагрузка на нижнюю часть спины (ношение туфель на шпильке). В результате нарушается иннервация мочевого пузыря и возникает его дисфункция, которая может вызвать рецидив цистита. Поэтому в комплексную терапию необходимо включать миорелаксанты (Феназепам, Баклофен) и спазмолитики (Папаверин, Галидор, Баралгин, Но-шпа).
Общее и местное противовоспалительное лечение применяется в основном при хроническом цистите — назначаются нестероидные противовоспалительные препараты (НПВП): диклофенак, пироксикам, лорноксикам, нимесулид; применяется местное лечение в виде промывания и инстилляций мочевого пузыря.
Боли при цистите часто принимают упорный, тягостный характер. При болезненном мочеиспускании назначают НПВП (нимесулид, кеторолак), при этом нельзя уменьшать количество потребляемой жидкости. Из обезболивающих средств наиболее эффективны Солпадеин — по 1–2 таблетки 4 раза в день, Гентос — по 15 капель 3 раза в день (в 1-й день до 8 раз в сутки), свечи с Анестезином, свечи с Цефеконом Н, микроклизмы с 2%-ным раствором новокаина.
Важнейшим звеном патогенетической терапии считается иммуномодулирующая терапия. Поэтому в комплексное лечение рекомендуется включать иммуномодулятор — Уро-Ваксом. Препарат представляет собой экстракт лиофилизированных бактериальных лизатов 18 различных штаммов E. Coli; назначается натощак по 1 капсуле в день в течение 10 дней при остром цистите и на срок до 3 мес при хроническом цистите и пиелонефрите. Через 3 мес после завершения вакцинации проводится ревакцинация, состоящая из трех десятидневных курсов в течение 3 мес.
Инфекции мочевого пузыря у женщин постменопаузального возраста связаны с эстрогенным дефицитом; проявлением урогенитальных расстройств является развитие атрофического цистоуретрита, синильного кольпита, выпадение слизистой оболочки уретры, сухость влагалища, зуд, жжение, частое и болезненное мочеиспускание, недержание мочи. Для лечения урогенитальных расстройств используют системную или местную терапию эстриолом (свечи или вагинальный крем Овестин), при этом чем раньше начато лечение, тем выше его эффективность.
Фитотерапия создает благоприятный фон для проведения антимикробной терапии, дополняет ее при хроническом течении заболевания. Чаще всего она используется для предупреждения развития осложнений и рецидивов заболевания, уменьшения выраженности воспалительных явлений и болей (Урокам, Урофлюкс, Канефрон, Фитолизин, Цистон).
В развитии ИМП существенное, а может быть и решающее значение имеют особенности социокультурного поведения пациентов.
В последние годы сексуальную активность считают основным фактором риска развития ИМП. Чаще всего цистит связан с регулярной половой жизнью. Поэтому необходимо четко выполнять правила сексуальной гигиены (обильные водные процедуры с туалетом наружных половых органов до полового акта и после, обязательное мочеиспускание после коитуса). При рецидивирующем течении цистита не следует пользоваться влагалищными диафрагмами и спермицидами, рекомендуется избегать сексуальных позиций, способствующих повышенной травматизации уретры. Если имеется связь между циститом и интимной близостью, то после полового акта необходим профилактический прием антибиотика (Фурадонин 50 мг, Фурамаг 50 мг, Норфлоксацин 200 мг, Ципрофлоксацин 125 мг). При отсутствии эффекта от профилактики инфекции после полового сношения женщинам необходимо проводить антибактериальное лечение в течение 6–12 мес.
Нарушения мочеиспускания у женщин и мужчин увеличивают риск возникновения ИМП. Мочеиспускание не следует подавлять произвольно: это ослабляет естественные защитные механизмы мочевого пузыря. При цистите нужно стараться добиться полного опорожнения мочевого пузыря.
Процесс выздоровления при цистите ускоряется при увеличении количества принимаемой жидкости. С профилактической целью рекомендуется пить 2–2,5 л жидкости в день. Лучше использовать обычную воду, неконцентрированные соки или минеральную воду без газа, настои трав, клюквенный и брусничный морс. Нельзя пить чай, кофе, кока-колу, газированные напитки, так как содержащийся в них кофеин раздражает слизистую оболочку мочевых путей.
Одежда не должна плотно облегать тело, чтобы не затруднять доступ крови к коже и не нарушать лимфоотток, не создавать перегрева и повышенной влажности в вагинально-анальной области, способствующих их колонизации и развитию инфекционных заболеваний.
В настоящее время большинство клиницистов рассматривают хронический цистит как вторичное заболевание, следствие поддерживающей его причины, которую необходимо найти и устранить. Только тогда можно добиться выздоровления. На сегодняшний день критериями излеченности цистита считаются ликвидация расстройств мочеиспускания, исчезновение бактериурии и лейкоцитурии, полное восстановление качества жизни и социальной адаптации пациента.
По вопросам литературы обращайтесь в редакцию.
Г. Н. Скрябин, кандидат медицинских наук, доцент
В. П. Александров, доктор медицинских наук, профессор
СПбМАПО, Санкт-Петербург