Чем лечить klebsiella pneumoniae у мужчин
Klebsiella pneumoniae (клебсиелла пневмонии)

Klebsiella pneumoniae в ЖКТ человека
Klebsiella pneumoniae колонизирует кишечник современного человека в первые 5–6 дней жизни, причем основным источником Klebsiella pneumoniae являются мать и персонал родильных домов. Обнаружение Klebsiella pneumoniae в желудочно-кишечном тракте (ЖКТ) человека, в общем случае, не требует лечения. У здорового человека в 1 г кала насчитывается до 10 5 Klebsiella pneumoniae.
Причиной клебсиеллеза органов ЖКТ может быть дисбактериоз или заражение от больных инфекционной формой клебсиеллеза. Болезнь проявляется в форме острого гастрита, гастродуоденита, кишечной инфекции и характеризуется острым началом, тошнотой, рвотой, болями в животе, поносом, повышением температуры и общей слабостью. Продолжительность клебсиеллеза органов ЖКТ — 1–5 дней.
Klebsiella pneumoniae — причина внутрибольничных инфекций
Klebsiella pneumoniae и инфекции мочевыводящих путей и половой сферы
Klebsiella pneumoniae — один из распространенных возбудителей инфекционных заболеваний мочевыводящих путей. В отличие от ЖКТ или кожи, для мочевыводящих путей Klebsiella pneumoniae всегда является патогенным микроорганизмом. Среди обращающихся за амбулаторной помощью пациентов с неосложненными инфекционными заболеваниями мочевыводящих путей причиной инфекции в 6,4 % случаев является Klebsiella pneumoniae. Для пациентов с осложненными инфекционными заболеваниями мочевыводящих путей эта цифра достигает 9,4 %. Klebsiella pneumoniae в мочеполовых путях часто является следствием внутрибольничных инфекций.
Клебсиелла пневмонии может встречаться во влагалищной микрофлоре, в частности, после приёма антибиотиков, результатом которого было уничтожение нормальной микрофлоры влагалища. Клебсиелла пневмонии в мочеполовых путях часто является следствием внутрибольничных инфекций.
Клебсиелла риносклеромы
Клебсиелла озены
Лечение клебсиеллезов
Для лечения клебсиеллезов обычно применяются антибиотики. Также используются лекарственные препараты, действующим веществом которого являются бактериофаги (Бактериофаг клебсиелл пневмонии очищенный жидкий, Секстафаг и др.). Бактериофаги действуют избирательно, не имеют противопоказаний, но они менее эффективны, чем антибиотики.
Антибактериальные средства, активные в отношении Klebsiella pneumoniae (из имеющих описание в данном справочнике): левофлоксацин, норфлоксацин, офлаксацин, а также гентамицин, нафтифин и другие.
Klebsiella pneumoniae устойчива к клотримазолу.
Klebsiella pneumoniae в систематике бактерий
Вид Klebsiella pneumoniae входит в род клебсиелла (лат. Klebsiella), семейство энтеробактерии (лат. Enterobacteriaceae), порядок энтеробактерии (лат. Enterobacteriales), класс гамма-протеобактерии (лат. γ proteobacteria), тип протеобактерии (лат. Proteobacteria), царство бактерии.
Устаревшее название Klebsiella pneumoniae — палочка Фридлендера. Карл Фридлендер (нем. Carl Friedländer, 1847–1887) — немецкий микробиолог, выделивший чистую культуру Klebsiella pneumoniae в 1882 году.
Первоначально Klebsiella pneumoniae была определена, как микроорганизм вызывающий пневмонию (отсюда и ее название). Однако её роль не сводится только к инфекциям респираторной системы. В общем случае Klebsiella pneumoniae классифицируется как условно-патогенный микроб, находящийся в нормальной ситуации и в определенных органах в симбиотическом отношении с человеческим организмом, а в иных ситуациях являющийся причиной инфекционных заболеваний.
Клебсиелла
Темой нынешнего разговора будет, с точки зрения автора, королева внутрибольничных инфекций любого стационара — Klebsiella pneumonia (или палочка Фридлендера).
Автор: Трубачева Е.С., врач – клинический фармаколог
Темой нынешнего разговора будет, с точки зрения автора, королева внутрибольничных инфекций любого стационара — Klebsiella pneumoniae (или палочка Фридлендера). Да-да, автор не ошибся, именно она, а не синегнойки или ацинетки, а именно ее величество — клебсиелла, практически абсолютная убийца тяжелых и крайне тяжелых пациентов. Почему это именно так, мы сегодня и поговорим.
Микробиологические аспекты
Первое и главное, о чем надо знать, — Klebsiella pneumonia — это представитель нормальной микрофлоры кишечника. Еще раз и большими буквами — НОРМАЛЬНОЙ! Не надо ее там лечить (как и стафилококк в носоглотке) — она там живет, и это ее естественный ареал обитания.
А все остальные локации, где она может быть обнаружена: нижние дыхательные пути, мочевыводящий тракт, секрет простаты или содержимое полости матки (анальный сексуальный акт без презерватива — зло, имейте это в виду при сборе анамнеза, особенно у женщин с послеродовым эндометритом, автор такого навидался в достатке… мужчин это тоже касается, и обнаружение подобной зверюшки в секрете простаты должно навести на определенные мысли и вопросы, и пока пациент не закончит данную практику, простатит вы ему при всем желании не вылечите), кровь и в раны при раневых инфекциях после хирургического вмешательства на брюшной полости — могут указывать на возбудителя текущего состояния.
Что вызывает:
Общим у всех этих патологий является одно — они все тем или иным образом связаны с вмешательством, и чаще всего (опуская уже упомянутые анальные сексуальные акты) это вмешательство носит ятрогенный характер. Клебсиелла не умеет ни летать, ни ходить, ни даже ползать, в очаг ее приносят либо неправильно вымытые руки, либо плохо обработанное медицинское оборудование.
Эпидемиологические аспекты
Как мы уже обсуждали в статье о синегнойной палочке, при некотором желании и упертости эпидемиологической службы или клинического фармаколога (или команды из оных, так как каждый знает свое звено), извести неферментеров из стационара — не самая сложная задача. Было бы желание у администрации этим заняться. Что касается лечащих врачей и среднего персонала, то это тот случай, когда достаточно обработать перчатки и далее, на уровне ЦСО и утилизации отходов, правильно избавиться от контаминированого материала, и если инструментарий не одноразовый, то очистить и простерилизовать его. То есть даже на уровне обработанных (или стерильных) перчаток, касающихся только одной области пациента (другая область, если необходимо, требует смены перчаток, либо обработки рук с полным выдерживанием экспозиции, а не чуть-чуть антисептиком помазал-растер-побежал), вы уже снижаете риск контаминации оным зверьем с последующим развитием синегнойной инфекции. Про ацинетобактер будет отдельная глава в разделе «неферментеры».
С клебсиеллой все намного сложнее. Эта, не побоюсь громкого слова, зверища, живет в кишечниках всего персонала медицинских учреждений. И в первую очередь, как понятно из ее названия, поражает нижние дыхательные пути. А если персонал работает с антибиотиками, то клебсиелла еще и устойчивая ко всему арсеналу применяемых препаратов (это к вопросу о разумном ограничении доступа к препаратам резерва). Так как сама клебсиелла не имеет ножек и крылышек, то попадает в оные пути она двумя способами: или в случае аспирации, или на руках персонала и с оборудования. Иного не дано. При аспирации это будет личная дикая зверюшка пациента, в случае грязных шаловливых ручек или оборудования (например, эндоскопов) — клебсиелла, высеваемая в отделении в процессе микробиологического мониторинга. А если этот мониторинг углубленный, то напрямую покажет, какая именно хрюшка, выйдя из туалетной комнаты, не соизволила помыть руки, понадеявшись на перчатки. И нет, перчатки, даже стерильные в данном случае, не спасают, они не презерватив. Руки надо мыть и обрабатывать правильно, обязательно соблюдая технологию и экспозицию.
Как вы понимаете, истребить медицинский персонал мы не можем, поэтому и полностью очистить стационар от данной проблемы не получится. И она обязательно выскочит, стоит на секунду расслабиться, и выскочит на самом тяжелом больном, где еще умудрится смутировать в такого урода, которого не достанешь никаким антибиотиком.
На общемировом клебсиеллу тоже очень сильно боятся, и когда в 2010 году вдруг в Великобритании обнаружили штамм NDM (он устойчив вообще ко всему набору существующих антибиотиков и обозван абсолютным убийцей), паника была знатной. В результате проведенного эпидемиологического расследования, по итогам которого большая группа видных ученых стала персонами non-grata в Индии, было установлено, что данный штамм привезен оттуда и из Пакистана. Присутствие в сточных водах возбудителей, имеющих карбапенемазы (то есть это уже не внутрибольничная флора, это то, что там живет на улице) на момент проведения расследования составляла 90% по CTX-M15 и 36% по NDM. С чем связан сей факт? С безрецептурным масштабным использованием карбапенемов и… проблемами с проточной канализацией. Ее либо нет, либо ей не пользуются, а делают все по старинке. А так как земной шар оказался очень маленьким, теперь NDM-штаммы обнаруживаются по всей планете. У нас, например, очень быстро данным штаммом заселились клиники Санкт-Петербурга. И медицина перед ними бессильна. До тех пор, пока не налажен эпиднадзор, а персонал не моет руки после каждого посещения туалета.
Так как любого врага надо знать в лицо, то наиболее часто встречаемые портреты у автора тоже есть.
Итак, дикая и ничем ни разу не пуганная клебсиелла выглядит вот так:
Где встречается? Те самые послеродовые эндометриты, как результат плотских утех, простатиты, а также раневые инфекции после оперативных вмешательств на брюшной полости у ранее не леченных пациентов.
— вы можете увидеть устойчивый внутрибольничный штамм, который еще можно чем-то полечить, но это будет тяжело и дорого, проще персонал научить руки мыть и бороды брить (фекальной микрофлоры в мужских бородах в таком достатке, что единственный вариант для тех, кто хоть как-то соприкасается с ранами, данное украшение не носить или не оперировать).
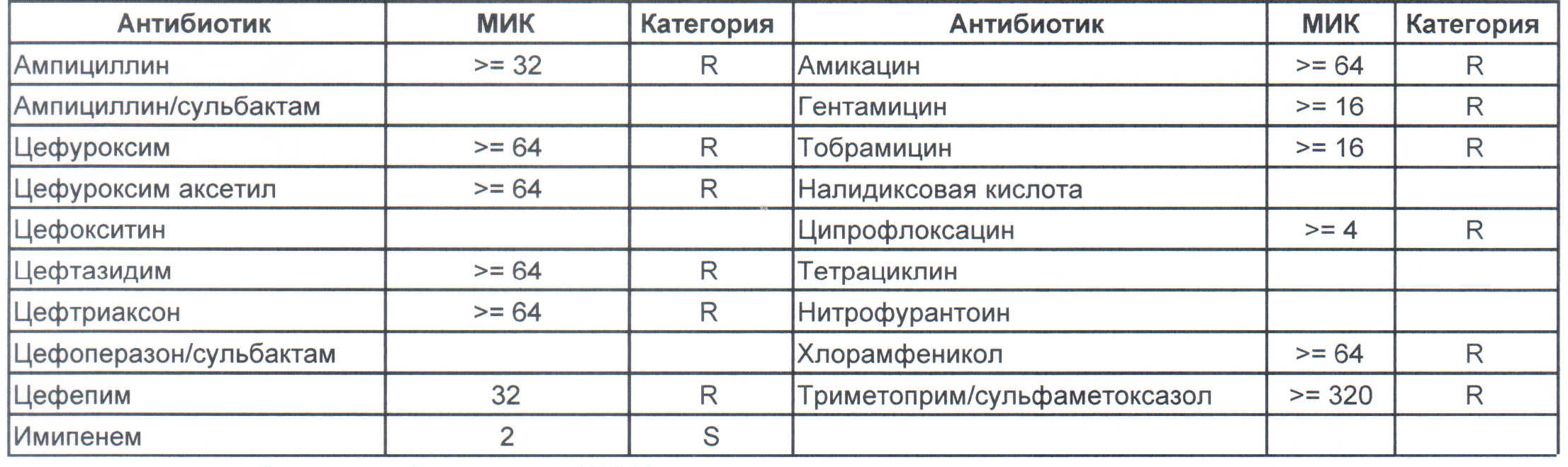
На следующей картинке:
— мы видим практически неубиваемого зверя, который сам по себе вбивает тот самый последний гвоздь в гроб пациента. Но как же Тигециклин, спросите вы. Отвечу — тигацил является бактериостатиком, и пока он наберет необходимую силу, пациента уже отнесут и закопают. Но даже это еще не предел. Предел на следующем рисунке, и нет, Имипенем при указанной MIC уже бессилен:
Как вы понимаете — эти два зверя являются абсолютными убийцами, против которых в данный момент медицина бессильна полностью. И именно такое зверье живет в стационарах без микробиологического мониторинга и систем противостояния в виде эпидемического надзора. Именно эти звери убивают самых тяжелых пациентов, если каким-то образом (руки персонала или плохо обработанное оборудование) в них попали. Но что хуже всего, эти штаммы способны передавать свои факторы устойчивости другой грамотрицательной флоре, например, кишечным палочкам, а потому пациенты, инфицированные такими клебсиеллами, должны быть полностью изолированы и карантинизированы. Спасти их, скорее всего, не получится, но хотя бы всех остальных оградите от инфицирования и последующего летального исхода, да и сами такую зверюшку не подцепите (как вы помните «врач — это диагноз», так не будем его себе усложнять).
Чем лечить?
Дикая клебсиелла отлично лечится препаратами группы цефалоспоринов третьего ряда.
А вот внутрибольничную можно побороть, только четко понимая, с чем вы имеете дело, и обычный диско-дифузионный метод диагностики тут не поможет. Нужны автоматизированные системы с определением MIC. Но во главе угла все равно стоит инфекционная безопасность пациентов. Коллеги! Автор понимает, что выглядит «городской сумасшедшей», коим в свое время был объявлен Земмельвейс, но он вас умоляет — мойте руки после посещения туалета и мойте их правильно. Вам это ничего не стоит, а пациенты выживут. Ничего более эффективного против внутрибольничных клебсиелл пока не придумано. А эпидемиологи ваших учреждений будут проводить свои работы по контролю и дезинфекции отделений и целых зданий. Так получилось, что именно эту королеву ВБИ мы, врачи, медсестры и младший персонал, носим исключительно в себе. Берегите себя, своих близких и своих пациентов, тем более в это нелегкое для отечественной медицины время, с угрозой введения врачебных статей в УК. Клебсиелла — это почти всегда чистая ятрогения. Повторюсь — берегите себя и мойте руки.
Симптомы клебсиеллёзов
В летний период становятся актуальны заболевания вызванные инфекционными агентами.
Особенно активны микроорганизмы семейства энтеробактерий – грамотрицательные, палочкообразные, с жгутиками для передвижения и прикрепления, факультативные анаэробы: кишечная палочка, сальмонелла, клебсиелла и др. Так, клебсиелла – klebsiella, может существовать в почве, воде, месяцами оставаясь жизнеспособной, сохраняется на пище и пыли.
Клебсиеллы могут попасть в организм через желудочно-кишечный тракт, с плохо вымытых рук, овощей и фруктов, с водой, с почвой. Однако, этот микроорганизм входит в группу условно-патогенной микрофлоры и определяется у абсолютно здоровых детей и взрослых, считается одним из элементов нормальной флоры кишечника.
При этом, клебсиелла является одной из самых распространённых внутрибольничных инфекций, т.к. она устойчива к действию факторов окружающей среды, высоким температурам. Хотя, за несколько минут она гибнет от дезинфектантов, а при очень высоких температурах через 1-1,5 часа. При несоблюдении надлежащих правил гигиены, санитарных норм в помещениях, встречаются случаи заражения новорожденных клебсиеллой в роддомах. Малыш постоянно плачет и не может заснуть, его беспокоят колики и частый понос. А причина — клебсиелла – бактерия, устойчивая к губительному действию внешней среды, покрытая плотной капсулой.
Факторы развития клебсиеллеза
Клебсиеллы относятся к одному семейству с бактериями рода Serratia и Enterobacter. Этими возбудителями, особенно Serratia, обладающий наибольшей лекарственной устойчивостью, обусловливаются вспышки инфекции в стационарах, в связи с загрязнением ряда медикаментозных средств, лекарственных растворов, применяемых в терапии органов дыхания. Их трудно, но можно дифференцировать только с помощью специальных проб. Klebsiella Enterobacter и Serratia, вызывающие внутрибольничную пневмонию, инфекцию мочевого тракта, бактериемию, обладают различной чувствительностью к противомикробным препаратам.

Если защита организма человека по какой то причине ослаблена: снижен общий иммунитет, часто грипп, ОРВИ, применение антибиотиков, употребление загрязненных, некачественных продуктов, сахарный диабет, алкоголизм и др., клебсиелла начинает активно размножаться, выделять токсины, вызывая эндотоксимию и воспалительные процессы в разных органах. Развиваются такие заболевания, как воспаление легких, воспалительные заболевания мочевыводящих путей, менингит, конъюнктивит, кишечные инфекции, сепсис и достаточно редкие болезни – озена (зловонный насморк), риносклерома.
Наиболее часто клебсиелла вызывает пневмонию и поражение кишечника. У взрослых людей чаще встречается пневмония, вызванная палочкой Фридлендера. В связи с особенностью иммунитета новорожденных и недостаточностью у них нормальной микрофлоры на коже, в дыхательных путях и особенно в кишечнике — клебсиелла — Klebsiella oxytoca — чаще вызывает поражения желудочно-кишечного тракта — толстого кишечника.
Симптомы клебсиеллы (клебсиеллёза) в ЖКТ у грудничков
Симптомы клебсиеллы у малышей схожи с симптомами дисбактериоза: вздутие, метеоризм, колики, срыгивание. Но чаще проявляются — жидким стулом со слизью, кровью и резким запахом, повышением температуры, лихорадкой, болями в животе и сильным обезвоживанием организма. В зависимости от того, какой иммунитет у малыша, течение заболевания может протекать как в лёгкой форме, так и грозить тяжелыми инфекционными осложнениями. Если клебсиелла в организме быстро размножается, выделяет токсины, нарастает интоксикация, обезвоживание, то заболевание может проявиться в течение нескольких часов и потребует срочной госпитализации ребенка.
Поэтому, при любом расстройстве стула, необходимо обратиться к врачу, сдать кал ребёнка на анализ, пройти обследование, чтобы точно выявить, какие именно бактерии вызвали изменение состояния ребёнка. Большую роль в восстановлении иммунитета и нормальной микрофлоры у новорожденного играет грудное вскармливание. При высокой обсеменённости клебсиеллой и тяжёлой форме заболевания, лечении ребенка в больнице, назначают сложную терапию с применением антибиотиков. Если заболевание грудничка протекает в лёгкой форме, то для коррекции микрофлоры кишечника назначают пробиотики. Синбиотики – Нормофлорины Л и Б – обладают активным противовоспалительным, антисептическим и питательным действием, что важно при клебсиеллёзной инфекции. Ребенок может чувствовать себя нормально, а при обследовании находят в анализах повышение количества клебсиелл. Тогда препараты с лакто- и бифидобактериями назначают для вытеснения излишнего количества клебсиеллы, повышения иммунитета, улучшения собственной полезной микрофлоры.
Симптомы клебсиеллы в других органах и системах
Если клебсиеллы попадают в мочевыделительную систему, то они способны вызывать уретрит, пиелонефрит, со стойким рецидивирующим течением, плохо поддающимся терапии и часто измененной чувствительностью к антибиотикам. В редких случаях клебсиеллёза, возможно такое осложнение, как – озена — зловонный насморк, с поражением слизистой носа, образованием гнойных, болезненных, кровоточащих корок.
Симптомы и признаки инфекций мочевыводящих путей, желчного пузыря и в брюшной полости, вызываемых клебсиеллами, не отличаются от симптоматики, обусловленной кишечной палочкой. Развиваются они чаще у больных сахарным диабетом и у пациентов, получающих антимикробные препараты, к которым устойчив возбудитель заболевания. Клебсиелла является также важным этиологическим фактором септического шока.
Клебсиелла известна как фактор развития легочных заболеваний, однако, среди причин, вызывающих бактериальную пневмонию, имеет около 1% всех случаев. Встречается преимущественно у мужчин в возрасте старше 40 лет, с хроническими бронхолегочными заболеваниями, больных сахарным диабетом и лиц с алкоголизмом. У пожилых людей, грамотрицательные бактерии заселяют ротоглотку и могут распространиться по дыхательному тракту, вызывая пневмонию или гнойный бронхит.
Клинические симптомы клебсиеллёзной пневмонии сходны с проявлениями при пневмококковой пневмонии, но чаще характеризуются более тяжелым течением: внезапным началом, ознобов, стойким повышением температуры тела, продуктивным кашлем, иногда с прожилками крови и резким запахом, с сильными плевральными болями, появлением одышки. Больные часто находятся в прострации и бредовом состоянии, за счет интоксикации. Чаще всего очаг воспаления располагается в правой верхней доле легкого, но может быстро прогрессировать, если лечение не проводится и распространиться с одной доли на другую. Появляются цианоз и одышка, могут возникнуть желтуха, рвота, диарея. Выявляется, при обследовании, образование плеврального выпота, уплотнение легочной ткани, или некротизирующая пневмония, с быстрой кавернизацией. На фоне интоксикации определяется снижение количества лейкоцитов в периферической крови, а не повышение, как при воспалении. Гораздо чаще наблюдаются абсцессы и эмпиемы легких. Это объясняется способностью клебсиелл вызывать деструкцию ткани. Не всегда выявляются характерные признаки при рентгеновском обследовании: уменьшение объема легкого, его уплотнение, эмфизематозные изменения. При медленном прогрессировании инфекционного воспалительного процесса может развиться хронический некротизирующий пневмонит, напоминающий туберкулез, с продуктивным кашлем, слабостью, выраженной анемией.
Лечение клебсиеллезов
Лечение заболеваний, вызванных клебсиеллой, зависит от локализации и выраженности патологического процесса. Антибиотики назначают в тяжелых случаях по чувствительности, при легком течении или только обнаружении в анализах повышения клебсиелл — не применяют. Обязательно используют разнообразные препараты, восстанавливающие кишечную микрофлору.
Как правило, антимикробную терапию рекомендуют начинать еще до получения результатов посева и определения лекарственной чувствительности к антибиотикам. В этом случае биокомплексы Нормофлорины, содержащие продукты жизнедеятельности живых лакто- и бифидобактерий с активным антисептическим, противовоспалительным действием, оказывают лечебный эффект при клебсиеллёзах, что доказано научными исследованиями и многолетней практикой, как у новорожденных, беременных, кормящих, так и взрослых и пожилых.
Klebsiella pneumoniae (клебсиелла пневмонии)
Клебсиелла пневмонии является разновидностью грамотрицательных бактерий условно-патогенного типа. Они присутствуют в нормальной микрофлоре у человека на уровне кожи, кишечника, ротовой полости. Внешне она напоминает округлую небольших размеров палочку до 1-2 мкм, остается неподвижной, образует капсулы, споры. Расположение – скоплениями или одиночно.
В ЖКТ
Klebsiella образует колонии в кишечнике после рождения человеке в первую неделю жизни. Это нормально, лечение не требуется. Стандартно в 1 г кала выделяется около 10 5 бактерии. Этот показатель повышается при нарушении или болезнях, инфицировании ЖКТ. Прием антибиотиков ведет к подавлению патогенной флоры и нормальной, нужной человеку. Активно размножаются сапрофиты с патогенным действием. Клабсиелез в кишечнике появляется в результате:
У пациента прогрессирует гастродуоденит, гастрит, кишечная инфекция с резким началом и выраженными симптомами. Длительность тяжелого состояния – до 5 дней.
Часто Klebsiella становится причиной внутрибольничных инфекций, когда происходит массовое заражение стойкими к антибиотикам штаммами всех пациентов, персонала. Сильное поражение отмечается при слабом иммунитете, курсах химиотерапии.
Описываемая бактерия пневмонии вызывает поражения мочеполовых путей, т.к. для них всегда остается патогенной флорой. Она часто поражает влагалищную среду, особенно если пройдет курс антибиотикотерапии, нарушивший нормальную микрофлору.
Отдельного внимания заслуживает клебсиелла риносклеромы, она же – палочка Фриша-Волковича. Она влечет развитие склеромы как инфекционной болезни, охватывающей дыхательные верхние пути и слизистую носа, бронхов. Появляются инфильтраты с последующим рубцеванием.
Что касается клебсиеллы озены, она обнаруживается у 80% пациентов с диагностированной озеной, так называется зловонный насморк. Болезнь сопровождается атрофией костных стенок и слизистой в носу, из-за чего появляется секрет, при засыхании дающий зловонные корки. Такая бактерия ведет к хроническому поражению:
Лечение
Терапия клебсиеллезов основана на приеме антибиотиков, лекарств с содержанием бактериофаг. Последние оказывают избирательное действие, дают меньше эффекта, но и противопоказаний не влекут. Из пробиотиков рекомендован Энтерол. Антибиотики, проявляющие активность к бактерии, представлены норфлоксацином, гентамицином, левофлоксацином, офлоксацином. Она не восприимчива к клотримазолу.
Систематика бактерий
Klebsiella относится к семейству энтеробактерий, раннее название определено палочкой Фридлендера. Это фамилия микробиолога, сумевшего в 1882 году открыть чистую культуру.
Изначально бактерия определялась микроорганизмом, провоцирующим развитие пневмонии. По сути же это микроб условно-патогенного типа, который при нормальной ситуации пребывает в симбиозе с человеком на протяжении длительного периода. Но при нарушениях и сбоях в организме, ослабленной работе иммунной системы становится возбудителем тяжелых патологий.
В ходе проведения последних исследований по систематике клебсиел к описываемому виду бактерий принято относить следующие подвиды:
Если рассматривать МКБ-10, здесь клебсиелла пневмонии отнесена в блок В95-В98 к «Вирусным, бактериальным, иным инфекционным агентам. Имеется отдельная подрубрика типа В96.1.
Упоминается клебсиелла и в «Классе Х с Болезнями дыхательных органов J00-J99.
Klebsiella pneumoniae (клебсиелла пневмонии)

Klebsiella pneumoniae в ЖКТ человека
Klebsiella pneumoniae колонизирует кишечник современного человека в первые 5–6 дней жизни, причем основным источником Klebsiella pneumoniae являются мать и персонал родильных домов. Обнаружение Klebsiella pneumoniae в желудочно-кишечном тракте (ЖКТ) человека, в общем случае, не требует лечения. У здорового человека в 1 г кала насчитывается до 10 5 Klebsiella pneumoniae.
Причиной клебсиеллеза органов ЖКТ может быть дисбактериоз или заражение от больных инфекционной формой клебсиеллеза. Болезнь проявляется в форме острого гастрита, гастродуоденита, кишечной инфекции и характеризуется острым началом, тошнотой, рвотой, болями в животе, поносом, повышением температуры и общей слабостью. Продолжительность клебсиеллеза органов ЖКТ — 1–5 дней.
Klebsiella pneumoniae — причина внутрибольничных инфекций
Klebsiella pneumoniae и инфекции мочевыводящих путей и половой сферы
Klebsiella pneumoniae — один из распространенных возбудителей инфекционных заболеваний мочевыводящих путей. В отличие от ЖКТ или кожи, для мочевыводящих путей Klebsiella pneumoniae всегда является патогенным микроорганизмом. Среди обращающихся за амбулаторной помощью пациентов с неосложненными инфекционными заболеваниями мочевыводящих путей причиной инфекции в 6,4 % случаев является Klebsiella pneumoniae. Для пациентов с осложненными инфекционными заболеваниями мочевыводящих путей эта цифра достигает 9,4 %. Klebsiella pneumoniae в мочеполовых путях часто является следствием внутрибольничных инфекций.
Клебсиелла пневмонии может встречаться во влагалищной микрофлоре, в частности, после приёма антибиотиков, результатом которого было уничтожение нормальной микрофлоры влагалища. Клебсиелла пневмонии в мочеполовых путях часто является следствием внутрибольничных инфекций.
Клебсиелла риносклеромы
Клебсиелла озены
Лечение клебсиеллезов
Для лечения клебсиеллезов обычно применяются антибиотики. Также используются лекарственные препараты, действующим веществом которого являются бактериофаги (Бактериофаг клебсиелл пневмонии очищенный жидкий, Секстафаг и др.). Бактериофаги действуют избирательно, не имеют противопоказаний, но они менее эффективны, чем антибиотики.
Антибактериальные средства, активные в отношении Klebsiella pneumoniae (из имеющих описание в данном справочнике): левофлоксацин, норфлоксацин, офлаксацин, а также гентамицин, нафтифин и другие.
Klebsiella pneumoniae устойчива к клотримазолу.
Klebsiella pneumoniae в систематике бактерий
Вид Klebsiella pneumoniae входит в род клебсиелла (лат. Klebsiella), семейство энтеробактерии (лат. Enterobacteriaceae), порядок энтеробактерии (лат. Enterobacteriales), класс гамма-протеобактерии (лат. γ proteobacteria), тип протеобактерии (лат. Proteobacteria), царство бактерии.
Устаревшее название Klebsiella pneumoniae — палочка Фридлендера. Карл Фридлендер (нем. Carl Friedländer, 1847–1887) — немецкий микробиолог, выделивший чистую культуру Klebsiella pneumoniae в 1882 году.
Первоначально Klebsiella pneumoniae была определена, как микроорганизм вызывающий пневмонию (отсюда и ее название). Однако её роль не сводится только к инфекциям респираторной системы. В общем случае Klebsiella pneumoniae классифицируется как условно-патогенный микроб, находящийся в нормальной ситуации и в определенных органах в симбиотическом отношении с человеческим организмом, а в иных ситуациях являющийся причиной инфекционных заболеваний.
Клебсиелла
Темой нынешнего разговора будет, с точки зрения автора, королева внутрибольничных инфекций любого стационара — Klebsiella pneumonia (или палочка Фридлендера).
Автор: Трубачева Е.С., врач – клинический фармаколог
Темой нынешнего разговора будет, с точки зрения автора, королева внутрибольничных инфекций любого стационара — Klebsiella pneumoniae (или палочка Фридлендера). Да-да, автор не ошибся, именно она, а не синегнойки или ацинетки, а именно ее величество — клебсиелла, практически абсолютная убийца тяжелых и крайне тяжелых пациентов. Почему это именно так, мы сегодня и поговорим.
Микробиологические аспекты
Первое и главное, о чем надо знать, — Klebsiella pneumonia — это представитель нормальной микрофлоры кишечника. Еще раз и большими буквами — НОРМАЛЬНОЙ! Не надо ее там лечить (как и стафилококк в носоглотке) — она там живет, и это ее естественный ареал обитания.
А все остальные локации, где она может быть обнаружена: нижние дыхательные пути, мочевыводящий тракт, секрет простаты или содержимое полости матки (анальный сексуальный акт без презерватива — зло, имейте это в виду при сборе анамнеза, особенно у женщин с послеродовым эндометритом, автор такого навидался в достатке… мужчин это тоже касается, и обнаружение подобной зверюшки в секрете простаты должно навести на определенные мысли и вопросы, и пока пациент не закончит данную практику, простатит вы ему при всем желании не вылечите), кровь и в раны при раневых инфекциях после хирургического вмешательства на брюшной полости — могут указывать на возбудителя текущего состояния.
Что вызывает:
Общим у всех этих патологий является одно — они все тем или иным образом связаны с вмешательством, и чаще всего (опуская уже упомянутые анальные сексуальные акты) это вмешательство носит ятрогенный характер. Клебсиелла не умеет ни летать, ни ходить, ни даже ползать, в очаг ее приносят либо неправильно вымытые руки, либо плохо обработанное медицинское оборудование.
Эпидемиологические аспекты
Как мы уже обсуждали в статье о синегнойной палочке, при некотором желании и упертости эпидемиологической службы или клинического фармаколога (или команды из оных, так как каждый знает свое звено), извести неферментеров из стационара — не самая сложная задача. Было бы желание у администрации этим заняться. Что касается лечащих врачей и среднего персонала, то это тот случай, когда достаточно обработать перчатки и далее, на уровне ЦСО и утилизации отходов, правильно избавиться от контаминированого материала, и если инструментарий не одноразовый, то очистить и простерилизовать его. То есть даже на уровне обработанных (или стерильных) перчаток, касающихся только одной области пациента (другая область, если необходимо, требует смены перчаток, либо обработки рук с полным выдерживанием экспозиции, а не чуть-чуть антисептиком помазал-растер-побежал), вы уже снижаете риск контаминации оным зверьем с последующим развитием синегнойной инфекции. Про ацинетобактер будет отдельная глава в разделе «неферментеры».
С клебсиеллой все намного сложнее. Эта, не побоюсь громкого слова, зверища, живет в кишечниках всего персонала медицинских учреждений. И в первую очередь, как понятно из ее названия, поражает нижние дыхательные пути. А если персонал работает с антибиотиками, то клебсиелла еще и устойчивая ко всему арсеналу применяемых препаратов (это к вопросу о разумном ограничении доступа к препаратам резерва). Так как сама клебсиелла не имеет ножек и крылышек, то попадает в оные пути она двумя способами: или в случае аспирации, или на руках персонала и с оборудования. Иного не дано. При аспирации это будет личная дикая зверюшка пациента, в случае грязных шаловливых ручек или оборудования (например, эндоскопов) — клебсиелла, высеваемая в отделении в процессе микробиологического мониторинга. А если этот мониторинг углубленный, то напрямую покажет, какая именно хрюшка, выйдя из туалетной комнаты, не соизволила помыть руки, понадеявшись на перчатки. И нет, перчатки, даже стерильные в данном случае, не спасают, они не презерватив. Руки надо мыть и обрабатывать правильно, обязательно соблюдая технологию и экспозицию.
Как вы понимаете, истребить медицинский персонал мы не можем, поэтому и полностью очистить стационар от данной проблемы не получится. И она обязательно выскочит, стоит на секунду расслабиться, и выскочит на самом тяжелом больном, где еще умудрится смутировать в такого урода, которого не достанешь никаким антибиотиком.
На общемировом клебсиеллу тоже очень сильно боятся, и когда в 2010 году вдруг в Великобритании обнаружили штамм NDM (он устойчив вообще ко всему набору существующих антибиотиков и обозван абсолютным убийцей), паника была знатной. В результате проведенного эпидемиологического расследования, по итогам которого большая группа видных ученых стала персонами non-grata в Индии, было установлено, что данный штамм привезен оттуда и из Пакистана. Присутствие в сточных водах возбудителей, имеющих карбапенемазы (то есть это уже не внутрибольничная флора, это то, что там живет на улице) на момент проведения расследования составляла 90% по CTX-M15 и 36% по NDM. С чем связан сей факт? С безрецептурным масштабным использованием карбапенемов и… проблемами с проточной канализацией. Ее либо нет, либо ей не пользуются, а делают все по старинке. А так как земной шар оказался очень маленьким, теперь NDM-штаммы обнаруживаются по всей планете. У нас, например, очень быстро данным штаммом заселились клиники Санкт-Петербурга. И медицина перед ними бессильна. До тех пор, пока не налажен эпиднадзор, а персонал не моет руки после каждого посещения туалета.
Так как любого врага надо знать в лицо, то наиболее часто встречаемые портреты у автора тоже есть.
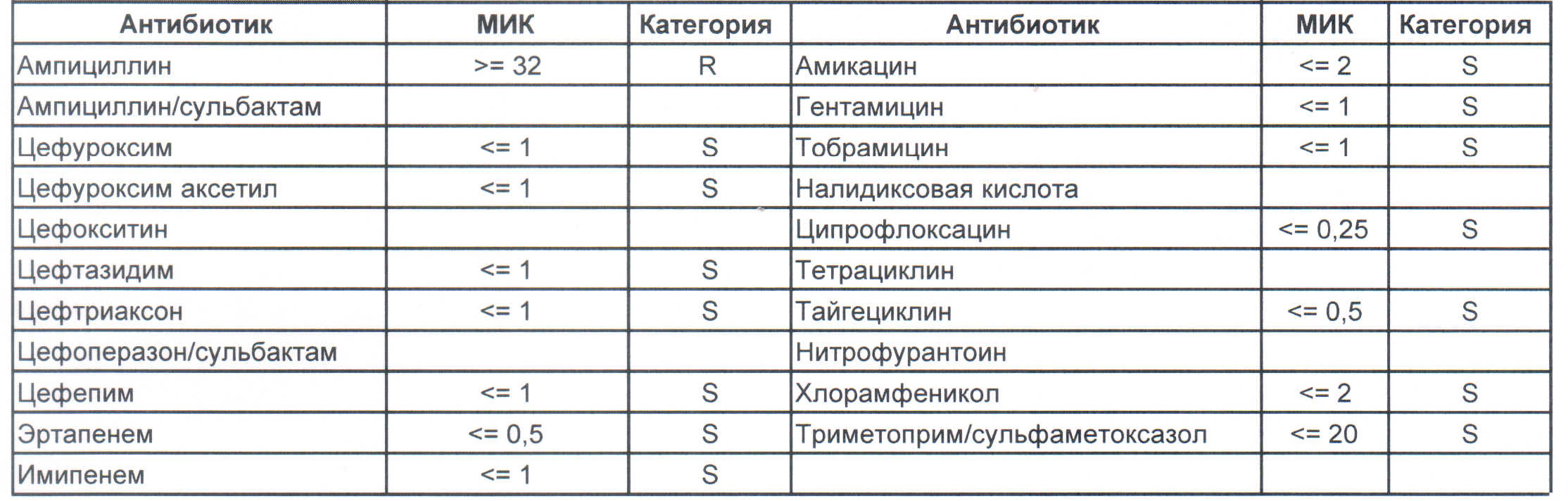
Итак, дикая и ничем ни разу не пуганная клебсиелла выглядит вот так:
Где встречается? Те самые послеродовые эндометриты, как результат плотских утех, простатиты, а также раневые инфекции после оперативных вмешательств на брюшной полости у ранее не леченных пациентов.
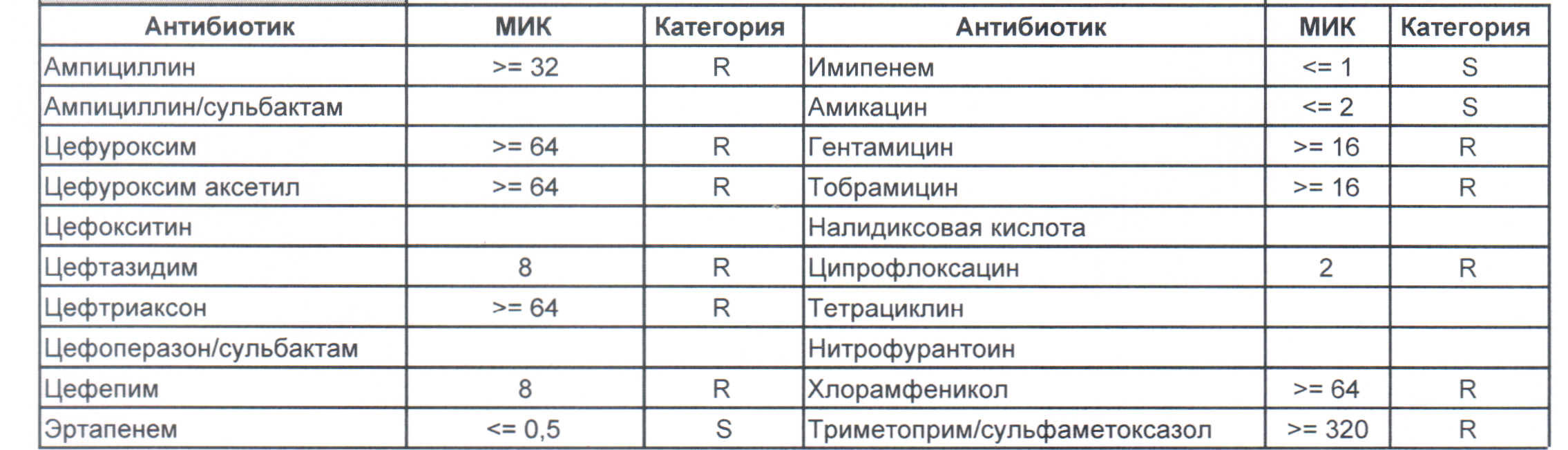
— вы можете увидеть устойчивый внутрибольничный штамм, который еще можно чем-то полечить, но это будет тяжело и дорого, проще персонал научить руки мыть и бороды брить (фекальной микрофлоры в мужских бородах в таком достатке, что единственный вариант для тех, кто хоть как-то соприкасается с ранами, данное украшение не носить или не оперировать).
На следующей картинке:
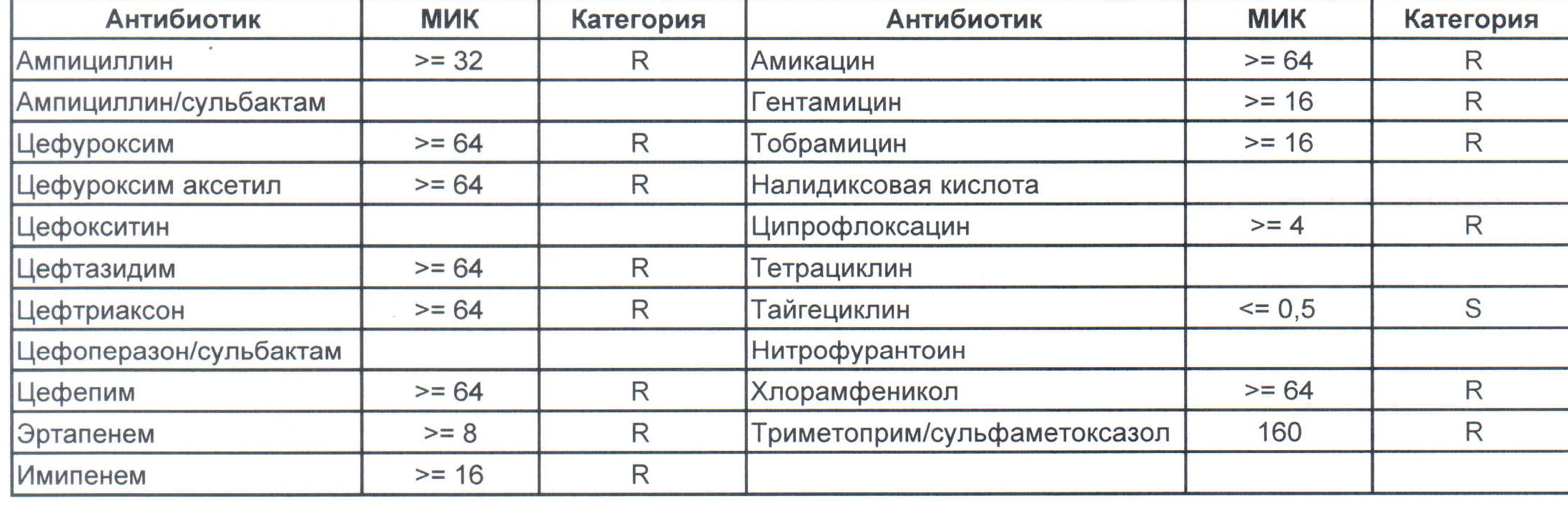
— мы видим практически неубиваемого зверя, который сам по себе вбивает тот самый последний гвоздь в гроб пациента. Но как же Тигециклин, спросите вы. Отвечу — тигацил является бактериостатиком, и пока он наберет необходимую силу, пациента уже отнесут и закопают. Но даже это еще не предел. Предел на следующем рисунке, и нет, Имипенем при указанной MIC уже бессилен:
Как вы понимаете — эти два зверя являются абсолютными убийцами, против которых в данный момент медицина бессильна полностью. И именно такое зверье живет в стационарах без микробиологического мониторинга и систем противостояния в виде эпидемического надзора. Именно эти звери убивают самых тяжелых пациентов, если каким-то образом (руки персонала или плохо обработанное оборудование) в них попали. Но что хуже всего, эти штаммы способны передавать свои факторы устойчивости другой грамотрицательной флоре, например, кишечным палочкам, а потому пациенты, инфицированные такими клебсиеллами, должны быть полностью изолированы и карантинизированы. Спасти их, скорее всего, не получится, но хотя бы всех остальных оградите от инфицирования и последующего летального исхода, да и сами такую зверюшку не подцепите (как вы помните «врач — это диагноз», так не будем его себе усложнять).
Чем лечить?
Дикая клебсиелла отлично лечится препаратами группы цефалоспоринов третьего ряда.
А вот внутрибольничную можно побороть, только четко понимая, с чем вы имеете дело, и обычный диско-дифузионный метод диагностики тут не поможет. Нужны автоматизированные системы с определением MIC. Но во главе угла все равно стоит инфекционная безопасность пациентов. Коллеги! Автор понимает, что выглядит «городской сумасшедшей», коим в свое время был объявлен Земмельвейс, но он вас умоляет — мойте руки после посещения туалета и мойте их правильно. Вам это ничего не стоит, а пациенты выживут. Ничего более эффективного против внутрибольничных клебсиелл пока не придумано. А эпидемиологи ваших учреждений будут проводить свои работы по контролю и дезинфекции отделений и целых зданий. Так получилось, что именно эту королеву ВБИ мы, врачи, медсестры и младший персонал, носим исключительно в себе. Берегите себя, своих близких и своих пациентов, тем более в это нелегкое для отечественной медицины время, с угрозой введения врачебных статей в УК. Клебсиелла — это почти всегда чистая ятрогения. Повторюсь — берегите себя и мойте руки.
Симптомы клебсиеллёзов
В летний период становятся актуальны заболевания вызванные инфекционными агентами.
Особенно активны микроорганизмы семейства энтеробактерий – грамотрицательные, палочкообразные, с жгутиками для передвижения и прикрепления, факультативные анаэробы: кишечная палочка, сальмонелла, клебсиелла и др. Так, клебсиелла – klebsiella, может существовать в почве, воде, месяцами оставаясь жизнеспособной, сохраняется на пище и пыли.
Клебсиеллы могут попасть в организм через желудочно-кишечный тракт, с плохо вымытых рук, овощей и фруктов, с водой, с почвой. Однако, этот микроорганизм входит в группу условно-патогенной микрофлоры и определяется у абсолютно здоровых детей и взрослых, считается одним из элементов нормальной флоры кишечника.
При этом, клебсиелла является одной из самых распространённых внутрибольничных инфекций, т.к. она устойчива к действию факторов окружающей среды, высоким температурам. Хотя, за несколько минут она гибнет от дезинфектантов, а при очень высоких температурах через 1-1,5 часа. При несоблюдении надлежащих правил гигиены, санитарных норм в помещениях, встречаются случаи заражения новорожденных клебсиеллой в роддомах. Малыш постоянно плачет и не может заснуть, его беспокоят колики и частый понос. А причина — клебсиелла – бактерия, устойчивая к губительному действию внешней среды, покрытая плотной капсулой.
Факторы развития клебсиеллеза
Клебсиеллы относятся к одному семейству с бактериями рода Serratia и Enterobacter. Этими возбудителями, особенно Serratia, обладающий наибольшей лекарственной устойчивостью, обусловливаются вспышки инфекции в стационарах, в связи с загрязнением ряда медикаментозных средств, лекарственных растворов, применяемых в терапии органов дыхания. Их трудно, но можно дифференцировать только с помощью специальных проб. Klebsiella Enterobacter и Serratia, вызывающие внутрибольничную пневмонию, инфекцию мочевого тракта, бактериемию, обладают различной чувствительностью к противомикробным препаратам.

Если защита организма человека по какой то причине ослаблена: снижен общий иммунитет, часто грипп, ОРВИ, применение антибиотиков, употребление загрязненных, некачественных продуктов, сахарный диабет, алкоголизм и др., клебсиелла начинает активно размножаться, выделять токсины, вызывая эндотоксимию и воспалительные процессы в разных органах. Развиваются такие заболевания, как воспаление легких, воспалительные заболевания мочевыводящих путей, менингит, конъюнктивит, кишечные инфекции, сепсис и достаточно редкие болезни – озена (зловонный насморк), риносклерома.
Наиболее часто клебсиелла вызывает пневмонию и поражение кишечника. У взрослых людей чаще встречается пневмония, вызванная палочкой Фридлендера. В связи с особенностью иммунитета новорожденных и недостаточностью у них нормальной микрофлоры на коже, в дыхательных путях и особенно в кишечнике — клебсиелла — Klebsiella oxytoca — чаще вызывает поражения желудочно-кишечного тракта — толстого кишечника.
Симптомы клебсиеллы (клебсиеллёза) в ЖКТ у грудничков
Симптомы клебсиеллы у малышей схожи с симптомами дисбактериоза: вздутие, метеоризм, колики, срыгивание. Но чаще проявляются — жидким стулом со слизью, кровью и резким запахом, повышением температуры, лихорадкой, болями в животе и сильным обезвоживанием организма. В зависимости от того, какой иммунитет у малыша, течение заболевания может протекать как в лёгкой форме, так и грозить тяжелыми инфекционными осложнениями. Если клебсиелла в организме быстро размножается, выделяет токсины, нарастает интоксикация, обезвоживание, то заболевание может проявиться в течение нескольких часов и потребует срочной госпитализации ребенка.
Поэтому, при любом расстройстве стула, необходимо обратиться к врачу, сдать кал ребёнка на анализ, пройти обследование, чтобы точно выявить, какие именно бактерии вызвали изменение состояния ребёнка. Большую роль в восстановлении иммунитета и нормальной микрофлоры у новорожденного играет грудное вскармливание. При высокой обсеменённости клебсиеллой и тяжёлой форме заболевания, лечении ребенка в больнице, назначают сложную терапию с применением антибиотиков. Если заболевание грудничка протекает в лёгкой форме, то для коррекции микрофлоры кишечника назначают пробиотики. Синбиотики – Нормофлорины Л и Б – обладают активным противовоспалительным, антисептическим и питательным действием, что важно при клебсиеллёзной инфекции. Ребенок может чувствовать себя нормально, а при обследовании находят в анализах повышение количества клебсиелл. Тогда препараты с лакто- и бифидобактериями назначают для вытеснения излишнего количества клебсиеллы, повышения иммунитета, улучшения собственной полезной микрофлоры.
Симптомы клебсиеллы в других органах и системах
Если клебсиеллы попадают в мочевыделительную систему, то они способны вызывать уретрит, пиелонефрит, со стойким рецидивирующим течением, плохо поддающимся терапии и часто измененной чувствительностью к антибиотикам. В редких случаях клебсиеллёза, возможно такое осложнение, как – озена — зловонный насморк, с поражением слизистой носа, образованием гнойных, болезненных, кровоточащих корок.
Симптомы и признаки инфекций мочевыводящих путей, желчного пузыря и в брюшной полости, вызываемых клебсиеллами, не отличаются от симптоматики, обусловленной кишечной палочкой. Развиваются они чаще у больных сахарным диабетом и у пациентов, получающих антимикробные препараты, к которым устойчив возбудитель заболевания. Клебсиелла является также важным этиологическим фактором септического шока.
Клебсиелла известна как фактор развития легочных заболеваний, однако, среди причин, вызывающих бактериальную пневмонию, имеет около 1% всех случаев. Встречается преимущественно у мужчин в возрасте старше 40 лет, с хроническими бронхолегочными заболеваниями, больных сахарным диабетом и лиц с алкоголизмом. У пожилых людей, грамотрицательные бактерии заселяют ротоглотку и могут распространиться по дыхательному тракту, вызывая пневмонию или гнойный бронхит.
Клинические симптомы клебсиеллёзной пневмонии сходны с проявлениями при пневмококковой пневмонии, но чаще характеризуются более тяжелым течением: внезапным началом, ознобов, стойким повышением температуры тела, продуктивным кашлем, иногда с прожилками крови и резким запахом, с сильными плевральными болями, появлением одышки. Больные часто находятся в прострации и бредовом состоянии, за счет интоксикации. Чаще всего очаг воспаления располагается в правой верхней доле легкого, но может быстро прогрессировать, если лечение не проводится и распространиться с одной доли на другую. Появляются цианоз и одышка, могут возникнуть желтуха, рвота, диарея. Выявляется, при обследовании, образование плеврального выпота, уплотнение легочной ткани, или некротизирующая пневмония, с быстрой кавернизацией. На фоне интоксикации определяется снижение количества лейкоцитов в периферической крови, а не повышение, как при воспалении. Гораздо чаще наблюдаются абсцессы и эмпиемы легких. Это объясняется способностью клебсиелл вызывать деструкцию ткани. Не всегда выявляются характерные признаки при рентгеновском обследовании: уменьшение объема легкого, его уплотнение, эмфизематозные изменения. При медленном прогрессировании инфекционного воспалительного процесса может развиться хронический некротизирующий пневмонит, напоминающий туберкулез, с продуктивным кашлем, слабостью, выраженной анемией.
Лечение клебсиеллезов
Лечение заболеваний, вызванных клебсиеллой, зависит от локализации и выраженности патологического процесса. Антибиотики назначают в тяжелых случаях по чувствительности, при легком течении или только обнаружении в анализах повышения клебсиелл — не применяют. Обязательно используют разнообразные препараты, восстанавливающие кишечную микрофлору.

Как правило, антимикробную терапию рекомендуют начинать еще до получения результатов посева и определения лекарственной чувствительности к антибиотикам. В этом случае биокомплексы Нормофлорины, содержащие продукты жизнедеятельности живых лакто- и бифидобактерий с активным антисептическим, противовоспалительным действием, оказывают лечебный эффект при клебсиеллёзах, что доказано научными исследованиями и многолетней практикой, как у новорожденных, беременных, кормящих, так и взрослых и пожилых.
Неосложненные инфекции нижних мочевых путей. Новые данные по резистентности возбудителей. Новые подходы к терапии
| В начале декабря в Москве состоялось заседание Дискуссионного клуба, посвященное проблеме лечения неосложненных инфекций нижних мочевых путей (НИМП). Модератор круглого стола, организованного при поддержке компании «Замбон», д.м.н., заместитель директора НИИуронефрологии и репродуктивного здоровья человека ГОУ ВПО «Первый МГМУ им. И.М. Сеченова» Андрей Зиновьевич ВИНАРОВ актуализировал необходимость междисциплинарного подхода к решению проблем профилактики и терапии НИМП: «Если неправильно поставлен диагноз, неверно назначен препарат, сроки или схема лечения, инфекция нередко становится рецидивирующей. Как подобрать терапию при НИМП? Этим вопросом ежедневно задаются урологи, гинекологи и терапевты. Чтобы обсудить новые подходы к лечению и профилактике острых и рецидивирующих циститов, мы пригласили ведущих специалистов в этой области». |  |
| Современные подходы к терапии НИМП |
Культуральное исследование мочи проводят при подозрении на острый пиелонефрит, отсутствии купирования симптомов, возникновении рецидива в течение 2 недель, при атипичных симптомах, а также при проведении научных и эпидемиологических исследований. Европейская ассоциация урологов (EAU) в 2007 г. приняла решение, согласно которому при наличии бактерий в количестве 1000 и более КОЕ/мл в средней порции утренней мочи при самостоятельном мочеиспускании у женщин диагностируется острый неосложненный цистит. При количестве бактерий порядка 10 000 и более КОЕ/мл в средней порции мочи диагностируется острый неосложненный пиелонефрит. Если же количество бактерий в двух средних порциях мочи, взятых с промежутком в 24 часа, составляет 100 000 и более КОЕ/мл, диагностируется асимптоматическая бактериурия. Как отметила докладчица, в России этот диагноз почти никогда не ставят, вместо этого ставится диагноз «хронический пиелонефрит», который в большинстве случаев оказывается ошибочным.
Более точные сведения о структуре возбудителей внебольничной ИМП содержат результаты исследования ДАРМИС (2011), проведенного в лечебных учреждениях 20 городов России, Беларуси и Казахстана, в ходе которого были изучены 987 штаммов возбудителей ИМП (табл. 1).
Таблица 1. Структура возбудителей внебольничной ИМП
| № п/п | Возбудитель | Доля, % |
| 1 | Escherichia coli | 64,57 |
| 2 | Klebsiella spp. | 9,5 |
| 3 | Enterococcus spp. | 6,46 |
| 4 | Staphylococcus spp. | 5,1 |
| 5 | Proteus mirabilis | 4,08 |
| 6 | Pseudomonas aeruginosa | 2,72 |
| 7 | Enterobacter spp. | 1,7 |
| 8 | Другие | 5,87 |
При выборе антибиотиков для лечения неосложненной ИНМП необходимо учитывать целый ряд факторов. К ним относятся спектр и чувствительность уропатогенов, эффективность антибиотиков в клинических исследованиях, переносимость препаратов, побочные эффекты, стоимость и доступностьпрепарата. Антибиотики должны создавать высокую концентрацию в моче и в то же время оказывать минимальное побочное действие на микрофлору кишечника и влагалища. Следует избегать назначения антибиотиков, характеризующихся плохим всасыванием из кишечника.
Одна из главных проблем в лечении НИМП заключается в использовании антибиотиков системного действия. Это способствует росту резистентности штаммов ведущих возбудителей и значительно ограничивает эффективность любого вида антибактериальной терапии. Чувствительность штаммов E. coli к антибиотикам изучалась в ходе исследования ARESC (2006), проводившегося в 10 странах. Установлено, что чувствительность E. coli к фосфомицину составляла более 98% во всех исследуемых регионах. Чувствительность к нитрофурантоину превышала 95% в 6 из 10 стран. Чувствительность к мециллинаму (этот препарат не зарегистрирован в России) превосходила 95% в 5 из 10 стран. Чувствительность к ципрофлоксацину составила более 95% в 3 из 10 стран.
В России, по данным за 20042005 гг., резистентность E. coli, выделенной у пациенток с неосложненной амбулаторной ИМП, к нитрофурантоину была равна нулю и в Москве, и в Петербурге, и в Новосибирске. Резистентность к фторхинолонам в Петербурге и Новосибирске также оказалась нулевой, но в Москве составляла 6,3%. Довольно высокой оказалась резистентность к котримоксазолу (25% в Новосибирске, 18,8% в Москве и 16,7% в Петербурге) и особенно к ампициллину (43,7% в Москве, 25% в Новосибирске и 22% в Петербурге).
Более поздние данные, полученные в 2010-2011 гг. в России, Беларуси и Казахстане, продемонстрировали рост резистентности E. coli к антибиотикам (табл. 2).
Таблица 2. Резистентность E. coli, выделенной у пациентов с внебольничной ИМП
| № п/п | Антибиотик | Резистентность E. coli, % | Резистентность всех возбудителей, % |
| 1 | Ампициллин | 36,8 | 45,1 |
| 2 | Ко-амоксиклав | 7,4 | 12,6 |
| 3 | Налидиксовая кислота | 13,2 | 22,8 |
| 4 | Ко-тримоксазол | 22,6 | 25,2 |
| 5 | Фторхинолоны | 9,5 | 19,2 |
| 6 | Цефиксим | 5,3 | 14,7 |
| 7 | БЛРС | 9,6 | 13,3 |
| 8 | Фуразидин | 0,5 | 2,9 |
| 9 | Фосфомицин | 1,1 | 2,1 |
| 10 | Амикацин | 0 | 1,5 |
| 11 | Карбапенемы | 0 | 0 |
По данным Европейской ассоциации урологии, уровень резистентности E. coli к триметоприм/сульфаметоксазолу (ТМП/СМХ), налидиксовой кислоте и ампициллину/ амоксициллину превышает 20%. Устойчивость к коамоксиклаву, фторхинолонам и цефалоспоринам составляет примерно 10%. По мнению экспертов Европейской ассоциации урологии, препараты, резистентность к которым у E. coli превышает 20%, не следует назначать для лечения НИМП. Препараты, резистентность к которым составляет от 10 до 20%, можно рассматривать как альтернативные, но не как основные.
Антимикробные препараты, широко применяемые в лечении других заболеваний, назначать при НИМП нежелательно. В числе этих препаратов профессор Т.С. Перепанова назвала аминопенициллины, фторхинолоны и цефалоспорины.
Таблица 3. Антибиотики, рекомендованные Европейской ассоциацией урологии для лечения острого цистита (2011)
| № п/п | Препарат | Доза | Курс |
| 1 | Фосфомицина трометамол | 3 г | 1 день |
| 2 | Нитрофурантоин | 50 мг каждые 6 ч | 7 дней |
| 3 | Нитрофурантоин (макрокристаллы) | 100 мг 2 раза в сутки | 5–7 дней |
| 4 | Пивмециллинам | 400 мг 2 раза в сутки | 3 дня |
В качестве альтернативных препаратов в рекомендациях указаны ципрофлоксацин, левофлоксацин, норфлоксацин, офлоксацин и цефлодоксима проксетил.
Диагноз «асимптоматическая бактериурия/кандидурия» ставится в тех случаях, когда в 2 культуральных исследованиях с промежутком в 24 часа и более количество бактерий в средней порции мочи составляет более 100 000 КОЕ/мл (при отсутствии катетера, по крайней мере, в течение 7 дней перед исследованиями). Но в России, как уже отмечала докладчица, бессимптомная бактериурия расценивается как хронический пиелонефрит, что является ошибкой.
Эпидемиологические данные свидетельствуют, что бессимптомная бактериурия наблюдается примерно у 6% беременных, гораздо чаще, чем острый цистит (1-2%) или острый пиелонефрит (1-2,5%). При этом многие лекарственные препараты не показаны беременным. К их числу относятся сульфаниламиды, триметоприм, аминогликозиды, хинолоны и фторхинолоны, нитроксолин. В III триместре беременности исключаются нитрофураны. Для лечения инфекции нижних отделов мочевыводящих путей у беременных рекомендованы только пенициллины, цефалоспорины и фосфомицина трометамол.
Рекомендуемые схемы антибактериальной терапии инфекций нижних отделов мочевыводящих путей у беременных:
Ведение беременных с инфекцией нижних отделов НМП, будь то бессимптомная бактериурия или острый цистит, начинается с 7-дневного курса терапии или одной дозы фосфомицина. Через 7-14 дней проводят культуральное исследование мочи. Если возбудители не выявлены, лечение считается успешно завершенным. При обнаружении возбудителей назначается повторный курс терапии с бактериологическим контролем, который проводится ежемесячно до наступления родов даже при отсутствии возбудителей в моче. При наличии патогенных микроорганизмов после повторного курса терапии назначают супрессивную терапию за 2 недели до родов и в течение 2 недель после с ежемесячным бактериологическим контролем.
Профессор Т.С. Перепанова высказалась против чрезмерного применения антибиотиков при хронической инфекции нижних отделов мочевыводящих путей (МВП) у беременных. По ее мнению, лучше назначать курс лечения антибиотиками только в период обострения, в противном случае это способствует естественному отбору возбудителей на резистентность.
По имеющимся данным, в России при лечении антибиотиками инфекций нижних отделов МВП у беременных назначают преимущественно фосфомицин (41,8%), поскольку данный препарат безопасен. Прием 1 дозы Монурала 1 раз в 10 дней в течение 3 месяцев является наилучшим вариантом терапии. В то же время довольно часто беременным назначают препараты, которые им абсолютно не показаны (нитроксолин, нитрофураны, фторхинолоны), и этот факт не может не беспокоить, отметила в заключение профессор Т.С. Перепанова.
| Рецидивирующие инфекции нижних мочевых путей у женщин. Актуальные вопросы диагностики, лечения и профилактики |

в особенности урологов и гинекологов. «Если использовать комплексный подход к анализу жалоб пациентов, а также общий план обследования этих больных, диагностических ошибок будет гораздо меньше», – заявила Л.А. Синякова.
Докладчица привела эпидемиологические данные. Около 20–25% женщин переносят цистит в той или иной форме, а 10% страдают хроническим рецидивирующим циститом. Частота рецидивов после первого эпизода цистита составляет 50%. Рецидивы обычно наблюдаются чаще трех раз в год.
В США ежегодно около 8 млн женщин обращаются к врачам с симптомами инфекции МВП. У девочек цистит диагностируется в 3 раза чаще, чем у мальчиков, и выявляется, главным образом, в возрасте от 4 до 12 лет.
Аномалии расположения наружного отверстия уретры служат фактором риска развития рецидивирующей и хронической инфекции МВП. Влагалищная дистопия выявлена у 43% больных, страдающих хроническим пиелонефритом с детского возраста, и у 26% больных с рецидивирующими ИНМП. У 87,5% женщин, у которых есть «вагинализация уретры» вследствие влагалищной дистопии, отмечаются инфекции, передаваемые половым путем. К факторам риска развития урогенитальных заболеваний относятся раннее начало половой жизни, количество половых партнеров свыше трех, аборты.
Одной из причин развития цистита и дизурии может быть генитальный герпес. При этом заболевании дизурия развивается в 58% случаев, цистит – в 47%, поражение шейки матки – в 88%. У беременных женщин при первой атаке генитального герпеса риск заражения плода достигает 50%, при рецидиве он снижается до 5%. «Таким образом, часть детей инфицированы этим вирусом с рождения», – отметила доктор Л.А. Синякова.
Опросы больных позволили уточнить особенности течения циститов на фоне урогенитальных инфекций. 32% больных жаловались на поллакиурию (до 11–14 раз в сутки) вне периода обострений. 96% женщин отмечали боли во время полового акта (диспареуния), в связи с чем 92% избегали сексуальных отношений. У 86% опрошенных женщин наблюдались умеренные и выраженные боли в области мочевого пузыря, малого таза, влагалища, промежности, уретры, которые становились причиной сексуальной и социальной дезадаптации. Наличие императивных позывов к мочеиспусканию отмечали 88% женщин, однако как «выраженные» их оценили
только 28% больных.
Опросы также показали неэффективность традиционной антибактериальной терапии. Одна из причин связана с неправильной диагностикой. Профессор Л.А. Синякова подчеркнула, что боль в мочевом пузыре при мочеиспускании и боль в мочевом пузыре при его наполнении являются симптомами двух разных заболеваний. Если одним больным можно проводить обычную цистоскопию в амбулаторных условиях, то в других случаях (при подозрении на терстициальный цистит) необходимо тщательно обследовать мочевой пузырь под наркозом. Докладчица также решительно высказалась в пользу биопсии при серьезных заболеваниях мочевого пузыря. Резистентность патогенных микроорганизмов к антибиотикам – одна из самых серьезных проблем здравоохранения, которая становится причиной гибели до 25 000 пациентов ежегодно только в Европе и связана с дополнительными расходами в размере 15 млрд евро.
| Монурель рекомендован в следующих случаях: для усиления эффекта антибиотикотерапии – по 1 таблетке в день течение недели; для профилактики развития рецидивирующих ИМП при неблагоприятных условиях – по 1 таблетке в день в течение неблагоприятного периода; как средство профилактики при часто рецидивирующих циститах (более 3 эпизодов в год) – по 1 таблетке в день 2 недели в течение 3 месяцев. Длительный прием препарата обеспечивает устойчивый противорецидивный эффект. |
Одна из причин резистентности – быстрый отбор штаммов, устойчивых к широко используемым препаратам. Американское сообщество по инфекционным болезням и Евросоюз планируют к 2020 г. создать 10 новых антибактериальных препаратов, которые будут обладать активностью к таким основным возбудителям, как кишечная палочка, продуцирующая беталактамазы расширенного спектра действия, стафилококк, клебсиелла и ряд других.
Другая причина резистентности связана с тем, что многие патогены обладают способностью к образованию биопленок. При наличии биопленок концентрация антибиотика, необходимая для эффективного лечения, повышается в сотни раз. При этом внутрь биопленок проникает очень малое количество молекул препаратов.
Л.А. Синякова привела результаты собственных исследований. Произведен посев биоптатов мочевого пузыря у 42 обследованных пациенток. У 20 из них отсутствовала бактериурия. В результате посева в 40 случаях получен рост микрофлоры в количестве 1000–100000 КОЕ/мл. Оценивали способность выделенных культур к образованию биопленки на абиогенных носителях в режиме бактериального анализатора BioTrack 4250. Результаты приведены в таблице 4.
Таблица 4. Патогенные микроорганизмы и образование биопленок
| № п/п | Микроорганизм | Выделенные культуры (n = 50) | Образование биопленок (n = 38) |
| 1 | Staphylococcus spp. | 7 | 6 |
| 2 | Enterococcus spp. | 4 | 3 |
| 3 | Kocuria spp. | 7 | 7 |
| 4 | Acinetobacter spp. | 7 | 5 |
| 5 | Klebsiella pneumoniae | 6 | 4 |
| 6 | Proteus mirabilis | 4 | 3 |
| 7 | Pseudomonas aeruginosa | 5 | 5 |
| 8 | Burkholderia cepacia | 5 | 5 |
| 9 | Flavimonas oryzihabitans | 2 | — |
| 10 | Brevundimonas vesicularis | 3 | — |
Л.А. Синякова обратила внимание слушателей на тот факт, что ни в одном случае в биоптатах мочевого пузыря у пациенток, страдающих рецидивирующим циститом, не высевалась кишечная палочка.
Алгоритм обследования пациенток со стойкой дизурией разработан кафедрой урологии и хирургической андрологии РМАПО в 2005 г., но серьезно переработан в 2011 г. в соответствии результатами новых исследований. Он включает, прежде всего, тщательно собранный анамнез. Необходимо проверить наличие таких факторов риска, как раннее начало половой жизни, частая смена половых партнеров, наличие инвазивных манипуляций, сопутствующие хронические гинекологические заболевания, вирусные инфекции (герпес, цитомегаловирус), дисбиоз влагалища.
Пациентки должны заполнять дневники мочеиспускания. Нужен влагалищный осмотр. Большое значе ние имеет общий анализ мочи. Производится посев мочи на флору и чувствительность к антибиотикам. Необходимо обследование на наличие инфекций, передаваемых половым путем (ИППП). Принципиально важно исследовать мазки из уретры, влагалища и цервикального канала, подчеркнула Л.А. Синякова. Алгоритм диагностики включает ультразвуковое исследование (УЗИ) почек, мочевого пузыря с определением остаточной мочи, матки и придатков. Проводят и допплерографию сосудов малого таза. Необходима также цистоскопия с биопсией.
Нормальная микрофлора влагалища – это микроэкологическая система, обеспечивающая защиту репродуктивных органов женщины.
Ведущую роль в ней играют лактобактерии (95%) – L. acidofilus, L. plantarum, L. casei, L. fermentus, L. salivarius и др. Кроме них, в состав этой микрофлоры входят и другие
микроорганизмы (5%) – бифидобактерии, пептококки, бактероиды, эпидермальные стафилококки, коринебактерии, гарднереллы, мобилункус, микоплазмы. Посев отделяемого из влагалища позволяет выявить, в норме ли микрофлора. «Если лактобактерий недостаточно, преобладает патогенная микрофлора, ее необходимо устранить, а потом восстанавливать нормальную флору влагалища», – объяснила профессор Л.А. Синякова.
Лечение НИМП включает целый ряд различных подходов. Этиологическое лечение – это антибактериальная терапия. Патогенетическое лечение включает коррекцию анатомических нарушений, лечение ИППП и коррекцию гормональных нарушений (применение эстрогенов в перименопаузе). Кроме того, определенное значение имеют посткоитальная профилактика, лечение воспалительных и дисбиотических гинекологических заболеваний, коррекция гигиенических и сексуальных факторов, коррекция иммунных нарушений и местное лечение. Однако первостепенное значение, по убеждению докладчицы, имеет антибактериальная терапия. Поскольку рецидивиру ющий цистит – инфекционное заболевание, только антимикробныепрепараты способны победить ин-фекцию и устранить причину заболевания.
Терапия НИМП антибиотиками преследует следующие основные цели: быстрое купирование симптомов, восстановление трудоспособности и социальной активности, предупреждение осложнений и профилактика рецидивов.
При рецидивирующем цистите необходим длительный курс антибактериальной терапии. Препарат выбирают с учетом выделенного возбудителя и антибиотикограммы. Антибиотики должны обладать сильным бактерицидным действием. Препаратами выбора являются фосфомицина трометамол (по 3 г 1 раз в 10 дней в течение 3 месяцев), Фурамаг, защищенные пенициллины, цефалоспорины (у детей и беременных), препараты бактериофагов, фторхинолоны.
Ключевое звено патогенеза ИМП – адгезия возбудителя (чаще всего E. coli) к клеткам уроэпителия благодаря взаимодействию между ворсинками бактерии и рецепторами эпителия. Монурал (фосфомицина трометамол) в субингибирующих концентрациях активно подавляет адгезивные свойства грамположительных и грамотрицательных бактерий на эпителиальных клетках мочевых путей.
Для профилактики ИМП Европейская ассоциация урологии рекомендует (2010) длительное применение низких профилактических доз антибиотиков, вакцинопрофилактику или использование экстракта клюквы (Vaccinium macrocarpon) ежесуточно в количестве, содержащем как минимум 36–72 мг проантоцианидина A. Из этих рекомендаций профессор Л.А. Синякова решительно отвергла применение низких доз антибиотиков, поскольку это способствует отбору резистентных штаммов возбудителей.
Для повседневной практики рекомендуется ежедневное употребление клюквы. Однако содержание проантоцианидинов в свежей клюкве или клюквенном морсе неизвестно. Именно поэтому используют препарат Монурель, который состоит из экстракта клюквы и витамина С, содержит 36 мг проантоцианидина А и обладает профилактическим действием. Он препятствует адгезии кишечной палочки к клеткам уротелия. Монурель рекомендован в следующих случаях: для усиления эффекта антибиотикотерапии – по 1 таблетке в день течение недели; для профилактики развития рецидивирующих ИМП при неблагоприятных условиях – по 1 таблетке в день в течение неблагоприятного периода; как средство профилактики при часто рецидивирующих циститах (более 3 эпизодов в год) – по 1 таблетке в день 2 недели в течение 3 месяцев. Длительный прием препарата обеспечивает устойчивый противорецидивный эффект.
В заключение своего выступления профессор Л.А. Синякова напомнила о наиболее важных аспектах лечения НИМП. Во-первых, все пациентки со стойкой дизурией должны проходить комплексное обследование, включающее цистоскопию с биопсией и морфологическим исследованием биоптата. Морфологическое исследование позволяет определить степень диспластических процессов в уротелии, выраженность изменений в субэпителиальной основе, планировать вид и длительность терапии. Во-вторых, назначение эмпирической системной и внутрипузырной терапии женщинам со стойкой дизурией является недопустимым.
| Синдром болезненного мочевого пузыря / интерстициальный цистит и инфекции мочевых путей. Современный взгляд на проблему |

Интерстициальный цистит (ИЦ) относится к важнейшим причинам дизурии. Помимо дизурии симптомом интерстициального цистита являются мучительные тазовые боли, на сегодняшний день ИЦ – одна из четырех наиболее часто встречающихся причин тазовых болей у женщин. 9 млн женщин в США страдают от хронической тазовой боли, значительную долю среди них составляют больные ИЦ.
В течение многих лет обсуждается роль лейкоплакии, эта тема об-суждалась еще на первом заседании Московского общества урологов в 1923 г. Однако до сих пор до
конца не выяснены как причины возникновения этого явления, таки степень его связи с воспалением. В Швейцарии проведено клиническое исследование с участием
103 пациенток в возрасте от 21 до 84 лет (средний возраст – 46 лет). Симптомы нижних мочевых путей (СНМП) у них наблюдались в среднем на протяжении 5 лет.
При цистоскопии обнаружено наличие лейкоплакии в треугольнике Льето. Положительная урокультура отмечена в 15%, а лейкоцитурия – в 30% случаев.
Курс лечения включал прием доксициклина по 100 мг 2 раза в сутки в течение 2 недель, а затем по 100 мг 1 раз в день в течение еще 2 недель. Одновременно проводилась профилактика кандидоза влагалища таблетками гексетидина или циклопироксоламина в течение 10 дней. Аналогичному лечению подвергались и сексуальные партнеры пациенток, использование презерватива во время полового акта было обязательным на протяжении 4 недель. Через 3 месяца из 103 пациенток 31 (30%) считали себя вылеченными. 42 женщины (41%) отмечали улучшение. В то же время 29 пациенток (28%) не отметили изменений, а 1 (1%) сообщила об усилении СНМП. У 8 из 31 пациентки (26%) при контрольной цистоскопии наблюдался полный регресс лейкоплакии в треугольнике Льето. В 12 случаях (39%)
отмечено уменьшение степени выраженности симптомов лейкоплакии. В 10 случаях (32%) цистоскопическая картина не изменилась.
Вывод швейцарских медиков: данное лечение следует предпринять прежде, чем ставить диагноз «интерстициальный цистит».
Интерстициальный цистит / синдром боли в мочевом пузыре диагностируется на основании хронической тазовой боли, давления или дискомфорта, связанных по ощущениям с мочевым пузырем и сопровождаемых, по крайней мере, одним из мочевых симптомов, таких как сильное, упорное желание мочиться или учащенное мочеиспускание. Должны быть исключены другие заболевания, имеющие похожие симптомы. Дальнейшее определение и классификация интерстициального
цистита / синдрома боли в мочевом пузыре могут быть предприняты на основании данных цистоскопии с гидробужированием и морфологическим исследованием биоптатов.
«Этиология и патогенез интерстициального цистита до сих пор недостаточно изучены», – признал профессор А.В. Зайцев. Основные этиологические теории развития синдрома болезненного мочевого пузыря / интерстициального цистита: инфекционная, аутоиммунная, гормональная теория, аллергическая, теория повышенной
проницаемости эпителия мочево го пузыря, теория тучных клеток и нейрогенного воспаления, воздействия токсических субстанций в моче, теория рефлекторной
симпатической дистрофии, теория травматического повреждения мочевого пузыря.
В последние 10–15 лет предпринимались серьезные попытки доказать инфекционную природу ИЦ. Однако это оказалось сложной задачей, поскольку у большинства больных с интерстициальным циститом посевы мочи стерильны и в некоторых случаях нормальные анализы мочи. Результаты зарубежных исследований не подтвердили наличия мочевой инфекции или колонизации мочевого пузыря простыми микроорганизмами. Вместе с тем незначительная бактериурия чаще наблюдается у пациенток с ин терстициальным циститом, чем в контрольной группе.
Не выявлена связь ИЦ с наличием вирусной или бактериальной ДНК в ткани мочевого пузыря. Наличие бактериурии в популяции больных интерстициальным циститом / синдромом болезненного мочевого пузыря не оказывает влияния на появление или исчезновениесимптомов заболевания.
Исследовали 314 пациенток с симптомами ИЦ. Влияние ИМП на начало ИЦ выявлено в 18–36% случаев. Ретроспективный анализ подтверждает, что часть женщин (возможно, меньшая) на момент возникновения ИЦ имели признаки ИМП или воспаления. Наличие ИМП в начале ИЦ может быть ключом к разгадке патогенеза заболевания. Профессор А.В. Зайцев также полагает, что у меньшей части больных ИЦ первопричиной болезни явилась инфекция, которая в дальнейшем исчезла, и их моча стала стерильной. Наличие ИМП в детском и подростковом возрасте увеличивает риск развития ИЦ в дальнейшем. У 41,6% из 125 пациенток с ИЦ в анамнезе имела место ИМП.
Провели микробиологическое исследование ткани мочевого пузыря у больных ИЦ. Всего обследовано 14 пациенток, средний возраст – 53 года, средняя продолжительность заболевания – 9 лет. В 9 из 14 случаев отмечена язвенная форма болезни. В количестве 1000–100000 КОЕ/ мл выявлены такие микроорганизмы, как Staphylococcus spp., Kocuria spp., Acinetobacter spp., Klebsiella pneumoniae, Proteus mirabilis, Pseudomonas spp., Burkholderia cepacia, Flavimonas oryzihabitans и Brevundimonas vesicularis, а такжеStaphylococcus pasteuri, образующий биопленки.
Докладчик призвал избегать длительного применения антибиотиков и оральных стероидов при таком заболевании, как ИЦ, и привел следующие показания к применению антимикробных препа ратов у больных синдромом болезненного мочевого пузыря:
«В остальных случаях у больных с интерстициальным циститом назначать антибактериальные препараты не следует, чтобы не дискредитировать лекарственные средства», – сказал в завершение своего доклада профессор А.В. Зайцев.
| Проантоцианидины и их роль в профилактике рецидивирующих циститов |

Клюква (Vaccinium macrocarpon, V. oxycoccus, V. microcarpum и V. erythrocarpum) – растение семейства вересковых, которое на протяжении тысячелетий использовалось в качестве средства лечения «мочевых проблем». Клюква обладает и другими полезными свойствами. Это важный источник витамина C и полифенолов. Доказано кардиопротективное действие клюквы, противораковые свойства, защитное действие против кариеса зубов. Но наибольший интерес вызывают проантоцианидины клюквы.
В опытах in vitro доказано, что клюква за счет проантоцианидинов ингибирует адгезию многих микроорганизмов (Escherichia coli, Proteus spp., Pseudomonas aeruginosa,
Staphylococcus aureus, S. typhymurium и Enterococcus faecalis) на различных поверхностях, в том числе даже синтетических. Предположительно, это происходит за счет ингибирования I- и P-типов фимбрий, утрачивающих способность прикрепляться к клеткам эпителия.
Компоненты клюквы ингибируют развитие бактериальных биопленок у человека, но очень селективно. Биопленки, продуцируемые патогенами полости рта и уропатогенными штаммами E. coli, повидимому, очень чувствительны к компонентам клюквы, их рост подавляется на 60–70%. А биопленки, продуцируемые Proteus mirabilis, нечувствительны.
Активным действующим веществом клюквы является тримерный A-тип проантоцианидинов. Тип B (встречается в винограде, яблоках, чае) неактивен.
Основной механизм действия клюквенных проантоцианидинов A-типа – это ингибирование связывания уропатогенов с P-типом фимбрий посредством маннозоспецифичных, лектиноподобных структур с маннозоподобными остатками на клетках слизистой оболочки. Ингибирование P-фимбрий обратимо. Есть данные, что проантоцианидины способствуют отделению P-фимбрий от бактерий, но по другим данным плотность P-фимбрий не меняется. Меньше данных, что проантоцианидины ингибируют I-фимбрии.
Существует устаревшее представление, будто действие клюквенного сока связано с изменением реакции мочи. В действительности однократно и многократно применяемая клюква, свежая, сухая и в виде сока, не оказывает клинически значимого влияния на pH мочи. Процессы, с точки зрения клинической фармакологии происходящие в организме с компонентами клюквы, – это всасывание, распределение, биотрансформация, выведение.
После приема добровольцами 480 мл клюквенного сока, содержащего 94,47 мг антоцианидинов, максимальная концентрация антоцианидинов в плазме крови достигалась через 1–4 часа и составляла 0,56–4,64 нмоль/л. Максимальная концентрация антоцианидинов в моче после приема добровольцами 200 мл клюквенного сока наблюдалась через 3–6 часов после приема сока, почечная экскреция была практически полной в течение первых 12 часов. Шесть из 12 антоцианидинов, идентифицированных в клюкве, обнаруживаются и в моче. Ферменты биотрансформации и транспортеры антоцианидинов неизвестны. О флавоноидах клюквы известно, что они могут являться субстратами транспортеров(SGLT1, MRP2, MRP3) и цитохрома P-450.
Предшествующие клинические исследования по использованию клюквы для профилактики ИМП страдали рядом серьезных недостатков: малое количество пациентов, неадекватная рандомизация, небольшая продолжительность исследования (менее 6 месяцев), отсутствие оценки адгезии на фоне терапии с точки зрения объективных параметров, высокая частота выхода пациентов из исследований (у детей – до 47%). Дозы клюквенного сока или порошкообразного экстракта были весьма разнообразны, в ряде исследований применялись нестандартизированные продукты. Однако к 2010 г. были проведены более качественные клинические исследования клюквы по профилактике ИМП, проанализированные в новом Кокрановском обзоре. В 10 исследованиях участвовали 1049 пациентов, рандомизированных в группы лечения или контроля. Лекарственная форма в виде сока использовалась в семи исследованиях, а таблетки – в четырех (в одном исследовании оценивались обе лекарственные формы). Во всех исследованиях использовали стандартизированные продукты, содержащие не меньше 36 мг проантоцианидинов. Применение продуктов из клюквы значительно снижало частоту ИМП у женщин за 12 месяцев(ОР 0,65; 95% ДИ 0,46–0,90) по сравнению с плацебо/контролем.
Убедительная эффективность продуктов из клюквы у пожилых мужчин или женщин или у пациентов,нуждающихся в периодической катетеризации, не показана.
Финское исследование 2001 г. эффективности клюквы в предотвращении рецидивов ИМП у женщин предусматривало деление пациенток на три равные группы по 50 человек: контрольную, группу пациентов, принимавших капсулы клюквы (Монурель), и группу, получавшую лактобактерии. Частота рецидивов в группе с Монурелем составила всего 16%, в контрольной – 35%, а в группе больных, принимавших лактобактерии, – 39%.
В другом исследовании сравнивалась эффективность экстракта клюквы (36 мг антоцианидинов в сутки в течение 6 месяцев) и триметоприма (100 мг/сут) для профилактики ИМП. Пациентки – женщины не моложе 45 лет с рецидивирующей ИМП (триметоприм – 68, клюква – 69). Рецидивы ИМП наблюдались у 14 женщин, получаших триметоприм, и у 25 пациенток, принимавших клюкву, но различия не были статистически достоверными. Не было различий во времени развития первого рецидива с момента начала применения триметоприма или клюквы. Частота отказа от применения составила 16% для триметоприма и 9% для клюквы.
Как отметил профессор Д.А. Сычев, при приблизительно одинаковой эффективности экстракта клюквы и низких доз антибактериального препарата следует сделать
выбор в пользу клюквы хотя бы во избежание развития резистентных к антибиотику штаммов микробов. Докладчик напомнил, что Европейская ассоциация урологии в
своих рекомендациях 2010 г. отнесла клюкву (Vaccinium macrocarpon) в дозировке проантоцианидинов 36–72 мг/сут к средствам профилактики ИМП.
| Европейская ассоциация урологии в своих рекомендациях 2010 г. отнесла клюкву (Vaccinium macrocarpon) в дозировке проантоцианидинов 36–72 мг/сут к средствам профилактики ИМП. |
Переносимость клюквы, по данным клинических исследований, достаточно хорошая, но у детей хуже, чем у взрослых. Частота отказов от лечения колебалась от 5 до
47% (у детей) и была наибольшей при применении сока (из-за вкуса) и наименьшей – при использовании капсул. Докладчик прокомментировал эти данные, напомнив,
что свежевыжатый сок горький и кислый, а потому дети его переносят с трудом. Отказы же от таблеток и капсул клюквы составляют лишь около 5%.
Зарегистрирован 1 случай иммуноопосредованной тромбоцитопении у 68-летнего мужчины, который употреблял в пищу неизвестное количество клюквенного
сока для облегчения симптомов дискомфорта, связанного с установкой мочевого катетера за 10 дней до госпитализации.
В литературе не найдено прямых доказательств безопасности или вреда для матери или плода употребления клюквы во время беременности. Безопасность или вред
клюквенного сока в период лактации не изучены. В этой связи в настоящее время назначать препараты клюквы беременным не разрешено, хотя Д.А. Сычев сомневается в пользе такого запрета.
Следует избегать лечения клюквой пациентов с установленным нефролитиазом. Однако, повидимому, клюква повышает вероятность образования только некоторых типов камней (уратных, оксалатных), а на другие типы (брушитный, апатитный,струвитный) оказывает антилитогенное действие.
В некоторых клинических исследованиях изучали фармакокинетическое взаимодействие клюквы с лекарственными средствами. Установлено, что клюквенный сок
не влияет на всасывание амоксициллина и цефаклора. Биодоступность данных препаратов не изменялась, когда принятые внутрь лекарства запивали клюквенным соком. Не было обнаружено какого-либо влияния употребления клюквенного сока в течение 14 дней по 200 мл в сутки на фармакокинетику циклоспорина. Нельзя сочетать прием клюквы с применением варфарина.
Большинство доступных в России продуктов клюквы не стандартизированы, содержание проантоцианидинов в них неизвестно. Это относится к таким продуктам, как
клюква свежая, клюква замороженная, клюквенные соки. Между тем необходимая суточная доза проантоцианидинов составляет 36 мг, что соответствует 750 мл концентрированного клюквенного сока.
Оптимальным выбором является применение клюквы в капсулах в виде препарата Монурель, заключил профессор Д.А. Сычев. Препарат рекомендуется принимать в
следующих случаях: