Чем лечить колит после приема антибиотиков
Антибиотикоассоциированный колит, тяжелого течения. Разбор клинического случая
Авторы клинического разбора:
Ивашкин Владимир Трофимович – академик РАМН, профессор, заведующий кафедрой проведевтики внутренних болезней и директор клиники пропедевтики внутренних болезней, гастроэнтерологии и гепатологии Первого МГМУ им И.М. Сеченова.
В клинику обратился пожилой мужчина 62 лет с жалобами на жидкий стул до 8 раз в сутки, повышение температуры тела до 38-39С, боль в околопупочной области спастического характера, общую слабость и похудание на 7 кг в течение месяца.
При объективном осмотре состояние средней тяжести, 38С, кожа и видимые слизистые бледные, язык сухой, живот увеличен в объеме за счет метеоризма, при пальпации умеренно болезненный по ходу толстой кишки.
Требовалось установить предварительный диагноз. Отрицательные результаты исследования кала на дизгруппу ставили под сомнение наличие кишечной инфекции, дебют воспалительных заболеваний кишечника у мужчины в 62 года представлялся маловероятным. Имеющиеся факторы риска антибиотикоассоциированного колита – прием антибиотиков, пожилой возраст, наличие сопутствующей патологии (ишемическая болезнь сердца, гипертоническая болезнь) свидетельствовали с высокой вероятностью о наличии антибиотикассоциированного колита, тяжелого течения (псевдомембранозный?).
Было начато обследование. В анализах крови обращали на себя внимание нормохромная железодефицитная анемия, лейкоцитоз со сдвигом лейкоцитарной формулы влево вплоть до миелоцитов, тромбоцитоз и ускорение СОЭ. Также выявлена гипонатриемия, гипоальбуминемия, снижение уровня железа, резкое повышение уровня С-реактивного белка, реакция кала на скрытую кровь с бензидином – положительная. При исследовании кала методом ИФА обнаружены токсины А и В C.difficile. Для исключения дилатации толстой кишки был сделан обзорный снимок брюшной полости в положении лежа – ширина петель в пределах нормы. При ультразвуковом исследовании брюшной полости обращало на себя внимание утолщение стенок толстой кишки до 10 мм. Утолщение стенок толстой кишки, сужение просвета кишки отмечалось и при компьютерной томографии органов брюшной полости.
При сигмоскопии: аппарат введен в сигмовидную кишку, на осмотренных участках слизистая умеренно гиперемирована, с множественными белесоватыми включениями. Слизистая прямой кишки гиперемирована, отёчна. Заключение: антибиотикоассоциированный колит (псевдомембранозный). (Рис. 2).
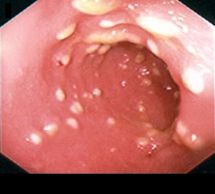
Рис. 2. Сигмоскопия
Морфологическая картина соответствовала псевдомембранозному колиту: выявлялся некроз эпителия, фибриновый выпот с нейтрофилами, типичные изъязвления слизистой напоминающие извержения вулкана, формирование псевдомембран (Рис.3).
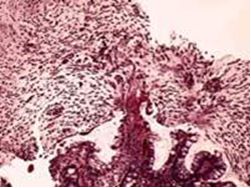
Рис. 3. Морфологическая картина псевдомембранозного колита
Таким образом, был установлен следующий клинический диагноз: Антибиотикоассоциированный колит, тяжелого течения (псевдомембранозный). Синдром нарушенного всасывания: железодефицитная анемия. Гипоальбуминемия.
Лечение больного включало регидратационную терапию, парентеральное питание, с дальнейшим переводом на энтеральное питание, метронидазолом 500 мг в/в каждые 6 ч, ванкомицином 250 мг 4 раза в сутки. Пробиотические препараты не назначались. На фоне лечения состояние больного улучшилось, нормализовалась температура тела, постепенно уменьшилась частота стула и общая слабость, больной прибавил в весе и был выписан в удовлетворительном состоянии.
Через 2 недели после выписки из стационара больному была назначена антибиотикотерапия после экстракции зуба, которая была прервана на 2-е сутки в связи с возникновением диареи. Больной обратился в нашу клинику. Был заподозрен рецидив C.difficile-ассоциированного колита, что было подтверждено обнаружением токсинов C.difficile в кале. Назначена терапия ванкомицином в начальной дозе 500 мг 2 раза в сутки с последующим постепенным снижением дозы в комбинации с пробиотическим препаратом Флорасан А по 1 капсуле 3 раза в день на 14 дней. Состояние больного быстро улучшилось, в течение 1 года наблюдения рецидивов диареи не отмечалось.
Пробиотические препараты (Флорасан А) оказывают отчетливый эффект в лечении антибиотикоассоциированного колита, что делает актуальным включение пробиотиков в схемы лечения. Важными элементами профилактики антибиотикоассоциированных поражений кишечника служат дифференцированное назначение антибиотиков под строгим и обязательным контролем врача, а также обязательное назначение пробиотиков одновременно с началом антибактериальной терапии.
Псевдомембранозный колит
Каждое достижение в медицине имеет свою цену Ричард К. Рут Слева бело-желтые бляшки в сигмовидной кишке, справа — сливающиеся бляшки, образующие псевдомембранозные поля в ободочной кишке Этиология Бактерии Clostridiulm difficil
Каждое достижение в медицине имеет свою цену
Ричард К. Рут
Бактерии Clostridiulm difficile (КД) являются достаточно крупными (от 0,5-1,9 до 3,0-16,9 мкм) подвижными грамположительными бактериями, относящимися к группе облигатных анаэробов (род Clostridiulm), образующих в неблагоприятных условиях овальные субтерминальные споры, которые устойчивы к нагреванию и способны к длительному (в течение нескольких лет) переживанию в аэробных условиях. Температурный оптимум роста вегетативных форм — 30-37ОС. Важнейшими факторами патогенности КД являются энтеротоксин А и цитотоксин В.
КД широко распространены в природе и имеют убиквитарное распространение, поскольку являются постоянными обитателями кишечника многих видов животных (домашних и диких), а в некоторых случаях могут обнаруживаться в испражнениях здоровых людей различных возрастных групп, включая новорожденных. В результате контаминации почвы КД могут обнаруживаться на различных объектах внешней среды, что представляет особую проблему в медицинских учреждениях. Несмотря на то что КД не относятся к патогенным бактериям, тем не менее в определенных условиях они способны вызывать такие заболевания, как антибиотикоопосредованные диареи (АОД) и псевдомембранозный колит (ПМК). Обнаружение КД на объектах внешней среды стационаров создает серьезную угрозу инфицирования пациентов. Хотя риск инфицирования при прямом контакте с бактериовыделителем или больным, как правило, невелик, однако длительный контакт может привести к развитию клинически манифестных форм инфекций, обусловленных КД (ИКД). В литературе имеются многочисленные описания внутрибольничных вспышек АОД в отделениях различного профиля [9], в том числе гериатрических, ортопедических, хирургических и пр., что позволяет говорить об ИКД как о нозокомиальной инфекции. Теоретически в отделениях любого профиля может быть зарегистрирована вспышка ИКД, однако наблюдения показывают, что наибольшему риску инфицирования КД подвергаются больные хирургических отделений и палат интенсивной терапии [7, 10]. Достаточно четко прослеживается следующая закономерность: чем более интенсивно используются инвазивные методы диагностики и лечения и агрессивная терапия, тем выше риск развития ИКД. Как показывают эпидемиологические исследования, удельный вес внутрибольничных инфекций, обусловленных КД, постоянно растет, особенно в тех странах, где налажена соответствующая лабораторно-диагностическая база [4].
Контролировать ситуацию с внутрибольничным инфицированием пациентов КД достаточно сложно. Во-первых, контроль за обсемененностью спорами КД объектов внешней среды в стационарах не проводится, во-вторых, споры КД резистентны к действию стандартных дезсредств.
Как показывают наблюдения, от 3 до 6% здоровых людей являются носителями КД. Здоровые дети первого года жизни, в том числе и новорожденные, являются носителями КД гораздо чаще — в 30-90%, хотя развитие ПМК в данной возрастной группе нетипично. В стационарах частота выявления бактерионосителей КД может быть выше. При этом у бактерионосителей, как правило, отсутствуют какие-либо клинико-лабораторные указания на развитие ИКД в анамнезе.
Сам по себе факт инфицирования пациентов КД не является определяющим в развитии ИКД. Условиями, необходимыми [4] для развития ИКД, в том числе и ПМК, являются:
Критическим фактором для развития ИКД, в том числе и ПМК, является снижение колонизационной резистентности кишечника, в частности толстой кишки, как следствие нарушения микробиоценоза. Особенность микробной экологии толстой кишки — это абсолютное доминирование в ней анаэробных бактерий, находящихся в соотношении с аэробами 1000:1 и плотностью популяции около 1012 микробных тел на 1 г фекалий. Несмотря на столь высокий популяционный уровень индигенной микрофлоры в толстой кишке, данный микробиоценоз легко нарушается, особенно под действием антибиотиков или других внешних факторов, а восстанавливается исключительно медленно [1, 2].
| Псевдомембранозный колит (ПМК) — это редкое, но опасное заболевание, вызывающееся спорообразующим анаэробным микробом Clostridiulm difficile. Несмотря на то что клинические проявления ПМК весьма вариабельны, чаще всего у больных наблюдаются длительная диарея, интоксикация, боль в животе и лейкоцитоз, возникающие, как правило, на фоне антибиотикотерапии |
Важнейшим и наиболее мощным ко-фактором, способствующим развитию ИКД, является использование антибиотиков. Антибиотикотерапия предшествует развитию ПМК в 60-85% случаях. Несмотря на то что ИКД может быть спровоцирована практически любыми антибиотиками и/или антимикробными препаратами, включая сульфаниламиды и метронидазол, чаще всего развитие ИКД отмечается на фоне приема цефалоспоринов III поколения, клиндамицина, ампициллина, амоксициллина с клавулановой кислотой, фторхинолонов. Макролиды и рифампицин достаточно редко выступают в роли ко-факторов в развитии ИКД. Следует помнить, что ни доза, ни кратность, ни даже способ введения препарата не влияют на возможность развития ИКД. Были случаи, когда даже однократное введение антибиотика приводило к развитию АОД и ПМК.
Кроме того, описаны случаи развития ИКД, в том числе и ПМК, при использовании химиотерапии, антинеопластических препаратов, иммуносупрессивной терапии, препаратов золота, нестероидных противовоспалительных средств, антидиарейных препаратов, нейролептиков. Нарушение микроэкологии кишечника, сопровождающееся колонизацией КД, встречается при обширных операциях на брюшной полости, длительном использовании назогастральных зондов и клизм, у пациентов реанимационных отделений и отделений интенсивной терапии, при почечной недостаточности и некоторых других состояниях.
Практика показывает, что особенно часто ИКД выявляется в хирургических стационарах, особенно у больных, перенесших операцию на кишечнике. Данное обстоятельство может иметь только одно объяснение: помимо того что обширные хирургические операции сами по себе могут способствовать развитию ИКД, такие больные более чем в 90% получают антибиотики широкого спектра действия, как с целью лечения, так и профилактики. И все же примерно у 10-11% хирургических больных ИКД развивается без предварительного приема антибиотиков.
Исследования канадских авторов [3] показали, что наиболее серьезную проблему АОД представляют в больницах с числом коек более 200, в которых уровень заболеваемости ИКД составляет от 30,8 до 40,3 случая на 100 тыс. больных. Согласно другим наблюдениям [10], ПМК развивается у амбулаторных больных при получении оральных антибиотиков с частотой один-три случая на 100 тыс. больных, а среди госпитализированных частота развития ПМК составляет один на 100 (в зависимости от профиля стационара).
Таким образом, многие исследователи заключают, что КД является ведущим клинически значимым патогеном, ответственным за развитие нозокомиальных диарей, на долю которых приходится от 20 до 45% всех внутрибольничных диарей [8].
Хотя КД могут обнаруживаться в стуле здоровых людей, имеются убедительные данные, свидетельствующие о том, что эти микроорганизмы не способны к длительному существованию в неизмененной нормальной микроэкосистеме кишечника. Фактором, способствующим колонизации КД толстой кишки, является глубокое угнетение анаэробной части индигенной микрофлоры кишечника.
Ведущими факторами патогенности КД являются токсические субстанции, вырабатываемые КД: токсин А (ТА) и токсин В (ТВ), которые in vivo проявляют синергизм действия [6]. ТА — это мощный энтеротоксин с цитотоксической активностью, вызывающий нарушение барьерной функции слизистой кишечника за счет повреждения эпителиоцитов и активацию секреции жидкости в просвет кишечника. ТВ — в 1000 раз более мощный цитотоксин, чем ТА, однако его цитотоксический эффект обусловлен нарушением полимеризации внутриклеточных филаментов актина. Пикограмм ТВ способен оказывать цитопатический эффект. Выявляемые в толстой кишке морфологические изменения слизистой обусловлены действием только токсинов, поскольку сами КД не обладают инвазивными свойствами и, как правило, в подслизистый слой не проникают. Протяженность и глубина морфологических изменений, выявляемых в толстой кишке, обусловливают тяжесть течения инфекционного процесса.
Несмотря на то что ИКД чаще всего развивается после лечения антибиотиками, тем не менее взаимодействие между защитными факторами организма, внешней средой и КД остается в значительной степени мало изученным, в силу чего многие стороны патогенеза до сих пор не ясны.
Спектр клинических проявлений ИКД варьирует в широких пределах: от бессимптомного носительства и самокупирующейся диареи до тяжелых колитов. Так как ПМК представляет собой крайнюю форму проявления ИКД с возможным рецидивирующим течением, часто неблагоприятным прогнозом и требует особо сложного лечения, наибольшее внимание врачи уделяют именно этой форме заболевания. В табл. 1 представлены факторы риска развития колита, обусловленного КД.
Таблица 1. Факторы риска развития колита, обусловленного КД
Средний возраст заболевших составляет 58-60 лет, хотя развитие ИКД принципиально не зависит от возраста больных [5]. Исключение составляют новорожденные и дети до года, у которых развитие ИКД является нетипичным, и это несмотря на то, что частота обнаружения в кишечнике токсигенных штаммов КД у них намного выше, чем у взрослых. Парадокс данной ситуации объясняется тем, что в данной возрастной группе в кишечном эпителии отсутствуют рецепторы для токсинов КД.
Для АОД характерно развитие диарейного синдрома (ДС) на фоне антибиотикотерапии, при этом общее состояние больных, как правило, не изменяется. Температура тела остается на исходном уровне, могут беспокоить небольшие боли в животе, стул умеренно водянистый. Диарейный синдром носит непродолжительный характер и купируется в течение одного-трех дней после прекращения антибиотикотерапии без дополнительного лечения. Установить истинное число больных с АОД, обусловленными КД, достаточно трудно, поскольку это состояние протекает легко, без выраженного обезвоживания и, как правило, заканчивается спонтанным выздоровлением.
Клиническая картина ПМК весьма вариабельна, поскольку данное заболевание осложняет течение основного патологического процесса. Типичными для ПМК являются жидкий стул, боль в животе и лихорадка. Степень выраженности этих признаков может широко варьировать. ПМК развивается, как правило, либо непосредственно на фоне проводимой антибиотикотерапии, либо через семь — десять дней (в редких случаях позже) после прекращения антибиотикотерапии.
Таблица 2. Факторы риска развития рецидивирующего течения ПМК
В клинической картине ПМК доминирует ДС, который в отдельных случаях бывает единственным проявлением заболевания. ДС, будучи наиболее постоянным клиническим признаком ПМК, в дебюте заболевания выявляется в 100% случаев. В отдельных случаях манифестация заболевания может начинаться с лихорадки. Частота дефекаций в сутки достигает пяти и более раз, доходя иногда до 20-30. Стул, как правило, водянистый, небольшого объема, но, учитывая кратность дефекаций, у больных могут развиваться водно-электролитные расстройства разной степени выраженности. Диарея носит упорный характер и может сохраняется до восьми — десяти недель. В отдельных случаях расстройство стула может носить перемежающий характер, когда диарея сменяется оформленным стулом, сохраняющимся в течение одного-двух дней. Часто стул содержит примесь слизи, тогда как примесь крови не характерна. Рвота встречается достаточно редко и выявляется в более поздние сроки заболевания, свидетельствуя о тяжести его течения.
Фактически одновременно с ДС у больных выявляются боли в животе разной интенсивности, преимущественно спастического характера, которые усиливаются при пальпации живота. Чаще всего боль не имеет четкой локализации и определяется по ходу кишечника.
В большинстве случаев температура тела у больных с ПМК держится на фебрильных цифрах, однако в последние годы участились случаи заболевания, при которых регистрируется гектическая лихорадка, превышающая 40°С.
Характерным для ПМК является достаточно выраженный лейкоцитоз периферической крови, достигающий 15х109/л, а в ряде случаев выявляются даже лейкемоидные реакции, при которых количество лейкоцитов может достигать 40х109/л. Имеются отдельные наблюдения, когда ПМК у больных развивается на фоне лейкопении. Как правило, лейкопения регистрируется у больных, получавших химиотерапию по поводу злокачественных опухолей. ПМК у таких больных протекает исключительно тяжело и часто носит фульминантное течение с развитием бактериемии. Именно фульминантное течение ПМК представляет наибольшую трудность в плане диагностики в силу необычности выявляемой клинической симптоматики, поскольку в этом случае наблюдается комбинированное поражение толстого и тонкого кишечника.
Для фульминантного течения ПМК характерно быстрое прогрессирование процесса. ДС, являющийся ключевым для АОД при фульминантном течении ПМК, может отсутствовать. Почти у половины больных регистрируются запор и признаки кишечной непроходимости. У таких пациентов выявляются признаки “острого живота”, лихорадка бывает выше 38,4ОС [9]. При компьютерной томографии брюшной полости выявляется асцит и значительное утолщение стенки толстой кишки. Несмотря на отчетливые клинические признаки “острого живота”, свободный воздух в брюшной полости не определяется. Особенностью ведения таких больных является то, что базисная медикаментозная терапия оказывается малоэффективной и требуется радикальное хирургическое вмешательство (субтотальная колэктомия). Летальность при фульминантном течении ПМК достигает 58%.
Учитывая длительный и упорный характер диареи, у больных с ПМК часто выявляются тяжелые электролитные расстройства (гипокалиемия), гиповолемия, снижение плазменного уровня альбуминов, развитие отеков вплоть до анасарки, гипотензия.
ПМК может осложняться развитием токсического мегаколона, перфорацией толстой кишки с развитием перитонита, инфекционно-токсическим шоком.
Рецидивирующее течение ПМК наблюдается в 20% у больных с первично установленным диагнозом после проведения стандартной антибиотикотерапии. Для больных, у которых выявлен хотя бы один рецидив, риск рецидивирующего течения ПМК возрастает до 45-68%. Механизм формирования рецидивирующего течения ПМК до сих пор до конца не выяснен. Полагают, что основной причиной является неполная санация кишечника от спор КД, хотя не исключается возможность реинфицирования.
Факторы риска развития рецидивирующего течения ПМК представлены в табл. 2.
Диагностика ИКД — это сложная проблема. Выделение возбудителя хоть и представляется важным, но имеет второстепенное значение в связи с медленным ростом бактерий. Важнейшим методом верификации диагноза ПМК является обнаружение токсинов КД в стуле. Токсигенные штаммы КД, вызывающие развитие ПМК, вырабатывают, как правило, оба токсина, однако “золотым стандартом” в диагностике ПМК может служить обнаружение ТВ при тестировании культуры клеток, которое представляет собой наиболее чувствительный метод. Предлагаемые коммерческие наборы ИФА по обнаружению токсинов А и В, к сожалению, уступают по специфичности и чувствительности цитотоксическому тесту. В последние годы разрабатываются методы ПЦР как альтернатива цитотоксическому тесту. Как показывают многие исследования, латекс-агглютинация, используемая для диагностики ИКД, на сегодня не может быть рекомендована как “базовый” метод диагностики, поскольку обладает достаточно низкой чувствительностью.
Не утратили своего диагностического значения эндоскопические методы. Патологические изменения локализуются преимущественно в дистальном отделе толстой кишки, и для их выявления достаточно провести сигмоидоскопию, однако у одной трети больных патологические изменения локализуются только в проксимальной части толстой кишки; в этом случае требуется проведение колоноскопии. Тонкий кишечник также может вовлекаться в патологический процесс, однако данный факт выявляется только на аутопсии. При сигмоидоскопии и колоноскопии отмечают диффузную гиперемию и отечность слизистой кишечника с утолщением стенки кишки, хотя в стенке кишки выявляется незначительная воспалительная реакция, а в подслизистом слое — скопление лимфоцитов. На поверхности обнаруживают характерные фибринозные бляшки желтовато-белого цвета в диаметре от 2 мм до 2 см и более (см. рис.), покрывающие язвы слизистой кишечника. Эти бляшки могут сливаться, образуя псевдомембранозные поля. Псевдомембраны обнаруживаются между прямой кишкой и левым изгибом ободочной кишки, но может поражаться и поперечная ободочная кишка. Гистологическое исследование показывает, что бляшки состоят из фибрина, муцина, слущенных эпителиальных клеток, разрушенных лейкоцитов и микробной флоры толстого кишечника.
Характер и объем проводимых терапевтических мероприятий у больных с ИКД определяется клиническим вариантом заболевания.
Асимптоматическое носительство, как правило, не требует специальных методов лечения.
При установлении диагноза ПМК лечение начинают незамедлительно. Прежде всего, если заболевание развилось на фоне антибиотикотерапии, необходима ее отмена.
Проводимая больным ПМК терапия преследует две основные цели: во-первых, необходимо купировать воспалительный процесс в кишечнике и, во-вторых, санировать кишечник от спор КД [4, 10].
Несмотря на то что антибиотики чаще всего служат причиной развития ИКД, именно антибактериальная терапия является неотъемлемой частью стандартной базисной терапии ПМК, проведение которой ограничивает колонизацию кишечника КД и купирует воспалительные изменения в кишечнике.
КД in vitro проявляют различную чувствительность к антибиотикам, однако наиболее стабильная чувствительность наблюдается к ванкомицину и метронидазолу. Обязательным условием проведения этиотропной терапии у больных с ПМК является энтеральное введение антибиотиков, поскольку при парентеральном их введении в кишечнике не создается достаточной концентрации и санации организма не наступает.
Несмотря на то что ванкомицин обычно назначают в дозе по 500 мг, проведенные исследования показывают, что дозы 125 мг четыре раза в день бывает вполне достаточно для купирования воспаления. В силу ограниченной доступности ванкомицина более широко используется метронидазол, который назначается в дозе 250–500 мг три-четыре раза в сутки. Оральный прием метронидазола в большинстве случаев эквивалентен ванкомицину, который предпочтителен в тяжелых случаях ПМК. Курс лечения антибиотиками составляет 10 дней. Если невозможен оральный прием препаратов, их вводят через назогастральный зонд. В редких случаях, при тяжелом течении ПМК, возможно комбинированное назначение ванкомицина (per rectulm) и метронидазола (внутривенно), но следует помнить, что внутривенное введение препаратов менее эффективно.
В качестве базисной антибактериальной терапии может использоваться и бацитрацин, однако в силу вариабельности и нестабильности фармакологического эффекта на КД предпочтение отдают метронидазолу и ванкомицину.
| Патоморфологические изменения при ПМК выявляются преимущественно в толстой кишке и характеризуются диффузной гиперемией, а также отечностью слизистой кишечника с утолщением стенки кишки и образованием характерных фибринозных налетов в виде бляшек желтовато-белого цвета |
Базисная антибактериальная терапия способствует достаточно быстрому купированию клинических проявлений заболевания: нормализация температуры наступает, как правило, уже в течение 24–48 часов, а частота и характер стула восстанавливается на 1–13-й день (в среднем 4,5 дня).
Были случаи, когда при неэффективности антибактериальной терапии у больных с ПМК использовался нормальный человеческий иммуноглобулин (ИГ) для внутривенного введения в дозе 200-300 мг/кг веса. Основанием для назначения данного препарата явились контрольные исследования, показавшие, что препараты ИГ содержат антитела против ТА и ТВ в концентрации 0,4-1,6 мг/мл IgG. На фоне проводимой терапии у больных регистрируется быстрое прекращение диареи, купирование болей в животе и нормализация температуры.
К сожалению, какой бы курс антибиотиков нами ни использовался, ни один из них не гарантирует полную санацию кишечника от спор КД, что создает угрозу для развития рецидивирующего течения ПМК [2]. Доказана высокая эффективность препаратов на основе непатогенных дрожжей Saccharomyces boulardii (СБ) для санации организма от спор КД. На основании большого количества наблюдений можно сделать вывод, что терапевтический эффект СБ проявляется как при сочетанном их назначении с антибиотиками, так и при проведении самостоятельного курса после антибиотикотерапии. Механизм действия СБ до конца не выяснен. Установлено, что они ингибируют рост КД, уменьшают образование и накопление цитотоксина в кишечнике, ингибируют кишечные эффекты токсинов за счет протеолиза самих токсинов и ингибирования связывания токсинов с рецепторами. Наиболее высокая клиническая эффективность СБ установлена преимущественно у больных с рецидивирующим течением ПМК. Как показывают наблюдения, не следует использовать СБ при первом эпизоде ПМК. СБ назначают по 1 г в сутки в течение четырех недель.
Эффект от использования энтеросорбентов и ионообменных смол (например, холестирамина, холестипола), несмотря на их способность связывать токсины КД, многими клиницистами оценивается как весьма скромный.
У больных с фульминантным течением ПМК базисная терапия часто оказывается малоэффективной, поэтому в таких случаях проводят хирургическое лечение [9]. Абсолютным показанием к хирургическому лечению (колэктомия с илеостомой) является наличие признаков перитонита.
Историческая справка
В 1965 году S. Goulstone и V. McGovern, анализируя анатомо-гистологические изменения, обнаруживаемые у больных с ПМК в кишечнике, высказали предположение, что данное заболевание вызывается неизвестным токсическим агентом, действующим локально. В 1969 году J. Small установил, что у лабораторных животных, получающих линкомицин гидрохлорид, развивается типичная патоморфологическая картина ПМК, что и явилось в последующих исследованиях лабораторной моделью изучения ПМК. R. Green в 1974 году выявил цитотоксичность в культуре клеток содержимого кишечника лабораторных животных, получавших антибиотики — это позволило предположить, что в развитии цитотоксического эффекта играет определенную роль неизвестный вирус. Установление зависимости развития диареи и/или колита на фоне использования антибиотиков послужило основанием для широкого использования в клинической практике термина “антибиотико-опосредованные диареи (колиты)”.
Несмотря на то что I. Hall и E. O’Toole впервые обнаружили Clostridiulm difficile в кишечном содержимом людей в 1935 году, их этиологическая роль в развитии ПМК и антибиотико-опосредованных диарей (АОД) была установлена только во второй половине 70-х годов.
Публикации в СМИ
Колит псевдомембранозный
Псевдомембранозный колит — острое, тяжёлое заболевание толстой кишки, развивающееся как осложнение антибактериальной терапии. Частота • В общей популяции — 6,7:100 000 лечившихся антибиотиками • У 10–20% стационарных больных обнаруживают Clostridium difficile • Преобладающий возраст — 40–75 лет.
Этиология — Clostridium difficile Уровень носительства среди взрослого населения составляет 2-3%.• Условия размножения Clostridium difficile — анаэробная среда и угнетение роста нормальной кишечной микрофлоры. Заболевание развивается при резистентности Clostridium difficile к антибиотикам, подавляющим жизнедеятельность прочей кишечной микрофлоры. Отсутствие конкуренции способствует ускоренному размножению Clostridium difficile и выделению токсинов • Наиболее часто колит вызывают клиндамицин, линкомицин, ампициллин, пенициллин, цефалоспорины, тетрациклин, эритромицин. Способ применения антибиотика не имеет значения. При приёме внутрь (кроме влияния на микрофлору) происходит местное воздействие антибиотика непосредственно на кишечную стенку.
Факторы риска • Длительное применение антибиотиков • Химиотерапия — фторурацил, метотрексат, комбинированные препараты • Хирургические вмешательства на кишечнике • Уремия • Ишемия кишечника • Трансплантация костного мозга.
Клиническая картина • Симптомы развиваются обычно от 3 дней до 4 недель от начала антибактериальной терапии • Водянистая диарея с неприятным запахом; редко — с примесью крови (в случае развития эрозивно-геморрагических изменений слизистой оболочки кишки). Частота стула может нарастать даже после прекращения приёма этиологически значимого антибиотика. Схваткообразные боли в нижних отделах живота, преимущественно в проекции толстого кишечника, после дефекации • Лихорадка (с повышением температуры тела до 38 °С). Дегидратация и электролитные расстройства — признак тяжёлого течения заболевания. Токсический мегаколон и перфорация толстой кишки — редкие, но серьёзные осложнения, требующие хирургического вмешательства.
Диагностика
• Анализ периферической крови •• Лейкоцитоз, сдвиг лейкоцитарной формулы влево •• Гипоальбуминемия.
• Подтверждение наличия Clostridium difficile •• Бактериологическое исследование каловых масс с определением в нем токсина Clostridium difficile — пробу на токсин считают положительной, если при исследовании на культуре ткани идентифицируют цитопатический токсин, нейтрализуемый специфическим антитоксином; частота положительного результата — 20–90% в зависимости от степени тяжести. Диагностика дисбиоза кишечника — газовая хроматография и масс-спектрометрия — выявляют существенные изменения состава нормальной микрофлоры в сторону увеличения концентрации различных микроорганизмов; общая колонизация слизистой оболочки увеличивается в 2-5 раз по сравнению с нормой.
• Колоноскопия — наличие жёлто-белых бляшковидных «мембран» из фибрина, лейкоцитов и отторгнутых некротизированных эпителиальных клеток, мягких, но плотно спаянных со слизистой оболочкой. Изменения наиболее выражены в дистальных отделах ободочной и прямой кишки •• Характерный признак — сохранение участков слизистой оболочки под псевдомембранозными наложениями, в виде мостиков перекидывающихся между пораженными участками Слизистая оболочка отечна, но не изъязвлена. При попытке снять псевдомембрану может возникнуть кровотечение. Гистологическое исследование может иметь диагностическое значение. Хотя по его результатам не всегда можно отличить картину псевдомембранозного колита от язвенного или ишемического.
• Обзорная рентгенография органов брюшной полости: вздутие толстой кишки • Ирригография •• Зубчатость контуров толстой кишки, связанная с изъязвлением слизистой оболочки или наличием псевдомембран, между выпуклыми поверхностями которых затекает бариевая взвесь •• Отёк стенки кишки, расширение складок, нарушение гаустрации.
Дифференциальная диагностика • Неспецифический язвенный колит • Болезнь Крона • Ишемический колит • Синдром раздражённой толстой кишки • Колиты инфекционной этиологии.
Тактика ведения • Отмена антибиотиков, обусловивших заболевание, за исключением случаев их назначения по жизненным показаниям • Этиотропная терапия, направленная на элиминацию Clostridium difficile. Ванкомицин по 125 мг 4 р/сут внутрь в течение 7–10 дней, при необходимости доза может быть увеличена до 500 мг 4 р/сут. Метронидазол 500 мг 2 р/сут внутрь или в/в в течение 7–10 дней • Коррекция метаболических нарушений и водно-электролитного баланса.
Бактериальная терапия — использование высоких доз пробиотиков (бифиформ, бифидобактерии бифидум и др.) или бактериальных смесей, имеющих сходство с человеческой фекальной флорой; возможно введение препаратов с помощью клизм на основе солевых р-ров, через назодуоденальный зонд или через колоноскоп. Эффект обусловлен бактерицидным действием фекальной флоры, что ведет к устранению симптомов заболевания более чем у 95% больных с диареей, ассоциированной с Clostridium difficile.
Хирургическое лечение. В случае развития тяжёлых осложнений (перфорация или острая токсическая дилатация толстой кишки) необходима тотальная колонэктомия или разгрузочная илеостома.
Осложнения • Токсическая дилатация толстой кишки • Перфорация толстой кишки • Тяжёлый синдром мальабсорбции.
Течение. Течение благоприятное в случае своевременного распознавания заболевания, отмены антибиотика, вызвавшего диарею, и адекватного лечения.
Синонимы • Псевдомембранозный энтероколит • Колика слизистая • Колика кишечная слизистая • Колика слизистая псевдомембранозная • Колит перепончатый • Колит слизисто-перепончатый • Колит слизистый
МКБ-10 • A04.7 Энтероколит, вызванный Clostridium difficile.
Код вставки на сайт
Колит псевдомембранозный
Псевдомембранозный колит — острое, тяжёлое заболевание толстой кишки, развивающееся как осложнение антибактериальной терапии. Частота • В общей популяции — 6,7:100 000 лечившихся антибиотиками • У 10–20% стационарных больных обнаруживают Clostridium difficile • Преобладающий возраст — 40–75 лет.
Этиология — Clostridium difficile Уровень носительства среди взрослого населения составляет 2-3%.• Условия размножения Clostridium difficile — анаэробная среда и угнетение роста нормальной кишечной микрофлоры. Заболевание развивается при резистентности Clostridium difficile к антибиотикам, подавляющим жизнедеятельность прочей кишечной микрофлоры. Отсутствие конкуренции способствует ускоренному размножению Clostridium difficile и выделению токсинов • Наиболее часто колит вызывают клиндамицин, линкомицин, ампициллин, пенициллин, цефалоспорины, тетрациклин, эритромицин. Способ применения антибиотика не имеет значения. При приёме внутрь (кроме влияния на микрофлору) происходит местное воздействие антибиотика непосредственно на кишечную стенку.
Факторы риска • Длительное применение антибиотиков • Химиотерапия — фторурацил, метотрексат, комбинированные препараты • Хирургические вмешательства на кишечнике • Уремия • Ишемия кишечника • Трансплантация костного мозга.
Клиническая картина • Симптомы развиваются обычно от 3 дней до 4 недель от начала антибактериальной терапии • Водянистая диарея с неприятным запахом; редко — с примесью крови (в случае развития эрозивно-геморрагических изменений слизистой оболочки кишки). Частота стула может нарастать даже после прекращения приёма этиологически значимого антибиотика. Схваткообразные боли в нижних отделах живота, преимущественно в проекции толстого кишечника, после дефекации • Лихорадка (с повышением температуры тела до 38 °С). Дегидратация и электролитные расстройства — признак тяжёлого течения заболевания. Токсический мегаколон и перфорация толстой кишки — редкие, но серьёзные осложнения, требующие хирургического вмешательства.
Диагностика
• Анализ периферической крови •• Лейкоцитоз, сдвиг лейкоцитарной формулы влево •• Гипоальбуминемия.
• Подтверждение наличия Clostridium difficile •• Бактериологическое исследование каловых масс с определением в нем токсина Clostridium difficile — пробу на токсин считают положительной, если при исследовании на культуре ткани идентифицируют цитопатический токсин, нейтрализуемый специфическим антитоксином; частота положительного результата — 20–90% в зависимости от степени тяжести. Диагностика дисбиоза кишечника — газовая хроматография и масс-спектрометрия — выявляют существенные изменения состава нормальной микрофлоры в сторону увеличения концентрации различных микроорганизмов; общая колонизация слизистой оболочки увеличивается в 2-5 раз по сравнению с нормой.
• Колоноскопия — наличие жёлто-белых бляшковидных «мембран» из фибрина, лейкоцитов и отторгнутых некротизированных эпителиальных клеток, мягких, но плотно спаянных со слизистой оболочкой. Изменения наиболее выражены в дистальных отделах ободочной и прямой кишки •• Характерный признак — сохранение участков слизистой оболочки под псевдомембранозными наложениями, в виде мостиков перекидывающихся между пораженными участками Слизистая оболочка отечна, но не изъязвлена. При попытке снять псевдомембрану может возникнуть кровотечение. Гистологическое исследование может иметь диагностическое значение. Хотя по его результатам не всегда можно отличить картину псевдомембранозного колита от язвенного или ишемического.
• Обзорная рентгенография органов брюшной полости: вздутие толстой кишки • Ирригография •• Зубчатость контуров толстой кишки, связанная с изъязвлением слизистой оболочки или наличием псевдомембран, между выпуклыми поверхностями которых затекает бариевая взвесь •• Отёк стенки кишки, расширение складок, нарушение гаустрации.
Дифференциальная диагностика • Неспецифический язвенный колит • Болезнь Крона • Ишемический колит • Синдром раздражённой толстой кишки • Колиты инфекционной этиологии.
Тактика ведения • Отмена антибиотиков, обусловивших заболевание, за исключением случаев их назначения по жизненным показаниям • Этиотропная терапия, направленная на элиминацию Clostridium difficile. Ванкомицин по 125 мг 4 р/сут внутрь в течение 7–10 дней, при необходимости доза может быть увеличена до 500 мг 4 р/сут. Метронидазол 500 мг 2 р/сут внутрь или в/в в течение 7–10 дней • Коррекция метаболических нарушений и водно-электролитного баланса.
Бактериальная терапия — использование высоких доз пробиотиков (бифиформ, бифидобактерии бифидум и др.) или бактериальных смесей, имеющих сходство с человеческой фекальной флорой; возможно введение препаратов с помощью клизм на основе солевых р-ров, через назодуоденальный зонд или через колоноскоп. Эффект обусловлен бактерицидным действием фекальной флоры, что ведет к устранению симптомов заболевания более чем у 95% больных с диареей, ассоциированной с Clostridium difficile.
Хирургическое лечение. В случае развития тяжёлых осложнений (перфорация или острая токсическая дилатация толстой кишки) необходима тотальная колонэктомия или разгрузочная илеостома.
Осложнения • Токсическая дилатация толстой кишки • Перфорация толстой кишки • Тяжёлый синдром мальабсорбции.
Течение. Течение благоприятное в случае своевременного распознавания заболевания, отмены антибиотика, вызвавшего диарею, и адекватного лечения.
Синонимы • Псевдомембранозный энтероколит • Колика слизистая • Колика кишечная слизистая • Колика слизистая псевдомембранозная • Колит перепончатый • Колит слизисто-перепончатый • Колит слизистый
МКБ-10 • A04.7 Энтероколит, вызванный Clostridium difficile.
Антибиотикоассоциированный колит, тяжелого течения. Разбор клинического случая
Авторы клинического разбора:
Ивашкин Владимир Трофимович – академик РАМН, профессор, заведующий кафедрой проведевтики внутренних болезней и директор клиники пропедевтики внутренних болезней, гастроэнтерологии и гепатологии Первого МГМУ им И.М. Сеченова.
В клинику обратился пожилой мужчина 62 лет с жалобами на жидкий стул до 8 раз в сутки, повышение температуры тела до 38-39С, боль в околопупочной области спастического характера, общую слабость и похудание на 7 кг в течение месяца.
При объективном осмотре состояние средней тяжести, 38С, кожа и видимые слизистые бледные, язык сухой, живот увеличен в объеме за счет метеоризма, при пальпации умеренно болезненный по ходу толстой кишки.
Требовалось установить предварительный диагноз. Отрицательные результаты исследования кала на дизгруппу ставили под сомнение наличие кишечной инфекции, дебют воспалительных заболеваний кишечника у мужчины в 62 года представлялся маловероятным. Имеющиеся факторы риска антибиотикоассоциированного колита – прием антибиотиков, пожилой возраст, наличие сопутствующей патологии (ишемическая болезнь сердца, гипертоническая болезнь) свидетельствовали с высокой вероятностью о наличии антибиотикассоциированного колита, тяжелого течения (псевдомембранозный?).
Было начато обследование. В анализах крови обращали на себя внимание нормохромная железодефицитная анемия, лейкоцитоз со сдвигом лейкоцитарной формулы влево вплоть до миелоцитов, тромбоцитоз и ускорение СОЭ. Также выявлена гипонатриемия, гипоальбуминемия, снижение уровня железа, резкое повышение уровня С-реактивного белка, реакция кала на скрытую кровь с бензидином – положительная. При исследовании кала методом ИФА обнаружены токсины А и В C.difficile. Для исключения дилатации толстой кишки был сделан обзорный снимок брюшной полости в положении лежа – ширина петель в пределах нормы. При ультразвуковом исследовании брюшной полости обращало на себя внимание утолщение стенок толстой кишки до 10 мм. Утолщение стенок толстой кишки, сужение просвета кишки отмечалось и при компьютерной томографии органов брюшной полости.
При сигмоскопии: аппарат введен в сигмовидную кишку, на осмотренных участках слизистая умеренно гиперемирована, с множественными белесоватыми включениями. Слизистая прямой кишки гиперемирована, отёчна. Заключение: антибиотикоассоциированный колит (псевдомембранозный). (Рис. 2).

Рис. 2. Сигмоскопия
Морфологическая картина соответствовала псевдомембранозному колиту: выявлялся некроз эпителия, фибриновый выпот с нейтрофилами, типичные изъязвления слизистой напоминающие извержения вулкана, формирование псевдомембран (Рис.3).

Рис. 3. Морфологическая картина псевдомембранозного колита
Таким образом, был установлен следующий клинический диагноз: Антибиотикоассоциированный колит, тяжелого течения (псевдомембранозный). Синдром нарушенного всасывания: железодефицитная анемия. Гипоальбуминемия.
Лечение больного включало регидратационную терапию, парентеральное питание, с дальнейшим переводом на энтеральное питание, метронидазолом 500 мг в/в каждые 6 ч, ванкомицином 250 мг 4 раза в сутки. Пробиотические препараты не назначались. На фоне лечения состояние больного улучшилось, нормализовалась температура тела, постепенно уменьшилась частота стула и общая слабость, больной прибавил в весе и был выписан в удовлетворительном состоянии.
Через 2 недели после выписки из стационара больному была назначена антибиотикотерапия после экстракции зуба, которая была прервана на 2-е сутки в связи с возникновением диареи. Больной обратился в нашу клинику. Был заподозрен рецидив C.difficile-ассоциированного колита, что было подтверждено обнаружением токсинов C.difficile в кале. Назначена терапия ванкомицином в начальной дозе 500 мг 2 раза в сутки с последующим постепенным снижением дозы в комбинации с пробиотическим препаратом Флорасан А по 1 капсуле 3 раза в день на 14 дней. Состояние больного быстро улучшилось, в течение 1 года наблюдения рецидивов диареи не отмечалось.
Пробиотические препараты (Флорасан А) оказывают отчетливый эффект в лечении антибиотикоассоциированного колита, что делает актуальным включение пробиотиков в схемы лечения. Важными элементами профилактики антибиотикоассоциированных поражений кишечника служат дифференцированное назначение антибиотиков под строгим и обязательным контролем врача, а также обязательное назначение пробиотиков одновременно с началом антибактериальной терапии.
Как выбрать пробиотики для кишечника: список препаратов
Правильное, сбалансированное содержание белков, жиров и углеводов является ключом к здоровью на долгие годы. Продукты не способны в полной мере обеспечить организм человека всем необходимым. Есть целый перечень лекарств, которые помогают держать себя в хорошей форме и не болеть от легкого дуновения ветра.
Предлагаем список лучших пробиотиков. Перед началом терапии рекомендуется проконсультироваться с врачом, чтобы исключить наличие противопоказаний и правильно рассчитать дозировку.
Полезные свойства
Пробиотики – живые микроорганизмы, которые могут принести пользу человеку. В большинстве случаев это бактерии, но могут быть и другие представители микробов (например, дрожжи). Пробиотики несут пользу для кишечника, нормализуя микрофлору и устраняя дисбактериоз.
Нормы и различные вариации
Пробиотики колонизируют кишечник полезными бактериями, противодействуют патогенной (вредной) флоре, вызывающей запор или диарею, повышают иммунитет.
Основную массу бактерий – пробиотиков можно разделить на 2 вида: лакто- и бифидобактерии. В каждом из них существует значительное количество подвидов. Они оказывают то или иное благотворное влияние на организм человека.
Отклонения от нормы
Чем отличаются пробиотики от пребиотиков?
Могут ли навредить пробиотики?
Пробиотики практически не имеют противопоказания. Не рекомендуется принимать при онкологических заболеваниях, поражении лимфатический и кровеносной системы, ВИЧ. С осторожностью рекомендуется принимать в период беременности и лактации. Маленьким детям допустимо давать только те препараты, которые не имеют возрастных ограничений.
Как выбрать пробиотики для кишечника?
Лучшие пробиотики для восстановления кишечника может посоветовать только врач. Должны быть учтены основные критерии: возраст пациента, состояние организма, характер дисфункций, противопоказания и пр. Самолечение может не дать должного результата и привести к развитию проблем со здоровьем.
В список препаратов включены лучшие пробиотики для восстановления микрофлоры кишечника. Рейтинг основан на эффективности, безопасности и соотношении цена-качество.
№1 – «Нормофлорин-Д» (Бифилюкс, Россия)
Биологически активная добавка разработана на основе лактобактерий и их метаболитов. Используется в комплексном лечении язвы двенадцатиперстной кишки и желудка, при ожирении и метаболическом синдроме. Назначается после антибактериальной терапии для восстановления нарушенного микробиоценоза.
Производитель: Бифилюкс, Россия
№2 – «Бифиформ» (Ferrosan, Дания)
Противодиарейный препарат регулирует равновесие микрофлоры кишечника. Содержит Bifidobacterium longum и Enterococcus faecium. МИБП-эубиотик назначается при непереносимости лактозы, для восстановления микрофлоры кишечника и для лечения хеликобактерной инфекции в составе комплексной терапии.
Производитель: Ferrosan [Ферросан], Дания
№3 – «Линекс» (Lek d. d., Словения)
Находится в первых рядах списка пробиотиков для кишечника. Основные активные компоненты этого препарата стимулируют изменение рН путем брожения лактозы. Это тормозит развитие патогенных и условно-патогенных микроорганизмов и создает благоприятные условия для пищеварительных ферментов.
Активные вещества, входящие в «Линекс» устойчивы к антибиотикам. Они оказывают влияние не только на нижние отделы кишечника, но и на верхние (этими свойствами обладают далеко не все пробиотики). Многокомпонентное средство, пригодно практически для всех пациентов, включая детей (даже тех, кто находится на искусственном питании).
Производитель: Lek d. d. [Лек д.д.], Словения
№4 – «Хилак Форте» (Merckle, Германия)
Комбинированный препарат для нормализации кислотности желудка в соответствии с физиологической нормой. Биологически восстанавливает микрофлору кишечника. Таким образом, создает неблагоприятную среду для жизнедеятельности патогенных и условно-патогенных бактерий.
Производитель: Merckle [Меркле], Германия
№5 – «Линекс Форте» (Sandoz, Словения)
Пробиотик регулирует равновесие микрофлоры кишечника. Разработан на основе молочнокислых живых бактерий, которые представляют собой составляющие естественной микрофлору. Широко используется при дисбактериоза, запорах и хеликобактериозе у детей и взрослых.
Производитель: Sandoz [Сандоз], Словения
№6 – «Бифидумбактерин» (Ланафарм, Россия)
Лучший пробиотик для восстановления микрофлоры, который устойчив ко многим лекарственным средствам и антибиотикам. «Бифидумбактерин» является антагонистом достаточно широкого спектра болезнетворных и условно болезнетворных микроорганизмов. Выпускается в форме ректальных суппозиториев и капсул.
Эффективность препарата обусловлена сильной концентрацией бифидобактерий. Быстро нормализует микрофлору кишечника, которая, будучи естественной, накапливает токсические вещества (как поступающие в организм извне, так и находящиеся в нем) и разлагает их на нетоксичные компоненты. Нельзя давать детям, страдающим непереносимостью молочных продуктов.
Производитель: Ланафарм, Россия
№7 – «Бак-Сет Форте» (Probiotics International, Великобритания)
Мульти-пробиотик нового поколения, который включает в состав 14 видов пробиотических живых бактерий. Они дополняют действие друг друга, устраняя проблемы с пищеварением у детей от 3-х летнего возраста и у взрослых. Усовершенствованная микрокапсулированная технология способствует сохранению полезных свойств бактерий на протяжении всего срока хранения препарата.
Производитель: Probiotics International [Пробиотикс Интернейшенал], Великобритания
№8 – «Бифиформ Баланс» (Pfizer, Россия)
Один из лучших пробиотиков для восстановления микрофлоры кишечника. разработан на основе лакто- и бифидобактерий. Биологически активная добавка к пище назначается для лечения дисбактериоза различной этиологии и поддерживает микрофлору кишечника. Способствует коррекции функциональных нарушений желудочно-кишечного тракта.
Производитель: Pfizer [Пфайзер], Россия
№9 – «Флорин Форте» (Партнер, Россия)
Лакто- и бифидобактерии, входящие в состав, принимают участие в процессах синтеза аскорбиновой кислоты, калия, витаминов группы В. В результате повышается устойчивость к агрессивным воздействиям окружающей среды. Также действующие компоненты участвуют в обменных процессах желчных кислот и пигментов. В их присутствии происходит синтез веществ, оказывающих антибактериальное действие. Также препарат повышает иммунную-реактивность человеческого организма.
Производитель: Партнер, Россия
№10 – «Бактериофаг» (Микроген НПО, Россия)
Стафилококковый раствор входит в список лучших пробиотиков для кишечника для взрослых и детей. Используется преимущественно в составе комплексной терапии с антибактериальными препаратами и другими лекарственными средствами.
Производитель: Микроген НПО, Россия
№11 – «Секстафаг» (Микроген НПО, Россия)
Завершает список препаратов пробиотиков для кишечника. Иммунобиологический препарат специфически лизирует бактерии стрептококков и стафилококков, протеи, кишечной и синегнойной палочки. Назначается при энтеральных и гнойно-воспалительных заболеваниях. При необходимости может быть использован в составе комплексной терапии.
Производитель: Микроген НПО, Россия
Пробиотические средства нормализуют процессы пищеварения, активируя перистальтику кишечника и восстанавливая микрофлору. Препараты способствуют синтезу полиаминов, укрепляют клеточный цитоскелет и регенерируют кишечный эпителий, повышая защитные функции организма. Они не только уменьшают газообразование, н и тормозят рост вредоносных микроорганизмов.
Какие пробиотики принимать в том или ином случае может посоветовать врач. Специалист отталкивается от показаний и общего состояния организма пациента, исключая развитие передозировки или побочных реакций.















