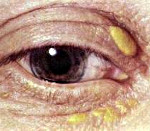
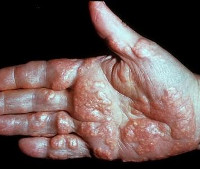
Чем лечить ксантомы желудка
Что такое ксантома?

Ксантомы на коже: что это такое?
Если происходит нарушение жирового обмена в тканях и клетках, то на теле человека появляются очаговые новообразования называемые ксантомами. Выглядят они как небольшие наросты белого или желтоватого цвета, содержащие внутри жировые клетки. Такие новообразования могут быть локальными, они появляются только на одном участке тела, и генерализованными, то есть те, что распространяются по всей коже.
Было установлено, что одной из главных причин появление ксантом является избыток холестерина в крови; так же на их появление может повлиять:
Новообразования появляются, когда кровь перенасыщена переработанными остатками жиров. Это заболевание опасно, тем, что сопровождается поражением сосудов и некоторых внутренних органов.
Виды ксантом
Разберем подробнее отдельные виды ксантом, их локализацию и внешний вид.

Специалисты выделяют два типа плоских ксантом:

Множественная узелковая ксантома.




Ксантома: как избавиться?
Диагностировать ксантому можно при первом же посещении врача дерматолога. По внешнему виду, мягкой форме, локализации и внутренней консистенции, врач может определить вид ксантомы. Для определения причин появления новообразований на теле, пациенту необходимо сдать анализ крови, в некоторых случаях пройти биопсию. Очень важно установить заболевание, которое вызвало появление бляшек. Также людям с признаками ксантом в обязательном порядке нужно пройти консультацию и у других врачей: эндокринолога и кардиолога.

Сегодня косметическое удаление проходит быстро и просто, с помощью современных методик. Расскажем о каждой более подробно:
— Лазерное удаление ксантомы. Это один из наиболее эффективных способов лечения новообразований на теле. Лазер безопасен, процедура проходит максимально комфортно для человека. Воздействие происходит только на саму ксантому, здоровая кожа не повреждается. Заживление ранок, после процедуры занимает 5-7 дней. Ни шрамов, ни рубцов на коже не остается. Лазерное удаление это современный и наименее травмотичный метод избавления от ненужных косметических дефектов.
— Хирургическое удаление. Если образования ксантом очень обширны, то врачи предлагают удалить их хирургическим путем с помощью скальпеля или ножниц. Процедура проводится под анестезией, после удаления ксантом, ранки обрабатываются антисептическими средствами, и накладывают повязки. Заживления обширных участков занимает до 10 дней и больше.
— Криодеструкция. С помощью жидкого азота низкой температуры разрушаются клетки новообразования и оно отмирает самостоятельно. Процедура проводится всего несколько минут. Однако чаще всего после криодеструкции на коже остаются небольшие рубцы.
— Радиоволновое удаление. В этом методе применяется электрический ток, ткани образования нагреваются до максимальной температуры и разрушаются. Благодаря чему ксантома исчезает с поверхности кожи.
Однако, рецидивы данного заболевания возможны. Необходимо тщательно следить за здоровьем и соблюдать диету, назначенную врачом.
Лазерное вмешательство при удалении новообразований кожи
Газета «Новости медицины и фармации» Гастроэнтерология (337) 2010 (тематический номер)
Вернуться к номеру
Ксантомы желудка
Авторы: Е.В. Симонова, к.м.н., ведущий научный сотрудник диагностического отделения, Л.Н. Мосийчук, д.м.н., заместитель директора института по научной работе, руководитель отделения заболеваний желудка и двенадцатиперстной кишки ГУ «Институт гастроэнтерологии АМН Украины», г. Днепропетровск
Версия для печати
Ксантома желудка (gastric xanthoma, gastric xanthelasma) (КЖ) — доброкачественное образование, клиническое значение которого на сегодняшний день остается неясным, а литературные данные крайне малочисленны.
Макроскопически ксантомы опре- деляются как единичные или множественные желтоватые или желтовато-беловатые пятна, бляшки или чечевицеподобные плоские или возвышающиеся образования с четкими краями в слизистой оболочке желудка. Размеры их варьируют от 0,1 до 1,5 см [1, 2].
Гистологически ксантомы представлены скоплением пенистых клеток (макрофагов), содержащих липиды. Ксантомы обычно расположены в собственном слое слизистой оболочки (СО) желудка, но иногда доходят до мышечной пластинки. Чаще локализуются в антральном отделе и нижней трети тела желудка, но при выраженном дуоденогастральном рефлюксе (ДГР) могут встречаться и в верхних отделах [1, 2].
Как уже было отмечено, проблема ксантоматоза желудка крайне скудно отражена в литературе. Этиопатогенез КЖ неизвестен, но считают, что существует взаимосвязь между КЖ и гиперлипидемией, диабетом, атрофическим гастритом [1–4]. Есть отдельные работы относительно взаимосвязи КЖ c инфекцией Helicobacter pilori (F. Arevalo, 2005; S. Gursoy, 2005; S. Hori, 1996; H. Isomoto, 1999). По мнению авторов, Нр-инфекция может спровоцировать появление КЖ [2, 5–7]. Существует и противоположный взгляд: по данным S. Yi с соавт. (2007), наличие КЖ не взаимосвязано с Нр [4].
Клиническое значение КЖ, согласно литературным данным, остается неясным. М. Naito с соавт. считают, что наличие КЖ может быть маркером патологических возрастных изменений СО желудка [8]. Нам встретилось несколько работ о сочетании КЖ с гиперплазиогенными полипами, с ранним раком желудка [9, 10]. S. Gursoy с соавт. (2005) обнаружили взаимосвязь КЖ с хроническим гастритом, оперированным желудком (при формировании гастроинтестинального анастомоза), кишечной метаплазией и Нр, то есть с предраковыми состояниями желудка [2].
По данным В.А. Романова, ксантомы чаще всего встречались у пациентов среднего и пожилого возраста на фоне атрофического гастрита с дуоденальным рефлюксом и кишечной метаплазией, в 70 % случаев — при раннем раке желудка кишечного типа [1]. Автор считает, что КЖ могут быть зачислены в так называемые сателлиты раннего рака.
По мнению большинства специалистов, нет необходимости во взятии биопсий из ксантом. Но учитывая тот факт, что в ряде случаев злокачественные образования желудка могут имитировать ксантомы, некоторые авторы считают необходимым морфологическое исследование КЖ с тщательным динамическим наблюдением таких больных [2, 11].
Таким образом, немногочисленные и противоречивые данные относительно роли ксантоматоза желудка обусловили необходимость дальнейшего изучения нами этой проблемы.
В рамках научно-исследовательской работы «Изучить механизмы развития предраковых состояний желудка под влиянием экзо- и эндогенных факторов и обосновать принципы торможения ведущих звеньев формирования патологического процесса» мы изучили частоту и роль ксантом желудка у больных с хроническим гастритом.
Нами обследовано 122 больных с хроническим гастритом (29 мужчин, 93 женщины в возрасте от 25 до 71 года, средний возраст 49,9 ± 2,1 года). Проводили эндоскопическое, гистологическое, цитологическое исследования, суточную рН-метрию, статистический анализ полученных данных (многофакторный корреляционный анализ).
У 21 пациента (8 мужчин, 13 женщин), средний возраст 43,3 ± 3,5 года, установлен неатрофический гастрит (НАГ).
У 101 больного (21 мужчина, 80 женщин), средний возраст 49,30 ± 1,16 года, диагностирован атрофический гастрит (АГ). В зависимости от выраженности морфологических изменений слизистой оболочки желудка эти больные были распределены на следующие группы:
І группа — атрофия СО желудка (n = 53);
ІІ группа — атрофия и кишечная метаплазия СО желудка (n = 35);
ІІІ группа — атрофия, кишечная метаплазия и дисплазия СО желудка (n = 13).
Эндоскопическое исследование (эзофагогастродуоденоскопия) с биопсией СО антрального отдела и тела желудка проводилось по общепринятой методике с использованием фиброгастродуоденоскопов Olympus (Япония). Для улучшения качества эндоскопического исследования с целью визуализации минимальных макроскопических изменений СО желудка во всех случаях применяли пеногаситель эспумизан в дозе 3–5 мл внутрь за 30 минут до эзофагогастродуоденоскопии.
Гистологические препараты окрашивали по Романовскому — Гимза, ставили ШИФ-реакцию. Наличие и выраженность инфекции Helicobacter pylori в СО желудка диагностировали с помощью цитологического исследования с окрашиванием мазков по Паппенгеймому и с помощью уреазного теста.
Суточный рН-мониторинг проводили по методике В.М. Чернобрового, которая дала возможность определять параметры ДГР: общее количество щелочных забросов с рН > 5 за период мониторирования, количество массивных забросов, с определением количества волн длительностью свыше 5 минут. На основании полученных данных рассчитывали общий процент времени с уровнем рН > 5 и рН Список литературы
Ксантома: безобидный симптом или серьёзная угроза для организма?
Возникновение ксантом на коже является именно таким сигналом, указывающим на дисбаланс обмена липидов в организме. Ксантомы представляют собой жировые новообразования на различных участках кожного покрова. Могут иметь самые разные формы и размеры. На практике они чаще всего встречаются у представительниц женского пола после 40 лет. Но нередки случаи появления ксантом и у мужчин, и в детском возрасте. Проблема не в самих ксантомах, а в том, что нарушения липидного обмена, из-за которых они возникли, могут грозить тяжёлыми последствиями вплоть до летального исхода.
Причины образования ксантом
Как мы уже знаем, ксантомы на коже образуются в результате липидных обменных нарушений. В свою очередь, это приводит к возрастанию их концентрации в крови при:
Важное значение имеет и наследственная предрасположенность. Так появление ксантом не отмечено у молодых пациентов, больных семейной гиперхолестеринемией (СГХС), которая сопровождается значительным повышением холестерина и триглицеридов в крови.
Классификация ксантом
Существует немалое разнообразие ксантом и каждый из её видов отличается своими характерными особенностями. Чаще всего в практике врача-дерматолога медицинской клиники встречаются следующие виды:
Что делать при появлении ксантом?
Очень важно при обнаружении у себя ксантом пройти консультацию у дерматолога. Не забывайте, что их появление связано с нарушениями липидного обмена. Это предупреждение об угрозе для здоровья и жизни. Последствия несвоевременно принятых мер могут быть очень печальными – от развития сердечно-сосудистых заболеваний до летального исхода. Однако следует знать, что квалифицированная диагностика и вовремя проведённое лечение могут привести в норму нарушенный обмен липидов и защитить вас от нежелательных осложнений.
Горская Ирина Владимировна, врач-дерматовенеролог, дерматолог, трихолог, косметолог медицинского центра «Целитель» в Махачкале, специалист высшей категории.
Ксантоматоз
Ксантоматоз – обменное заболевание, при котором на поверхности кожных покровов и в некоторых других тканях формируются отложения липидов, главным образом холестерола и холестанола (ксантомы). Симптомами этого состояния являются желтоватые безболезненные бляшки и наросты на коже лица, нижних век (ксантелазма), конечностей и туловища без признаков воспаления. Диагностика ксантоматоза осуществляется по результатам осмотра кожных покровов, а также изучения основных показателей липидного обмена (уровня холестерина и липопротеидов в крови). Лечение разделяется на общее – коррекция липидного обмена – и местное, при котором производят удаление ксантом хирургическим путем или средствами медицинской косметологии.
Общие сведения
Ксантоматоз представляет собой множественные отложения липоидных веществ в коже (в некоторых случаях – в костях, твердой мозговой оболочке, сухожилиях), которые обусловлены гиперлипидемией. Одним из первых исследователей, который сумел верно описать и охарактеризовать это дерматологическое состояние еще в 1835 году, был французский врач П. Райе. Ксантоматоз кожи является лишь частью проявлений при нарушенном липидном обмене, помимо этого у больных могут наблюдаться также ксантелазмы, атеросклероз, липоидная дуга роговицы и даже пороки сердца, обусловленные отложением липидов на клапанах. Это состояние не является распространенным, может быть обусловлено, как первичными (генетическими) нарушениями, так приобретенными расстройствами метаболизма жиров. В некоторых случаях ксантоматоз обусловлен возрастными изменениями. В зависимости от типа и характера нарушений липидного обмена, это кожное заболевание может проявиться в разном возрасте – от детского и подросткового до преклонного и старческого.
Причины ксантоматоза
Главной причиной развития ксантоматоза является нарушение липидного обмена с развитием гиперлипидемии – состояния, при котором в крови резко увеличивается количество различных фракций липопротеидов. Такие изменения могут иметь различную природу – например, первичное расстройство метаболизма жиров имеет пять разновидностей. Каждая из них обусловлена нарушением работы определенного звена транспорта жиров и холестерина в организме, но все они имеют примерно одинаковый итог – триглицериды и холестерол в виде липопротеидов начинают накапливаться в крови, изменяя ее реологические свойства.
В результате сложных процессов липиды начинают проникать в клетки и межклеточное пространство тканей кожи и сухожилий, формируя там скопления, которые визуально определяются как ксантомы. Множественное образование таких скоплений на кожных покровах и носит название ксантоматоза.
Помимо первичных или наследственных нарушений липидного обмена, ведущих к гиперлипидемии и ксантоматозу, существуют и приобретенные факторы, способные увеличивать уровень триглицеридов и холестерина в крови. К ним относят сахарный диабет, высокое поступление жиров с пищей, гипотиреоз, воспаление поджелудочной железы (панкреатит), поражение печени (тяжелый гепатит, цирроз). В некоторых случаях гиперлипидемия с развитием ксантоматоза возникает в преклонном возрасте как часть комплекса старческих изменений в организме. Как правило, вторичные, или приобретенные, формы ксантоматоза чаще встречаются у лиц старшего или пожилого возраста, тогда как первичные могут развиваться как у детей, так и у взрослых. Патогенез отложения липидов в коже при вторичных гиперлипидемиях не имеет характерных отличий.
Симптомы ксантоматоза
Сами ксантомы при этом состоянии могут иметь различный внешний вид, который во многом зависит от причин, обусловивших развитие ксантоматоза. Так, выделяют эруптивные ксантомы, которые имеют сначала красный, затем желтоватый цвет, но багровый ободок сохраняется вокруг них еще долгое время. Они имеют четкие границы и полусферическую форму. Туберозные ксантомы характеризуются симметричным образованием, имеют желтый или коричневый цвет и могут достигать довольно крупных размеров – до 2-3 сантиметров. Плоские ксантомы, выявляемые при некоторых типах ксантоматоза, представляют собой пятна или бляшки желтого цвета, довольно часто возникают на ладонных поверхностях кисти. Также в отдельные типы иногда выделяют сухожильные ксантомы и ксантелазмы – жировые отложения на веках.
Классификация такого состояния, как ксантоматоз неотрывно связана с разновидностями нарушений липидного обмена. От типа подобных расстройств зависит характер липидных образований на коже и в других тканях, возраст их развития, клиническое течение и ряд других факторов. Все причины гиперлипидемии, ведущей к ксантоматозу, делят на две группы – первичные и вторичные. Первичные, в свою очередь, подразделяются на пять разновидностей, которые характеризуются патологиями разных звеньев липидного обмена:
Таким образом, если причиной ксантоматоза выступают первичные формы гиперлипидемии, то по характеру высыпаний, возрасту больного и другим симптомам можно примерно определить ее тип. В отношении вторичных типов нарушения липидного обмена такой четкой взаимосвязи не выявляется. Течение ксантоматоза при этом зависит от тяжести расстройства метаболизма липидов и реактивности организма – возможно появление как одиночных ксантом небольшого размера, так и множественных отложений жироподобных веществ по всему телу диаметром до 3-4 сантиметров. В случае вторичного ксантоматоза к клинической картине заболевания всегда добавляются симптомы основной патологии, которая стала причиной сбоя обмена жиров (сахарный диабет, цирроз печени и другие).
Диагностика ксантоматоза
Обычно в дерматологии диагностика такого состояния, как ксантоматоз, не представляет особых трудностей. Для этого используют метод осмотра кожных покровов пациента, биохимический анализ крови или исследование липидограммы, в спорных случаях могут производить биопсию ксантом для гистологического изучения. При осмотре дерматологом выявляются различные по форме, размерам и локализации образования от желтого до коричневого цвета, которые могут быть окружены багрово-красной каймой или неизмененной кожей. Они безболезненны и не вызывают у пациента никакого беспокойства, за исключением эстетического дефекта. Нередко обращает на себя внимание ожирение пациента или, наоборот, его чрезмерная худоба (при сахарном диабете первого типа).
Липидограмма указывает на высокий уровень различных фракций липидов крови – липопротеидов очень низкой плотности, хиломикронов, холестерина или триглицеридов. Увеличивается значение индекса атерогенности, что указывает на преобладание вредных фракций липопротеидов в крови больного. Сочетание гиперлипидемии и наличия ксантом на коже уже достаточно четко свидетельствует в пользу ксантоматоза у пациента. При гистологическом изучении тканей в очагах поражения определяется большое количество пенистых клеток с их преимущественной локализацией вокруг кровеносных сосудов. При окраске суданом-3 клеточные включения в них становятся оранжевого цвета, что говорит об их липидной природе. Эпидермис в области развития скоплений жироподобных веществ при ксантоматозе мало изменен, иногда отмечается незначительный гиперкератоз.
Лечение и прогноз ксантоматоза
Общее лечение ксантоматоза сводится к снижению уровня липоидных компонентов в крови и нормализации обмена жиров. Для этой цели используют как диету с низким содержанием липидов, так и специальные противоатеросклеротические препараты – например, аторвастатин. В тех случаях, когда гиперлипидемия обусловлена другим заболеванием, необходимо начинать его лечение – например, устранять гипотиреоз, гепатит, контролировать сахарный диабет. В некоторых случаях, особенно при молодом возрасте пациента, и если ксантоматоз проявлялся эруптивными ксантомами, после нормализации уровня липидов в крови кожные проявления заболевания способны самостоятельно исчезать. В других случаях ксантомы необходимо убирать хирургическими методиками, криодеструкцией, лазерным прижиганием или электрокоагуляцией.
Прогноз ксантоматоза напрямую зависит от причин гиперлипидемии, так как некоторые ее формы способны проявляться не только кожными симптомами, но и пороками сердца, атеросклерозом коронарных и мозговых сосудов, гепатомегалией. Ксантомы сами по себе не представляют угрозы жизни пациента и могут создавать только косметические неудобства. Прогноз относительно выздоровления и полного устранения ксантоматоза в ряде случаев благоприятный – при поддержании оптимального уровня липидов в крови новые образования не появляются, а уже сформировавшиеся можно убрать косметологическими методами. Однако если по различным причинам снова будет иметь место гиперлипидемия, то возможен рецидив заболевания.
Чем лечить ксантомы желудка
А.А. Самсонов (1), Н.Н. Голубев (2), Д.Н. Андреев (1), Е.Ю. Стручкова (1)
(1) ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава РФ, Москва; (2) ФГБУ «Поликлиника № 3» УДП РФ, Москва
Полипы желудка являются нередкой диагностической находкой при эндоскопическом исследовании верхнего отдела желудочно-кишечного тракта. В среднем при поведении эзофагогастродуоденоскопии (ЭГДС) они выявляются у 2% пациентов [1, 2]. При этом тактика их ведения недостаточно стандартизирована и часто вызывает вопросы со стороны клиницистов.
Полипом называют любое образование на слизистой оболочке, выступающее в просвет органа. Данный термин отражает лишь определенные макроскопические изменения, выявляемые при ЭГДС, и не обозначает самостоятельной нозологической единицы. Природу полипа можно установить только после морфологического исследования, хотя некоторые эндоскопические признаки ориентировочно указывают на предположительный диагноз. На сегодняшний день отсутствует общепринятая классификация полипов желудка. В зависимости от количества образований выделяют одиночные и множественные полипы. При обнаружении более 20 полипов говорят о полипозе желудка.
Эндоскопическая классификация, предложенная S. Yamada в 1966 г., выделяет четыре типа полипов [3]:
Помимо формы необходимо оценить и характер поверхности полипа, которая может быть гладкой, дольчатой или ворсинчатой (папилломатозной). С клинической точки зрения крайне важна морфологическая классификация полипов желудка, т.к. гистологическое строение во многом определяет дальнейшую тактику ведения. В соответствии с классификацией гастроинтестинальных опухолей Всемирной организации здравоохранения (ВОЗ) полипы желудка подразделяются на эпителиальные и неэпителиальные.
В каждой из этих категорий выделяют опухоли и опухолеподобные изменения [4].
Из эпителиальных полипов к опухолям относят только аденоматозные полипы (аденомы), тогда как остальные полипы данной категории по гистологическому строению истинными неоплазиями не являются и представляют собой опухолеподобные изменения. Из неэпителиальных полипов к опухолям причисляют гастроинтестинальные стромальные опухоли, лейомиомы, липомы, фибромы и фибромиомы, нейрогенные и сосудистые неоплазии, в то время как фиброидные полипы, ксантомы и гетеротопия ткани поджелудочной железы относятся к опухолеподобным изменениям.
При эндоскопическом исследовании форму полипов могут иметь аденокарцинома желудка, MALT-лимфома, гастроинтестинальные стромальные опухоли, карциноид и метастазы в желудок опухолей другой локализации.
Аденоматозные полипы (аденомы)
Аденоматозные полипы представляют собой образования, состоящие из папиллярных и тубулярных структур, выстланных диспластическим эпителием. Большое клиническое значение данного типа полипов определяется высоким риском малигнизации, что позволяет отнести их к предраковым заболеваниям слизистой оболочки желудка [4]. В западных странах доля аденом среди других полипов желудка составляет от 0,5 до 3,75%. В регионах с высокой распространенностью аденокарциномы желудка этот показатель значительно выше и составляет 9–20%. Соотношение мужчин и женщин составляет 2:1 [1].
Макроскопически аденоматозные полипы характеризуются как единичные (примерно в 80% случаев) образования на ножке или широком основании с бархатистой дольчатой поверхностью. Их размер обычно составляет менее 2 см. Однако встречаются и значительно более крупные аденомы. Поверхность полипов может быть изъязвлена. Аденомы наиболее часто локализуются в антральном отделе. Реже их выявляют на слизистой оболочке тела желудка. В большинстве случаев данный тип полипов развивается на фоне атрофического гастрита, ассоциированного с инфекцией Helicobacter pylori [1].
Как правило, аденоматозные полипы не имеют клинической симптоматики. У некоторых пациентов изъязвление их поверхности вызывает желудочное кровотечение, которое редко бывает выраженным. В ряде случаев хроническая скрытая кровопотеря ведет к развитию железодефицитной анемии. Крупные полипы могут стать причиной обструкции пилорического канала желудка.
Классификация ВОЗ выделяет три основных типа аденом:
Папиллярная аденома состоит из узких или широких пальцевидных выростов различной формы, основу которых составляет собственная пластинка слизистой оболочки. Тубулярная аденома образована разветвленными железами, заключенными в ткань собственной пластинки слизистой оболочки. Папилло-тубулярная аденома характеризуется промежуточным морфологическим строением. Поверхность аденоматозных полипов покрыта эпителием, всегда имеющим признаки дисплазии низкой или высокой степени [5]. На основании морфологических и гистохимических признаков может быть выделено два основных фенотипа аденоматозных полипов. Наиболее распространены аденомы кишечного типа, эпителий которых представлен энтероцитами, бокаловидными клетками и клетками Панета. Аденомы желудочного типа регистрируются значительно реже и могут состоять из поверхностно-ямочного эпителия тела желудка (фовеолярная аденома) или клеток пилорических желудочных желез (пилорическая аденома). Пилорические аденомы чаще развиваются у женщин пожилого возраста и локализуются преимущественно в теле желудка. По некоторым данным, в 26% случаев в ткани пилорических аденом имеются фокусы аденокарциномы [1, 6, 7].
Аденоматозные полипы возникают спорадически или могут быть ассоциированы с семейным аденоматозным полипозом. Папиллярные аденомы, как правило, являются спорадическими, а тубулярные чаще встречаются при семейном полипозе. Большинство спорадических аденом формируются на фоне хронического атрофического хеликобактерного гастрита с очагами кишечной метаплазии. Риск их развития увеличивается с возрастом. Данные полипы являются одним из этапов канцерогенеза, ведущим к развитию рака желудка. Особенно опасны в плане высокого риска неопластического прогрессирования образования размером более 2 см. При гистологическом исследовании тканей таких аденоматозных полипов фокусы аденокарциномы выявляются в 50% случаев [2, 4, 8].
У 30% пациентов на момент выявления аденоматозных полипов гистологические признаки злокачественного новообразования регистрируются в других участках слизистой оболочки. Таким образом, аденоматозные полипы являются маркером высокого риска развития аденокарциномы в окружающей слизистой оболочке желудка [2, 4, 8]. Все аденоматозные полипы вне зависимости от размеров и гистологического строения подлежат удалению с применением методов эндоскопической полипэктомии или эндоскопической резекции слизистой оболочки. Все пациенты после удаления аденом нуждаются в регулярном наблюдении с целью выявления новых или ранее не обнаруженных полипов и раннего рака желудка. Рецидив аденом наблюдается не более чем в 5% случаев. У 1,3% пациентов с аденоматозными полипами в дальнейшем выявляется рак желудка [9].
Первое контрольное эндоскопическое исследование необходимо проводить через год после полипэктомии. При нормальных результатах интервал обследования можно увеличивать до 3–5 лет. Если гистологическое исследование ткани полипов показало наличие дисплазии высокой степени, то наблюдение должно быть индивидуализировано, а первую гастроскопию необходимо провести не позже чем через 6 месяцев [4, 9].
Фундальные железистые полипы
Фундальные железистые полипы относятся к наиболее часто встречающимся полипам желудка. Доля данных образований среди всех полипов желудка, по разным данным, составляет от 13 до 77% [4]. Фундальные железистые полипы представляют собой хорошо ограниченные, округлые, гладкие, блестящие образования бледно-розового цвета небольших размеров (менее 1 см) на широком основании. Как правило, они множественные и локализуются на слизистой оболочке дна и верхней части тела желудка. Описаны случаи гигантских полипов, достигающих 3–8 см. Окружающая слизистая оболочка обычно не изменена [2, 10, 11].
Гистологически фундальные железистые полипы представляют собой значительно расширенные в виде кист главные железы тела желудка, просвет которых выстлан уплощенными мукоцитами, париетальными и главными клетками [1]. Фундальные железистые полипы могут возникать спорадически либо быть ассоциированными с приемом ингибиторов протонной помпы (ИПП) и наследственным аденоматозным полипозом.
Этиология и патогенез фундальных полипов изучены недостаточно. Ранее полагалось, что они относятся к гамартомам. Однако сообщения о возникновении этих образований на фоне длительной терапии ИПП позволило сделать предположение об участии в их патогенезе механизмов, связанных с подавлением секреции соляной кислоты [12]. Спорадические полипы часто одиночны или немногочисленны (10). Они выявляются преимущественно у H. pylori-негативных лиц без атрофического гастрита. По некоторым данным, хеликобактериоз оказывает протективное действие в отношении развития этих полипов. При гистологическом исследовании ткани спорадических фундальных полипов участки дисплазии эпителия выявляются менее чем в 1% случаев [1].
Связь фундальных железистых полипов с приемом ИПП остается предметом дискуссий. По данным исследований, этот тип полипов встречался у 36% пациентов, принимавших антисекреторные средства более года, и лишь у 12% лиц, не получавших кислотосупрессивную терапию (увеличение риска в 4 раза). Средний период приема ИПП, необходимый для формирования полипов, составляет 32,5 месяца, а регресс этих образований отмечен спустя 3 месяца после отмены кислотосупрессивной терапии.
У пациентов, получающих ИПП, фундальные железистые полипы, как правило, более многочисленны по сравнению со спорадическими случаями [13, 14]. Причины формирования полипов на фоне приема ИПП не ясны.
У большинства пациентов, получающих антисекреторную терапию, они никогда не развиваются. Одна из теорий предполагает важную роль гипергастринемии. Гастрин вызывает гиперплазию и протрузию в просвет главных желез париетальных клеток, что в свою очередь ведет к их расширению и формированию кист. В дальнейшем при еще большем увеличении этих кист в размерах возникают фундальные железистые полипы [15]. В то же время этиологическая взаимосвязь между ИПП и данным видом полипов нуждается в подтверждении в проспективных исследованиях, т.к. ряд работ такой ассоциации не выявил [4].
Фундальные железистые полипы обнаруживают у 53–88% пациентов с семейным аденоматозным полипозом. В такой ситуации полипы всегда множественные и могут покрывать всю поверхность тела желудка. При гистологическом исследовании в отличие от спорадических фундальных полипов дисплазия выявляется в 25–41% случаев. В частности, в исследовании L.K. Bianchi и соавт. у 38% пациентов была выявлена дисплазия низкой, а у 3% обследованных больных высокой степеней [16, 17]. Спорадические фундальные железистые полипы и фундальные полипы, ассоциированные с приемом ИПП, имеют очень низкий риск малигнизации. Показана возможность спонтанного регресса. При наличии типичной эндоскопической картины и небольших размерах полипов (0,5 см) диагноз устанавливается на основании гистологического исследования одного биоптата. При обнаружении полипов размером 0,5–1,0 см биопсия должна быть взята из каждого такого образования. Полипы размером более 1 см должны быть удалены. Вопрос об отмене ИПП также должен решаться индивидуально. При небольших размерах полипов терапия может быть продолжена, тогда как при полипах размером более 1 см прием антисекреторных препаратов должен быть прекращен [2].
У пациентов с семейным аденоматозным полипозом дисплазия эпителия фундальных полипов, по некоторым данным, выявляется в 40% случаев. Риск ее развития возрастает при большом размере полипов (>1 см), наличии полипов в двенадцатиперстной кишке и антральном гастрите [2]. Точно дифференцировать спорадические фундальные железистые полипы и фундальные полипы при семейном аденоматозном полипозе во время проведения ЭГДС невозможно. Для выявления полипоза толстой кишки пациентам до 40 лет с множественными фундальными полипами показано проведение сигмо- или колоноскопии. Исследование толстой кишки также необходимо проводить при выявлении в биоптатах этих полипов очагов дисплазии. В свою очередь в комплекс диспансерных мероприятий в отношении больных с аденоматозным полипозом должна обязательно входить ЭГДС.
Гиперпластические полипы
По частоте встречаемости гиперпластические полипы находятся на втором месте после фундальных железистых полипов. По разным данным, их доля среди всех полипов желудка составляет от 18 до 70%. Они могут развиваться в любом возрасте, но наиболее часто выявляются после 60–65 лет. Гиперпластические полипы локализуются преимущественно в антральном отделе и теле желудка, однако они могут формироваться на слизистой кардии и дна. В большинстве случаев это единичные образования размером 0,5–1,5 см. Описаны гигантские полипы размером до 13 см. Маленькие полипы имеют гладкую поверхность и широкое основание. Более крупные образования имеют ножку и дольчатую, часто эрозированную поверхность. В большинстве случаев данный тип полипов развивается на фоне атрофического хеликобактерного гастрита с очагами кишечной метаплазии. Множественные гиперпластические полипы могут выявляться у пациентов с болезнью Менетрие.
Гиперпластические полипы в большинстве случаев не имеют какой-либо клинической симптоматики.
У некоторых пациентов изъязвление их поверхности вызывает желудочное кровотечение и железодефицитную анемию. Описаны случаи обструкции пилорического канала и ампулы фатерова сосочка с развитием вторичного панкреатита [1, 2]. Гистологически гиперпластические полипы характеризуются значительным удлинением и ветвлением выстланных фовеолярным эпителием желудочных ямок, которые в последующем формируют кисты или штопороподобные структуры. Другим характерным признаком служит инфильтрация собственной пластинки слизистой оболочки плазматическими клетками, лимфоцитами, эозинофилами, мастоцитами, макрофагами и нейтрофилами. Между ямками могут располагаться пучки гладкомышечных волокон.
В эпителии гиперпластических полипов участки дисплазии встречаются достаточно редко (2–3%). Описаны и случаи обнаружения фокусов карциномы. Неопластические изменения трудно дифференцировать с регенеративной атипией эпителия и стромы, которая нередко имеет место в ткани данных полипов [1]. Причины развития гиперпластических полипов на сегодняшний день не ясны. Как правило, они формируются при избыточной регенерации в ответ на повреждение слизистой оболочки и часто ассоциированы с хроническим хеликобактерным гастритом и пернициозной анемией. Данные образования нередко располагаются рядом с эрозиями, язвами и гастроэнтероанастамозами [1].
Гиперпластические полипы могут как увеличиваться в размерах и числе, так и регрессировать спонтанно или после проведения эрадикации H. pylori. Злокачественная трансформация эпителия полипов редка (0,6–2,1%) и чаще наблюдается при размерах полипов более 2 см. В то же время этот тип полипов ассоциирован с высоким риском развития неоплазии в окружающей слизистой оболочке. Полного удаления с последующим эндоскопическим наблюдением через несколько месяцев требуют крупные гиперпластические полипы. Необходимость проведения полипэктомии при небольших размерах образования признается не всеми авторами. В этом случае обоснованной может быть наблюдательная тактика с проведением повторной ЭГДС через год. Целесообразно тщательное гистологическое исследование слизистой оболочки желудка на предмет наличия очагов дисплазии и аденокарциномы. Биоптаты берутся из пяти стандартных точек и любых подозрительных участков [4]. Эрадикация H. pylori и устранение хронического активного воспаления слизистой оболочки, на фоне которого развиваются гиперпластические полипы, могут способствовать регрессу этих образований в 70% случаев [2, 18].
Гамартомы
Гамартомы желудка относятся к редким клиническим находкам и представлены ювенильными полипами и полипами при синдромах Пейтца–Егерса и Коудена.
Ювенильный полип
Ювенильные полипы представляют собой единичные (не более двух) гамартомы, которые могут выявляться уже в детском возрасте. В отличие от ювенильного полипоза спорадические ювенильные полипы не несут риска развития неоплазии [19].
Небольшие ювенильные полипы имеют округлую форму и широкое основание. Полипы большого размера приобретают дольчатую структуру и ножку. Локализуются преимущественно в антральном отделе желудка. При гистологическом исследовании ювенильные полипы трудно дифференцировать с гиперпластическими. Они состоят из кистозно расширенных железистых и фовеолярных структур, выстланных нормальным желудочным эпителием и окруженных отечной стромой с элементами воспаления. Гладкомышечные волокна в собственной пластинке слизистой оболочки отсутствуют, что отличает их от полипов Пейтца–Егерса [4].
Ювенильный полипоз является редким аутосомно-доминантным заболеванием с вариабельной пенетрантностью. Он характеризуется наличием гамартомных полипов ЖКТ и повышенным риском развития рака желудка (15–20% в течение жизни) и толстой кишки. Выявляется в детском или подростковом возрасте [20]. При ювенильном полипозе имеют место множественные полипы желудка округлой формы, часто с эрозированной поверхностью. Клинические проявления данного типа полипов могут включать обструкцию привратника, анемию и гипопротеинемию [1]. Морфологическое исследование выявляет извилистые удлиненные и кистозно расширенные железы. Прилегающая слизистая оболочка с признаками отека и воспаления [4]. Высокий риск развития рака желудка и толстой кишки диктует необходимость проведения ЭГДС и колоноскопии с интервалом 1–3 года [2, 4].
Синдром Пейтца–Егерса
Синдром Пейтца–Егерса является редким аутосомно-доминантным наследуемым заболеванием, для которого характерны наличие гамартомных полипов желудка, тонкой и толстой кишки, пигментные пятна на коже и слизистых оболочках, а также повышенный риск развития злокачественных опухолей ЖКТ, молочной железы, эндометрия, яичников и легких. Риск развития рака желудка в течение жизни при синдроме Пейтца–Егерса составляет около 30%. Однако рак редко развивается собственно в тканях гамартомных полипов [21].
У пациентов с данным наследственным заболеванием полипы локализуются в антральном отделе и теле желудка. Они могут располагаться на широкой основе или иметь ножку; поверхность полипов бархатистая или паппилярная. Размер образований обычно не превышает 1 см. Окружающая слизистая оболочка не изменена. При гистологическом исследовании обнаруживают выстланные фовеолярным эпителием гиперплазированные железы, разделенные пучками гладкой мускулатуры, источником которых служит мышечная пластинка слизистой оболочки. Последний морфологический признак позволяет отличать данный тип полипов от полипов при ювенильном полипозе.
Пациентам с синдромом Пейтца–Егерса при наличии полипов желудка показано проведение ЭГДС с частотой один раз в 3 года, которое должно являться частью комплексной программы наблюдения. В возрасте 50 лет этот промежуток должен быть сокращен до 1–2 лет. Полипэктомия, видимо, не снижает риска развития рака желудка и потому может быть рекомендована для устранения осложнений [21].
Синдром Коудена
Синдром Коудена является редким наследуемым аутосомно-доминантным заболеванием, характеризующимся наличием множественных гамартом и неоплазий кожи, слизистой оболочки ЖКТ, щитовидной и молочной желез, мочеполовой системы и мозга. Заболевание чаще всего диагностируется в детском или юношеском возрасте [22]. Гамартомные полипы желудка или двенадцатиперстной кишки при синдроме Коудена выявляются у 66–100% пациентов. Данный тип полипов имеет, как правило, доброкачественную природу. Злокачественная трансформация наблюдается редко. Прогноз определяется высоким риском развития рака внежелудочной локализации. При гистологическом исследовании визуализируются удлиненные кистозно расширенные железы с паппилярными складками, между которыми определяются гладкомышечные компоненты. После уточнения диагноза дальнейшего наблюдения полипов желудка у пациентов с синдромом Коудена не требуется [19].
Полипозные синдром
Семейный аденоматозный полипоз
Семейный аденоматозный полипоз представляет собой аутосомно-доминантное заболевание, связанное с мутацией в гене APC и характеризующееся наличием множественных полипов толстой кишки. Колоректальный рак в течение жизни развивается практически у всех пациентов с семейным аденоматозным полипозом. В 15–20% случаев заболевание развивается «de novo» при неотягощенном наследственном анамнезе [23].
Полипы желудка и двенадцатиперстной кишки регистрируются соответственно у 30–100 и 50–90% пациентов с семейным анденоматозным полипозом. В большинстве случаев полипы желудка представлены фундальными железистыми полипами и лишь в 5% случаев выявляются аденомы антрального отдела. Дифференциальный диагноз требует обязательного взятия биоптатов из ткани не менее пяти полипов. При наличии аденом и фундальных полипов размером более 1 см показана полипэктомия. Полипы двенадцатиперстной кишки имеют злокачественный потенциал и служат основной причиной смертности после выполнения профилактической колэктомии [4].
Эндоскопическое наблюдение должно проводиться с частотой 1 раз в 1–2 года. В отношении пациентов с крупными множественными полипами двенадцатиперстной кишки, содержащими очаги дисплазии, необходимо рассмотреть возможность хирургического лечения [4, 24].
Синдром Кронкайта–Канады
Синдром Кронкайта–Канады – очень редкое ненаследственное заболевание неизвестной этиологии, манифестирующее в возрасте 60–70 лет.
В мире описано около 400 пациентов с этой патологией. Для данного синдрома характерно наличие полипов ЖКТ и дерматологической триады в составе ониходистофии, аллопеции, гиперпигментации кожи. Полипоз пищеварительной системы часто вызывает диарею, мальабсорбцию, гипопротеинемию и потерю веса. Пятилетняя выживаемость составляет 55% [24].
Полипы желудка при синдроме Кронкайта–Канады имеют широкое основание и красноватый цвет. Гистологически выявляются гиперплазия ямок и кистозно расширенные железы, окруженные воспаленной и отечной стромой. Морфологически данные образования не отличимы от ювенильных и гиперпластических полипов. Некоторым дифференциальным признаком может служить выраженное воспаление окружающей слизистой оболочки, которая остается нормальной при других гамартомных полипозных синдромах [1].
Неэпителиальные интрамуральные полипы
Воспалительные фиброзные полипы
Воспалительные фиброидные полипы относятся к редким образованиям в подслизистой оболочке и составляют не более 1–3% от всех полипов желудка. Данный тип полипов может быть выявлен в любом отделе ЖКТ, но 80% приходится на антральный отдел желудка. Причины развития остаются неизвестными. Наиболее часто выявляются у женщин в возрасте 50–60 лет. Воспалительные фиброидные полипы нередко ассоциированы с атрофическим гастритом и гипохлоргидрией, однако злокачественного потенциала не имеют [2, 4].
При эндоскопическом исследовании определяются единичные, хорошо ограниченные образования размером 1–5 см, имеющие широкую основу или ножку. Слизистая оболочка, покрывающая полип, не изменена, однако образования больших размеров имеют центральное вдавление или изъязвления [4]. Гистологическое исследование выявляет наличие подслизистых сосудов, окруженных циркулярно расположенными фибробластами и воспалительным инфильтратом, в котором преобладают эозинофилы. Морфология может давать ложноотрицательные результаты, т.к. образования располагаются в подслизистом слое [4].
Клинические проявления в большинстве случаев отсутствуют, но, как и при любых полипах больших размеров, могут иметь место обструкция привратника, кровотечение и анемия. При полипах крупных размеров рекомендуется проведение полипэктомии, однако полное удаление образования может быть затруднено из-за его прорастания в стенку желудка [2].
Ксантома/ксантелазма
Ксантома слизистой оболочки желудка является доброкачественным образованием, не имеющим самостоятельного клинического значения. Образование ксантом не связано с гиперлипидемией и отражает наличие репаративных процессов. Данные образования выявляются при проведении ЭГДС у 1–7% пациентов [2, 25].
Макроскопически ксантомы характеризуются как небольшие (3–10 мм), имеющие вид узелков или пластинок плоские образования светло-желтого цвета с четкими границами. Локализуются преимущественно в антральном отделе по малой кривизне, вокруг привратника или рядом с зонами регенерации слизистой оболочки (язвы, эрозии, анастамозы). Часто ассоциируются с хроническим хеликобактерным гастритом и могут быть множественными. Ксантомы состоят из скоплений, содержащих холестерин и нейтральный жир макрофагов, локализующихся в собственной пластинке слизистой оболочки.
Ксантома не требует эндоскопического наблюдения, однако для подтверждения диагноза и исключения перстневидноклеточного рака желудка требуется гистологическое исследование [2].
Гетеротопия поджелудочной железы
На долю гетеротопии поджелудочной железы приходится менее 1% всех полипов желудка. Как правило, она представляет собой одиночное округлое подслизистое образование диаметром около 10 мм, локализующееся в препилорическом отделе. В центре часто имеется углубление, обозначающее устье панкреатического протока. Окружающая слизистая оболочка не изменена. Гистологически выявляется нормальная ткань поджелудочной железы с ацинарными клетками и протоками. Из-за подслизистого расположения гетеротопии адекватный забор биопсийного метериала может быть затруднен. Помощь в диагностике оказывает эндоскопическая ультрасонография, которая может быть дополнена тонкоигольной аспирацией [2].
Гетеротопия поджелудочной железы имеет доброкачественное течение и в большинстве случаев не сопровождается клиническими проявлениями.
В крайне редких ситуациях наблюдаются боль в верхней части живота, явления обструкции привратника, панкреатит и аденокарцинома гетеротопированной ткани. В этих случаях может потребоваться хирургическая или эндоскопическая резекция [2, 26]. При неосложненном течении лечения или эндоскопического наблюдения не требуется.
Липома
Липома желудка выявляется относительно редко. На ее долю приходится около 1–2% всех доброкачественных опухолей этого органа. Типичным местом локализации является антральный отдел. В большинстве случаев образование располагается в подслизистом слое.
Эндоскопически липома желудка выглядит как гладкое подслизистое образование, выступающее в просвет органа. Слизистая оболочка над опухолью обычно не изменена, но может наблюдаться изъязвление и углубление в центре. При гистологическом исследовании под слизистой оболочкой обнаруживаются скопления дифференцированных адипоцитов без признаков атипии.
В большинстве случает липома не имеет клинических проявлений, однако могут наблюдаться боли в эпигастрии, диспепсия, кровотечение, анемия и обструкция привратника [27].
Алгоритм ведения пациентов с полипами желудка
Общий алгоритм ведения пациентов с полипами желудка представлен на рисунке. Большинство полипов желудка не имеют симптомов и выявляются случайно – при проведении ЭГДС.
В такой ситуации для определения дальнейшей тактики критически важно получение эндоскопистом максимального объема диагностической информации. Это позволит избежать обременительного для пациента повторного эндоскопического исследования.
В протоколе ЭГДС необходимо подробно описать локализацию, количество, форму, поверхность и размеры полипов, а также состояние окружающей слизистой оболочки желудка. При наличии технических возможностей к протоколу должны быть приложены эндофотографии. Данные полноценного эндоскопического заключения часто позволяют сделать предположение о типе полипов еще до получения результатов морфологического исследования.
При обнаружении полипов желудка обязательно выполнение биопсии с последующим гистологическим исследованием образцов. При подозрении на гиперпластические или аденоматозные полипы необходимо получить биоптаты окружающей слизистой оболочки по стандартной схеме (2 биоптата из антрального отдела, 1 – из угла желудка, 2 – из тела). При подозрении на фундальные железистые полипы биопсии непораженной слизистой оболочки обычно не требуется [2, 28].
Крупные полипы размером более 1 см, полипы с очагами дисплазии, а также полипы, имеющие клиническую симптоматику, требуют проведения полипэктомии или эндоскопической резекции слизистой оболочки. Выполнение этих манипуляций должно осуществляться в хорошо оснащенных клинических центрах, т.к. требует медикаментозной подготовки и несет значительный риск развития серьезных осложнений (кровотечение и перфорация). Перед проведением эндоскопического лечения необходима оценка общего состояния пациента, сопутствующих заболеваний и риска развития кровотечения [2, 28].
После удаления аденоматозного или гиперпластического полипа повторная ЭГДС должна быть проведена через год. Наличие в ткани полипа дисплазии высокой степени диктует необходимость более коротких интервалов, которые в первые 2–3 года могут составлять 6 месяцев. Пациенты с простыми фундальными железистыми полипами и воспалительными фиброидными полипами не нуждаются в дальнейшем наблюдении. При полипозных синдромах мониторинг должен осуществляться в соответствии с существующими клиническими рекомендациями [2, 28].
Поскольку аденомы и нередко другие виды полипов часто ассоциированы с хеликобактерной инфекцией (хеликобактерный хронический атрофический гастрит), основываясь на рекомендациях Киотского протокола (2015), таким больным рекомендована эрадикационная терапия независимо от варианта оперативного лечения (предпочтительно до оперативного лечения) [29, 30]. Как наиболее эффективные варианты эрадикации с учетом актуальности растущей резистентности пилорического хеликобактера к антибиотикотерапии, в первую очередь к кларитромицину, рекомендуются схемы, предложенные МОО «Альянс клинических химиотерапевтов и микробиологов», разработанные для амбулаторной практики на основании последних консенсусов по проблеме хеликобактерной инфекции (Киотский консенсус, Маастрихт-IV–V, V Московское соглашение и др.): ИПП в двойной дозе 2 раза в сутки+соли висмута1 0,12 г 4 раза в сутки+метронидазол внутрь 0,5 г 3 раза в сутки+тетрациклин внутрь 0,5 г 4 раза в сутки. Как вариант – ИПП в двойной дозе2 2 раза в сутки+кларитромицин внутрь 0,5 г 2 раза в сутки или джозамицин внутрь 1,0 г 2 раза в сутки+амоксициллин внутрь 1,0 г 2 раза в сутки+соли висмута 0,12 г 4 раза в сутки. Как альтернативная терапия: ИПП в двойной дозе 2 раза в сутки+кларитромицин внутрь 0,5 г 2 раза в сутки или джозамицин внутрь 1,0 г 2 раза в сутки+амокси-циллин внутрь 1,0 г 2 раза в сутки, данная схема может использоваться в условиях низкого уровня популяционной устойчивости H. pylori к макролидам (≤15–20%). Все схемы назначаются на срок 1014 дней. С учетом того что эффективность эрадикации H. pylori помимо антибиотикорезистентности микроорганизма зависит от ряда генетических особенностей пациента (полиморфизмы генов CYP2C19, MDR1, IL-1β), целесообразно обязательное проведение контроля эрадикации не ранее чем через 4 недели [31, 32].
Литература
1. Park D.Y., Lauwers G.Y. Gastric Polyps: classification and management. Arch. Pathol. Lab. Med. 2008;132:633–40.
2. Carmack S.W., Genta R.M., Graham D.Y., Lauwers G.Y. Management of gastric polyps: a pathologybased guide for gastroenterologists. Nat. Rev. Gastroenterol. Hepatol. 2009;6:331–41.
3. Yamada S., Ichikawa H. Endoscopic characteristics of epithelial gastric polyps. J. Gastroenterol. 1966;6:132–654.
4. Goddard A.F., Badreldin R., Pritchard D.M., et al. The management of gastric polyps. Gut. 2010;59:1270–76.
5. Аруин Л.И., Капуллер Л.Л., Исаков В.А. Морфологическая диагностика болезней желудка и кишечника. М.,1998, 496 с.
6. Hiroyoshi O., Riddell R. Gastric Adenoma: Reclassification based on phenotypes and its clinical and diagnostic significance. Pathol. Case Rev. 2008;13:189–198.
7. Vieth M., Kushima R., Borchard F., Stolte M. Pyloric gland adenoma: a clinicopathological analysis of 90 cases. Virchows Arch. 2003;442:317–21.
8. Abraham S.C., Park S.J., Mugartegui L., et al. Sporadic fundic gland polyps with epithelial dysplasia: evidence for preferential targeting for mutations in the adenomatous polyposis coli gene. Am. J. Pathol. 2002;161:1735–42.
9. Hirota W.K., Zuckerman M.J., Adler D.G., et al. ASGE guideline: the role of endoscopy in the surveillance of premalignant conditions of the upper GI tract. Gastrointest. Endosc. 2006;63:570–80.
10. El Hajj I.I., Hawchar M., Soweid A., et al. Giant sporadic fundic gland polyp: endoscopic and endosonographic features and management. World J. Gastroenterol. 2008;14:6593–95.
11. Spiegel A., Stein P., Patel M., et al. A Report of gastric fundic gland polyps. Gastroenterology & Hepatology. 2010;6:45–8.
12. Raghunath A.S., O’Morain C., McLoughlin R.C. Review article: the longterm use of proton-pump inhibitors. Aliment. Pharmacol. Ther. 2005;2(suppl. 1):55–63.
13. Jalving M., Koornstra J.J., Wesseling J., et al. Increased risk of fundic gland polyps during long-term proton pump inhibitor therapy. Aliment Pharmacol. Ther. 2006;24:1341–48.
14. Choudhry U., Boyce H.W. Coppola Jr.D. Proton pump inhibitor associated gastric polyps: a retrospective analysis of their frequency, and endoscopic, histologic, and ultrastructural characteristics. Am. J. Clin. Pathol. 1998;110:615–21.
15. Cats A., Schenk B.E., Bloemena E., et al. Parietal cell protrusions and fundic gland cysts during omeprazole maintenance treatment. Hum. Pathol. 2000;31:684–90.
16. Burt R. Clinical management of gastric fundal gland polyps. Gastroenterology 2003;125:1462–69.
17. Bianchi L.K., Burke C.A., Bennett A.E., et al. Fundic gland polyp dysplasia is common in familial adenomatous polyposis. Clin. Gastroenterol. Hepatol. 2008;6:180–85.
18. Liu W.Z., Xie Y., Cheng H., et al. Fourth Chinese National Consensus Report on the management of Helicobacter pylori infection J Dig Dis 2013;14:211–221.
19. Lam-Himlin D., Arnold C.A., De Petris G. Gastric polyps and polyposis syndromes. Diagnostic Histopathology. 2013;20:1–11.
20. Hizawa K., Iida M., Yao T., et al. Juvenile polyposis of the stomach: clinicopathological features and its malignant potential. J. Clin. Pathol. 1997;50:771–74.
21. Beggs A.D., Latchford A.R., Vasen H.F.A., et al. Peutze-Jeghers syndrome: a systematic review and recommendations for management. Gut. 2010;59:975–86.
22. Uppal S., Mistry D., Coatesworth A.P. Cowden disease: a review. Int. J. Clin. Pract. 2007;61:645–52.
23. Vasen H.F.A., Moslein G., Alonso A., et al. Guidelines for the clinical management of familial adenomatous polyposis (FAP). Gut 2008;57:704–13.
24. Samoha S., Arber N. Cronkhite-Canada syndrome. Digestion 2005;71:199–200.
25. Yi S.Y. Dyslipidemia and H. pylori in gastric xanthomatosis. World J. Gastroenterol. 2007;13:4598–601.
26. Ormarsson O.T., Gudmundsdottir I., Marvik R. Diagnosis and treatment of gastric heterotopic pancreas. World J. Surg. 2006;30:1682–89.
27. Alberti D., Grazioli L., Orizio P., et al. Asymptomatic giant gastric lipoma: What to do? Am J Gastroenterol 1999;94:3634–47.
28. Shaib Y.H., Rugge M., Graham D.Y., Genta R.M. Management of gastric polyps: an endoscopy-based approach. Clin gastroenterol hepatol 2013;11:1374–84.
29. Маев И.В., Андреев Д.Н., Самсонов А.А., Дичева Д.Т., Парцваниа-Виноградова Е.В. Эволюция представлений о дефиниции, классификации, диагностике и лечении гастрита, ассоциированного с инфекцией helicobacter pylori (по материалам киотского консенсуса, 2015). Фарматека. 2016;6:24–33.
30. Маев И.В., Самсонов А.А., Андреев Д.Н. Инфекция Helicobacter pylori. М., 2016.
31. Maev I.V., Andreev D.N., Kucheryavyi Yu.A., Dicheva D.T. Host factors influencing the eradication rate of Helicobacter pylori. World Applied Sci. J. 2014;30:134–40.
32. Маев И.В., Кучерявый Ю.А., Андреев Д.Н. Актуальные возможности оптимизации антихеликобактерной терапии. Лечащий врач. 2014;4:73–9.
Об авторах / Для корреспонденции
Самсонов А.А. – д.м.н., проф. кафедры пропедевтики внутренних болезней и гастроэнтерологии ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России, Москва
Ксантома желудка: причины, признаки и симптомы, как лечится

Ксантома желудка – это такие жировые отложения, которые откладываются в виде единичных или множественных образований в разных отделах органа. У медиков не сложилось единого мнения по вопросу об опасности этой опухоли. Некоторые научные источники указывают на высокую вероятность ракового перерождения ксантом.
Согласно МКБ ксантома желудка имеет код У 78.2.
Основные причины патологии
Этиология и патогенез образования ксантом изучен недостаточно.
Факторы, провоцирующие образование ксантом:
Клиническая картина
Внешне ксантома желудка выглядит в виде небольшого нароста–бляшки, возвышающуюся над поверхностью слизистой. Гистологическое строение представлено скоплением клеток, большую часть которых заполняют жировые включения. Ядра клеток и другие структуры оттеснены к периферии.

Признаки и симптомы заболевания
Часто ксантомы обнаруживаются при проведении ФГС желудка как случайная находка. Длительное время данная патология протекает без выраженных симптомов. Так как ксантома редко развивается изолированно, как правило, это происходит на фоне других поражений органа, симптоматика не отличается специфичностью, а появляющиеся признаки часто присутствуют и при различных болезнях ЖКТ.
Методы диагностики
Основной способ обнаружение ксантом – эндоскопический метод.
Признаком ксантомы является обнаружение на слизистой желудка желтоватых образований, характерной особенностью которых является то, что они прикрыты сверху толстым слоем пенистой слизи и плохо визуализируются при ФГС без специальной подготовки. Перед эндоскопией пациент принимает препараты, растворяющие слизистый покров.
Биохимический анализ крови показывает увеличенную концентрацию холестерина и дислипидемию с преобладанием липопротеидов низкой плотности.
Диагноз ставят на основании гистологического исследования биоптата из подозрительных на ксантому образований в слизистой желудка. Микроскопически определяются пенистые клетки, в цитоплазме которых находится большое количество липидов, в том числе и холестерин.
При некоторых заболеваниях пищеварительного тракта происходят изменения слизистой желудка, напоминающие гистологическую картину при ксантоме, поэтому в ходе дифференциальной диагностики используют иммуногистохимический метод с определением специфического маркера.
Лечение
Основное направление терапии при ксантоме – это нормализация липидного обмена.
Медикаментозная терапия
Статины – группа липидснижающих препаратов, механизмом действия которых, является угнетение фермента, необходимого при синтезе холестерина: Церивастатин, Розувастатин.
Безафибрат – активирует ферменты, участвующие в обмене липидов. Ускоряет выведение из организма липидов низкой плотности.
Никотиновая кислота (Ниацин) снижает концентрацию липопротеидов низкой плотности и повышает содержание нужных липопротеидов высокой плотности.
Препараты – секвестры желчных кислот связывают в кишечнике желчные кислоты, переводя их в нерастворимое соединение, выводят из организма с калом: Колестирамин, Холестид.
Некоторые лекарственные препараты, применяемые в гомеопатии, также способны понизить уровень холестерина в крови до физиологической нормы: Холвакор, Холестеринум, Пульсатилла.
Для радикального удаления ксантом желудка, если существует угроза злокачественного перерождения опухоли, используют малоинвазивные методы хирургии – лазер или электрокоагуляцию.
Лечебное питание
Основные принципы гиполипидной диеты:
Способы лечения народной медицины
Доказано лечебное действие на холестериновый обмен включение в рацион продуктов, содержащих Омега-3 жирных кислот. Чемпионами по содержанию этого вещества признаются рыбий жир и льняное масло.
Рыбий жир выпускается в капсулах, поэтому при приеме не ощущается его неприятный вкус и запах. Рекомендуется курс в течение месяца по 2 капсулы в день во время или после еды.
Натуральное льняное масло употребляют по чайной ложке 2–3 раза в день после еды.
В чесноке присутствует аминокислота аллицин, которая способна снизить уровень холестерина. Для приготовления настойки в 500 мл спирта добавляют 100 г измельченного чеснока. Через две недели, настой пьют по 10 капель ежедневно.
Экстракт артишока. В 500 мл спирта всыпают 100 г сушеного корня артишока. После отстаивания в течение 14 дней процеживают и пьют по чайной ложке дважды в день.
Семена подорожника предупреждают реабсорбцию желчи, тем самым не происходит всасывания холестерина в кровь. Принимают измельченные в блендере сухие семена (по чайной ложке), запивая водой. Курс – 1 месяц.
Народные рецепты фитотерапии:
Полезное видео
Чем опасен рак желудка можно узнать из этого видео.
Профилактика
Предупреждение нарушений липидного обмена, а значит и образование ксантом желудка, возможно при соблюдении здорового образа жизни:
Что такое ксантома?

Ксантомы на коже: что это такое?
Если происходит нарушение жирового обмена в тканях и клетках, то на теле человека появляются очаговые новообразования называемые ксантомами. Выглядят они как небольшие наросты белого или желтоватого цвета, содержащие внутри жировые клетки. Такие новообразования могут быть локальными, они появляются только на одном участке тела, и генерализованными, то есть те, что распространяются по всей коже.
Было установлено, что одной из главных причин появление ксантом является избыток холестерина в крови; так же на их появление может повлиять:
Новообразования появляются, когда кровь перенасыщена переработанными остатками жиров. Это заболевание опасно, тем, что сопровождается поражением сосудов и некоторых внутренних органов.
Виды ксантом
Разберем подробнее отдельные виды ксантом, их локализацию и внешний вид.

Специалисты выделяют два типа плоских ксантом:

Множественная узелковая ксантома.




Ксантома: как избавиться?
Диагностировать ксантому можно при первом же посещении врача дерматолога. По внешнему виду, мягкой форме, локализации и внутренней консистенции, врач может определить вид ксантомы. Для определения причин появления новообразований на теле, пациенту необходимо сдать анализ крови, в некоторых случаях пройти биопсию. Очень важно установить заболевание, которое вызвало появление бляшек. Также людям с признаками ксантом в обязательном порядке нужно пройти консультацию и у других врачей: эндокринолога и кардиолога.

Сегодня косметическое удаление проходит быстро и просто, с помощью современных методик. Расскажем о каждой более подробно:
— Лазерное удаление ксантомы. Это один из наиболее эффективных способов лечения новообразований на теле. Лазер безопасен, процедура проходит максимально комфортно для человека. Воздействие происходит только на саму ксантому, здоровая кожа не повреждается. Заживление ранок, после процедуры занимает 5-7 дней. Ни шрамов, ни рубцов на коже не остается. Лазерное удаление это современный и наименее травмотичный метод избавления от ненужных косметических дефектов.
— Хирургическое удаление. Если образования ксантом очень обширны, то врачи предлагают удалить их хирургическим путем с помощью скальпеля или ножниц. Процедура проводится под анестезией, после удаления ксантом, ранки обрабатываются антисептическими средствами, и накладывают повязки. Заживления обширных участков занимает до 10 дней и больше.
— Криодеструкция. С помощью жидкого азота низкой температуры разрушаются клетки новообразования и оно отмирает самостоятельно. Процедура проводится всего несколько минут. Однако чаще всего после криодеструкции на коже остаются небольшие рубцы.
— Радиоволновое удаление. В этом методе применяется электрический ток, ткани образования нагреваются до максимальной температуры и разрушаются. Благодаря чему ксантома исчезает с поверхности кожи.
Однако, рецидивы данного заболевания возможны. Необходимо тщательно следить за здоровьем и соблюдать диету, назначенную врачом.
Лазерное вмешательство при удалении новообразований кожи
Ксантоматоз
Ксантоматоз – обменное заболевание, при котором на поверхности кожных покровов и в некоторых других тканях формируются отложения липидов, главным образом холестерола и холестанола (ксантомы). Симптомами этого состояния являются желтоватые безболезненные бляшки и наросты на коже лица, нижних век (ксантелазма), конечностей и туловища без признаков воспаления. Диагностика ксантоматоза осуществляется по результатам осмотра кожных покровов, а также изучения основных показателей липидного обмена (уровня холестерина и липопротеидов в крови). Лечение разделяется на общее – коррекция липидного обмена – и местное, при котором производят удаление ксантом хирургическим путем или средствами медицинской косметологии.
Общие сведения
Ксантоматоз представляет собой множественные отложения липоидных веществ в коже (в некоторых случаях – в костях, твердой мозговой оболочке, сухожилиях), которые обусловлены гиперлипидемией. Одним из первых исследователей, который сумел верно описать и охарактеризовать это дерматологическое состояние еще в 1835 году, был французский врач П. Райе. Ксантоматоз кожи является лишь частью проявлений при нарушенном липидном обмене, помимо этого у больных могут наблюдаться также ксантелазмы, атеросклероз, липоидная дуга роговицы и даже пороки сердца, обусловленные отложением липидов на клапанах. Это состояние не является распространенным, может быть обусловлено, как первичными (генетическими) нарушениями, так приобретенными расстройствами метаболизма жиров. В некоторых случаях ксантоматоз обусловлен возрастными изменениями. В зависимости от типа и характера нарушений липидного обмена, это кожное заболевание может проявиться в разном возрасте – от детского и подросткового до преклонного и старческого.
Причины ксантоматоза
Главной причиной развития ксантоматоза является нарушение липидного обмена с развитием гиперлипидемии – состояния, при котором в крови резко увеличивается количество различных фракций липопротеидов. Такие изменения могут иметь различную природу – например, первичное расстройство метаболизма жиров имеет пять разновидностей. Каждая из них обусловлена нарушением работы определенного звена транспорта жиров и холестерина в организме, но все они имеют примерно одинаковый итог – триглицериды и холестерол в виде липопротеидов начинают накапливаться в крови, изменяя ее реологические свойства.
В результате сложных процессов липиды начинают проникать в клетки и межклеточное пространство тканей кожи и сухожилий, формируя там скопления, которые визуально определяются как ксантомы. Множественное образование таких скоплений на кожных покровах и носит название ксантоматоза.
Помимо первичных или наследственных нарушений липидного обмена, ведущих к гиперлипидемии и ксантоматозу, существуют и приобретенные факторы, способные увеличивать уровень триглицеридов и холестерина в крови. К ним относят сахарный диабет, высокое поступление жиров с пищей, гипотиреоз, воспаление поджелудочной железы (панкреатит), поражение печени (тяжелый гепатит, цирроз). В некоторых случаях гиперлипидемия с развитием ксантоматоза возникает в преклонном возрасте как часть комплекса старческих изменений в организме. Как правило, вторичные, или приобретенные, формы ксантоматоза чаще встречаются у лиц старшего или пожилого возраста, тогда как первичные могут развиваться как у детей, так и у взрослых. Патогенез отложения липидов в коже при вторичных гиперлипидемиях не имеет характерных отличий.
Симптомы ксантоматоза
Сами ксантомы при этом состоянии могут иметь различный внешний вид, который во многом зависит от причин, обусловивших развитие ксантоматоза. Так, выделяют эруптивные ксантомы, которые имеют сначала красный, затем желтоватый цвет, но багровый ободок сохраняется вокруг них еще долгое время. Они имеют четкие границы и полусферическую форму. Туберозные ксантомы характеризуются симметричным образованием, имеют желтый или коричневый цвет и могут достигать довольно крупных размеров – до 2-3 сантиметров. Плоские ксантомы, выявляемые при некоторых типах ксантоматоза, представляют собой пятна или бляшки желтого цвета, довольно часто возникают на ладонных поверхностях кисти. Также в отдельные типы иногда выделяют сухожильные ксантомы и ксантелазмы – жировые отложения на веках.
Классификация такого состояния, как ксантоматоз неотрывно связана с разновидностями нарушений липидного обмена. От типа подобных расстройств зависит характер липидных образований на коже и в других тканях, возраст их развития, клиническое течение и ряд других факторов. Все причины гиперлипидемии, ведущей к ксантоматозу, делят на две группы – первичные и вторичные. Первичные, в свою очередь, подразделяются на пять разновидностей, которые характеризуются патологиями разных звеньев липидного обмена:
Таким образом, если причиной ксантоматоза выступают первичные формы гиперлипидемии, то по характеру высыпаний, возрасту больного и другим симптомам можно примерно определить ее тип. В отношении вторичных типов нарушения липидного обмена такой четкой взаимосвязи не выявляется. Течение ксантоматоза при этом зависит от тяжести расстройства метаболизма липидов и реактивности организма – возможно появление как одиночных ксантом небольшого размера, так и множественных отложений жироподобных веществ по всему телу диаметром до 3-4 сантиметров. В случае вторичного ксантоматоза к клинической картине заболевания всегда добавляются симптомы основной патологии, которая стала причиной сбоя обмена жиров (сахарный диабет, цирроз печени и другие).
Диагностика ксантоматоза
Обычно в дерматологии диагностика такого состояния, как ксантоматоз, не представляет особых трудностей. Для этого используют метод осмотра кожных покровов пациента, биохимический анализ крови или исследование липидограммы, в спорных случаях могут производить биопсию ксантом для гистологического изучения. При осмотре дерматологом выявляются различные по форме, размерам и локализации образования от желтого до коричневого цвета, которые могут быть окружены багрово-красной каймой или неизмененной кожей. Они безболезненны и не вызывают у пациента никакого беспокойства, за исключением эстетического дефекта. Нередко обращает на себя внимание ожирение пациента или, наоборот, его чрезмерная худоба (при сахарном диабете первого типа).
Липидограмма указывает на высокий уровень различных фракций липидов крови – липопротеидов очень низкой плотности, хиломикронов, холестерина или триглицеридов. Увеличивается значение индекса атерогенности, что указывает на преобладание вредных фракций липопротеидов в крови больного. Сочетание гиперлипидемии и наличия ксантом на коже уже достаточно четко свидетельствует в пользу ксантоматоза у пациента. При гистологическом изучении тканей в очагах поражения определяется большое количество пенистых клеток с их преимущественной локализацией вокруг кровеносных сосудов. При окраске суданом-3 клеточные включения в них становятся оранжевого цвета, что говорит об их липидной природе. Эпидермис в области развития скоплений жироподобных веществ при ксантоматозе мало изменен, иногда отмечается незначительный гиперкератоз.
Лечение и прогноз ксантоматоза
Общее лечение ксантоматоза сводится к снижению уровня липоидных компонентов в крови и нормализации обмена жиров. Для этой цели используют как диету с низким содержанием липидов, так и специальные противоатеросклеротические препараты – например, аторвастатин. В тех случаях, когда гиперлипидемия обусловлена другим заболеванием, необходимо начинать его лечение – например, устранять гипотиреоз, гепатит, контролировать сахарный диабет. В некоторых случаях, особенно при молодом возрасте пациента, и если ксантоматоз проявлялся эруптивными ксантомами, после нормализации уровня липидов в крови кожные проявления заболевания способны самостоятельно исчезать. В других случаях ксантомы необходимо убирать хирургическими методиками, криодеструкцией, лазерным прижиганием или электрокоагуляцией.
Прогноз ксантоматоза напрямую зависит от причин гиперлипидемии, так как некоторые ее формы способны проявляться не только кожными симптомами, но и пороками сердца, атеросклерозом коронарных и мозговых сосудов, гепатомегалией. Ксантомы сами по себе не представляют угрозы жизни пациента и могут создавать только косметические неудобства. Прогноз относительно выздоровления и полного устранения ксантоматоза в ряде случаев благоприятный – при поддержании оптимального уровня липидов в крови новые образования не появляются, а уже сформировавшиеся можно убрать косметологическими методами. Однако если по различным причинам снова будет иметь место гиперлипидемия, то возможен рецидив заболевания.
Современная стратегия ведения пациента с предраковыми заболеваниями желудка

Представлен обзор, обобщающий существующие международные рекомендации по ведению пациентов с атрофическим гастритом, кишечной метаплазией и дисплазией желудка. Показано, что пациенты с хроническим атрофическим гастритом или кишечной метаплазией имеют повы
The review summarize existing international recommendations for managing patients with atrophic gastritis, intestinal metaplasia and gastric dysplasia. It is shown that patients with chronic anthropic gastritis or intestinal metaplasia have an increased risk of stomach adenocarcinoma development. Helicobacter pylori eradication tends to relieve indications of chronic nonatrophic gastritis and can lead to partial regression of atrophic gastritis, and reduces the risk of stomach cancer development.
Несмотря на успехи в области диагностики и лечения, рак желудка остается серьезной проблемой в мировом масштабе, занимая шестое место по уровню заболеваемости и второе — в структуре смертности от онкологических заболеваний [1–2]. Самые высокие показатели отмечаются в странах Восточной и Центральной Азии, Латинской Америке, самые низкие — в Северной Америке. В Восточной Азии заболеваемость раком желудка составляет 32,1 на 100 000 у мужчин, 13,2 — у женщин, в Южной Корее — 57,8 и 23,5 на 100 000, в Японии 40,7 и 16,0 на 100 000 для мужчин и женщин соответственно [1–2]. Наименьшая заболеваемость наблюдается в Северной Америке и большинстве районов Африки. Так, в Соединенных Штатах Америки (5,5 на 100 000 у мужчин; 2,8 — у женщин) [1]. Россия относится к странам с умеренным риском рака желудка, наряду с Португалией, Сингапуром, Эстонией. По итогам 2018 г., согласно российской статистике, в структуре общей заболеваемости удельный вес опухолей желудка достигал 20,4 на 100 000 населения у мужчин и 8,8 — у женщин [3]. Улучшение эпидемиологической ситуации по раку желудка наблюдается, как правило, в странах, где разработаны профилактические мероприятия, высокий уровень осведомленности населения и длительное время существуют национальные программы скрининга и ведения пациентов с предраковыми заболеваниями [4].
Цель представленного обзора — обобщение существующих международных рекомендаций по ведению пациентов с атрофическим гастритом, кишечной метаплазией и дисплазией желудка.
В 2012 г. Европейским обществом гастроинтестинальной эндоскопии (ESGE), Европейской группой по изучению Helicobacter и микробиоты (EHMSG), Европейским обществом патологов (ESP) и Португальским обществом гастроинтестинальной эндоскопии (SPED) были разработаны первые международные рекомендации по лечению предраковых состояний и изменений желудка (MAPS I). В 2019 г. опубликована обновленная версия рекомендаций под названием MAPS II [4]. Данные рекомендации были представлены на рассмотрение в разных странах.
Различные формы рака имеют свои специфические характеристики, знание которых позволит оптимизировать диагностику рака желудка на ранних стадиях. Подавляющее большинство раков желудка — аденокарциномы (АК, около 90%), которые происходят из желез слизистой оболочки желудка. Аденокарциномы желудка (АКЖ) подразделяют на кардиальные и некардиальные. Выделяют два основных гистологических типа некардиальных АКЖ: диффузные и кишечные. Кардиальной формой рака желудка является некардиальная аденокарцинома кишечного типа (90% АКЖ). Последняя имеет строение опухоли, сходное с картиной рака кишки. Для них характерны отчетливые железистые структуры, состоящие из высокодифференцированного цилиндрического эпителия с развитой щеточной каемкой. Диффузный тип опухоли представлен слабо организованными группами или одиночными клетками с большим содержанием муцина (перстневидные клетки) и характеризуется диффузным инфильтративным ростом. Возможен смешанный тип — в опухоли присутствуют участки кишечного и диффузного типа [5]. Дифференцированный тип чаще встречается у пожилых мужчин и развивается медленно, тогда как диффузный тип чаще встречается у женщин более молодого возраста и имеет худший прогноз [5].
Обзор представленных рекомендаций не распространяется на наследственный/семейный диффузный рак желудка, для которого разработаны специальные рекомендации [6].
Аденокарцинома желудка кишечного типа представляет собой окончательный исход последовательности «воспаление — атрофия — метаплазия — дисплазия — карцинома», известной как каскад Корреа [7–11].
Рекомендация 1 (MAPS II). Пациенты с хроническим атрофическим гастритом или кишечной метаплазией подвержены риску развития аденокарциномы желудка (высокий уровень доказательности) [4].
Хронический атрофический гастрит и кишечную метаплазию (КМ) рассматривают как предраковые состояния, поскольку они сами по себе связаны с риском развития рака желудка и на их фоне возможно развитие дисплазии и аденокарциномы [7–11].
Рекомендация 2 (MAPS II). Гистологически подтвержденная кишечная метаплазия — наиболее надежный маркер атрофии слизистой оболочки желудка (высокий уровень доказательности) [4].
Рекомендация 3 (MAPS II). Необходимо выявлять пациентов с гастритом на поздних стадиях, т. е. с атрофией и (или) кишечной метаплазией, слизистой оболочки как антрального отдела желудка, так и тела желудка, поскольку считается, что они подвержены более высокому риску развития аденокарциномы желудка (умеренный уровень доказательности, сильная рекомендация).
Рекомендация 4 (MAPS II). Дисплазию тяжелой степени и инвазивную карциному следует рассматривать как исходы, которые необходимо предотвратить при лечении пациентов с хроническим атрофическим гастритом или кишечной метаплазией (умеренный уровень доказательности, сильная рекомендация).
Рекомендация 5 (MAPS II). У пациентов с эндоскопически определяемыми патологическими изменениями, указывающими на дисплазию легкой или тяжелой степени или карциному, следует определить стадию заболевания и начать лечение (высокий уровень доказательности, сильная рекомендация).
Рекомендация 6 (MAPS II). Эндоскопия высокого разрешения в сочетании с хромоэндоскопией более эффективна, чем эндоскопия высокого разрешения в белом свете, при диагностике предраковых состояний желудка и неопластических поражений на ранней стадии (высокий уровень доказательности).
Рекомендация 7 (MAPS II). При наличии возможности и после надлежащего обучения для диагностики предраковых состояний желудка следует применять виртуальную хромоэндоскопию с увеличением или без увеличения изображения, что позволяет выполнять контролируемую биопсию на участках атрофических и метапластических изменений, а также обеспечивает выявление неопластических поражений (умеренный уровень доказательности, сильная рекомендация).
Рекомендация 8 (MAPS II). Для надлежащего определения стадии предраковых состояний желудка первая диагностическая эндоскопия верхнего отдела желудочно-кишечного тракта должна включать взятие биопсийных образцов из желудка для определения наличия инфекции Helicobacter pylori и выявления атрофического гастрита на поздних стадиях (умеренный уровень доказательности, сильная рекомендация) [4].
Рекомендация 9 (MAPS II). Следует выполнить биопсию как минимум на двух топографических участках (по малой и большой кривизне, как в антральном отделе желудка, так и в теле желудка). Следует дополнительно выполнить биопсию видимых предполагаемых неопластических поражений (умеренный уровень доказательности, сильная рекомендация) [4].
Рекомендация 10 (MAPS II). Для выявления пациентов с гастритом на поздних стадиях можно использовать системы гистопатологического определения стадии заболевания (например, оперативную систему оценки гастрита (OLGA) и оперативную систему оценки гастрита, основанную на кишечной метаплазии (OLGIM)). Стадии III и IV могут указывать на пациентов, подверженных более высокому риску развития рака желудка [12].
Следует рассмотреть возможность выполнения дополнительной биопсии из угла желудка (умеренный уровень доказательности, слабая рекомендация). Данный подход позволяет обеспечить максимальную степень выявления пациентов с предраковыми состояниями, в особенности в случаях, когда применение хромоэндоскопии для прицельной биопсии невозможно [4].
В случае выявления патологического изменения и результатов эндоскопической оценки, указывающих на наличие дисплазии, рекомендуется проводить резекцию патологического участка без дополнительной биопсии [4].
При наличии возможности для диагностики предраковых состояний желудка следует применять виртуальную хромоэндоскопию с увеличением или без увеличения изображения, что позволяет выполнять контролируемую биопсию на участках атрофических и метапластических изменений, а также обеспечивает выявление неопластических поражений. Эндоскопия высокого разрешения в сочетании с хромоэндоскопией более эффективна, чем эндоскопия высокого разрешения в белом свете, при диагностике предраковых состояний желудка и неопластических поражений на ранней стадии. Если при такой эндоскопии высокого разрешения не выявлены патологические изменения, рекомендуется выполнить биопсию для определения стадии гастрита (если ее не выполняли ранее) и эндоскопическое наблюдение в течение от 6 месяцев (при дисплазии тяжелой степени) до 12 месяцев (при дисплазии легкой степени) [4].
Дисплазия желудка представляет собой предпоследнюю стадию последовательности желудочного канцерогенеза. Ее определяют как гистологически подтвержденные неопластические изменения эпителия без признаков тканевой инвазии, что указывает на непосредственное неопластическое предраковое изменение [13]. Всемирная организация здравоохранения подтвердила классификацию дисплазии/интраэпителиальной неоплазии [14]:
Диагноз «неопределенная дисплазия/неоплазия» не следует изначально рассматривать как безобидный, несмотря на то, что у большинства пациентов прогноз будет благоприятным. В действительности в одном из исследований было установлено, что 26,8% резецированных поражений, классифицированных как неопределенная дисплазия/неоплазия по результатам биопсии перед резекцией, фактически представляли собой неопластические поражения (5,0% — аденома и 21,8% — ранний рак желудка) [15].
Следует помнить, что даже дисплазия легкой степени может представлять собой злокачественное новообразование [16].
В случае видимых патологических изменений одной эндоскопической биопсии недостаточно для диагностики злокачественного новообразования, при наличии любого эндоскопически определяемого патологического изменения с любыми неопластическими изменениями необходимо производить его эндоскопическую резекцию[4].
Рекомендуется проверка гистологических препаратов и немедленная (в кратчайшие возможные сроки) повторная оценка с применением эндоскопии высокого разрешения и хромоэндоскопии [4].
При отсутствии эндоскопически определяемых патологических изменений у пациентов с дисплазией рекомендуется выполнять немедленную повторную оценку с применением эндоскопии высокого разрешения и хромоэндоскопии (виртуальной или с применением красителя) [4].
Пациентам с неопределенной дисплазией, дисплазией, как и с карциномой, диагностированными на основании результатов неприцельной биопсии, необходимо дообследование и лечение только в клиниках, специализирующихся на диагностике и эндоскопическом лечении рака желудка [4].
Неинвазивные методы диагностики предраковых изменений слизистой оболочки желудка
Низкий уровень пепсиногена I в сыворотке крови и (или) низкое соотношение пепсиногена I/II позволяет выявлять пациентов с атрофическим гастритом на поздних стадиях. У таких пациентов рекомендуется выполнять эндоскопию, в особенности при отрицательном результате серологического теста на H. pylori. В качестве предельных значений указывается уровень пепсиногена I
* ФГБОУ ВО МГМСУ им. А. И. Евдокимова Минздрава России, Москва
** ФГБОУ ВО ОмГМУ МЗ РФ, Омск
*** МЦ ЦБ РФ, Москва
**** ФГБОУ ВО СибГМУ Минздрава России, Томск
# ФГБОУ ВО КубГМУ Минздрава России, Краснодар
## ГБУЗ ГБ № 3 г. Сочи Минздрава КК, Сочи
### ИГМАПО — филиал ФГОУ ДПО РМАНПО Минздрава России, Иркутск
#### ФГБОУ ВО КрасГМУ им. проф. В. Ф. Войно-Ясенецкого Минздрава России, Красноярск
@ ФГБОУ ВО УрГМУ Минздрава России, Екатеринбург
@@ ФГБОУ ВО Южно-Уральский ГМУ Минздрава России, Челябинск
Современная стратегия по ведению пациента с предраковыми заболеваниями желудка/ Л. Б. Лазебник, Е. А. Лялюкова, Г. В. Белова, И. В. Долгалёв, Н. В. Корочанская, В. К. Косёнок, А. С. Лялюкова, Е. В. Онучина, М. М. Петрова, Л. В. Прохорова, А. С. Сарсенбаева
Для цитирования: Лечащий врач № 9/2019; Номера страниц в выпуске: 60-64
Теги: хронический атрофический гастрит, кишечная метаплазия, аденокарцинома желудка