Чем лечить папилломавирусную инфекцию
Лечение папиллом. Вопросы и ответы
Принято считать, что около 93% населения земного шара являются носителями вируса папилломы человека. Однако лишь у небольшой части людей заболевание проявляется появлением папиллом. Сегодня мы поговорим о том, как можно лечить папилломы и что можно сделать если они появились вновь после удаления.
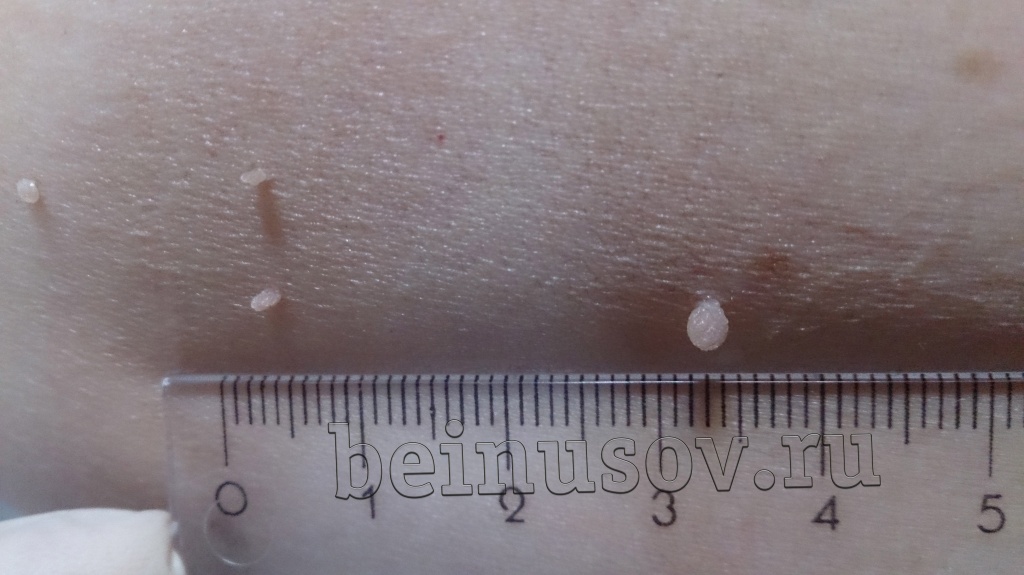
Как на самом деле они выглядят?
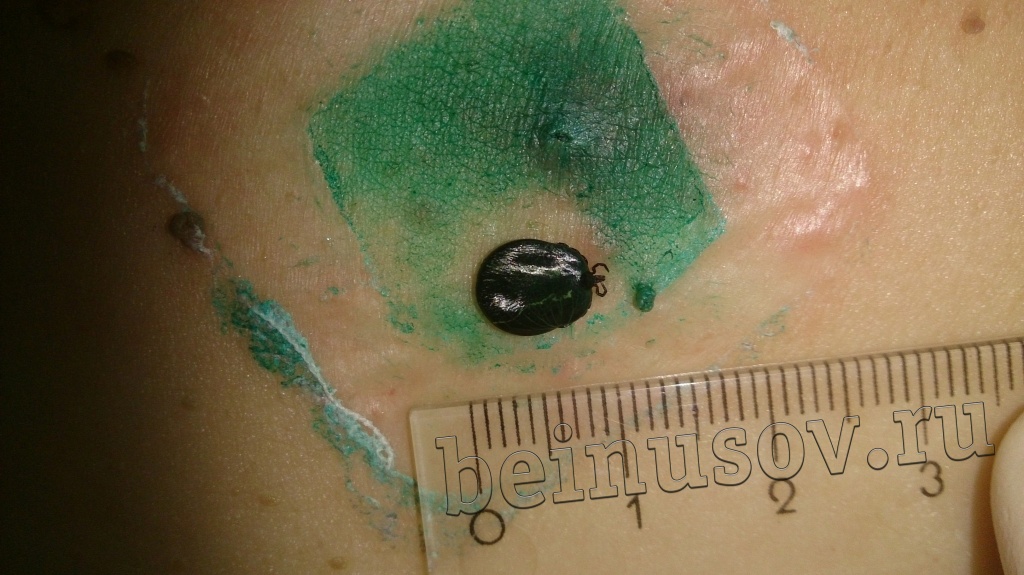
Очень часто пациенты, которые приходят ко мне на приём, просят удалить им папиллому или несколько и указывают на пигментный невус, фибропапиллому или бородавку. Один раз в качестве папилломы для удаления мне предложили клеща (не шучу):
Как избавиться от папиллом?
Существует всего два основных метода лечения папиллом
Если папилломы появились вновь после удаления?
Как проходит удаление папиллом?
В нашей клинике удаление папиллом производится методом радиоволновой хирургии.
Просто посмотрите это короткое видео и многие вопросы отпадут сами собой.
Коротко о главном:
Решили расстаться с Вашими папилломами? Это можно сделать по адресам в Санкт-Петербурге (Асафьева 7/1)
Другие статьи:
Полезная статья? Сделайте репост в Вашей социальной сети!
Оставьте комментарий или задайте вопрос
Записывайтесь на вебинар «Канцерогены в косметике: правда, ложь и. маркетинг»
Что такое вирус папилломы человека и как его лечить
Вирус папилломы человека (ВПЧ) воздействуют на эпителиальные клетки и имеют диаметр частиц 55 нм. Особенностью является пролиферация эпителия кожи, а также слизистых оболочек. На начальной стадии возбудитель обычно поражает базальные клетки эпителия, проникая в них через микротравмы. Локализованные папилломы обычно встречаются на коже шеи, в подмышечных впадинах, в паху и на половых органах (чаще всего), слизистой оболочке рта и в носоглотке.
Этот вирус может существовать на протяжении многих лет бессимптомно. Для обнаружения ВПЧ используют электронно-микроскопические или молекулярные гибридизированные методы.
Типы вируса папилломы человека
У людей различают ВПЧ, который поражает слизистые оболочки и кожный покров. Среди большого количества папилломавирусов выделяют виды с низким и высоким онкогенным риском. Доказано, что онкогенные свойства связаны со способностью интегрировать ДНК в геном клеток человека.
Активируется вирус в 10-20% случаев. В зависимости от его типа, это может привести к доброкачественным или злокачественным поражениям. Некоторые ВПЧ не онкогенны. Они приводят к появлению бородавок и остроконечных кондилом. Наиболее распространенными являются ВПЧ 6 и 11.
Онкогены ВПЧ – это те, у которых высокий риск развития раковых поражений, особенно на шейке матки или анусе. Что касается кожного покрова, чаще встречается ВПЧ 16 и 18, а также 5 и 8, которые могут привести к раку кожи. Наиболее известной формой рака, вызванной ВПЧ, является рак шейки матки. Но мужчины также могут заразиться вирусом папилломы, который в худших случаях вызывает рак пениса или анального отверстия.
Часто женщины сталкиваются с ВПЧ 16 – это форма, при которой наблюдается интросомальное паразитирование, т. е. вне клеточной хромосомы (доброкачественное). ВПЧ 18 отличается высоким риском развития онкологии – сначала образуются доброкачественные опухоли, которые спустя некоторое время перерождаются в рак. Вирионы в данном случае имеют крохотные размеры (до 30 нм).
Особенности заражения
Вирус папилломы человека очень заразен. Он обычно передается через прямой контакт, кожа к коже или слизистая оболочка к слизистой оболочке, с инфицированным человеком. При генитальной инфекции это чаще всего происходит во время вагинального или орального сексуального контакта. Большое количество половых партнеров или других ИППП (инфекции, передающиеся половым путем) повышают риск. Косвенная передача через предметы, загрязненную одежду или постельное белье также возможна, но происходит довольно редко.
В 7% случаев передача вируса от матери к ребенку может произойти во время родов, когда инфекция активна. Риск увеличивается до 40% в случае заражения ВПЧ 16 или 18.
Проникая в эпителий, нарушая целостность, папилломавирусная инфекция способствует росту нижнего слоя эпителиальных клеток в виде кондилом или бородавок. Такая форма болезни заразна и быстро передается другим. Как правило, бородавки и кондиломы не вызывают метастазов и часто спонтанно исчезают.
Симптомы ВПЧ
Инкубационный период длится до 9 месяцев (в среднем 3 месяца). ВПЧ может присутствовать в организме без очевидных симптомов. Вирус может оставаться незамеченным в течение нескольких месяцев или нескольких лет. Даже на этом этапе он является заразным.
Кожные бородавки обычно встречаются группами и при расчесывании их количество увеличивается. У двух наиболее распространенных форм папилломы либо сероватые, твердые, возвышенные с пересеченной поверхностью (обычная бородавка), либо плоские и красноватые (плоская бородавка). Колючие бородавки встречаются на подошвах стоп или на пятках, растут внутрь и поэтому часто болезненны.
Также возможно заражение слизистых оболочек в верхних дыхательных путях. Может быть поражена конъюнктива глаз, что приводит к розовым стеблевым наростам.
Труднее обнаружить бессимптомное течение, которое врач может увидеть только с помощью вспомогательных средств, таких как уксусная кислота (вызывает обесцвечивание бородавок) или микроскоп.
Кроме того, вирус также может поселиться в клетках без каких-либо изменений тканей. Тогда говорят о скрытой инфекции, то есть наличии возбудителей, но без симптомов. После инфицирования эта фаза может длиться от нескольких недель до нескольких месяцев.
Возможные последствия
При заражении вирусы проникают в клетки покровной ткани кожи и слизистой оболочки, оседают в ядрах клеточных структур и размножаются там. Обычно такие ВПЧ-инфекции остаются незамеченными и заживают сами по себе без последствий, т. к. иммунная система успешно борется с возбудителем.
Однако некоторые из типов ВПЧ создают изменения кожи, т. е. наросты. Возможные формы включают генитальные бородавки или кондиломы и папилломы, которые могут поражать, например, лицо, руки или ноги.
Постановка диагноза
Тест на ВПЧ-инфекцию проводится у женщин в рамках профилактических визитов к гинекологу. При гинекологическом осмотре мазок берется из слизистой оболочки шейки матки, это называется тестом Папаниколау (цитологическое исследование). Полученный материал изучается на предмет изменений тканей для определения предраковых состояний.
Кроме того, может быть проведен тест на ВПЧ, в котором клеточный материал из мазка слизистой оболочки или образца ткани тестируется в лаборатории на наличие определенных вирусов. Однако это позволяет доказать только инфицирование пораженного участка, но не сделать никаких заявлений о том, произошли ли изменения тканей. Таким образом, тест на ВПЧ имеет смысл, особенно в сочетании с тестом на Папаниколау, и может помочь обнаружить предшественники рака на ранней стадии.
Если тест положительный, это еще не причина для беспокойства, поскольку инфекция не всегда приводят к раку. Рекомендуется регулярное обследование, чтобы обнаружить изменения тканей на ранней стадии. И наоборот, отрицательный результат теста не позволяет утверждать, существовала ли в прошлом инфекция, с которой успешно боролся организм.
Для мужчин нет профилактического обследования, в рамках которого тест проводился бы регулярно. Если существует соответствующее онкологическое заболевание, исследование опухоли может определить, лежит ли ВПЧ-инфекция в основе рака.
Специализированные методы ДНК также используются в лабораторной диагностике, например ПЦР в режиме «реального времени». Аногенитальные бородавки, вызванные ВПЧ 6 и 11 типа, легко выявляются при проведении гинекологического осмотра.
Как вылечить вирус папилломы человека
В большинстве случаев заболевание не требует лечения, потому что оно проходит само по себе, а затем вирусы больше не обнаруживаются. Однако, если это не так, инфекция может длиться дольше и сохраняться в течение нескольких месяцев или лет.
На сегодняшний день не существует методов системного воздействия на этот вирус, за счет которых можно было бы полностью его уничтожить. Тем не менее, лечение образовавшихся бородавок уменьшает количество вирусов, поэтому во многих случаях иммунная система может бороться с остальными вирусами и таким образом избавляться от них. В некоторых случаях возбудители выживают и могут вызывать симптомы заболевания снова и снова.
В случае рака, вызванного ВПЧ, лечение значительно сложнее. При раке шейки матки часто целесообразно удаление матки, соответственно верхней части влагалища и яичников. Это можно дополнить лучевой терапией, чтобы исключить вероятность рецидивов. Другие раковые заболевания, вызванные ВПЧ, чаще всего лечатся целенаправленной терапией, такой как лучевая или химиотерапия.
Следует помнить, что операция не является кардинальным решением, а только решает косметическую проблему, т. к. после удаления вирус способен оставаться в окружающих тканях и кондиломы могут появляться снова.
Профилактика заражения
Существует две прививки: двухвалентная вакцина против ВПЧ 16 и 18 и четырехвалентная против ВПЧ 6, 11, 16 и 18. Вакцинация рекомендуется для всех молодых девочек в возрасте от 14 лет и старше.
Вакцинация не защищает от всех видов ВПЧ. Поэтому всем женщинам в возрасте от 25 до 65 лет, даже если они вакцинированы, рекомендуется проводить регулярные осмотры через мазок.
Своевременное обнаружение и полное удаление кондилом снижает риск возникновения заболеваний. Эффективность использования презервативов для защиты от передачи инфекции может значительно снизить риск развития этого заболевания. Наиболее перспективным способом профилактики и лечения начальных стадий заболевания, вызванного этой инфекцией, является специфическая поливалентная вакцина.
Папилломавирусная инфекция сегодня: клиническое разнообразие, лечение и профилактика
Папилломавирусы относятся к семейству Papovaviridae и в течение многих тысяч лет паразитируют на людях. Это мелкие безоболочечные 20-гранные ДНК-содержащие вирусы, которые поражают эпителиальные клетки разных анатомических зон.
Папилломавирусы относятся к семейству Papovaviridae и в течение многих тысяч лет паразитируют на людях. Это мелкие безоболочечные 20-гранные ДНК-содержащие вирусы, которые поражают эпителиальные клетки разных анатомических зон. Вирусы папилломы человека (ВПЧ) классифицируются на пять эволюционных групп: альфа, бета, гамма, мю и ню. Представители группы альфа поражают генитальный тракт, а остальные только кожу. Диаметр вируса 55 нм, геном ВПЧ представлен длинной двуспиральной циркулярной ДНК с размером 8 тысяч пар основ. В зависимости от времени экспрессии гены ВПЧ делятся на ранние и поздние, соответственно они кодируют ранние Е1-Е7 и поздние L1- и L2-протеины.
Оценить распространенность папилломавирусной инфекции (ПВИ) среди населения очень трудно. Предполагается, что генитальные бородавки встречаются приблизительно у 1% сексуально-активного населения, у 5–40% инфекция протекает субклинически или бессимптомно. У беременных женщин частота выявления всех типов ВПЧ составляет 30–65%, а типов высокого онкогенного риска — 20–30% [1].
Наиболее распространенный путь передачи — это прямой контакт с кожным покровом или слизистой оболочкой больного человека или вирусоносителя. Вирус сохраняет жизнеспособность в воде (бассейне, бане), а также передается при половых контактах. Папилломавирусы, инфицирующие кожу и слизистые оболочки аногенитального тракта, являются одной из самых распространенных сексуально-трансмиссивных инфекций, с которой женщины и мужчины встречаются в первые годы сексуальной активности. Пик инфицирования ВПЧ во всем мире составляет от 17 до 25 лет, затем распространенность инфекции снижается и вновь повышается в возрасте 35–44 или 45–54 лет. Вероятно, это отражает возрастающую социальную тенденцию разводов и новых партнерских отношений, формирующихся в старшем возрасте. Факторами риска инфицирования ПВИ являются другие инфекции, передающиеся половым путем (ИППП), применение оральных контрацептивов, курение и недостаточность клеточного иммунитета у инфицированных лиц. В 1989 г. доказана вертикальная передача вируса, что подтверждают сообщения об обнаружении ВПЧ в амниотической жидкости беременных и у детей, рожденных от матерей-носителей ВПЧ [2]. Возможный риск колеблется по данным разных авторов от 3% до 80% [3]. Данный разброс объясняется различиями в методике проведения полимеразной цепной реакции (ПЦР) на выявление ДНК ВПЧ. При этом ПВИ может передаваться трансплацентарно и интранатально (в частности, ВПЧ 6 и 11)). Риск инфицирования прямо пропорционален тяжести инфекции (количеству вирусных частиц) и времени безводного промежутка в родах, однако проведенные исследования свидетельствуют о том, что родоразрешение путем кесарева сечения не снижает риск инфицирования плода, что свидетельствует о преимущественно внутриутробном его заражении [2]. Интранатальное инфицирование может приводить к ювенильному рецидивирующему респираторному папилломатозу (частота составляет 1,7–2,6 на 100 000 детей и 1 на 1500 родов среди женщин с генитальной ПВИ) [4]. Все проведенные статистические исследования однозначно указывают на то, что единственным путем приобретения онкогенных типов ВПЧ, поражающих гениталии, является половой путь [5].
С учетом тропизма ВПЧ подразделяют на мукотропные и дермотропные. В зависимости от канцерогенности известные папилломавирусы можно условно разбить на три основные группы: неонкогенные (ВПЧ 1, 2, 3, 5, 10, 63), низкого онкогенного риска (в основном ВПЧ 6, 11, 42, 43, 44), высокого онкогенного риска (ВПЧ 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 и 68). Различия в онкогенных свойствах ВПЧ связаны со способностью определенных типов вирусов определять число митозов в пораженных клетках.
Для вируса папилломы человека характерен широкий спектр эпителиальных пролиферативных повреждений. Гиперплазия и гиперкератоз как основные патоморфологические и клинические проявления кожной инфекции, вызванной ВПЧ, а также обширность и глубина поражений зависят от типа вируса. ВПЧ 1-го, 2-го, 4-го и 63-го типа может быть причиной вульгарных и подошвенных бородавок. Плоские бородавки могут быть вызваны 3-м, 10-м, 28-м, 41-м, 49-м и 75-м типами ВПЧ. Среди дерматотропных вирусов выделена подгруппа вирусов, ассоциированных с верруциформной эпидермодисплазией и актиническими кератомами: типы 5, 8, 9, 12, 14, 15, 17, 19–25, 36, 46 и 47. ВПЧ 5-го и 8-го типов индентифицированы как причина развития плоскоклеточной карциномы у больных верруциформной эпидермодисплазией [6, 7]. У пациентов, страдающих рецидивирующим респираторным папилломатозом, чаще обнаруживают ВПЧ 6-го и/или 11-го типа.
На сегодняшний день выделяют около 40 генитальных типов ВПЧ. Причиной генитальных бородавок (остроконечных кондилом) в 90% случаев являются 6-й и 11-й типы папилломавируса. Показано, что диспластические процессы шейки матки наиболее часто развиваются на фоне персистирующих генитальных инфекций, наибольшую роль из которых отводят ВПЧ [8, 9]. Типы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 и 59 могут быть причиной развития цервикальных интраэпителиальных неоплазий (CIN), вульварных интраэпителиальных неоплазий (VIN), рака гортани. Рак шейки матки — один из немногих видов злокачественных новообразований с установленной этиологией заболевания. За открытие роли ВПЧ в развитии рака шейки матки немецкий ученый Harald zur Hausen был удостоен в 2008 г. Нобелевской премии в области медицины и физиологии. Ежегодно в мире регистрируется около 0,5 млн новых случаев цервикального рака, и согласно прогнозу экспертов в отсутствие активного вмешательства к 2020 г. это число увеличится более чем на 700 000 случаев [10].
Длительный латентный период инфекции, развитие рака лишь у некоторых инфицированных ПВИ дают основание полагать, что помимо персистенции генома ВПЧ необходимым для развития рака условием являются нарушение структуры и функции клеточных генов. В качестве инициирующего фактора выступают мутации в различных участках гена Е1-Е2, который в норме отвечает за эписомальный статус ДНК ВПЧ. В результате повреждения Е1 происходит интеграция генома ВПЧ в хромосомы клетки хозяина. Поскольку Е1-Е2 регулируют и контролируют вирусную транскрипцию, их разрушение заканчивается неконтролируемой экспрессией генов Е6-Е7, которые непосредственно запускают процессы опухолевой трансформации. Онкогенные свойства продуктов Е6-Е7 обусловлены их способностью образовывать комплексы с белками р53 (для Е6) и рRb (для Е7). При изменении нормальных функций р53 клетка, которая должна была погибнуть, начинает бесконтрольно делиться, образуя опухолевидный рост. В патогенезе канцерогенеза имеет место супрессия местного иммунитета, обусловленная синтезом вирусного онкобелка Е7. Белок Е7 нейтрализует противовирусную и противоопухолевую активность интерферона альфа-2 за счет его способности избирательно блокировать большинство генов, индуцируемых интерфероном, сводя на нет все усилия интерферонотерапии. Также белок Е7 ингибирует экспрессию генов основного комплекса гистосовместимости, затрудняя распознавание опухолевых клеток иммунной системой хозяина. Биологические свойства и молекулярная структура ВПЧ-белков изучены достаточно полно, тем не менее, конкретные пути реализации канцерогенного эффекта вируса требуют дальнейшего уточнения. У пациентов, инфицированных наиболее агрессивными вариантами ВПЧ, а также имеющих генетические, гормональные, иммунные и другие кофакторы, ПВИ будет развиваться до предраковых состояний и может прогрессировать в рак.
Инкубационный период ПВИ колеблется от 1 до 12 месяцев (в среднем 3 месяца). Клинические проявления ПВИ гениталий могут быть различными: остроконечные кондиломы, папилломы с экзофитным ростом, плоские папилломы. Кондиломы представляют собой бородавчатые возвышения, которые могут быть единичными, но чаще множественными, слившимися в группы и напоминающими цветную капусту или петушиные гребни. Их поверхность покрыта многослойным плоским эпителием, нередко с ороговением. Особенно быстрый рост остроконечных кондилом наблюдается при беременности, у подростков и у ВИЧ-инфицированных индивидов (развитие гигантской опухоли Бушке–Левенштейна). Вполне естественно, что эпидемия ВПЧ-инфекции у взрослых не могла не отразиться на увеличении показателей заболеваемости аногенитальными бородавками среди детей. Данные современных методов показали, что папилломавирусные поражения у детей связаны с теми же типами ВПЧ, что и у взрослых, но в силу физиологических особенностей и незрелости защитных механизмов дети и подростки более уязвимы, чем взрослые.
Субклинические формы представлены интраэпителиальными папилломами с эндофитным ростом. Папилломы шейки матки обычно бывают плоскими или интраэпителиальными («атипичными»). Выявляются с помощью кольпоскопии, цитологического и гистологического исследований. Тяжесть течения и скорость регрессии определяется типом ВПЧ.
Однако аногенитальные бородавки образуют только вершину айсберга под названием «ВПЧ-инфекция». Большинство клинических случаев представлено пациентками с латентной формой ВПЧ-инфекции, у которых ВПЧ часто случайно диагностируется при проведении ПЦР-диагностики или онкоцитологическом исследовании соскоба из цервикального канала (признаки койлоцитической атипии).
Клиническая диагностика остроконечных кондилом и папиллом обычно не вызывает затруднений, если это не ранняя стадия заболевания, когда образования малых размеров, или не «атипичная» форма ПВИ. Но даже при не вызывающей сомнения клинике ВПЧ-инфекцию необходимо подтверждать лабораторно. Основным методом диагностики является цитологический. Обнаружение койлоцитов, трансэпителиальной лимфоцитарной инфильтрации и базально-клеточной гиперплазии в биоптате считается подтверждением ПВИ гениталий. Широко используется определение ДНК 12 типов ВПЧ высокого онкогенного риска методом полимеразной цепной реакции (ПЦР) в реальном времени (типы ВПЧ 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59) в соскобе цервикального канала, уретры или в моче. Внедряется в практику метод амплификации нуклеиновых кислот (МАНК). Серологическим методом диагностики является выявление антител против вирусоспецифичных протеинов Е2, Е6 и Е7, наличие которых является маркером текущей инфекции. Для этого используется ЕLISA — тест с высокоочищенными рекомбинантными протеинами Е6 и Е7. Снижение концентрации этих антител является показателем успешно проводимой терапии ПВИ и цервикальных неоплазий.
Установлено, что регрессия ВПЧ-обусловленных повреждений напрямую зависит от состояния Т-клеточного иммунитета и нейтрализующие антитела блокируют распространение вирусной инфекции. И хотя часто ВПЧ-обусловленные образования самостоятельно поддаются регрессии, у многих, особенно у лиц с иммунодефицитами, ПВИ приобретает персистирующий характер и способна к реинфекции. Резистентность ВПЧ к лечению связана с особенностью строения вируса, позволяющей длительно персистировать в организме, усугубляя уже имеющийся вторичный иммунодефицит. Сложный цикл внутриядерной репликации, возможность существования инфекции в эписомальной и интегрированной формах, трудности изучения патогенеза вируса на биологических моделях обуславливают отсутствие патогенетической терапии ПВИ на сегодняшний день [11].
В соответствии с руководством «Клинические рекомендации. Дерматовенерология» под ред. А. А. Кубановой (2010) и Европейским руководством по лечению ИППП терапия проявлений ВПЧ-инфекции должна удовлетворять следующим требованиям: деструкция, предупреждение развития осложнений, уменьшение числа рецидивов, улучшение качества жизни пациентов. Поскольку отсутствует метод элиминации ВПЧ, лечение направлено на устранение клинических признаков ВПЧ: любых разновидностей бородавок или патологии шейки матки при наличии атипичных клеток в мазках и биоптатах. Традиционные методы лечения бородавок общеизвестны и включают крио-, электро-, радиоволновую и лазерную хирургию, а также обработку цитотоксическими (подофиллин, подофиллотоксин, 5-фторурацил), химическими веществами (Солкодерм, Веррукацид, Дуофил и пр.), вызывающими цитолиз и некроз ткани [13]. В настоящее время наиболее эффективным, особенно при обширных высыпаниях и рецидивирующем течении заболевания, в том числе и в детской практике, является использование комбинированных методов терапии — сочетанное применение физических, химических или медикаментозных методов, которое включает местное лечение и применение различных системных неспецифических противовирусных (Лавомакс) и иммуномодулирующих препаратов (интерфероны и индукторы интерферонов) [12, 13]. Так, для лечения респираторного папилломатоза у детей используются криодеструкция, эндоларингеальный фонофорез цитостатиков, фотодинамическая терапия, интерферонотерапия (интерферон альфа-2) иммунокорригирующая терапия (мурамилпептид). Перспективным методом в лечении клинических манифестаций ВПЧ могло быть применение лечебных вакцин. Недостатком вакцинотерапии является ее узкое терапевтическое действие, тогда как около 40 штаммов ВПЧ паразитируют гениталии. Следовательно, с повестки дня не снимается необходимость лечебного метода, обладающего свойством элиминации вируса. Поэтому проводится поиск новых средств, включая индукторы интерферона для лечения генитальных кондилом и других клинических манифестаций ВПЧ.
Адекватная иммунотерапия способствует подавлению активности ВПЧ, снижая частоту рецидивов, и его элиминации. Среди других хорошо изученных препаратов, применяемых в комплексном лечении ПВИ, в клинической практике используются интерферон альфа-2, 5% Имиквимод, инозин пранобекс, индол-3-карбинол (Индинол, Промисан). Рекомендуется внутриочаговое введение интерферонов, особенно в случае иммунодефицита, или системное назначение в течение 4 недель. Клинические данные свидетельствуют об высокой эффективности сочетания лазерной терапии с локальным применением интерферонов или индукторов интерферона. Так, применение СО2-лазерного иссечения аногенитальных остроконечных кондилом у детей является безопасным, относительно атравматичным и эффективным методом лечения [15]. Для лечения беременных рекомендуют физические деструктивные методы: СО2-лазер, радионож, криотерапия.
ВПЧ — генетически стабильный ДНК-вирус, поэтому вероятность его генетической трансформации ничтожно мала. Генетическая стабильность означает, что инфекцию этим вирусом можно предупредить на длительный срок путем вакцинации. В 2006 г. Управление по контролю за продуктами питания и лекарственными средствами США (FDA) зарегистрировало первую в мире квадривалентную вакцину Гардасил, продемонстрировавшую эффективность в предупреждении инфекции ведущими типами ВПЧ (6/11/16/18). В дополнение к защите против четырех вакцинных типов Гардасил обеспечивает частичную перекрестную защиту против персистирующей инфекции и цервикальных поражений, вызванных десятью невакцинными типами ВПЧ высокого риска, включая ВПЧ 31, 33, 35, 45, 52 и 58, которые филогенетически родственны ВПЧ 16 и 18. В настоящее время квадривалентная вакцина зарегистрирована и применяется более чем в 130 странах мира. В 2008 г. зарегистрирована также двухвалентная вакцина Церварикс, содержащая два типа капсидных белков L1 ВПЧ — 16 и 18. В контексте профилактики наилучших результатов можно достичь сочетанием скрининговых программ обследования с повсеместной разумной организацией плановой добровольной вакцинации населения, особенно определенных медико-социальных контингентов (подростки из группы рискового поведения, сексуально-активные женщины, принимающие комбинированные оральные контрацептивы, лица с иммунодефицитом различного генеза).
Литература
Е. И. Касихина, кандидат медицинских наук, доцент
ГОУ ДПО РМАПО, Москва
Интимные противовирусные: консультируем покупателя
Обзор лекарств, применяющихся при лечении ВПЧ и герпесе, — механизм действия, преимущества и свойства, о которых стоит предупредить клиента
Первый стол регулярно отпускает местные противовирусные и иммуномодулирующие препараты, показанные для лечения герпетической и/или папилломавирусной инфекции (ВПЧ). Обе инфекции принадлежат к числу самых распространенных в мире патологий, передающихся половым путем. Как качественно и деликатно консультировать клиентов с этими болезнями, какие советовать противовирусные лекарственные средства при ВПЧ, какие от герпеса и на что обращать внимание — читайте в нашей статье.
ВПГ и ВПЧ: сходства и отличия
Прежде всего, важно понимать, что вирус простого герпеса (ВПГ) и вирус папилломы человека (ВПЧ), провоцирующие герпетическую и папилломавирусную инфекции соответственно, кардинально отличаются друг от друга.
«Галавит» при герпесвирусной инфекции способствует:
У взрослых и подростков старше 12 лет в комплексной терапии:
Суппозитории — 5 дней по 1 суппозиторию, затем по одному через день. Курс — 2 упаковки суппозиториев.
Таблетки подъязычные — 10 дней по 1 таблетке 4 раза в день. Затем продолжить прием через сутки в течение 10 дней по 4 таблетки в день.
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. НЕОБХОДИМО ПРОКОНСУЛЬТИРОВАТЬСЯ СО СПЕЦИАЛИСТОМ.
Генитальный герпес ассоциирован с заражением ВПГ 1‑го или 2‑го типа. По статистике, заболеванием страдают около 12 % популяции [1]. Однажды проникнув в организм, вирус «поселяется» в нем навсегда — на сегодняшний день не существует метода лечения от вируса герпеса, которое позволило бы окончательно избавиться от возбудителя. Симптомы генитального герпеса, которые возникают периодически, во время рецидивов, значительно снижают качество жизни. Интересно, что частота новых эпизодов заболевания зависит от типа вируса: при инфицировании ВПГ-1 фиксируют примерно 1 рецидив в год, в то время как при заражении ВПГ-2 их число может достигать 6 и более [2].
Несмотря на то, что специфического лечения ВПГ не существует, ряд препаратов может облегчить состояние при обострениях. Согласно отечественным и западным рекомендациям, с этой целью применяют пероральные противовирусные средства от герпеса на основе ацикловира и валацикловира. Однако в России также рекомендована местная терапия, не включенная в западные стандарты. За границей такие методы в рекомендациях отсутствуют ввиду их меньшей активности по сравнению с таблетками [3].
Несколько по‑другому обстоит ситуация с папилломавирусной инфекцией (ВПЧ). Она считается самым распространенным в мире заболеванием, передаваемым половым путем [4]. В какой‑то момент жизни ВПЧ заражается большинство взрослых людей, однако в 90 % случаев в течение двух лет после заражения происходит естественная элиминация вируса. В противном случае инфицированный становится пожизненным носителем.
К сожалению, лекарства от вируса папилломы человека не существует, так же как и в случае с вирусом простого герпеса. Однако первый, в отличие от второго, может быть смертельно опасен: ВПЧ 16‑го и 18‑го типов ассоциированы со злокачественными новообразованиями — в частности, с раком шейки матки и некоторыми другими опухолями. Единственное эффективное на сегодня медикаментозное лечение папилломавирусной инфекции заключается в эрадикации кондилом, которые являются проявлениями клинической и субклинической форм инфекции. С этой целью при лечении вируса папилломы человека применяют ряд местных противовирусных препаратов, доказавших активность в исследованиях. В то же время в отечественной практике врачи назначают и ЛС, имеющие сомнительную доказательную базу. Рассмотрим их преимущества и недостатки более детально.
Локальные иммуномодуляторы при ВПЧ и ВПГ
К числу «универсальных» средств, которые могут назначаться при различных вирусных инфекциях — от банальных респираторных до герпетической и папилломавирусной, — относятся интерфероны. В частности — препараты интерферона альфа-2b человеческого рекомбинантного.
Интерферон альфа-2b имеет противовирусные, иммуномодулирующие и антипролиферативные свойства. Он подавляет репликацию РНК- и ДНК-содержащих вирусов, усиливает активность макрофагов, увеличивает цитотоксичность лимфоцитов к клеткам-мишеням. Применение содержащих интерферон альфа-2b средств сопровождается повышением уровня иммуноглобулинов типа А, нормализацией IgE [5]. Однако эти терапевтические эффекты в полной мере проявляются при системном введении препарата, когда достигается его высокая концентрация в крови. При этом следует заметить, что могут развиваться достаточно мощные побочные эффекты, в том числе лихорадка, потеря аппетита, головные, мышечные, суставные боли и множество других неблагоприятных реакций.
Из-за специфического профиля безопасности инъекционные препараты интерферона назначаются только в очень серьезных случаях, когда риск побочных эффектов оправдан — например, при лечении гепатитов, ряда онкологических заболеваний и пр. ВПГ и ВПЧ-инфекции к таким ситуациям не относятся и не являются показаниями для системного назначения интерферона. В то же время в РФ зарегистрирован весьма внушительный перечень местных форм интерферона альфа-2b, в том числе и мазей/кремов для обработки слизистых оболочек при генитальном герпесе.
Теоретически локальные препараты интерферона должны обладать всеми преимуществами инъекционных и не иметь их побочных эффектов, поскольку местные формы или очень незначительно всасываются в системный кровоток, или вовсе не проникают в кровь. Однако, на сегодня нет достаточно надежных доказательств эффективности интерферонов при местном применении. Тем не менее, в отечественной практике их довольно часто назначают в составе комплексного лечения рецидивов генитальной герпетической инфекции.
Наряду с местными формами, содержащими только интерферон альфа-2b, в РФ зарегистрировано и несколько комбинированных препаратов:
+ Высокий профиль безопасности.
! Целесообразность применения местных форм ацикловира при генитальном герпесе подвергается серьезным сомнениям ввиду недостаточной активности, что подтверждено в западных рекомендациях [3].Препараты интерферона альфа-2b, как моно-, так и комбинированные, отпускаются как по рецепту, так и без — в зависимости от указания на правила отпуска в инструкции конкретного препарата. Важно обратить внимание посетителя на то, что препараты от ВПЧ первой линии лечения — пероральные формы ацикловира и валацикловира — должен выписать врач, поэтому нужно посоветовать незамедлительно обратиться за консультацией к доктору.
Синтетические противовирусные местные препараты
Эту группу ЛС можно условно разделить на средства, применяемые при генитальной герпетической инфекции, и противовирусные препараты, назначаемые для лечения папиллом и кондилом, связанных с папилломавирусной инфекцией.
Местные препараты при генитальном герпесе
Несколько ЛС, зарегистрированных в РФ, применяются для лечения и профилактики рецидивов генитального герпеса.
Тромантадин
Противовирусный препарат от герпеса, производное адамантана (подобно известным противовирусным римантадину и амантадину). Ингибирует прикрепление вируса к поверхности клеточной мембраны, препятствуя проникновению возбудителя внутрь клетки. Предотвращает слияние клеток и затрудняет распространение вируса за счет изменения синтеза гликопротеинов [5]. Выпускается в форме геля для наружного применения, который можно наносить на слизистые оболочки при обострении ВПГ-инфекции [5].
Отпуск: без рецепта.
! Есть данные о развитии контактной аллергической реакции при использовании препарата [7].
Иммуномодулятор, способный регулировать активность клеток врожденного и приобретенного иммунитета, в том числе макрофаги, нейтрофилы и натуральные киллеры. При этом этот противовирусный препарат против герпеса повышает устойчивость организма к бактериальным, вирусным и грибковым инфекциям, сокращая их частоту, выраженность и длительность (5). Кроме того, препарат нормализует образование антител и регулирует выработку интерферонов, а также блокирует избыточный синтез провоспалительных цитокинов и снижает уровень оксидантного стресса (5).
Отпуск: Без рецепта
+ Высокий профиль безопасности (5).
Азоксимера бромид
Российский препарат, предположительно, проявляющий иммуностимулирующий эффект. По данным инструкции [5], напрямую влияет на фагоциты и естественные киллеры, стимулирует образование антител и синтез интерферона, проявляет антиоксидантные и детоксикационные свойства. В отечественной практике применяется при широком спектре заболеваний — от гриппа до злокачественных новообразований.
Вагинальные суппозитории азоксимера бромида применяются для профилактики рецидивов генитального герпеса.
Отпуск: без рецепта.
+ Высокий профиль безопасности. По данным производителя [5], побочные эффекты не зарегистрированы.
! Суппозитории азоксимера бромида не показаны для лечения активной формы герпеса!
Местные противовирусные препараты для лечения ВПЧ (папилломавируса)
Некоторые топические противовирусные препараты, активные в отношении папилломавирусов, в отличие от ряда препаратов, помогающих от вируса герпеса, имеют прочную доказательную базу и применяются во всем мире для лечения проявлений ВПЧ — в частности, кондилом.
Имихимод
Модификатор иммунного ответа, не оказывающий противовирусного действия. Активность проявляет за счет способности индуцировать выработку интерферона-альфа и других цитокинов. Показан для лечения остроконечных кондилом в урогенитальной зоне [5].
+ Прочная доказательная база. Препарат определенно снижает вирусную нагрузку. Доказано, что применение крема имихимода 5 %-ного 3 раза в неделю на ночь на протяжении 16 недель эффективно и безопасно для лечения кондилом. Частота рецидивов оценивается как низкая [8]. Имихимод рекомендован для лечения генитальных кондилом авторитетным американским регулятором FDA [8].
! При нанесении имихимода более чем в 10 % случаев наблюдаются зуд и боль [5], о чем следует предупредить покупателя.
Местные противовирусные средства растительного происхождения
Аммония глицирризинат
Активный компонент препарата — активированную глицирризиновую кислоту — получают из корня солодки. Оказывает комплексное иммуностимулирующее, противовирусное, противовоспалительное, противозудное действие. Глицирризиновая кислота прерывает репликацию ряда ДНК и РНК вирусов, в том числе вируса простого герпеса, папилломы человека, цитомегаловируса [5].
Показана в качестве препарата для лечения папилломавирусной инфекции и вируса простого герпеса, в том числе и при инфицировании вирусами онкогенного типа. Выпускается в форме спрея, который распыляют на слизистые оболочки и пораженные участки кожи.
Отпуск: без рецепта.
+ Имеет широкий спектр показаний, среди которых профилактика и лечение кандидозного вульвовагинита, дискомфорт в области половых органов. Может применяться при беременности и кормлении грудью; хорошо переносится.
Подофиллотоксин
Активный компонент подофиллина, производного растительных экстрактов, выделяемых из корневищ с корнями подофилла щитовидного — растения семейства барбарисовых. Обладает выраженными противоопухолевыми и противовирусными свойствами, оказывает цитотоксическое действие. При наружном применении прижигает и мумифицирует кондиломы. Применяется в качестве препарата для местного лечения от вируса папилломы человека. Выпускается в форме раствора для обработки остроконечных кондилом [8].
+ Доказанный эффект. По данным исследований, 0,5 %-ный раствор подофиллотоксина уменьшает число аногенитальных бородавок с 6,3 до 1,1, разрушая около 70 % образований [8].
! Необходимо соблюдать осторожность при применении — попадание на здоровую кожу может приводить к изъязвлению. Местные реакции при применении, аллергические реакции. Первостольник, отпуская этот противовирусный препарат от папиллом и кондилом, должен обратить внимание клиента на эту особенность и напомнить, что ЛС следует хранить в недоступном для детей месте.
Тетрагидроксиглюкопиранозилксантен
Российский препарат. Активный компонент выделяют из растения копеечника альпийского или копеечника желтеющего.
Согласно инструкции, обладает противовирусной активностью в отношении ВПГ-1 и ВПГ-2, а также цитомегаловируса и некоторых других ДНК-содержащих вирусов. Кроме того, предположительно, препарат активирует клеточный и гуморальный иммунитет, ингибирует рост ряда бактерий и патогенных простейших, в том числе трихомонад, а также оказывает умеренное противовоспалительное действие. Применяют в форме мази в составе комбинированного лечения острых и рецидивирующих форм герпеса, в том числе генитального [5].
Отпуск: без рецепта.
+ Благоприятный профиль безопасности, возможность применять в составе комплексного лечения.
Полисахариды побегов Solanum tuberosum
Рецептурный российский препарат, активный компонент получают из побегов паслена клубненосного. По данным инструкции, проявляет противовирусный эффект в отношении ВПГ-1 и ВПГ-2, способствует индукции интерферонов и повышает иммунный ответ [5]. Следует заметить, что фармакокинетические свойства препарата не изучались. Вагинальные суппозитории применяются в комплексной терапии генитального герпеса.
Отпуск: без рецепта.
+ Высокий профиль безопасности. Побочные эффекты проявляются редко.
Десмодиума канадского травы экстракт
Противовирусный препарат от герпеса растительного происхождения, созданный из сухого экстракта травы десмодиума канадского. По данным инструкции, проявляет противовирусную активность в отношении вирусов герпеса, стимулирует выработку интерферона [5]. Мазь показана для применения при острых и рецидивирующих формах герпеса, в том числе урогенитального.
Отпуск: без рецепта.
+ Высокий профиль безопасности — побочные эффекты не выявлены.
Гипорамина экстракт
Российская разработка на основе экстракта листьев облепихи. По данным инструкции, активен в отношении вирусов простого герпеса, цитомегаловирусов и некоторых других [5]. Мазь, содержащая экстракт гипорамин, показана для лечения и профилактики эпизодов герпеса, в том числе и генитального.
Отпуск: без рецепта.
+ Высокий профиль безопасности; возможность использовать во время беременности и лактации (после консультации с врачом).
Мелиссы лекарственной листьев экстракт
По данным инструкции, проявляет противовирусную активность в отношении ВПГ, оказывает противовоспалительное действие [5]. Крем, содержащий экстракт листьев мелиссы, применяют при поражениях слизистых и кожи, в том числе и в урогенитальной зоне.
Отпуск: без рецепта.
+ Высокий профиль безопасности.
В заключение хочется еще раз подчеркнуть: широкий ассортимент позволяет первостольникам предлагать разные ЛС при запросах на местные средства для лечения проявлений ВПГ или лекарства от ВПЧ. Но при этом не следует забывать о необходимости рекомендовать посетителю обратиться к врачу, ведь именно доктор должен назначить препараты первой линии и подобрать при необходимости комплексную схему лечения папилломавирусной инфекции.
Папилломавирусная инфекция и влагалищный микробиоценоз
Рассмотрено лечение влагалищного дисбиоза у пациенток с папилломавирусной инфекцией с учетом международных рекомендаций. Состояние микробиоценоза влагалища и его своевременная коррекция с дополнительным применением иммуномодуляторов положительно может вли
The study was performed on the treatment of sheathed disbiosis in patients with the papyloma virus infection taking into account international recommendations. The state of micro biocenosis of sheath and its timely correction with the additional application of immune modulators can positively influence the flow of papyloma virus.
.jpg)
Вероятность инфицирования ВПЧ при половом контакте достигает 60–67%. Риск инфицирования выше у молодых женщин, особенно у подростков, т. к. эпителий шейки матки в этом возрасте более восприимчив к трансформирующему действию инфекций, что связано с его незрелостью и, по мнению ряда авторов, отсутствием специфического иммунитета [3–5].
Однако установлено, что ВПЧ является ведущим, но не единственным фактором цервикального канцерогенеза. Влагалище и шейка матки представляют собой единую анатомо-функциональную систему, поэтому патология этих локализаций редко бывает изолированной. Важными кофакторами канцерогенеза считаются влагалищный дисбиоз и цервикальное воспаление.
ВПЧ, попадая в нижние отделы генитального тракта женщины, вызывает папилломавирусную инфекцию (ПВИ), которая может протекать в различных формах: латентной (отсутствие клинических и морфологических изменений при обнаружении ДНК ВПЧ), субклинической (плоские кондиломы, малые формы поражения многослойного плоского эпителия) и клинической (экзофитные кондиломы, вирусные вульвовагиниты и цервициты, а также ЦИН и РШМ).
Следует отметить и то, что ПВИ часто встречается с другими заболеваниями, передающимися половым путем, и как микст-инфекция выявляется в 71% случаев. При этом с генитальным кандидозом ПВИ сочетается в 33,3% случаев, с бактериальным вагинозом (БВ) — в 66,7% случаев, генитальным герпесом и цитомегаловирусной инфекцией — в 37% случаев, хламидийной и микоплазменной инфекцией — в 46,3% случаев [1, 7]. Сочетание ПВИ с другими инфекциями оказывает заметное влияние на клинические проявления, особенности течения, прогноз и устойчивость к терапии. При ПВИ могут наблюдаться различные типы влагалищного мазка по классификации Е. Ф. Кира (1995 г.) — промежуточный, дисбиоз влагалища, вагинит (воспалительный тип мазка).
В последние годы было показано, что в инфекционном процессе ВПЧ различают две стадии: стадию репродуктивной инфекции, когда вирусная ДНК находится в свободном состоянии, и стадию интегративной инфекции, когда ДНК вируса встраивается в геном инфицированных клеток. Первая стадия является обратимой, и у многих инфицированных наступает ремиссия. Стадия интегративной инфекции является первым шагом к опухолевому перерождению клетки и очень часто заканчивается развитием карциномы [3]. Опухолевая трансформация возникает с большей вероятностью при взаимодействии ВПЧ с другими канцерогенами или инфекционными агентами. Интеграция вируса в геном сопровождается увеличением синтеза белков Е6 и Е7, что через ряд реакций ведет к безудержной клеточной пролиферации. Сдерживает ее белок Р16 ink-4 а, синтез которого резко увеличивается при интегративной форме ПВИ. Кроме того, по данным ряда исследователей, одним из путей малигнизации клеток, инфицированных ВПЧ, является то, что вирус модифицирует клеточный метаболизм таким образом, что клетка приобретает способность превращать эстрадиол преимущественно в 16а-гидроксистерон (16а-ОН), который является прямым активатором экспрессии гена Е7, ответственного за опухолевую трансформацию клеток [3]. Вырабатываемый при этом онкобелок Е7, с одной стороны, активирует механизмы патологической пролиферации клеток, а с другой, блокирует механизмы развития иммунологической защиты, которые имеют определенные особенности при ПВИ [9]. Как и в случаях с другими хроническими заболеваниями с длительным персистированием вирусов, при ПВИ закономерно развиваются иммунодефицитные состояния, которые рассматриваются как вторичные иммунодефициты, обусловленные недостаточностью разных звеньев иммунной системы [2]. ВПЧ не инфицируют антиген-представляющие клетки, что является причиной отсутствия прямого пути активации системы иммунитета при ПВИ. Длительной персистенции ВПЧ способствует установленная в ряде исследований способность вируса «ускользать» от системного иммунного надзора. Хотя ВПЧ инфицирует преимущественно базальные клетки, репликация вируса и сборка вирусных частиц происходит в дифференцированных клетках поверхностного слоя эпителия, которые подвергаются последующему апоптозу, и вышеуказанный процесс не сопровождается признаками воспаления, а иммунная система его практически игнорирует [10]. Однако эффекторные клетки иммунной системы при этом продуцируют ряд цитокинов (в т. ч. интерфероны альфа, бета и гамма), которые снижают транскрипцию генов Е6 и Е7 у ВПЧ 16-го, 18-го и 33-го типов в трансформированных вирусами клетках. Дисбаланс клеточного иммунитета при ПВИ подтверждается такими данными, как сочетание спонтанной регрессии гиперпластических проявлений ПВИ с инфильтрацией окружающих их тканей лимфоцитами и макрофагами, а также результатами некоторых исследований (Bontkes et al., 1999), свидетельствующих о связи элиминации ВПЧ из организма с появлением ответов Т-хелперов на С-концевой домена вирусного белка Е2 [9].
При наличии кофакторов канцерогенеза — влагалищного дисбиоза и цервикального воспаления присоединяются дополнительные механизмы.
Так, при влагалищном дисбиозе на эпителий шейки матки воздействуют нитрозамины, выделяющиеся в процессе жизнедеятельности анаэробных бактерий, а также другие факторы агрессии, выделяющиеся грибами рода Candida на фоне усиленной адгезии к эпителиоцитам при сочетании БВ и вульвовагинального кандидоза, вызывающие патологические изменения в тканях. Кроме того, влагалищный дисбиоз и ВПЧ ведут к снижению выработки SIgA, что также способствует персистенции ВПЧ, увеличению площади атипичного со сниженной концентрацией гликогена эпителия шейки. Это еще больше снижает секрецию SIgA и усугубляет влагалищный дисбиоз. При хроническом цервикальном воспалении происходит миграция натуральных киллеров и фагоцитов, которые высвобождают медиаторы воспаления, ассоциированные с ЦИН и РШМ, а также происходит повышенная продукция антимикробных оксидантов, которые могут вызвать окислительные повреждения ДНК хозяина (Минкина Г. Н., Манухин И. Б., 2001).
Интересно, что при эктопии на фоне ПВИ и влагалищного дисбиоза выявлен более высокий, чем без эктопии, уровень пролиферативной активности базальных и парабазальных клеток, при этом отмечен дисбаланс иммунной системы по показателям клеточного иммунитета (CD4, CD8, CD3) интерферонового статуса, содержания цитокинов и SIgA, что можно связать с высоким онкогенным потенциалом изменений шейки матки на фоне ПВИ и влагалищного дисбиоза (Вотрина И. Р., Рудакова Е. Б., 2004).
Изменения на шейке матки при ПВИ проходят несколько этапов: от ЦИН различной степени выраженности до РШМ. Существует представление о следующих вариантах развития изменений эпителия шейки матки при ЦИН: регресс-спонтанное без лечения исчезновение признаков неоплазии в пласте экзоцервикса, дальнейшее прогрессирование изменений, персистенция ЦИН, полное отсутствие каких-либо изменений в течение длительного времени. При ЦИН 1-й степени (ЦИН 1) вероятность этих событий составляет: регресс — от 40% до 75% случаев, прогрессирование от 5% до 10% случаев, персистенция — от 29% до 43% [4, 6].
В настоящее время не существует этиотропной терапии и практически отсутствует системное лечение пациенток с ВПЧ-ассоциированной патологией шейки матки. Тем не менее сформулированы два принципа лечения этой группы пациенток [5, 8, 9]:
Безусловно, такой подход оправдан при всех субклинических и клинически выраженных формах ПВИ. Исключение составляет группа пациенток с ЦИН 1 без гиперпластических проявлений ПВИ. Алгоритм ведения таких пациенток четко не определен. В связи с высокой вероятностью регресса при ЦИН 1 в качестве тактики выбора может применяться наблюдение с цитологическим контролем через 6–12 месяцев или ВПЧ-тестирование через 12 месяцев [6].
С учетом всей вышеизложенной информации нами совместно с Лазаревой О. В., Мозговым С. И., Редькиным Ю. В., Батуровой О. Г. (Омская государственная медицинская академия) проведено исследование по изучению влияния нормализации влагалищного микробиоценоза (при бактериальном вагинозе, специфическом и неспецифическом вагините и цервиците) и иммуномодулирующей терапии у 76 пациенток в возрасте от 18 до 35 лет с ЦИН 1 на фоне ПВИ (без гиперпластических разрастаний) и влагалищного дисбиоза на течение ПВИ и ЦИН при их информированном согласии [8].
Лечение бактериального вагиноза, специфического и неспецифического вагинита и цервицита проводилось в соответствии с принятыми стандартами, с учетом международных рекомендаций CDC (Centers for Disease Control and Prevention). Системная терапия дополнялась местным применением комбинированного препарата Полижинакс. Выбор препарата для местного применения определялся его широким спектром действия за счет двух антибиотиков и антимикотика, а также возможностью быстрого достижения противовоспалительного клинического эффекта без применения кортикостероидов, что является принципиальным при лечении пациенток с генитальной вирусной инфекцией, так как не имеет побочных эффектов на местный и общий иммунитет. Важным компонентом в составе Полижинакса является диметикон, который позволяет быстро и равномерно распределить лекарство в складках влагалища, обладает защитным, противозудным действием, усиливает местное действие компонентов препарата, полностью исключая системные эффекты входящих в состав лекарств. Экципиентный состав, в который входят соевый лецитин, фосфолипиды, аминокислоты, витамины А, Е, Д, также обладает трофическим, восстанавливающим и противовоспалительным действием. Важно, что Полижинакс не влияет отрицательно на лактобациллы. Препарат применялся вагинально 1 раз в сутки в течение 6 дней.
Иммуномодулирующая и противовоспалительная терапия проводилась препаратом Галавит ® (аминодигидрофталадизион натрия) по следующей схеме: 5 дней по 1 ректальному суппозиторию 1 раз в день, далее по 1 ректальному суппозиторию через день. На курс — 20 суппозиториев. Выбор препарата обусловлен тем, что Галавит ® — единственный препарат, в инструкции которого зарегистрировано сочетание противовоспалительного и иммуномодулирующего действия (коды АТХ: L03, G02). Препарат доказал хорошую терапевтическую эффективность в лечении целого ряда вирусных и бактериальных инфекций и вторичных иммунодефицитных состояний в гинекологической практике [2, 9].
Противовоспалительное действие препарата реализуется за счет направленного торможения выброса активными макрофагами избыточного количества цитокинов воспаления (ИЛ-1, ИЛ-6, ФНО-альфа). Галавит ® также обладает иммуномодулирующими свойствами (нормализует функциональную активность иммунокомпетентных клеток, стимулирует выработку собственного интерферона), чем способствует формированию эффективного иммунного ответа.
Галавит ® проявляет как антиоксидантные свойства, так и прооксидантные свойства, поскольку стимулирует клеточное дыхание, увеличивая продолжительность жизни и функциональную работоспособность иммунокомпетентных клеток в экстремальных условиях (воспаление, гипоксия, интоксикация и прочее). Выраженное противовоспалительное действие препарата Галавит ® выгодно отличает его от других иммуномодуляторов, для которых характерно, как правило, провоспалительное действие. Кроме того, в отличие от кортикостероидов и нестероидных противовоспалительных препаратов, Галавит ® не только не оказывает повреждающего воздействия на желудочно-кишечный тракт, но, напротив, обладает репаративными и противоязвенными свойствами.
Контрольное изучение влагалищного микробиоценоза проводилось сразу после окончания лечения, РАР-мазки (тест Папаниколау) и ВПЧ- тестирование — через 6 и 12 месяцев.
Результаты исследования показали, что нормализация влагалищного микробиоценоза произошла у всех женщин. Через 6 месяцев ДНК ВПЧ не определялась в шейке матки у 22 пациенток (28,9%), а ЦИН 1 — у 16 пациенток (20,5%). Через 12 месяцев ДНК ВПЧ не определялась еще у 24 пациенток, а ЦИН 1 — еще у 19 пациенток. В целом без применения деструктивных методов при наблюдении в течение года у пациенток репродуктивного возраста на фоне ПВИ и нарушенного микробиоценоза влагалища (бактериального вагиноза, специфического и неспецифического вагинита и цервицита) в общей сложности элиминация ВПЧ произошла в 58,9% случаев, а регрессия ЦИН — в 44,9% случаев.
Таким образом, результаты нашего предварительного несравнительного когортного исследования подтверждают литературные данные о том, что состояние микробиоценоза влагалища и его своевременная коррекция с дополнительным применением препаратов иммуномодулирующего и противовоспалительного действия положительно влияет на течение папиломавирусной инфекции (ПВИ и ЦИН 1) у женщин.
Литература
Е. Б. Рудакова, доктор медицинских наук, профессор
ГУЗ Московский областной перинатальный центр, Балашиха