Чем лечить внутрибрюшное давление
Гастроэзофагеальная рефлюксная болезнь
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) — хроническое рецидивирующее заболевание, характеризующееся морфологическим изменением слизистой оболочки пищевода вследствие ретроградного заброса желудочного или желудочно-кишечного содержимого, проявляющеес
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) — хроническое рецидивирующее заболевание, характеризующееся морфологическим изменением слизистой оболочки пищевода вследствие ретроградного заброса желудочного или желудочно-кишечного содержимого, проявляющееся пищеводными и внепищеводными симптомами.
В последние годы возрастает и частота проявлений, и частота выявления этой патологии. Еще в 1999 г. отечественными учеными приводилась статистика распространенности ГЭРБ среди детей в пределах 2–4% [3]. В настоящее время истинная частота ГЭРБ у детей неизвестна, колебания составляют от 8,7 до 49% [5]. Также следует отметить тенденцию к «омоложению» этой патологии.
Эволюция ГЭРБ может приводить к развитию метапластических изменений в пищеводе. Точных данных о распространенности данного состояния у детей нет, однако сам факт роста частоты пищевода Барретта у детей также не вызывает сомнений. Особое значение проблеме ГЭРБ придает высокий риск малигнизации метаплазий [6].
Непосредственной причиной, приводящей к развитию ГЭРБ, является гастроэзофагеальный рефлюкс (ГЭР) — непроизвольное затекание или заброс желудочного/желудочно-кишечного содержимого в пищевод.
Для предотвращения заброса существует «антирефлюксный» барьер, регулирующий так называемые «закрывающие» и «открывающие» механизмы [2]. Первые препятствуют рефлюксу, преобладание вторых, наоборот, создает предпосылки для его возникновения.
В механизме закрытия кардии основная роль принадлежит нижнему пищеводному сфинктеру (НПС) — это кардиальное мышечное утолщение, имеющее особую иннервацию, кровоснабжение, специфическую автономную моторику.
Физиологическое функционирование НПС поддерживается:
С другой стороны, механизмы открытия кардии связывают с повышением внутрибрюшного давления (при кашле, запорах и др.); с дискоординацией моторики желудка и пищевода, в том числе перистальтическими и эвакуаторными функциями. Следует отметить, что нарушения эвакуаторной функции желудка у новорожденных могут быть напрямую связаны с неврологическими расстройствами, а также с созреванием этой функции спустя несколько недель после рождения.
Таким образом, в патогенезе возникновения ГЭР ведущим является дисбаланс между «закрывающими» и «открывающими» механизмами, возникающий вследствие следующих причин:
ГЭР может существовать как физиологический процесс, при этом физиология этого явления поддерживается факторами защиты: резистентностью слизистой оболочки пищевода, эффективным клиренсом (т. е. способностью к самоочищению посредством перистальтики), буферным действием слюны, своевременной эвакуацией желудочного содержимого.
Физиологический процесс может становиться патологическим под действием провоцирующих факторов:
Патологический ГЭР реализуется при нарушении равновесия между факторами защиты и факторами агрессии. В итоге увеличивается длительность экспозиции рефлюксата на слизистую пищевода. По данным отечественных исследователей, у новорожденных преобладает щелочной рефлюксат [2]. При этом повреждение слизистой пищевода происходит под воздействием лизолецитина и желчных кислот при участии трипсина. Итогом такой агрессии является чаще всего выраженный фибринозно-эрозивный эзофагит.
Соляная кислота и активированный пепсин как факторы агрессии приобретают значение в более старшем возрасте и нередко приводят к стенозированию пищевода.
Показано, что присутствие обоих рефлюксантов в полости пищевода не только способствует формированию эзофагита, но и кишечной метаплазии эпителия, т. е. пищевода Барретта [6]. Метаплазированный таким образом эпителий при определенных условиях может подвергаться дисплазии, являющейся основой для формирования аденокарциномы. Важную роль в развитии метаплазии и дисплазии эпителия играют желчные кислоты, обладающие не только повреждающим эффектом на эпителий, но также способствующие малигнизации. В частности, желчные кислоты повышают активность циклооксигеназы-2 в эпителиальных клетках слизистой оболочки пищевода, усиливая тем самым пролиферативные процессы.
Группами риска по развитию патологического ГЭР являются дети с отягощенной наследственностью по заболеваниям ЖКТ, преимущественно мужского пола, с органической патологией гастродуоденальной зоны, вегетативной дисфункцией, очагами хронической инфекции, в т.ч. глистно-паразитарной инвазией, ожирением, мезенхимальной недостаточностью и др.
По некоторым данным, возникновению ГЭРБ может способствовать эрадикационная терапия, снижающая перистальтическую активность желудка при сохранной кислотопродуцирующей функции [4].
Клиническая картина ГЭРБ многообразна. Выделяют пищеводные и внепищеводные симптомы.
Пищеводные симптомы: изжога (ощущение жжения за грудиной); регургитация (пассивное истечение содержимого желудка); отрыжка (попадание в полость рта воздуха, а также кислого и горького содержимого); боли за грудиной; одинофагия (боль или неприятные ощущения при прохождении пищи по пищеводу); дисфагия (нарушение глотания); тошнота; рвота; симптом «мокрой подушки» (как проявление регургитации).
Внепищеводные симптомы подразделяются на оториноларингологические, бронхолегочные, кардиологические, стоматологические.
Механизмы развития внепищеводных проявлений ГЭРБ связывают как с микроаспирацией содержимого желудка в рото- и носоглотку, нижние дыхательные пути, так и с активацией так называемых ноцицепторов поврежденной слизистой пищевода и прямым раздражением блуждающего нерва, приводящих к рефлекторному бронхо- или ларингоспазму.
Наиболее часто ГЭР-ассоциированными респираторными проявлениями являются бронхиальная астма (по различным данным, частота этой патологии достигает 80%), хроническая пневмония, рецидивирующий и хронический бронхит, отиты и синуситы, апноэ, синдром внезапной смерти.
Кардиологические проявления ГЭР характеризуются болями, маскирующимися как стенокардические. Такие боли возникают, как правило, в горизонтальном положении тела. Также возможно развитие аритмий. Кардиоваскулярные проявления возникают вследствие эзофагокардиального рефлекса.
Среди стоматологических проявлений описываются эрозии эмали зубов и развитие кариеса.
Следует отметить, что клинические проявления ГЭРБ зависят от возраста ребенка. У детей младшего возраста преобладают респираторные расстройства, синдромы срыгиваний и рвоты. У детей старшего возраста отмечаются выраженные «пищеводные» жалобы.
Постановка диагноза ГЭРБ основывается на совокупности диагностических критериев: клинических, эндоскопических, гистологических, рН-мониторинга, рентгенологических, манометрических, ультразвуковых и др.
Для оценки воспалительных изменений пищевода используется классификация G. Tytgat в модификации В.Ф.Приворотского с соавторами, по которой выделяется четыре степени эзофагита, а также три степени нарушения моторной функции.
I степень. Умеренно выраженная очаговая эритема и (или) рыхлость слизистой абдоминального отдела пищевода. Умеренно выраженные моторные нарушения в области НПС (подъем Z-линии до 1 см), кратковременное провоцированное субтотальное (по одной из стенок) пролабирование на высоту 1–2 см, снижение тонуса НПС.
II степень. То же + тотальная гиперемия абдоминального отдела пищевода с очаговым фибринозным налетом и возможным появлением одиночных поверхностных эрозий, чаще линейной формы, располагающихся на верхушках складок слизистой пищевода. Моторные нарушения: отчетливые эндоскопические признаки недостаточности кардиального жома (НКЖ), тотальное или субтотальное провоцированное пролабирование на высоту 3 см с возможной частичной фиксацией в пищеводе.
III степень. То же + распространение воспаления на грудной отдел пищевода. Множественные (иногда сливающиеся) эрозии, расположенные не циркулярно. Возможна повышенная контактная ранимость слизистой. Моторные нарушения: то же + выраженное спонтанное или провоцированное пролабирование выше ножек диафрагмы с возможной частичной фиксацией.
IV степень. Язва пищевода. Синдром Барретта. Стеноз пищевода.
Следует подчеркнуть, что нередко в педиатрической практике повреждение пищевода при ГЭРБ может быть эндоскопически неразличимым. В этой связи в последнее время широко стали использоваться термины «эндоскопически негативная» или «эндоскопически позитивная» ГЭРБ.
Так, по данным отечественных исследователей [6], из 473 детей с диагностированной ГЭРБ клинико-эндоскопические признаки присутствовали у 89%, только эндоскопические признаки — у 7%, а у 4% детей имелись только клинические проявления.
Гистологическое исследование у детей проводится по следующим показаниям [5]:
Гистологическая картина рефлюкс-эзофагита характеризуется гиперплазией эпителия в виде утолщения слоя базальных клеток и удлинения сосочков, а также лимфо-плазмоцитарной инфильтрацией и полнокровием сосудов подслизистого слоя.
Выявить ГЭР позволяет суточная внутрижелудочная рН-метрия, в ходе которой определяются общее число эпизодов рефлюкса в течение суток и их продолжительность. В норме рН в пищеводе составляет 5,5–7,0, а достоверным критерием ГЭР считается снижение рН ниже 4. Критерием патологического ГЭР считается частота эпизодов рефлюкса более 50 в сутки и суммарная продолжительность рефлюксов в течение суток, превышающая 4,5% от всего периода наблюдения. В оценке результатов рН-метрии используются нормативные показатели, разработанные T. R. DeMeester (1993).
Контрастная рентгенография с барием в настоящее время стала реже применяться в диагностике собственно ГЭР. В то же время она остается весьма информативным исследованием для выявления аномалий ЖКТ, нарушающих его моторику. В связи с этим на сегодняшний день контрастная рентгенография рассматривается как метод выявления органической причины ГЭР и решения вопроса о возможности и целесообразности ее устранения, в т.ч. хирургическим путем.
Манометрия пищевода — наиболее точный метод исследования функции НПС. Он позволяет регистрировать давление в различных отделах пищевода, во время дыхания и глотания, а также оценивать характер перистальтических волн. Давление в пределах 15–30 мм рт. ст. соответствует норме, снижение менее 10 мм рт. ст. свидетельствует о грубой патологии НПС, от 10 до 15 мм рт. ст. — о недостаточности НПС, а выше 30 мм рт. ст. — об ахалазии пищевода [2].
Билиметрия — метод, основанный на спектрофотометрии рефлюксата; позволяет проводить 24-часовое мониторирование дуодено-гастроэзофагеальных рефлюксов.
Интраэзофагеальная импедансометрия позволяет выявить рефлюкс, его высоту, продолжительность и агрессивность (AR), а также скорость и эффективность пищеводного клиренса (CL). Патологический рефлюкс регистрируется при AR > 10%. Значение CL
А. А. Коваленко
С. В. Бельмер, доктор медицинских наук, профессор
РГМУ, Москва
Тактика ведения и лечение больных с интраабдоминальной гипертензией
О патогенезе ИАГ / АКС писалось ранее.
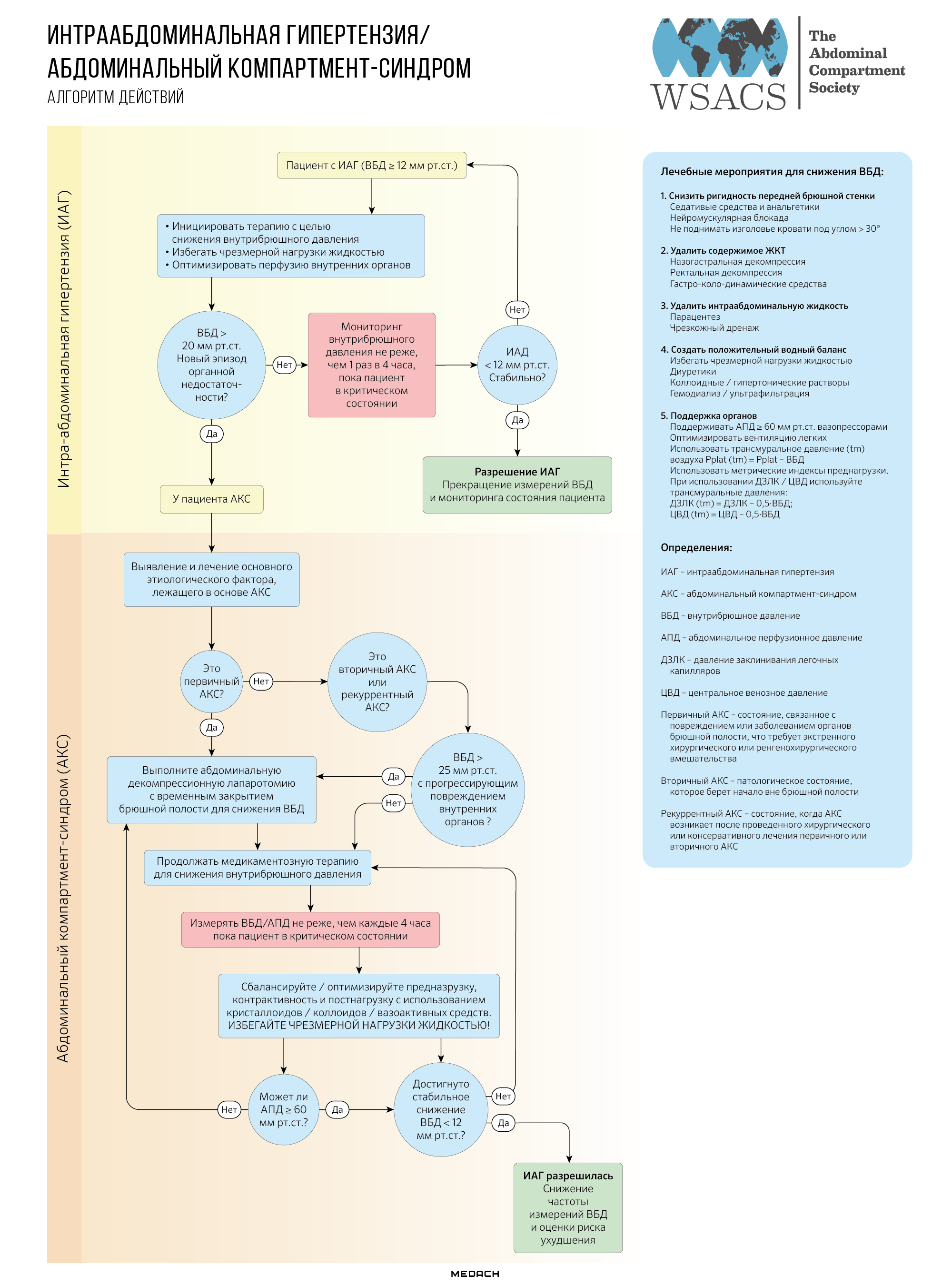
Всемирным обществом абдоминального компартмент-синдрома (WSACS) предложен алгоритм лечения, основанный на этиологии интраабдоминальной гипертензии (ИАГ) и абдоминального компартмент-синдрома (АКС).
WSACS предлагает следующие варианты лечения:
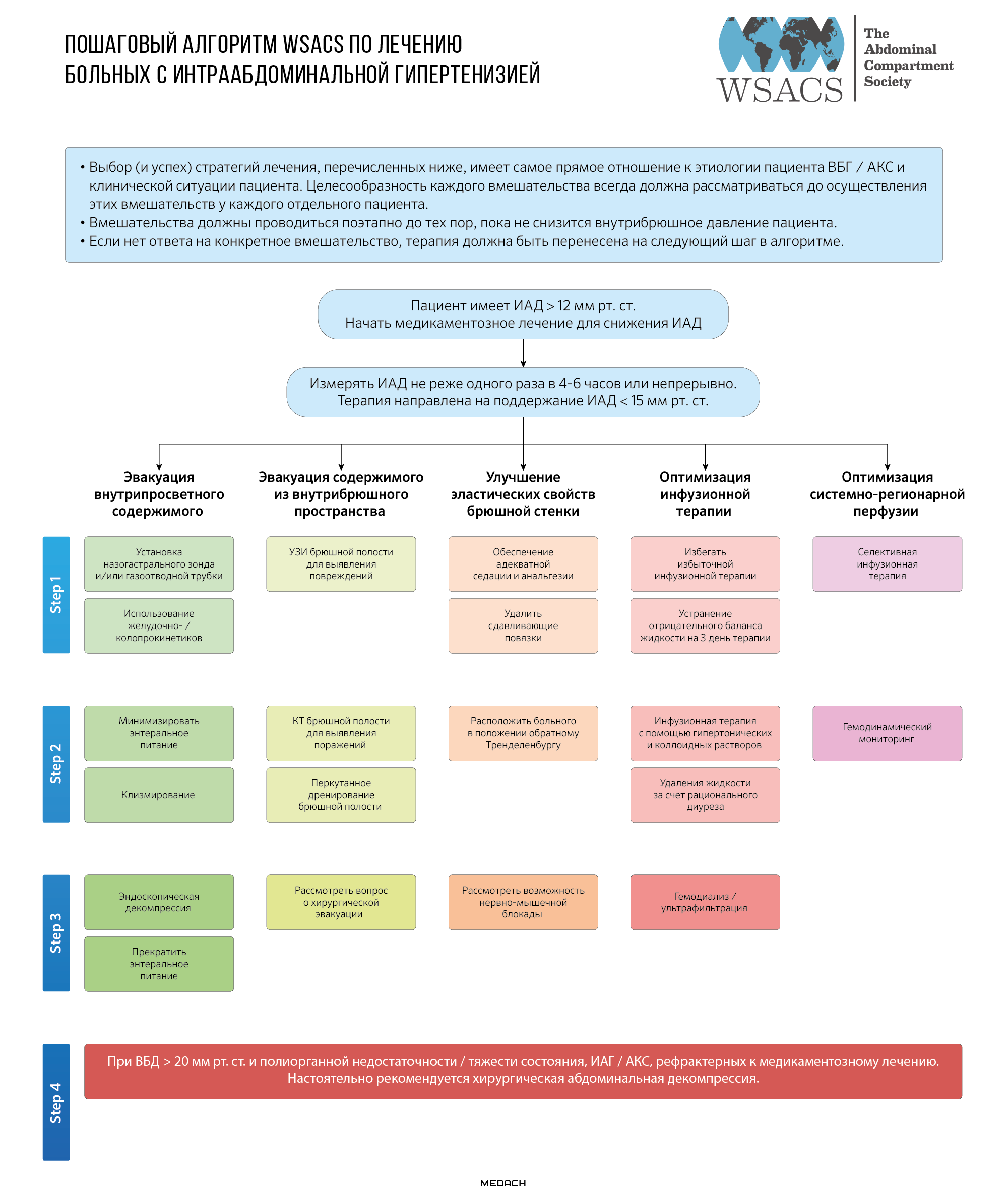
Также WSACS в 2013 году был создан и утвержден многоуровневый алгоритм, который направлен на улучшение исхода заболевания и снижение затрат на госпитализацию.
Схема №1. Алгоритм WSACS по ведению больных с ИАГ
Схема №2. Пошаговый алгоритм WSACS по лечению больных с ИАГ
Эвакуация кишечного содержимого
Часто у тяжелобольных пациентов, особенно у пациентов с заболеваниями брюшной полости, такими как панкреатит, перитонит, травмы живота, а также у пациентов после операции встречается илеус, что приводит к застою внутрипросветного содержимого. Назогастральное дренирование — первый шаг к снижению интраабдоминального давления (ИАД) у этих пациентов. Введение прокинетиков, таких как метоклопрамид, часто используется для преодоления вздутия живота и подвздошной кишки в частности, что, таким образом, является еще одним вариантом лечения ИАГ. В тех случаях, когда такие фармакологические меры не приводят к уменьшению внутрипросветного объема, может быть рассмотрена эндоскопическая декомпрессия.
Эвакуация внутрибрюшного внепросветного содержимого
Асцит и кровь являются наиболее распространенными компонентами поражений, занимающих внутрибрюшное пространство; абсцессы и свободный воздух также могут способствовать развитию ИАГ. При размещении в свободном внутрибрюшном пространстве эти образования могут быть легкими мишенями для чрескожного дренирования, которое может быть выполнено у постели больного в отделении интенсивной терапии под ультразвуковым контролем.
Улучшение эластических свойств брюшной стенки
Ригидность брюшной стенки является существенным фактором, влияющим на ИАГ. Повышенный тонус мышц живота, чаще всего вызванный болью или возбуждением, может быть снят адекватной анальгезией и седацией, если это необходимо. Следует избегать использования ограничительных повязок. Неоднократно было установлено, что нервно-мышечная блокада эффективна в снижении ИАД у пациентов с ИАГ. Нервно-мышечная блокада может рассматриваться в случаях, когда более простые меры недостаточны или неэффективны.
Оптимизация инфузионной терапии и системной/регионарной перфузии
Инфузионная терапия также может способствовать развитию ИАГ. Особенно актуальным такое осложнение является у пациентов с синдромом капиллярной утечки, при котором жидкость накапливается в стенке кишечника и брыжейке, свободной брюшной полости, забрюшинном пространстве и брюшной стенке. В таком случае борьба с ИАГ предполагает удаление избыточной жидкости из перегруженных объемами пациентов. В зависимости от клинической ситуации можно использовать ультрафильтрацию или диуретики.
Хирургическая декомпрессия
Если попытки уменьшить ИАД с помощью медикаментозного лечения недостаточны, следует рассмотреть возможность декомпрессивной лапаротомии.
Декомпрессивная лапаротомия может быть выполнена в операционной или в кровати в отделении интенсивной терапии. Наиболее распространенным методом является срединная лапаротомия от мечевидного отростка до лобка, однако были разработаны и другие менее инвазивные методы, причем одним из наиболее перспективных подходов является подкожная фасциотомия linea alba. Хирургическая декомпрессия означает, что пациент остается с открытым животом (лапаростомой), что может привести к серьезным потерям жидкости, инфекции, свищам, вентральной грыже и косметическим проблемам. В последние годы методы временного закрытия брюшной полости значительно улучшились, что привело к снижению частоты осложнений и более раннему закрытию фасции. Малоинвазивные методы в настоящее время не являются стандартом лечения первичной или рецидивирующей АКС.
Нужно учитывать, что время проведения вмешательства имеет важное значение: Ментула и соавт. описаны неблагоприятные исходы у больных с тяжелым острым панкреатитом, когда декомпрессия проводилась более чем через 4 дня после поступления в ИАГ.
Вместо заключения
Лечение ИАГ и АКС требует индивидуального, мультидисциплинарного подхода и определенного профессионализма. Последнее связано даже не столько с вынесением определенного решения, сколько с самым сложным в деле врача — умением балансировать между доступными возможностями и необходимыми мероприятиями. Соблюдение этого самого баланса в сочетании с разработанными алгоритмами и принципами позволяет добиться благоприятного исхода для больного.
Чем лечить внутрибрюшное давление
В 1970 году, Sönderberg и Westin выявили корреляцию между прямым способом измерения ВБД во время лапароскопии и непрямым методом чрезпузырного измерения [40]. В 1972 Shenansky и Gillenwater доказали влияние ПВБД на сердечно-сосудистую и почечную системы [41]. Первые опыты проведения лапароскопических операций привели к признанию негативных последствий пневмоперитонеума при ПВБД. Ivankovich с соавторами описал случай развития у больной сердечно-сосудистой недостаточности при проведении гинекологической лапароскопии [32] в дальнейшем, начав изучение физиологии этого явления [25]. В 1976 году Lenz с соавторами изучал изменения в сердечно-сосудистой системе во время лапароскопии, подчеркнув опасность пневмоперитонеума у пациентов с сердечно-сосудистыми заболеваниями, анемиями, гиповолемией [30]. Одновременно, Richardson и Trinkle (1976) проводили исследование гемодинамических и респираторных изменений при ПВБД [37]. Еще раньше, в шестидесятых, а затем и в семидесятых годах двадцатого века, были проведены исследования в группе больных с асцитами, предоставляющие доказательства клинической значимости ПВБД, выявлена корреляция между развитием ВБГ и увеличением смертности от сердечно-легочной недостаточности [15, 21, 27]. Начало восьмидесятых ознаменовалось рядом ключевых исследований: Kashtan в соавторстве (1981) открыл влияние ВБД на гемодинамику [28]; Harman в соавторстве (1982) [23], а немного позднее Richards с соавторами (1983) [39], выявили негативные последствия ВБГ на функцию почек, а также доказали эффективность декомпрессивной лапаротомии.
Kron с соавторами (1984). в комбинированном клиническом и экспериментальном исследовании показал, что ВБД может быть использовано в качестве критерия для проведения повторных операций на брюшной полости, а также декомпрессии [29].
Потепенно в медицинских кругах рос интерес к проблеме ВБГ. Smith в соавторстве (1985) сообщил о снижении явлений послеоперационной анурии после декомпрессивной лапаротомии [42]. Barnes с соавторами (1985) изучал сердечно-сосудистую реакцию на повышение ВБД [10]. Caldwell и Ricotta (1987) изучали влияние ВБГ на висцеральный кровоток [13]. Jacques и Lee (1988) сообщили о восстановлении функции почек после снижения интраабдоминального давления [26]. Cullen в соавторстве (1989) выявил, что декомпрессивная лапаротомия способствует регрессии сердечно-сосудистой, почечной и дыхательной недостаточности [16]. Измерение ВБД с помощью катетера, установленного в мочевой пузырь, становится обыденным явлением в отделениях интенсивной терапии.
В 1989 году термин АКС окончательно вошел в обиход. Burch c соавторами [12] указывают, что первая публикация в печати с использованием данного термина принадлежит W. Beaumont: «. у четверых пациентов с разрывом аневризмы брюшной аорты после оперативного лечения увеличилось внутрибрюшное давление. Это сопровождалось повышением давления на вдохе и повышением центрального венозного давления, снижением количества выделяемой мочи, а также вздутием живота. Эта совокупность клинических проявлений получила название абдоминальный компартмент-синдром, вызванный массивным интерстициальным и забрюшинным отеком.. В реанимации выполнена декомпрессивная лапаротомия, после операции зарегистрировали существенное увеличение сердечного индекса, дыхательного объема и темпа диуреза, центрального венозного давления, снижение показателей давления в легочной артерии, максимального давления на вдохе, pCO2 в артериальной крови и уровня лактата плазмы».
В настоящее время существуют различные методы профилактики и лечения ВБГ и АКС. При наличии у больного высокого риска развития АКС его профилактику следует начинать интраоперационно [4, 6].
Лечение АКС должно носить комплексный характер, в котором важным звеном является совокупность консервативных методов. Особое место в консервативном лечении отводится искусственной вентиляции легких с увеличением положительного давления в конце выдоха [32]. Чрезмерно высокий уровень положительного давления в конце выдоха вызывает усиление гемодинамических нарушений, недостаточный уровень давления способствует развитию ателектотравмы. В условиях ВБГ снижается прежде всего комплайнс грудной стенки, поэтому оптимально использование малых дыхательных объемов (5-6 мл/кг) с целью предотвращения баро- и волюмотравмы [21]. Инфузионная терапия имеет патогенетическую направленность только перед подготовкой больного к операции [33, 36]. В случаях, когда декомпрессия не выполняется, массивные инфузии усиливают проявления АКС [19]. У пациентов с гнойно-септической патологией органов живота не обнаружено отрицательного влияния на регионарную перфузию тканей от применения норадреналина, а использование адреналина или допамина предположительно приводит к перераспределению крови в спланхническом бассейне [8]. Восстановление перфузии ранее неадекватно перфузированных тканей сопровождается высвобождением в общую циркуляцию большого количества токсических продуктов (лактат, аденозин, калий), что сопровождается развитием аритмии, депрессии миокарда, вазодилятацией [5].
Острая боль повышает ригидность мышц передней брюшной стенки [42]. Применение эпидуральной анестезии в предоперационном периоде у больных с экстренной хирургической патологией с синдромом интраабдоминальной гипертензии в 1,5 раза уменьшает степень выраженности болевого напряжения передней брюшной стенки, что в свою очередь значительно снижает клинические проявления дисфункции респираторной системы и гемодинамических нарушений [5].
Необходимость кишечной декомпрессии в лечении АКС не вызывает сомнений [2, 18, 47]. Предпочтительным для этой цели считается вариант использования назоинтестинальных зондов различных конструкций. Выбор способа интубации ЖКТ зависит от сложившейся клинической ситуации и от причин, вызвавших ОКН и перитонит.
Хирургическая декомпрессия до сих пор остается единственным методом лечения, сопровождающимся достоверным снижением летальности. Снижение летальности возможно до 20 % при ранней диагностике АКС и до 43-65 % при поздней диагностике [2]. Большинство исследователей [39, 42] основным методом лечения считают хирургическое вмешательство, oднако показания к оперативному лечению АКС до настоящего времени окончательно не разработаны. При увеличении ВБД свыше 20 мм рт. ст. тактика лечения зависит от наличия признаков недостаточности органов, обусловленных увеличением ВБД. При отсутствии органной недостаточности производится мониторинг ВБД каждые 4 часа до тех пор, пока пациент находится в критическом состоянии. При признаках недостаточности органов, связанных с увеличением ВБД, тактика различается в зависимости от причины АКС. При первичном АКС показана декомпрессия брюшной полости и при необходимости временное закрытие брюшной полости. При вторичном или рецидивирующем АКС при ВБД более 25 мм рт. ст. с прогрессирующей органной недостаточностью необходима декомпрессивная лапаростомия [1, 3, 4, 31]. По мнению M. Schein [22, 43], лапаростомия показана в тех случаях, когда «живот не может быть закрыт или не должен быть закрыт.» В работе C. Tons [47] показано, что декомпрессивная лапаростомия приводит к снижению ВБД с 31 до 17 см вод. ст. Необходимо отметить, что декомпрессивная лапаростомия может осложниться нарастанием острой сердечно-сосудистой недостаточности и асистолией в связи с резким снижением ВБД, общего периферического сопротивления, усугублением гиповолемии и реперфузией обширных ишемизированных зон, что может сопровождаться высвобождением в общую циркуляцию большого количества токсических продуктов (лактат, аденозин, калий) и развитием аритмии, депрессии миокарда, вплоть до асистолии [4, 5].
В резолюции 3-го мирового конгресса по АКС (Бельгия, 2007) признано, что окончательное закрытие брюшной полости возможно при ВБД ниже 10 мм рт. ст. [8].
Таким образом, к концу двадцатого века разработаны и внедрены в рутинную клиническую практику способы измерения ВБД, выявлены физиологические эффекты ВБГ, а с начала двадцать первого века стали разрабатываться способы ее лечения. В нашу задачу не входило описание всей истории вопроса, однако приведенные краткие сведения говорят о глубине рассматриваемой проблемы.
Рецензенты:
Быков А.В., д.м.н., профессор, зав. кафедрой хирургических болезней и нейрохирургии ФУВ ВолгГМУ, г. Волгоград;
Полянцев А.А., д.м.н., профессор, зав. кафедрой общей хирургии с урологией ВолгГМУ, г. Волгоград.
Синдром портальной гипертензии
Введение
Кровь, питающая ряд органов брюшной полости, отводится по единому венозному руслу. Эта вена называется (учитывая ее расположение) воротной или портальной веной печени; она имеет множество ответвлений и является наиболее крупной веной в организме человека, достигая в диаметре 8-12 мм. Как и в любом ином магистральном кровеносном сосуде, в воротной вене должно постоянно поддерживаться определенное кровяное давление – здесь оно в норме составляет от 5-7 до 10-12 мм рт. ст. Хроническое превышение этого уровня приводит к общим нарушениям гемо- и гидродинамики брюшной полости, дегенеративным изменениям в тканях и другим тяжелым последствиям, которые в совокупности образуют синдром портальной гипертензии.
По определению, синдром не является самостоятельным заболеванием; это устойчивое, повторяющееся сочетание взаимосвязанных клинических симптомов, которое может формироваться в силу разных причин, но обладает собственными специфическими закономерностями развития и протекания. Это в полной мере касается и синдрома портальной гипертензии.
Причины
Выделяют две основные группы причин развития портальной гипертензии: внепеченочные и внутрипеченочные. На этих же критериях (конкретная локализация блока воротной вены) построены общепринятые ее классификации, обычно включающие под- или предпеченочную форму, внутрипеченочную (с несколькими подтипами), надпеченочную и смешанную.
Согласно доступной медицинской статистике, наиболее распространенной (85-90%) является внутрипеченочная локализация нарушений портально-венозного оттока. В этиологическом плане внутрипеченочная портальная гипертензия чаще всего обусловлена циррозом печени или иным процессом дегенеративного замещения паренхиматозных клеток соединительной тканью.
Предпеченочная форма составляет 10-12% в общем объеме портальной гипертензии и, как правило, развивается вследствие механического давления (например, злокачественной опухолью), врожденных или приобретенных аномалий анатомического строения вены, воспалительного процесса в миокарде, обструктивного тромбоза Бадда-Киари и пр.
Частота надпеченочной (постпеченочной) формы не превышает 3-4%; причинами обычно становятся прорастание опухоли, тромбоз, эндофлебит печеночных вен.
В целом, к перечню этиопатогенетических факторов портальной гипертензии следует добавить все разновидности гепатитов, онкозаболевания, патологию билиарной (желчевыводящей) и сердечнососудистой систем, последствия травм и некоторых хирургических вмешательств, отравления (медикаментами, грибами, соединениями меди и пр.), ожоги. Кроме того, портальная гипертензия нередко развивается на фоне жизнеугрожающих состояний в ходе реанимационных мероприятий.
Симптоматика
Классическая триада симптомов включает варикозное расширение вен пищевода и верхних отделов желудка (в 85% случаев), спленомегалию (селезенка в той или иной степени увеличена практически всегда) и асцит (массивное скопление жидкости в брюшной полости).
Ранние проявления синдрома портальной гипертензии могут быть неспецифическими: признаки диспепсии (абдоминальные боли и тяжесть в животе, тошнота, различные проблемы с дефекацией, метеоризм и т.д.). Кроме того, по мере нарастания выраженности нарушений кровоснабжения печени снижается ее способность к выполнению дезинтоксикационных функций, что отражается и на функционировании мозга, – развивается т.н. печеночная энцефалопатия с присущей ей психоневрологической симптоматикой. При тяжелой печеночной недостаточности наблюдается желтуха. Прямую угрозу жизни несут (и нередко приводят к летальному исходу) внутренние кровотечения из растянутых и истонченных венозных стенок.
Выраженность, стадийность и скорость появления симптомов в значительной мере различаются при разных типах портальной гипертензии. Так, «водянка живота» (асцит) в одних случаях развивается постепенно, в других остро, и т.д.
Диагностика
Диагноз устанавливается путем сопоставления жалоб, анамнестических данных, результатов клинического осмотра и инструментального обследования. В частности, необходимой и обязательной является ФГДС (фиброгастродуоденоскопия), в ходе которой визуализируются вены пищевода и желудка, оценивается их статус и собирается другая клинически значимая информация. Назначают УЗИ в дуплекс-режиме, рентгенографию, по необходимости – дополнительные методы исследования селезенки и гепатобилиарной системы (сканирование печени, спленоманометрия, спленопортография, КТ, МРТ и т.д.).
Лечение
Синдром портальной гипертензии, в целом, весьма проблематичен в терапевтическом плане. Амбулаторное консервативное лечение и курсы поддерживающей терапии могут занимать несколько лет; назначаются «прицельные» гипотензивные средства для снижения давления в воротной, нижней полой и печеночных венах, вазо- и гепатопротекторы. Однако с усугублением ситуации амбулаторное лечение становится все менее эффективным, и пациента приходится госпитализировать, – сроки стационарного лечения варьируют от двух недель до месяца и более.
Масштабы и цели хирургического вмешательства, – если оно целесообразно и необходимо, – определяются особенностями конкретного случая: в различных ситуациях основной задачей может быть восстановление венозной проходимости, коррекция путей отвода крови, удаление из брюшной полости избыточной жидкости при асците, склерозирование расширенных и кровоточащих вен пищевода, и т.д. Однако относительными или абсолютными противопоказаниями к операции могут становиться сопутствующие хронические заболевания, беременность, пожилой возраст, тяжелое общее состояние пациента (обусловленное, например, выраженной печеночной недостаточностью).
Отдаленный прогноз при некоторых формах синдрома портальной гипертензии (внутрипеченочная, надпеченочная) неблагоприятен, особенно при пищеводно-желудочных геморрагиях у больных циррозом печени. В других случаях оперативное вмешательство может значительно улучшить ситуацию. Однако единственным радикальным лечением в настоящее время остается трансплантация печени.
Симптомы и лечение внутрибрюшного давления, как измерить и снизить
Не все придают важности боли и дискомфорта в животе во время еды. Этот симптом может указывать на увеличение предыдущего давления. Трудно диагностировать заболевание на ранней стадии, потому что внешнее давление отличается от внутреннего давления. Когда системы нарушены, организм не работает должным образом.
Что это такое?
Тело представляет собой механизм, в котором сложные процессы происходят каждый день. Пациент не замечает этого и продолжает свою повседневную рутину. Эти процессы несут ответственность за правильное функционирование органов и внутренних систем, поддержание здоровья. Одним из важных процессов для тела является давление.
Когда внутренний баланс нарушен, человек начинает испытывать неприятные чувства. Поэтому для сохранения здоровья никогда не подходит, уделять должное внимание всем типам внутреннего давления. Прежде всего, это относится к внутрикорревному давлению. Увеличение давления внутри брюшной полости называется внутризонной гипертонией (IAH). Болезнь развивается в результате ненормального функционирования легких, сердец, почек и кишечников.
Если человек здоров, давление indebile варьируется от 0 до 5 мм рт. — Это норма. У взрослого пациента в критическом состоянии этот показатель может подняться до 7 мм рт. Увеличение наблюдается в нескольких других заборах о заботах организма — ожирение и родов. В этом случае индикатор давления не выходит за пределы 10-15 мм рт.
У пациента тело успевает адаптироваться к новым условиям, и это не влияет на его здоровье. В результате хирургического вмешательства, то есть брюшная полость, устройство будет отображаться 13 мм рт. Такие ценности не угрожают жизни пациента в таких условиях. Нельзя сказать о насильственном повышении давления без каких-либо важных причин.
Методы измерения
Для измерения внутрибакального давления используется один из двух существующих методов:
В первом случае используется катетер, который вводит пациента через мочевой пузырь. Он считается менее информативным, чем хирургический метод. Это относится, когда второй невозможен. В этом случае не должно быть никаких осложнений.
Измерение внутреннего давления хирургическим методом возможно во время операции. Доктор помещает специальный датчик в брюшной халате, которая через некоторое время показывает уровень давления. Измерительное устройство также можно разместить на жидкой толстой кишечнике. Это отличается хорошей информационной ценностью. Уменьшенные или повышенные значения указывают на развитие патологического процесса в организме человека.
Если вы начнете заметить характерные симптомы, необходимо спросить своего доктора.
Клиническая картина
Индикаторы часто наблюдаются. В то же время нерелевантные изменения не раскрываются никак. Это не признак серьезной болезни.
Значительные изменения в предыдущем значении давления выглядят следующим образом:
Если есть блок гипертонии Питера, трудно определить. Симптомы неспецифических недостаточно. Для ставки точного диагноза пациент должен быть подвергнут полной исследованию. На основании полученных данных доктор ставит диагноз и прописывать лечение.
Лечение
Трудно поставить действительный диагноз на основе перечисленных симптомов. Другие болезни также могут иметь такой же набор предупреждающих симптомов. Чтобы поставить точный диагноз, необходимо обратиться к врачу, который проведет все необходимые диагностические обследования и анализы. В первую очередь рассматриваются два фактора, определяющие причину и тяжесть заболевания.
Для подтверждения диагноза пациенту выдается зонтик, который вводится ректально. Во время процедуры пациент не чувствует боли, возможен лишь небольшой дискомфорт. Этот метод используется для измерения показателей. С его помощью невозможно снизить внутрибрюшное давление.
Если пациент не игнорирует симптомы и как можно скорее приступит к лечению, это остановит первую стадию заболевания. В этом случае пациент избежит осложнений в виде полиорганной недостаточности. Продолжительность терапии зависит от стадии заболевания. В этом случае лечение проводится несколькими методами:
Если пациент жалуется на недомогание и имеет серьезные жалобы, проводится немедленная диагностика. При этом измеряется ВБД. Если он превышает 25 мм рт. Ст., Требуется срочная операция. Используется абдоминальная хирургия.
Медикаментозная терапия и физиотерапевтические методы
В его состав входят следующие препараты:
Витамины и минеральные комплексы назначают для поддержания функции пищеварительного тракта.
Физиотерапевтические процедуры проводятся после основного лечения. Они помогают стабилизировать водный и электролитный баланс в организме. Это может быть установка дренажной трубки или клизма с лечебными отварами. Часто применяется стимуляция диуреза.
Следует избегать факторов, повышающих внутрибрюшное давление. Пациенту не следует носить облегающую одежду, лучше выбирать свободный крой. Чтобы не подвергать опасности свое здоровье, следует избегать чрезмерного затягивания ремня брюк. Положение лежа должно быть не менее 20 градусов.
Избегайте упражнений, в которых вам нужно поднимать тяжелые веса (более 10 кг). Мышцы живота также следует беречь от чрезмерного напряжения. Пациенту рекомендуется избегать физических упражнений. Разнообразное питание позволит поддерживать организм в стабильном состоянии.
Питание для пациента
Рацион подбирается индивидуально для каждого случая. При этом учтены общие рекомендации:
Повышенное давление в брюшной полости — результат ожирения. Бесконтрольное употребление вредных продуктов отравляет организм. При обнаружении ВБД у пациентов с такой проблемой назначают диету. Для нормализации веса разработан комплекс физических упражнений.
В случае повышенного или пониженного ВБД в первую очередь необходимо своевременно обратиться за медицинской помощью.
В этом случае можно не только вылечить болезнь на ранней стадии, но и избежать осложнений. Важную роль играют профилактические меры, направленные на укрепление всего тела. При наличии хронических заболеваний время от времени посещайте физиотерапевтические процедуры.
Заключение
Выбранный метод лечения ИАГ зависит от причин заболевания, симптомов и степени тяжести заболевания. Если у пациента может возникнуть внутрибрюшное давление, предпринимаются различные лечебные мероприятия. Чем дольше будет лечение, тем сложнее будет избавиться от болезни и уберечь внутренние органы от осложнений. Не следует забывать о показателях внутрибрюшного давления, периодически измеряемых у пациента.
Гастроэзофагеальная рефлюксная болезнь
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) — хроническое рецидивирующее заболевание, характеризующееся морфологическим изменением слизистой оболочки пищевода вследствие ретроградного заброса желудочного или желудочно-кишечного содержимого, проявляющеес
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) — хроническое рецидивирующее заболевание, характеризующееся морфологическим изменением слизистой оболочки пищевода вследствие ретроградного заброса желудочного или желудочно-кишечного содержимого, проявляющееся пищеводными и внепищеводными симптомами.
В последние годы возрастает и частота проявлений, и частота выявления этой патологии. Еще в 1999 г. отечественными учеными приводилась статистика распространенности ГЭРБ среди детей в пределах 2–4% [3]. В настоящее время истинная частота ГЭРБ у детей неизвестна, колебания составляют от 8,7 до 49% [5]. Также следует отметить тенденцию к «омоложению» этой патологии.
Эволюция ГЭРБ может приводить к развитию метапластических изменений в пищеводе. Точных данных о распространенности данного состояния у детей нет, однако сам факт роста частоты пищевода Барретта у детей также не вызывает сомнений. Особое значение проблеме ГЭРБ придает высокий риск малигнизации метаплазий [6].
Непосредственной причиной, приводящей к развитию ГЭРБ, является гастроэзофагеальный рефлюкс (ГЭР) — непроизвольное затекание или заброс желудочного/желудочно-кишечного содержимого в пищевод.
Для предотвращения заброса существует «антирефлюксный» барьер, регулирующий так называемые «закрывающие» и «открывающие» механизмы [2]. Первые препятствуют рефлюксу, преобладание вторых, наоборот, создает предпосылки для его возникновения.
В механизме закрытия кардии основная роль принадлежит нижнему пищеводному сфинктеру (НПС) — это кардиальное мышечное утолщение, имеющее особую иннервацию, кровоснабжение, специфическую автономную моторику.
Физиологическое функционирование НПС поддерживается:
С другой стороны, механизмы открытия кардии связывают с повышением внутрибрюшного давления (при кашле, запорах и др.); с дискоординацией моторики желудка и пищевода, в том числе перистальтическими и эвакуаторными функциями. Следует отметить, что нарушения эвакуаторной функции желудка у новорожденных могут быть напрямую связаны с неврологическими расстройствами, а также с созреванием этой функции спустя несколько недель после рождения.
Таким образом, в патогенезе возникновения ГЭР ведущим является дисбаланс между «закрывающими» и «открывающими» механизмами, возникающий вследствие следующих причин:
ГЭР может существовать как физиологический процесс, при этом физиология этого явления поддерживается факторами защиты: резистентностью слизистой оболочки пищевода, эффективным клиренсом (т. е. способностью к самоочищению посредством перистальтики), буферным действием слюны, своевременной эвакуацией желудочного содержимого.
Физиологический процесс может становиться патологическим под действием провоцирующих факторов:
Патологический ГЭР реализуется при нарушении равновесия между факторами защиты и факторами агрессии. В итоге увеличивается длительность экспозиции рефлюксата на слизистую пищевода. По данным отечественных исследователей, у новорожденных преобладает щелочной рефлюксат [2]. При этом повреждение слизистой пищевода происходит под воздействием лизолецитина и желчных кислот при участии трипсина. Итогом такой агрессии является чаще всего выраженный фибринозно-эрозивный эзофагит.
Соляная кислота и активированный пепсин как факторы агрессии приобретают значение в более старшем возрасте и нередко приводят к стенозированию пищевода.
Показано, что присутствие обоих рефлюксантов в полости пищевода не только способствует формированию эзофагита, но и кишечной метаплазии эпителия, т. е. пищевода Барретта [6]. Метаплазированный таким образом эпителий при определенных условиях может подвергаться дисплазии, являющейся основой для формирования аденокарциномы. Важную роль в развитии метаплазии и дисплазии эпителия играют желчные кислоты, обладающие не только повреждающим эффектом на эпителий, но также способствующие малигнизации. В частности, желчные кислоты повышают активность циклооксигеназы-2 в эпителиальных клетках слизистой оболочки пищевода, усиливая тем самым пролиферативные процессы.
Группами риска по развитию патологического ГЭР являются дети с отягощенной наследственностью по заболеваниям ЖКТ, преимущественно мужского пола, с органической патологией гастродуоденальной зоны, вегетативной дисфункцией, очагами хронической инфекции, в т.ч. глистно-паразитарной инвазией, ожирением, мезенхимальной недостаточностью и др.
По некоторым данным, возникновению ГЭРБ может способствовать эрадикационная терапия, снижающая перистальтическую активность желудка при сохранной кислотопродуцирующей функции [4].
Клиническая картина ГЭРБ многообразна. Выделяют пищеводные и внепищеводные симптомы.
Пищеводные симптомы: изжога (ощущение жжения за грудиной); регургитация (пассивное истечение содержимого желудка); отрыжка (попадание в полость рта воздуха, а также кислого и горького содержимого); боли за грудиной; одинофагия (боль или неприятные ощущения при прохождении пищи по пищеводу); дисфагия (нарушение глотания); тошнота; рвота; симптом «мокрой подушки» (как проявление регургитации).
Внепищеводные симптомы подразделяются на оториноларингологические, бронхолегочные, кардиологические, стоматологические.
Механизмы развития внепищеводных проявлений ГЭРБ связывают как с микроаспирацией содержимого желудка в рото- и носоглотку, нижние дыхательные пути, так и с активацией так называемых ноцицепторов поврежденной слизистой пищевода и прямым раздражением блуждающего нерва, приводящих к рефлекторному бронхо- или ларингоспазму.
Наиболее часто ГЭР-ассоциированными респираторными проявлениями являются бронхиальная астма (по различным данным, частота этой патологии достигает 80%), хроническая пневмония, рецидивирующий и хронический бронхит, отиты и синуситы, апноэ, синдром внезапной смерти.
Кардиологические проявления ГЭР характеризуются болями, маскирующимися как стенокардические. Такие боли возникают, как правило, в горизонтальном положении тела. Также возможно развитие аритмий. Кардиоваскулярные проявления возникают вследствие эзофагокардиального рефлекса.
Среди стоматологических проявлений описываются эрозии эмали зубов и развитие кариеса.
Следует отметить, что клинические проявления ГЭРБ зависят от возраста ребенка. У детей младшего возраста преобладают респираторные расстройства, синдромы срыгиваний и рвоты. У детей старшего возраста отмечаются выраженные «пищеводные» жалобы.
Постановка диагноза ГЭРБ основывается на совокупности диагностических критериев: клинических, эндоскопических, гистологических, рН-мониторинга, рентгенологических, манометрических, ультразвуковых и др.
Для оценки воспалительных изменений пищевода используется классификация G. Tytgat в модификации В.Ф.Приворотского с соавторами, по которой выделяется четыре степени эзофагита, а также три степени нарушения моторной функции.
I степень. Умеренно выраженная очаговая эритема и (или) рыхлость слизистой абдоминального отдела пищевода. Умеренно выраженные моторные нарушения в области НПС (подъем Z-линии до 1 см), кратковременное провоцированное субтотальное (по одной из стенок) пролабирование на высоту 1–2 см, снижение тонуса НПС.
II степень. То же + тотальная гиперемия абдоминального отдела пищевода с очаговым фибринозным налетом и возможным появлением одиночных поверхностных эрозий, чаще линейной формы, располагающихся на верхушках складок слизистой пищевода. Моторные нарушения: отчетливые эндоскопические признаки недостаточности кардиального жома (НКЖ), тотальное или субтотальное провоцированное пролабирование на высоту 3 см с возможной частичной фиксацией в пищеводе.
III степень. То же + распространение воспаления на грудной отдел пищевода. Множественные (иногда сливающиеся) эрозии, расположенные не циркулярно. Возможна повышенная контактная ранимость слизистой. Моторные нарушения: то же + выраженное спонтанное или провоцированное пролабирование выше ножек диафрагмы с возможной частичной фиксацией.
IV степень. Язва пищевода. Синдром Барретта. Стеноз пищевода.
Следует подчеркнуть, что нередко в педиатрической практике повреждение пищевода при ГЭРБ может быть эндоскопически неразличимым. В этой связи в последнее время широко стали использоваться термины «эндоскопически негативная» или «эндоскопически позитивная» ГЭРБ.
Так, по данным отечественных исследователей [6], из 473 детей с диагностированной ГЭРБ клинико-эндоскопические признаки присутствовали у 89%, только эндоскопические признаки — у 7%, а у 4% детей имелись только клинические проявления.
Гистологическое исследование у детей проводится по следующим показаниям [5]:
Гистологическая картина рефлюкс-эзофагита характеризуется гиперплазией эпителия в виде утолщения слоя базальных клеток и удлинения сосочков, а также лимфо-плазмоцитарной инфильтрацией и полнокровием сосудов подслизистого слоя.
Выявить ГЭР позволяет суточная внутрижелудочная рН-метрия, в ходе которой определяются общее число эпизодов рефлюкса в течение суток и их продолжительность. В норме рН в пищеводе составляет 5,5–7,0, а достоверным критерием ГЭР считается снижение рН ниже 4. Критерием патологического ГЭР считается частота эпизодов рефлюкса более 50 в сутки и суммарная продолжительность рефлюксов в течение суток, превышающая 4,5% от всего периода наблюдения. В оценке результатов рН-метрии используются нормативные показатели, разработанные T. R. DeMeester (1993).
Контрастная рентгенография с барием в настоящее время стала реже применяться в диагностике собственно ГЭР. В то же время она остается весьма информативным исследованием для выявления аномалий ЖКТ, нарушающих его моторику. В связи с этим на сегодняшний день контрастная рентгенография рассматривается как метод выявления органической причины ГЭР и решения вопроса о возможности и целесообразности ее устранения, в т.ч. хирургическим путем.
Манометрия пищевода — наиболее точный метод исследования функции НПС. Он позволяет регистрировать давление в различных отделах пищевода, во время дыхания и глотания, а также оценивать характер перистальтических волн. Давление в пределах 15–30 мм рт. ст. соответствует норме, снижение менее 10 мм рт. ст. свидетельствует о грубой патологии НПС, от 10 до 15 мм рт. ст. — о недостаточности НПС, а выше 30 мм рт. ст. — об ахалазии пищевода [2].
Билиметрия — метод, основанный на спектрофотометрии рефлюксата; позволяет проводить 24-часовое мониторирование дуодено-гастроэзофагеальных рефлюксов.
Интраэзофагеальная импедансометрия позволяет выявить рефлюкс, его высоту, продолжительность и агрессивность (AR), а также скорость и эффективность пищеводного клиренса (CL). Патологический рефлюкс регистрируется при AR > 10%. Значение CL
А. А. Коваленко
С. В. Бельмер, доктор медицинских наук, профессор
РГМУ, Москва
Синдром портальной гипертензии
Введение
Кровь, питающая ряд органов брюшной полости, отводится по единому венозному руслу. Эта вена называется (учитывая ее расположение) воротной или портальной веной печени; она имеет множество ответвлений и является наиболее крупной веной в организме человека, достигая в диаметре 8-12 мм. Как и в любом ином магистральном кровеносном сосуде, в воротной вене должно постоянно поддерживаться определенное кровяное давление – здесь оно в норме составляет от 5-7 до 10-12 мм рт. ст. Хроническое превышение этого уровня приводит к общим нарушениям гемо- и гидродинамики брюшной полости, дегенеративным изменениям в тканях и другим тяжелым последствиям, которые в совокупности образуют синдром портальной гипертензии.
По определению, синдром не является самостоятельным заболеванием; это устойчивое, повторяющееся сочетание взаимосвязанных клинических симптомов, которое может формироваться в силу разных причин, но обладает собственными специфическими закономерностями развития и протекания. Это в полной мере касается и синдрома портальной гипертензии.
Причины
Выделяют две основные группы причин развития портальной гипертензии: внепеченочные и внутрипеченочные. На этих же критериях (конкретная локализация блока воротной вены) построены общепринятые ее классификации, обычно включающие под- или предпеченочную форму, внутрипеченочную (с несколькими подтипами), надпеченочную и смешанную.
Согласно доступной медицинской статистике, наиболее распространенной (85-90%) является внутрипеченочная локализация нарушений портально-венозного оттока. В этиологическом плане внутрипеченочная портальная гипертензия чаще всего обусловлена циррозом печени или иным процессом дегенеративного замещения паренхиматозных клеток соединительной тканью.
Предпеченочная форма составляет 10-12% в общем объеме портальной гипертензии и, как правило, развивается вследствие механического давления (например, злокачественной опухолью), врожденных или приобретенных аномалий анатомического строения вены, воспалительного процесса в миокарде, обструктивного тромбоза Бадда-Киари и пр.
Частота надпеченочной (постпеченочной) формы не превышает 3-4%; причинами обычно становятся прорастание опухоли, тромбоз, эндофлебит печеночных вен.
В целом, к перечню этиопатогенетических факторов портальной гипертензии следует добавить все разновидности гепатитов, онкозаболевания, патологию билиарной (желчевыводящей) и сердечнососудистой систем, последствия травм и некоторых хирургических вмешательств, отравления (медикаментами, грибами, соединениями меди и пр.), ожоги. Кроме того, портальная гипертензия нередко развивается на фоне жизнеугрожающих состояний в ходе реанимационных мероприятий.
Симптоматика
Классическая триада симптомов включает варикозное расширение вен пищевода и верхних отделов желудка (в 85% случаев), спленомегалию (селезенка в той или иной степени увеличена практически всегда) и асцит (массивное скопление жидкости в брюшной полости).
Ранние проявления синдрома портальной гипертензии могут быть неспецифическими: признаки диспепсии (абдоминальные боли и тяжесть в животе, тошнота, различные проблемы с дефекацией, метеоризм и т.д.). Кроме того, по мере нарастания выраженности нарушений кровоснабжения печени снижается ее способность к выполнению дезинтоксикационных функций, что отражается и на функционировании мозга, – развивается т.н. печеночная энцефалопатия с присущей ей психоневрологической симптоматикой. При тяжелой печеночной недостаточности наблюдается желтуха. Прямую угрозу жизни несут (и нередко приводят к летальному исходу) внутренние кровотечения из растянутых и истонченных венозных стенок.
Выраженность, стадийность и скорость появления симптомов в значительной мере различаются при разных типах портальной гипертензии. Так, «водянка живота» (асцит) в одних случаях развивается постепенно, в других остро, и т.д.
Диагностика
Диагноз устанавливается путем сопоставления жалоб, анамнестических данных, результатов клинического осмотра и инструментального обследования. В частности, необходимой и обязательной является ФГДС (фиброгастродуоденоскопия), в ходе которой визуализируются вены пищевода и желудка, оценивается их статус и собирается другая клинически значимая информация. Назначают УЗИ в дуплекс-режиме, рентгенографию, по необходимости – дополнительные методы исследования селезенки и гепатобилиарной системы (сканирование печени, спленоманометрия, спленопортография, КТ, МРТ и т.д.).
Лечение
Синдром портальной гипертензии, в целом, весьма проблематичен в терапевтическом плане. Амбулаторное консервативное лечение и курсы поддерживающей терапии могут занимать несколько лет; назначаются «прицельные» гипотензивные средства для снижения давления в воротной, нижней полой и печеночных венах, вазо- и гепатопротекторы. Однако с усугублением ситуации амбулаторное лечение становится все менее эффективным, и пациента приходится госпитализировать, – сроки стационарного лечения варьируют от двух недель до месяца и более.
Масштабы и цели хирургического вмешательства, – если оно целесообразно и необходимо, – определяются особенностями конкретного случая: в различных ситуациях основной задачей может быть восстановление венозной проходимости, коррекция путей отвода крови, удаление из брюшной полости избыточной жидкости при асците, склерозирование расширенных и кровоточащих вен пищевода, и т.д. Однако относительными или абсолютными противопоказаниями к операции могут становиться сопутствующие хронические заболевания, беременность, пожилой возраст, тяжелое общее состояние пациента (обусловленное, например, выраженной печеночной недостаточностью).
Отдаленный прогноз при некоторых формах синдрома портальной гипертензии (внутрипеченочная, надпеченочная) неблагоприятен, особенно при пищеводно-желудочных геморрагиях у больных циррозом печени. В других случаях оперативное вмешательство может значительно улучшить ситуацию. Однако единственным радикальным лечением в настоящее время остается трансплантация печени.
Интраабдоминальная гипертензия и абдоминальный компартмент-синдром
Интраабдоминальная гипертензия (ИАГ) (Intra-abdominal Hypertension (IAH)) и абдоминальный компартмент-синдром (АКС) (Abdominal Compartment Syndrome (ACS)) являются тяжелыми осложнениями заболеваний, как у хирургических, так и у нехирургических больных. Однако эти два сопутствующих явления, при своей высокой распространенности, часто остаются непризнанными или не диагностированными. ИАГ воздействует на региональную и общую перфузии, что может привести к полиорганной недостаточности и летальному исходу.
Наиболее ранним проявлением, даже при относительно низком уровне ИАГ, является олигурия и острое повреждение почек (ОПП). Профилактика ИАГ путем раннего выявления и мониторинга пациентов группы риска может полностью исключить развитие АКС. Понимание этиологии и патофизиологии ИАГ и AКС имеет важное значение для выявления патологии и может быть использовано в качестве руководства при его профилактике и осуществлении соответствующей терапии.
Определение
Определение и руководящие принципы ИАГ и АКС установлены Всемирным обществом абдоминального компартмент-синдрома (WSACS).
Интраабдоминальное давление (ИАД) — давление внутри брюшной полости.
В среднем у взрослого человека нормальный уровень ИАД находится в пределах 0–5 мм рт.ст., в то время как у тяжелобольных взрослых он обычно составляет 5–7 мм рт. ст.
Интраабдоминальная гипертензия (ИАГ) — постоянное или рецидивирующее патологическое повышение ИАД больше ≥ 12 мм рт.
Абдоминальный компартмент синдром (АКС) — устойчивая ИАГ (более 20 мм рт.ст.), при абдоминальном перфузионном давлении (АПД) 25 мм рт.
С другой стороны, АКС дополнительно классифицируется в зависимости от причины и продолжительности ИАГ на первичную, вторичную и рецидивирующую.
Эти системы классификационных групп, разработанные WSACS, облегчают последующее управление ИАГ и АКС в рамках организации поэтапного подхода к ведению больных.
Предрасполагающие условия и факторы риска
Наиболее распространенные факторы риска развития ИАГ и/или АКС в соответствии WSACS:
Примечание. Некоторые из этих факторов риска далеки от патофизиологического обоснования и клинического суждения.
Развитие ИАГ у пациентов, которым проводится интенсивная терапия, связано с ухудшением клинического исхода, и это может наблюдаться у пациентов с тяжелым острым панкреатитом, распространенность интраабдоминальной гипертензии у этого типа пациентов составляет около 40–50 %, что обычно является осложнением ранней и агрессивной инфузионной терапии.
Помимо серьезных ожогов и сепсиса, которые являются одними из причин вторичного ИАГ/АКС, травмы и хирургические манипуляции в области живота являются предрасполагающими условиями, влияющими на развитие первичного ИАГ/АКС и, следовательно, послеоперационной почечной недостаточности. В проспективном наблюдательном исследовании, которое включало 263 пациента, ИАГ (определяемая как ИАП, превышающая или равная 18 мм рт.ст.) была независимой причиной нарушения функции почек после абдоминальной операции.
Патофизиология
Чтобы понять основные принципы ИАГ и АКС, мы можем сравнить его в целом с компартмент-синдромом, когда повышение давления ухудшает капиллярный кровоток, в конечном итоге уменьшая приток в артериолы и уменьшая венозный отток. В дальнейшем это вызывает клеточную гипоксию, которая, в свою очередь, предшествует анаэробному дыханию и молочнокислому ацидозу.
Человеческое тело можно рассматривать как сочетания различных анатомических отделов, взаимодействующие друг с другом, по этой причине патофизиология внутриполостной гипертензии и компартмент-синдрома является многофакторной и может наблюдаться почти во всех системах органов.
ИАГ, очевидно, не только вызывает снижение перфузии во всех органах брюшной полости, но и оказывает влияние на внебрюшинные органы, а в некоторых случаях даже оказывает влияние на внутричерепное давление. Проще говоря, когда внутрибрюшное давление повышается, многие органы постепенно начинают отказывать. Было установлено, что ИАГ вызывает ряд патофизиологических изменений, начиная с региональных нарушений кровотока и заканчивая явной недостаточностью систем органов и развитием АКС.
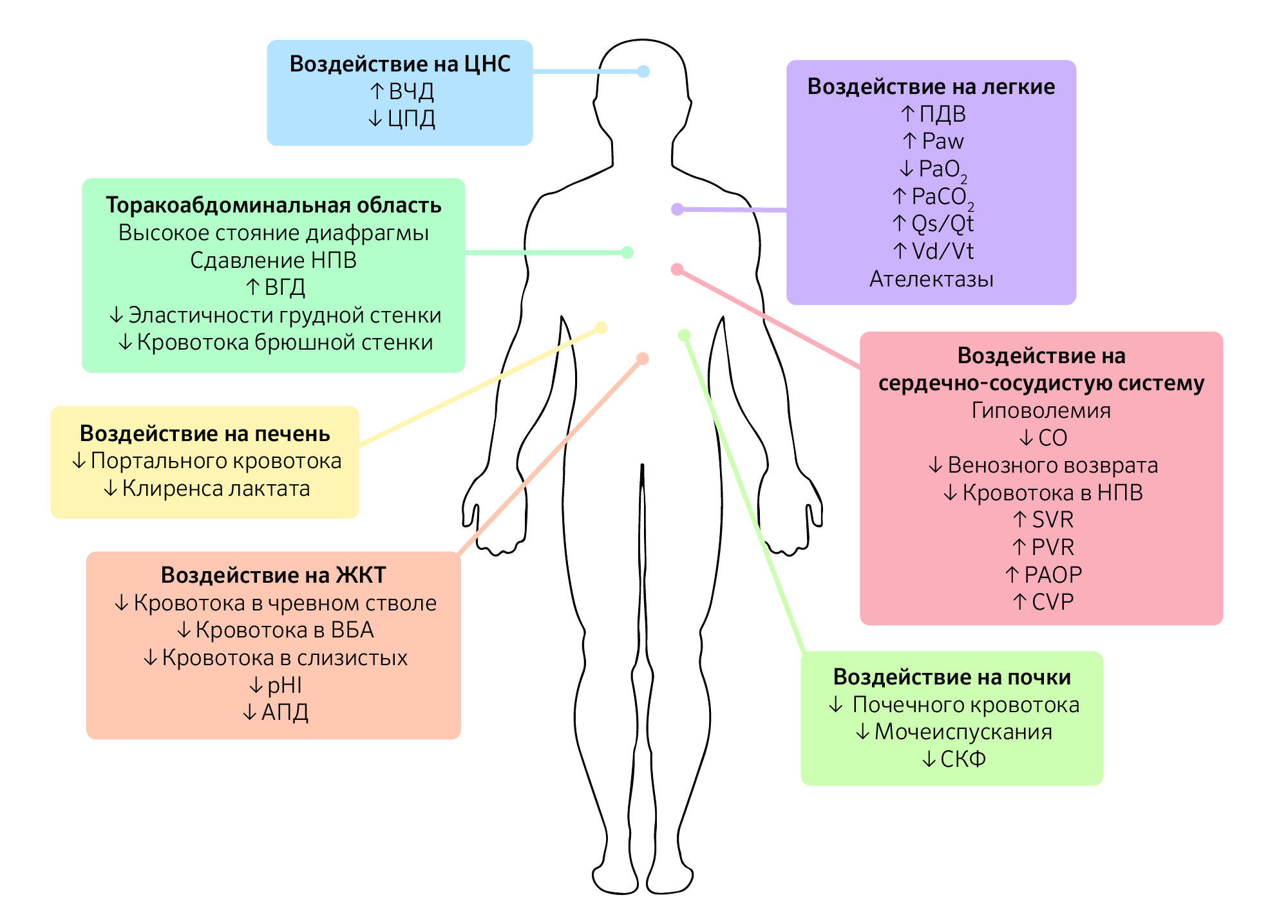
Помимо уровня ИАД и этиологии ИАГ у пациента, схожую по значимости роль играет коморбидность, которую следует принимать во внимание, поскольку это снижает порог ИАД, вызывающий клинические проявления (изображение 1).
Изображение 1 | Патофизиологические последствия интраабдоминальной гипертензии.
Последствия интраабдоминальной гипертензии не ограничиваются только органами брюшной полости, а, скорее, оказывают прямое или косвенное воздействие на каждую систему органов в организме. Схема влияния ИАГ на системы органов.
Сокращения: ВЧД — внутричерепное давление; ЦПД — церебральное перфузионное давление; ВГД — внутригрудное давление; НПВ — нижняя полая вена; ВБА — верхняя брыжеечная артерия; pHI — pH слизистой желудка ; АПД — абдоминальное перфузионное давление; ПДВ — пиковое давление вдоха; Paw, mean airway pressure —среднее давление в дыхательных путях; PaО 2 — парциальное давление кислорода в артериальной крови; PaCO 2 — парциальное давление углекислого газа в артериальной крови; Qs/Qt — внутрилегочный шунт; Vd/Vt — легочное мертвое пространство; CO, cardiac output — сердечный выброс; SVR — системное сосудистое сопротивление; PVR — легочное сосудистое сопротивление; PAOP — окклюзионное давление в легочной артерии; CVP — центральное венозное давление; СКФ — скорость клубочковой фильтрации.
Воздействие ИАГ и АКС на различные системы органов
Сердечно-сосудистая система
Повышение ИАГ увеличивает внутригрудное давление путем брюшно-грудной передачи через краниальное смещение диафрагмы. Это явление создает прямое сжатие внутригрудных органов. Прямая компрессия сердца вызывает снижение сократительной способности, наполнения сердца и эластичности правого желудочка. ИАГ также приводит к нарушению венозного возврата, поскольку давление нижней полой вены увеличивается параллельно увеличению ИАГ, это отмечается даже при ИАД 10 мм рт. ст. Кроме того, отклонение диафрагмы вызывает анатомическое сужение полой вены, что приводит к дальнейшему снижению венозного возврата к сердцу и, в конечном счете, сердечного выброса. С другой стороны, сдавление легочной паренхимы приводит к сдавлению сосудистой сети, тем самым увеличивая легочное, аортальное и системное сосудистое сопротивление. Потому, несмотря на снижение венозного возврата и сердечного выброса, среднее артериальное давление остается стабильным, что делает его неточным гемодинамическим маркером.
Измерение давления на основе внутрисердечного или внутрисосудистого объема также имеет тенденцию быть недостоверным. Это объясняется тем, что, как окклюзионное давление легочной артерии (pulmonary artery occlusion pressure, PAOP), так и центральное венозное давление (central venous pressure, CVP) измеряются пропорционально барометрическому давлению, когда на самом деле эти показатели — сумма внутрисосудистого и внутригрудного давления.
Параметрами, которые более точно отражают состояние внутрисосудистого объема, являются следующие: конечный диастолический объем правого желудочка (right ventricular end-diastolic volume, RVEDV), общий конечный диастолический объем (global end-diastolic volume, GEDV) и ударный объем, поскольку они остаются незатронутыми изменениями внутригрудного давления.
Дыхательная система
Аналогичным образом повышенное ИАД передается в грудную клетку главным образом через отклонение диафрагмы, вызывающее сдавление легочной паренхимы. Паренхиматозное сжатие при ИАД 16 мм рт. ст. снижает эластичность легочной ткани на 50 %. Паренхиматозное давление также вызывает снижение емкости вдоха и функциональной остаточной емкости, в то время как пиковое инспираторное, экспираторное и среднее давление в дыхательных путях увеличиваются. В результате возникает альвеолярный ателектаз, увеличивается альвеолярное мертвое пространство, снижается легочный капиллярный кровоток, что приводит к снижению транспорта кислорода и снижению экскреции углекислого газа, а также увеличению фракции внутрилегочного шунта (Qsp/Qt) и рассогласованию вентиляции и перфузии (VQ) и, в конечном счете, к гипоксемии и гиперкапнии.
Функция почек
Несколько механизмов были предложены в качестве этиологии для ИАГ-индуцированной почечной дисфункции и недостаточности. Компрессия почечных артерий и вен в сочетании с компрессией почечных канальцев — вероятный механизм, лежащий в основе ИАГ/АКС-индуцированной почечной дисфункции и недостаточности, сопровождающейся снижением сердечного выброса. Различные авторы предположили, что прямое сдавление паренхимы провоцирует развитие «синдрома почечного компартмента», при котором почечный артериальный кровоток уменьшается, а почечное венозное давление и почечное сосудистое сопротивление повышается. Это приводит к тому, что кровь шунтируется от коры почек и клубочков, что приводит к нарушению функции клубочков и канальцев, вызывая ишемию почек и последующую почечную недостаточность.
При ИАД более 15 мм рт.ст. отмечается олигурия, в то время как анурия проявляется при ИАД более 30 мм рт. ст. Клинически наблюдаются изменения в функции почек, такие как снижение СКФ, повышение содержания азота мочевины в крови (BUN) и креатинина в сыворотке крови, увеличение фракционной экскреции натрия, снижение концентрации натрия и хлорида в моче и увеличение концентрации калия в моче. Однако все эти изменения, по-видимому, могут быть устранены, если ИАГ диагностируется и успешно управляется до того, как произойдет существенная дисфункция органа.
Желудочно-кишечная система
Высокое давление в брюшной полости вызывает мальперфузию кишечника из-за нарушения артериального и венозного кровотока. Было показано, что повышение ИАД на 10 мм рт. ст. снижает брыжеечный кровоток. Снижение перфузии кишечника вызывает ишемию кишечника и даже отек кишечника и кишечную непроходимость. Перфузия слизистой оболочки кишечника также нарушается, вызывая снижение рН и молочнокислый ацидоз, который в конечном итоге повреждает слизистый барьер кишечника. Потеря слизистого барьера приводит к внутрипросветной бактериальной транслокации, приводящей к сепсису или септическому шоку и последующему ухудшению исхода.
Гепатобилиарная система
Повышенный ИАД существенно влияет на функцию печени. Прямое сжатие печени нарушает печеночный венозный и портальный кровоток. Кроме того, сужение печеночных вен на уровне диафрагмы ослабляет печеночный венозный кровоток, в то время как печеночный артериальный поток нарушается из-за снижения сердечного выброса.
На клеточном уровне микроциркуляторный кровоток также снижается, нарушая метаболизм глюкозы, вызывая увеличение производства лактата и одновременно нарушая механизм его утилизации.
Центральная нервная система
Устойчивое и длительное повышение внутрибрюшного и внутригрудного давлений вызывает повышение внутричерепного давления (ВЧД) и снижение церебрального перфузионного давления (ЦПД). Bloomfield и соавторами в ходе двух различных исследований было установлено, что при повышении внутригрудного давления снижается мозговой венозный поток, что, в свою очередь, вызывает внутримозговой отек.
Диагноз
Раннее выявление пациентов группы риска является первым шагом в диагностике ИАГ и АКС. WSACS рекомендует проводить скрининг на ИАГ/АКС при наличии двух или более факторов риска. Рекомендация состоит в том, чтобы оценить ИАД на исходном уровне, и, если оно повышено, то ИАД необходимо продолжать контролировать каждые 4-6 часов.
Клиническое обследование, такое как пальпация и измерение окружности живота, оказалось крайне неточным и ненадежным в диагностике ИАГ и/или АКС. Радиографический ввод, такой как обычная рентгенография грудной клетки и/или живота, УЗИ брюшной полости, компьютерная томография и МРТ брюшной полости, также оказался ограниченным, поскольку результаты не являются ни чувствительными, ни специфичными для ИАГ и АКС. Тем не менее они могут продемонстрировать наличие возможной причины ИАГ, а также могут выявить воздействие ИАД (высокий уровень стояния диафрагмы, уплощение нижней полой вены, сжатие почечных вен и повышенное усиление стенки кишечника).
Когда комбинация рентгенологических данных сочетается с клинической картиной, тогда рентгенолог и врач-клиницист должны поднять вопрос о возможной ИАГ и/или АКС в качестве дифференциального диагноза.
Лучшим методом установления или исключения факта ИАГ является измерение внутрибрюшного давления. Существуют прямые и косвенные способы определения ИАД. Прямое измерение внутрибрюшного давления может быть выполнено с помощью внутрибрюшинного катетера с датчиком давления. Методы косвенного измерения включают определение любого из следующих давлений:
В связи с положением мочевого пузыря в брюшной полости, внутрипузырный метод считается простым, точным и минимально инвазивным; следовательно, это надежный и воспроизводимый способ измерения ИАД.
Техника внутрипузырного метода измерения ИАД
При выполнении измерения, необходимо соблюдать несколько рекомендаций:
Необходимое оборудование
Изображение 2 | Система мониторинга ИАД ABVISER IPA
Шаги для измерения внутрипузырного давления:
Выводы
Установлено, что измерение ИАП имеет существенное прогностическое значение для тяжелобольных пациентов, так как ИАГ и АКС часто ассоциируются с неблагоприятными исходами. По этой причине ранняя и постоянная оценка, включая серийные измерения ИАД, должна контролироваться у любого пациента, у которого есть подозрение на ИАП/АКС.
Раннее распознавание имеет важное значение в управлении и благоприятном для пациента исходе. Необходимо понять патофизиологию ИАГ и АКС, исходить из более высокой настороженности и проверить наличие ИАГ у всех пациентов, имеющих факторы риска. В идеале хотелось бы иметь возможность диагностировать развивающийся ИАГ и АКС и вмешиваться до начала дисфункции и отказа органов и систем.
Предпочтительно, чтобы раннее терапевтическое вмешательство, будь то медицинские или хирургические попытки уменьшить ИАГ, рассматривалось как можно раньше. Руководящие принципы и рекомендации WSACS дают врачам полезное понимание ИАГ и АКС и их клинического управления для улучшения выживаемости пациентов.