Чем лечится болезнь паркинсона
Что такое болезнь Паркинсона? Причины возникновения, диагностику и методы лечения разберем в статье доктора Полякова Т. А., невролога со стажем в 12 лет.
Определение болезни. Причины заболевания
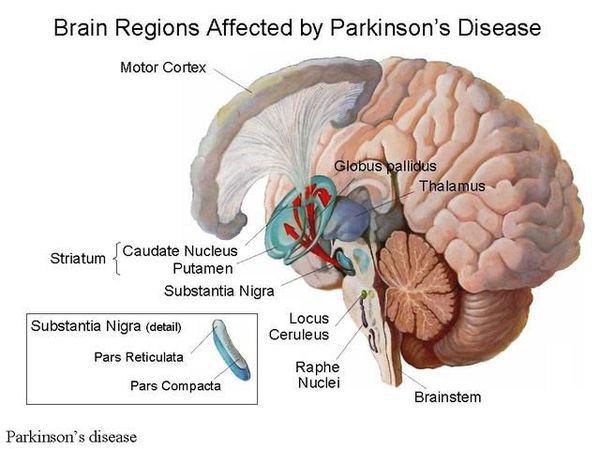
Болезнь Паркинсона — это одно из самых распространенных нейродегенеративных заболеваний, поражающее преимущественно дофамин-продуцирующие (дофаминергические) нейроны в определенной области мозга, называемой чёрной субстанцией с накоплением в клетках белка альфа-синуклеина и особых внутриклеточных включений (телец Леви). Это заболевание — самая частая причина синдрома паркинсонизма (80% всех случаев). Распространенность болезни Паркинсона составляет около 140 (120-180) случаев на 100 000 населения. [1] Заболевание чаще всего проявляет себя после 50 лет, однако нередки случаи дебюта болезни и в более раннем возрасте (с 16 лет). Мужчины страдают немного чаще женщин.
Причина остается в значительной степени неизвестной. Предполагается, что на возникновение заболевания влияют генетические факторы, внешняя среда (возможное воздействие различных токсинов), процессы старения. Генетические факторы имеют доминирующее значение при раннем развитии болезни Паркинсона. Молодые пациенты с этим заболеванием и с семейной историей болезни с большей вероятностью переносят гены, связанные с болезнью Паркинсона, такие, как SNCA, PARK2, PINK1 и LRRK2. В одном из последних исследований показано, что 65% людей с ранним началом болезни Паркинсона в возрасте до 20 лет и 32% людей с началом от 20 до 30 лет имели генетическую мутацию, которая, как полагают, увеличивает риск развития болезни Паркинсона. [2]
Симптомы болезни Паркинсона
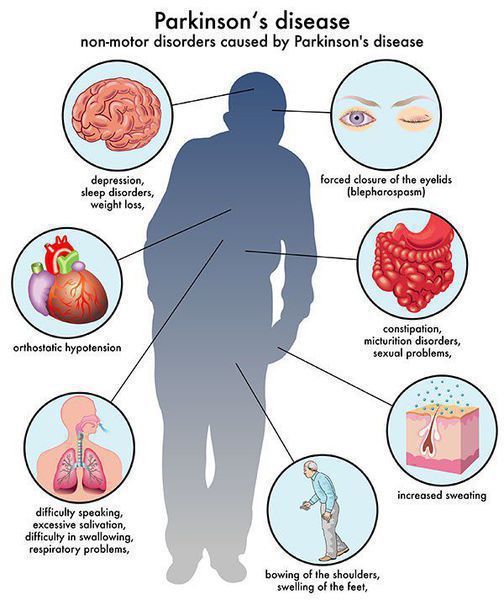
Многие симптомы болезни Паркинсона не связаны с движением. Немоторные («невидимые симптомы») болезни Паркинсона распространены и могут влиять на повседневную жизнь больше, чем более очевидные трудности с движением. Они могут включать:
В начале заболевания нередко ставится неверный диагноз — плечелопаточный периартрит, проявляющийся болью и напряжением в мышцах руки и спины.
Синдром паркинсонизма является основным клиническим проявлением болезни Паркинсона, его симптомы: [1]
Вначале симптомы возникают только с одной стороны тела, но постепенно приобретают двусторонний характер. Симптомы остаются выраженными на той стороне, где возникли в начале заболевания. Симптомы на другой стороне тела часто не становятся такими же тяжелыми, как симптомы на начальной стороне. Движения становятся все более замедленными (основной симптом паркинсонизма). Симптомы заболевания колеблются в течения дня и зависят от многих факторов.
Патогенез болезни Паркинсона
Болезнь Паркинсона относится к группе синуклеинопатий, так как избыточное накопление в нейронах альфа-синуклеина приводит к их гибели. Повышенный уровень альфа-синуклеина может быть следствием нарушения внутриклеточной системы клиренса белков, осуществляемого лизосомамии и протеосомами. У пациентов обнаружено нарушение функционирования указанной системы, среди причин которого указывают старение, окислительный стресс, действие воспаления, токсины окружающей среды. Клетки гибнут предположительно из-за активации генетически запрограмированного механизма (апоптоза). [4]
Классификация и стадии развития болезни Паркинсона
Болезнь Паркинсона классифицируется по форме, стадии и темпу прогрессирования заболевания.
В зависимости от преобладания в клинической картине того или иного симптома выделяют следующие формы: [1]
1. Смешанная (акинетико-ригидная-дрожательная) форма характеризуется наличием всех трёх основных симптомов в разном соотношении.
2. Акинетико-ригидная форма характеризуется выраженными признаками гипокинезии и ригидности, к которым обычно рано присоединяются нарушения ходьбы и постуральная неустойчивость, при этом тремор покоя отсутствует или выражен минимально.
3. Дрожательная форма характеризуется доминированием в клинической картине тремора покоя, признаки гипокинезии уходят на второй план.
Для характеристики стадий Болезни Паркинсона используется шкала Хен–Яра, 1967:
Выделяют три варианта темпа прогрессирования заболевания:
Осложнения болезни Паркинсона
Болезнь Паркинсона — не смертельное заболевание. Человек умирает с ним, а не от него. Однако поскольку симптомы ухудшаются, они могут вызвать инциденты, которые приводят к смерти. Например, в сложных случаях затруднение глотания может привести к тому, что пациенты начнут аспирировать пищу в легкие, что приведет к пневмонии или другим легочным осложнениям. Потеря равновесия может привести к падению, которое, в свою очередь, может привести к серьезным травмам или смерти. Серьезность этих инцидентов во многом зависит от возраста пациента, общего состояния здоровья и стадии заболевания.
На более поздних стадиях заболевания проявляются более выраженные симптомы болезни Паркинсона: дискинезия (непроизвольные движения или подергивание частей тела, которые могут возникнуть в результате длительного использования леводопы, застывания (внезапное отсутствие возможности двигаться) или семенящая походка (короткие, почти бегущие шаги, которые как будто ускоряются сами по себе).
Следует помнить, что болезнь Паркинсона очень индивидуальна по своему течению и у каждого протекает по своему сценарию.
Диагностика болезни Паркинсона
Паркинсонизм относится к числу тех расстройств, которые можно диагностировать на расстоянии, особенно при развёрнутой картине заболевания. Однако диагностировать болезнь Паркинсона на ранней стадии сложно. Ранняя и точная диагностика заболевания очень важна для разработки лучших стратегий лечения и поддержания высокого качества жизни как можно дольше. В практике возможна недооценка или переоценка болезни Паркинсона. Невролог, специализирующийся на расстройствах движения сможет поставить наиболее точный диагноз. Первоначальная оценка проводится на основе анамнеза, неврологического обследования с использованием специальных тестов для оценки симптомов заболевания. Неврологическое обследование включает в себя оценку координации, ходьбы и мелких моторных задач, оценку нейропсихологического статуса.
Практика получения второго мнения в значительной степени зависит от личного выбора пациента. Но имейте в виду, что болезнь Паркинсона часто трудно диагностировать точно, особенно когда симптомы незначительно выражены. Простейшего диагностического теста нет, и примерно 25% диагнозов болезни Паркинсона неверны. Болезнь Паркинсона начинается с мало видимых симптомов, поэтому многие врачи, которые не обучены в сфере двигательных расстройств, не могут поставить точный диагноз. На самом деле даже лучшие неврологи могут ошибаться. Если врач не имеет особого опыта в этой области, то необходимо консультироваться со специалистом по расстройствам движения. Хороший невролог поймет ваше желание подтвердить диагноз. Второе мнение может помочь принять своевременно правильные решения относительно диагноза и терапии.
Лечение болезни Паркинсона
Несмотря на то, что излечения болезни Паркинсона не существует, есть множество методов, которые могут позволить вести полноценную и продуктивную жизнь на многие годы вперед. Многие симптомы могут облегчаться лекарствами, хотя со временем они могут утратить свою эффективность и вызвать нежелательные побочные эффекты (например, непроизвольные движения, известные как дискинезия).
Существует несколько методов лечения, замедляющих появление моторных симптомов и улучшающих двигательные функции. Все эти методы лечения предназначены для увеличения количества дофамина в головном мозге либо путем его замещения, либо продления эффекта дофамина путем ингибирования его распада. Исследования показали, что терапия на ранней стадии может задержать развитие двигательных симптомов, тем самым улучшая качество жизни. [5]
На характер и эффективность лечения влияет ряд факторов:
Задача терапии при болезни Паркинсона — восстановить нарушенные двигательные функции и поддержать оптимальную мобильность в течение максимально длительного периода времени, сведя к минимуму риск побочных действий препаратов. [1]
Существуют также хирургические вмешательства, такие, как глубокая стимуляция мозга, подразумевающая имплантацию электродов в мозг. Из-за рисков, присущих этому типу лечения, большинство пациентов исключают данный метод лечения до тех пор, пока лекарства, которые они принимают, больше не дают им значимого облегчения. Обычно этот метод лечения проводится у пациентов с длительностью заболевания от четырех лет, получающих эффект от лекарств, но имеющих моторные осложнения, такие, как: значительное «отключение» (периоды, когда лекарство плохо работает и симптомы возвращаются) и/или дискинезии (неконтролируемые, непроизвольные движения). Глубокая стимуляция мозга лучше всего работает в отношении таких симптомов, как: скованность, медлительность и тремор, не работает с целью коррекции устойчивости, застывания при ходьбе и немоторных симптомах. Данное лечение может даже усугубить проблемы с памятью, поэтому хирургия не рекомендуется для людей с когнитивными расстройствами. [6]
Различные новые способы введения леводопы открывают дополнительные возможности терапии. Сегодня используется интестинальный (кишечный) дуодопа-гель, который уменьшает ежедневные периоды «выключения» и дискинезию у пациентов с прогрессирующей болезнью Паркинсона благодаря постоянному неимпульсному режиму введения препарата. [7]
Исследуется альтернативный подход, использование допаминовых продуцирующих клеток, полученных из стволовых клеток. Хотя терапия стволовыми клетками имеет большой потенциал, требуется больше исследований, прежде чем такие клетки могут стать инструментом в лечении болезни Паркинсона. [8] [9]
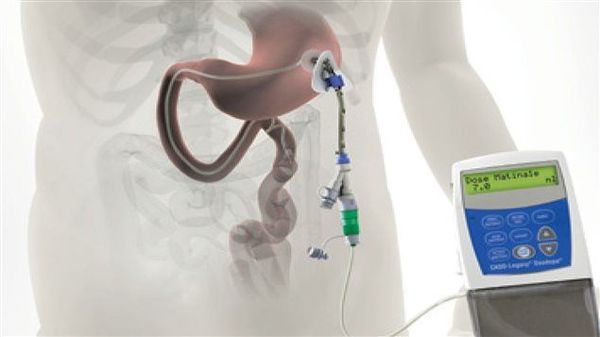
По мере прогрессирования болезни Паркинсона возможности хранения и буферизации дофамина в мозге становятся все более скомпрометированными, сужая терапевтическое окно для терапии и приводя к колебаниям двигательной системы человека. Апоморфин в виде помпы доставляет подкожную инфузию в течение дня для лечения флуктуаций (феномены «ON-OFF») у пациентов с болезнью Паркинсона, которые недостаточно контролируются пероральным антипаркинсоническими препаратами. Эта система используется постоянно, чтобы обеспечить мозг непрерывной стимуляцией.
Прогноз. Профилактика
Болезнь Паркинсона уникальна для каждого человека, никто не может предсказать, какие симптомы появятся и когда именно. Существуют общее сходство картины прогрессирования болезни, но нет никакой гарантии, что то, что наблюдается у одного, будет у всех с аналогичным диагнозом. Некоторые люди оказываются в инвалидных колясках; другие все еще участвуют в марафонах. Некоторые не могут застегнуть ожерелье, в то время как другие делают ожерелья вручную.
Пациент может сделать всё, чтобы активно повлиять на течение болезни Паркинсона и, по крайней мере, на одну очень вескую причину: ухудшение симптомов часто значительно медленнее у тех, кто проявляет позитивную и активную позицию по отношению к своему состоянию, чем те, кто этого не делает. В первую очередь рекомендуется найти врача, которому доверит пациент, и который будет сотрудничать по развивающемуся плану лечения. Снижение стресса обязательно — стресс ухудшает каждый симптом болезни Паркинсона. Рекомендуются занятия образовательного направления: рисование, пение, чтение стихов, рукоделие, изучение языков, путешествия, работа в коллективе, занятия общественной деятельностью.
К сожалению, даже если адекватно подобрать медикаментозную терапию, это не гарантирует того, что клетки перестанут гибнуть при болезни Паркинсона. Терапия должна быть направлена на создание благоприятных условий для двигательной активности с учётом индивидуальных особенностей клинической картины заболевания. Как показывают результаты многочисленных исследований, профессиональная двигательная реабилитация является необходимым условием для замедления прогрессирования заболевания и улучшения его прогноза. На сегодняшний день по данным клинических исследований показана эффективность реабилитационной программы по протоколам LSVT LOUD, LSVT BIG, теоретическая основа которых сводится к развитию нейропластичности вещества мозга. Она направлена на коррекцию дрожания, ходьбы, постуры, равновесия, мышечного тонуса и речи. [10]
Реабилитационные методики должны быть направленные не только на поддержание сохранившихся двигательных способностей, но и выработку новых навыков, которые бы помогали человеку с болезнью Паркинсона преодолевать ограниченность его физических возможностей, чему способствует программа танцевально-двигательной терапии при болезни Паркинсона, работающая более чем в 100 сообществах по всему миру, включая Россию. Танцевальная терапия позволяет частично решить конкретные проблемы болезни Паркинсона: потеря равновесия, ухудшение координации, шаркающая походка, тремор, застывания, социальная изоляция, депрессия и повышенный уровень тревожности.
Согласно американскому исследованию с участием 52 больных болезнью Паркинсона, регулярная практика аргентинского танца уменьшает симптомы болезни, улучшает баланс и улучшает выполнение сложных движений при болезни Паркинсона. [11]
Болезнь Паркинсона: как с ней справляться
Рисунок 1. Применение антихолинергических препаратов, известных с прошлого века, для снятия тремора и ригидности ограничено из-за их побочных эффектов Каковы основные диагностические критерии болезни Паркинсона? Когда пациента необходимо
 |
| Рисунок 1. Применение антихолинергических препаратов, известных с прошлого века, для снятия тремора и ригидности ограничено из-за их побочных эффектов |
Каковы основные диагностические критерии болезни Паркинсона?
Когда пациента необходимо отправить к специалисту?
С каких препаратов начать лекарственную терапию?
Каким образом устранить побочное действие специфической терапии?
Причины паркинсонизма до сих пор неизвестны, а лечение остается симптоматическим, несмотря на то, что прошло уже четверть века с тех пор, как леводопа прочно внедрилась в жизнь больных паркинсонизмом.
Но не будем слишком пессимистичны — современные методы лечения продлевают жизнь таким больным и делают ее более или менее нормальной [1]. Один человек из тысячи страдает болезнью Паркинсона. Диагноз ставится на основании клинического синдрома, включающего гипокинезию, ригидность, тремор и нарушенные рефлексы позы. Уровень допамина снижается почти на 80% к моменту появления клинических признаков, поэтому неудивительно, что невозможно точно указать время появления первых симптомов.
Далеко не всегда просто отличить идиопатическую болезнь Паркинсона от других состояний, включая такое часто встречающееся, как эссенциальный тремор, и менее распространенные заболевания, которым присущи иные неврологические симптомы — супрануклеарный паралич, автономные нарушения или мозжечковые симптомы [2].
Патолого-анатомические исследования показывают, что каждый пятый диагноз в данной группе заболеваний ошибочен. Перед тем как поставить диагноз, важно убедиться в наличии по крайней мере двух из четырех основных клинических признаков, помня при этом, что у большинства пациентов симптоматика асимметрична. В сомнительных случаях помогает пробное лечение леводопой или допаминовыми агонистами [3].
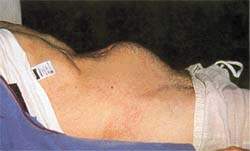 |
| Рисунок 2. Задержка мочи часто сопровождает болезнь Паркинсона |
Основной проблемой в контролировании болезни Паркинсона на сегодняшний день остается поздняя недостаточность допаминергической терапии, проявляющаяся в исчезновении или колебаниях реакции на препарат или в развитии дискинезий и прочих побочных эффектов у 75% пациентов после пяти лет лечения [4].
Расширение спектра препаратов и вновь возросший интерес к хирургическому лечению объясняется стремлением избежать или уменьшить проблемы длительного лечения.
Врач общей практики, подозревающий у пациента болезнь Паркинсона, должен решить, к кому его направить — к невропатологу, гериатру или другим специалистам. Особенно это важно в хронических прогрессирующих случаях у молодых людей, нуждающихся в длительном лечении.
Пациенту крайне необходимо рассказать о его болезни, прогнозе и сути применяемого лечения. Как и при астме, диабете и другом хроническом заболевании, врач и пациент должны действовать сообща, при активном участии последнего в принятии решений, касающихся лечения.
Как правило, с такими пациентами легко договориться, но по мере прогрессирования заболевания их приходится уговаривать принимать различные препараты несколько раз в день.
Контроль за заболеванием не сводится лишь к лекарственной терапии, напротив, психотерапия, трудотерапия, обучение навыкам речи и психологические методы существенно улучшают состояние пациентов [5]. Регулярная физиотерапия, назначаемая до допаминергических препаратов, замедляет прогрессирование заболевания [6], поэтому сразу после установления диагноза нужно советовать пациентам физические упражнения, соблюдение диеты, трудотерапию.
Весьма часто такие методы используются на более поздних стадиях заболевания, когда ничто другое уже не помогает, в то время как их нужно использовать для предупреждения развития болезни. Общество больных болезнью Паркинсона выпускает информационные сборники для персонала больниц и специальный обучающий материал для пациентов.
В ряде центров специально обученные сиделки помогают больным и тем, кто за ними ухаживает. Несмотря на отсутствие конкретных научных данных, многие пациенты признают эффект музыкотерапии, обучения, йоги и прочих дополнительных методов лечения.
Количество доступных препаратов и их новых форм в последние десять лет значительно увеличилось и обещает еще большее увеличение в ближайшем будущем. В табл. 1 приведены основные группы препаратов.
Таблица 1. Лекарственные препараты, применяемые для лечения паркинсонизма
антихолинергические препараты
Антихолинергические средства применялись еще в прошлом веке. Они до сих пор помогают справиться с тремором и, в меньшей степени, с ригидностью, практически не влияя на гипокинезию. Выбор среди них невелик. Все они имеют побочные эффекты: сухость во рту, нарушение аккомодации, запор и задержка мочи. У пожилых пациентов они склонны вызывать спутанность сознания и прочие психиатрические нарушения.
Следует отметить, что все антипаркинсонические средства способны вызывать подобные проблемы и любое нарушение ментальной функции требует пересмотра целесообразности применения и адекватности доз препарата. Леводопа, в настоящее время назначаемая вместе с ингибитором периферической декарбоксилазы (ИНД), остается пока самым эффективным лекарственным средством. В начале курса лечения могут возникать тошнота, рвота, поэтому пациенты предпочитают принимать их вместе с пищей или с противорвотными лекарствами — домперидоном и метоклопрамидом.
Необходимо учитывать, что большое потребление белка может мешать всасыванию леводопы.
Кроме психологических расстройств необходимо отметить и другие побочные эффекты — дискинезии или непроизвольные движения. Они бывают различными: движения языка и губ, гримасы, болезненные напряжения мышц, хореоатетоз, двигательное беспокойство. Снижение дозы препарата, как правило, уменьшает и дискинезию, однако пациенты часто предпочитают последнюю невозможности передвигаться вообще.
Другой элемент нарушений, возникающих при длительном лечении, — колебания реакции на препарат. Вначале это проявляется феноменом «выключения» — продолжительность действия леводопы-ИПД все время уменьшается. В тяжелых случаях человек внезапно переключается от движения, обычно с дискинезиями, к полной неподвижности.
 |
| Рисунок 3. Нарушение постуральных рефлексов — одна из составляющих клинического синдрома |
Для преодоления подобных проблем были разработаны формы с дозированным высвобождением препарата, позволяющие избежать колебаний концентраций лекарства в крови, и порошковые формы, обеспечивающие быстрое нарастание уровня лекарства в крови.
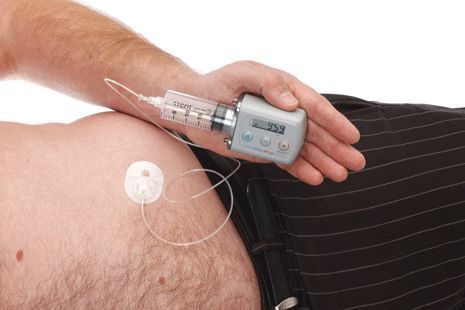
Агонисты допамина действуют на различные участки дофаминового рецептора. Соответственно разнится и их действие. Применяемые в одиночку, агонисты допамина менее эффективны, чем леводопа, но и реже приводят к колебаниям и дискинезиям [4]. Желудочно-кишечные побочные эффекты и воздействие на психику у них такие же. Апоморфин отличается от прочих упомянутых средств тем, что вводится путем инъекции.
По данным исследования, проведенного в Соединенных Штатах, селигин отсрочивает необходимость назначения леводопы, имеет нейропротекторные свойства и способен замедлять развитие болезни [7]. С тех пор, однако, было доказано, что селегилин сам по себе обладает умеренным допаминергическим эффектом, а также амфетаминоподобным и антидепрессантным воздействием; его защитные свойства в настоящее время находятся под сомнением [8].
Механизм действие селегилина — блокада моноаминоксидазы В, одного из основных ферментов допаминового метаболизма. Бытует мнение, что он потенциирует действие леводопы.
Ингибиторы катехол-о-метилтрансферазы (КОМТ) просто замедляют метаболизм допамина. По крайней мере два таких препарата уже готовятся к массовому производству [9, 10].
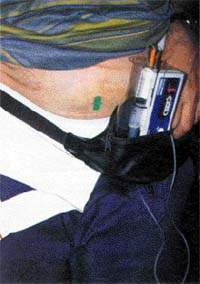 |
| Рисунок 4. Инъекции апоморфина применяют в трудно поддающихся лечению случаях |
Допаминергический эффект антивирусного препарата амантадина замечен еще много лет назад, но он менее эффективен, чем леводопы. Точный механизм его действия неизвестен, но все же его пытаются применять в случаях, резистентных к терапии леводопой; кроме того, его назначение совместно с леводопой позволяет уменьшить дозу последней.
Бесспорно, при назначении лекарственных препаратов следует учитывать возраст пациента, степень нарушений и индивидуальные особенности, однако невропатологи, как и другие специалисты, единого подхода к последовательности применения препаратов пока не разработали. Некоторые считают, что откладывать применение леводопы не имеет смысла, и начинают со стандартных схем ее использования.
Еще один подход заключается в использовании сначала пролонгированных форм, применении только дофаминового агониста или в сочетании с низкими дозами леводопы; или же назначают на какое-то время один селегилин, а затем присоединяют леводопу.
Какой бы схеме вы ни следовали, целесообразно начинать с низких доз, осторожно и постепенно подбирая необходимую дневную дозу. По возможности нужно избегать резких изменений в схеме приема или быстрого увеличения дозы.
При развитии феномена «выключения» нередко, хотя и на непродолжительное время, может оказаться полезным разделение дневной дозы препарата на несколько более мелких приемов. Можно попробовать присоединить к леводопе селегилин и/или агонист допамина, а также использовать вместо леводопы (или чаще дополнительно к ней) лекарственные формы пролонгированного действия. Биодоступность подобных форм меньше, чем у обычных препаратов, и их доза обычно несколько больше. У отдельных пациентов хороший результат дает прием препарата до, а не после еды или сокращение потребления белка.
В случаях с ярко выраженным феноменом включения-выключения используют те же приемы, в сочетании с индивидуальным подбором наиболее эффективной схемы лечения.
| Не рекомендуется устраивать длительные перерывы между приемами препаратов |
При отсутствии успеха от перорального приема препарата можно использовать такие новые методы, как подкожное введение апоморфина. Правда, для этого требуется обученный персонал, лучше всего — специальная сиделка для больных паркинсонизмом.
Другой подход — нейрохирургия. Проводят стереотоксическую паллидотомию или стимуляцию таламуса при феномене включения-выключения, а также при упорном треморе [11]. Имеющиеся на сегодняшний день данные обнадеживают. Они свидетельствуют об уменьшении дискинезии и удлинении периода включения. Однако, как и трансплантацию фетальных тканей, подобные хирургические методы пока следует считать экспериментальными, требующими дальнейшего изучения и оценки.
Кроме дискинезий и тремора, у многих пациентов при прогрессировании заболевания развиваются когнитивные и психические расстройства. При этом необходимо снижать дозу препарата.
Небольшие перерывы в приеме лекарств, отмена допаминергических препаратов на короткое время — такие «каникулы» (один-два дня каждую неделю) позволяют снизить психотоксичность [10]. Отмена препаратов на длительный срок не рекомендуется, поскольку может повлечь серьезные или даже необратимые нарушения способности двигаться.
Болезнь Паркинсона сопровождается нарушениями сна, депрессией, задержкой мочи, запорами, болями, расстройствами автономной нервной системы и сексуальными отклонениями. Все это поддается лекарственной коррекции. Просто надо дать возможность пациенту подробно описать все, что его беспокоит. Ограниченное время консультации вместе с тяжелыми проблемами общения, от которых страдают многие пациенты, могут быть преодолены посредством заранее подготовленного самим пациентом или сиделкой описания его состояния.
1. Clarke C. E. Mortality from Parkinson’s disease in England and Wales 1921-89. J. Neurol. Neurosurg Psychiatry 1993; 56:690-3.
2. Quinn N. Parkinsonism — recognition and differential diagnosis. BMJ 1995; 310:447-52.
3. Hughes A. J., Lees A. J., Stern G. M. Challenge test to predict the dopaminergic response in untreated Parkinson’s disease. Neurology 1991; 41:1723-5.
4. Marsden C. D. Parkinson’s disease. J. Neurol. Neurosurg Psychiat 1994; 57:672-81.
5. Patti F., Reggio A., Nicoletti F. et al. Effects of rehabilitation therapy on Parkinsonians’ disability and functional independence. J. Neurol. Rehab 1996; 10:223-231.
6. Doshay L. J. Method and value of physiotherapy in Parkinson’s disease. N. Eng. J. Med. 1962; 266:878-80.
7. Parkinson Study Group. Effects of tocopherol and deprenyl on the progression of disability in early Parkinson’s disease. N. Eng. J. Med. 1993; 328:176-83.
8. Jankovic J., Shoulson I., Weiner W. J. Early-stage Parkinson’s disease: to treat or not to treat. Neurology 1994; 44(suppl1):S4-S7.
9. Pouttinen H. M., Rinne U. K. A double-blind pharmocokinetic and clinical dose-response study of entacapone as an adjuvant to levadopa therapy in advanced Parkinson’s disease. Clin. Neuropharmac 1996; 19:283-96.
10. Stocchi F., Nordera G., Marsden C. D. Strategies for treating patients with advanced Parkinson’s disease with disastrous fluctuations and dyskinesias. Clin. Neuropharmac 1997; 20:95-115.
11. Obeso J. A., Guridi J., Delong M. Surgery for Parkinson’s disease. J. Neurol. Neurosurg. Psychiat 1997; 62:2-8.
Болезнь Паркинсона: как с ней справляться
Рисунок 1. Применение антихолинергических препаратов, известных с прошлого века, для снятия тремора и ригидности ограничено из-за их побочных эффектов Каковы основные диагностические критерии болезни Паркинсона? Когда пациента необходимо
 |
| Рисунок 1. Применение антихолинергических препаратов, известных с прошлого века, для снятия тремора и ригидности ограничено из-за их побочных эффектов |
Каковы основные диагностические критерии болезни Паркинсона?
Когда пациента необходимо отправить к специалисту?
С каких препаратов начать лекарственную терапию?
Каким образом устранить побочное действие специфической терапии?
Причины паркинсонизма до сих пор неизвестны, а лечение остается симптоматическим, несмотря на то, что прошло уже четверть века с тех пор, как леводопа прочно внедрилась в жизнь больных паркинсонизмом.
Но не будем слишком пессимистичны — современные методы лечения продлевают жизнь таким больным и делают ее более или менее нормальной [1]. Один человек из тысячи страдает болезнью Паркинсона. Диагноз ставится на основании клинического синдрома, включающего гипокинезию, ригидность, тремор и нарушенные рефлексы позы. Уровень допамина снижается почти на 80% к моменту появления клинических признаков, поэтому неудивительно, что невозможно точно указать время появления первых симптомов.
Далеко не всегда просто отличить идиопатическую болезнь Паркинсона от других состояний, включая такое часто встречающееся, как эссенциальный тремор, и менее распространенные заболевания, которым присущи иные неврологические симптомы — супрануклеарный паралич, автономные нарушения или мозжечковые симптомы [2].
Патолого-анатомические исследования показывают, что каждый пятый диагноз в данной группе заболеваний ошибочен. Перед тем как поставить диагноз, важно убедиться в наличии по крайней мере двух из четырех основных клинических признаков, помня при этом, что у большинства пациентов симптоматика асимметрична. В сомнительных случаях помогает пробное лечение леводопой или допаминовыми агонистами [3].
 |
| Рисунок 2. Задержка мочи часто сопровождает болезнь Паркинсона |
Основной проблемой в контролировании болезни Паркинсона на сегодняшний день остается поздняя недостаточность допаминергической терапии, проявляющаяся в исчезновении или колебаниях реакции на препарат или в развитии дискинезий и прочих побочных эффектов у 75% пациентов после пяти лет лечения [4].
Расширение спектра препаратов и вновь возросший интерес к хирургическому лечению объясняется стремлением избежать или уменьшить проблемы длительного лечения.
Врач общей практики, подозревающий у пациента болезнь Паркинсона, должен решить, к кому его направить — к невропатологу, гериатру или другим специалистам. Особенно это важно в хронических прогрессирующих случаях у молодых людей, нуждающихся в длительном лечении.
Пациенту крайне необходимо рассказать о его болезни, прогнозе и сути применяемого лечения. Как и при астме, диабете и другом хроническом заболевании, врач и пациент должны действовать сообща, при активном участии последнего в принятии решений, касающихся лечения.
Как правило, с такими пациентами легко договориться, но по мере прогрессирования заболевания их приходится уговаривать принимать различные препараты несколько раз в день.
Контроль за заболеванием не сводится лишь к лекарственной терапии, напротив, психотерапия, трудотерапия, обучение навыкам речи и психологические методы существенно улучшают состояние пациентов [5]. Регулярная физиотерапия, назначаемая до допаминергических препаратов, замедляет прогрессирование заболевания [6], поэтому сразу после установления диагноза нужно советовать пациентам физические упражнения, соблюдение диеты, трудотерапию.
Весьма часто такие методы используются на более поздних стадиях заболевания, когда ничто другое уже не помогает, в то время как их нужно использовать для предупреждения развития болезни. Общество больных болезнью Паркинсона выпускает информационные сборники для персонала больниц и специальный обучающий материал для пациентов.
В ряде центров специально обученные сиделки помогают больным и тем, кто за ними ухаживает. Несмотря на отсутствие конкретных научных данных, многие пациенты признают эффект музыкотерапии, обучения, йоги и прочих дополнительных методов лечения.
Количество доступных препаратов и их новых форм в последние десять лет значительно увеличилось и обещает еще большее увеличение в ближайшем будущем. В табл. 1 приведены основные группы препаратов.
Таблица 1. Лекарственные препараты, применяемые для лечения паркинсонизма
антихолинергические препараты
Антихолинергические средства применялись еще в прошлом веке. Они до сих пор помогают справиться с тремором и, в меньшей степени, с ригидностью, практически не влияя на гипокинезию. Выбор среди них невелик. Все они имеют побочные эффекты: сухость во рту, нарушение аккомодации, запор и задержка мочи. У пожилых пациентов они склонны вызывать спутанность сознания и прочие психиатрические нарушения.
Следует отметить, что все антипаркинсонические средства способны вызывать подобные проблемы и любое нарушение ментальной функции требует пересмотра целесообразности применения и адекватности доз препарата. Леводопа, в настоящее время назначаемая вместе с ингибитором периферической декарбоксилазы (ИНД), остается пока самым эффективным лекарственным средством. В начале курса лечения могут возникать тошнота, рвота, поэтому пациенты предпочитают принимать их вместе с пищей или с противорвотными лекарствами — домперидоном и метоклопрамидом.
Необходимо учитывать, что большое потребление белка может мешать всасыванию леводопы.
Кроме психологических расстройств необходимо отметить и другие побочные эффекты — дискинезии или непроизвольные движения. Они бывают различными: движения языка и губ, гримасы, болезненные напряжения мышц, хореоатетоз, двигательное беспокойство. Снижение дозы препарата, как правило, уменьшает и дискинезию, однако пациенты часто предпочитают последнюю невозможности передвигаться вообще.
Другой элемент нарушений, возникающих при длительном лечении, — колебания реакции на препарат. Вначале это проявляется феноменом «выключения» — продолжительность действия леводопы-ИПД все время уменьшается. В тяжелых случаях человек внезапно переключается от движения, обычно с дискинезиями, к полной неподвижности.
 |
| Рисунок 3. Нарушение постуральных рефлексов — одна из составляющих клинического синдрома |
Для преодоления подобных проблем были разработаны формы с дозированным высвобождением препарата, позволяющие избежать колебаний концентраций лекарства в крови, и порошковые формы, обеспечивающие быстрое нарастание уровня лекарства в крови.
Агонисты допамина действуют на различные участки дофаминового рецептора. Соответственно разнится и их действие. Применяемые в одиночку, агонисты допамина менее эффективны, чем леводопа, но и реже приводят к колебаниям и дискинезиям [4]. Желудочно-кишечные побочные эффекты и воздействие на психику у них такие же. Апоморфин отличается от прочих упомянутых средств тем, что вводится путем инъекции.
По данным исследования, проведенного в Соединенных Штатах, селигин отсрочивает необходимость назначения леводопы, имеет нейропротекторные свойства и способен замедлять развитие болезни [7]. С тех пор, однако, было доказано, что селегилин сам по себе обладает умеренным допаминергическим эффектом, а также амфетаминоподобным и антидепрессантным воздействием; его защитные свойства в настоящее время находятся под сомнением [8].
Механизм действие селегилина — блокада моноаминоксидазы В, одного из основных ферментов допаминового метаболизма. Бытует мнение, что он потенциирует действие леводопы.
Ингибиторы катехол-о-метилтрансферазы (КОМТ) просто замедляют метаболизм допамина. По крайней мере два таких препарата уже готовятся к массовому производству [9, 10].
 |
| Рисунок 4. Инъекции апоморфина применяют в трудно поддающихся лечению случаях |
Допаминергический эффект антивирусного препарата амантадина замечен еще много лет назад, но он менее эффективен, чем леводопы. Точный механизм его действия неизвестен, но все же его пытаются применять в случаях, резистентных к терапии леводопой; кроме того, его назначение совместно с леводопой позволяет уменьшить дозу последней.
Бесспорно, при назначении лекарственных препаратов следует учитывать возраст пациента, степень нарушений и индивидуальные особенности, однако невропатологи, как и другие специалисты, единого подхода к последовательности применения препаратов пока не разработали. Некоторые считают, что откладывать применение леводопы не имеет смысла, и начинают со стандартных схем ее использования.
Еще один подход заключается в использовании сначала пролонгированных форм, применении только дофаминового агониста или в сочетании с низкими дозами леводопы; или же назначают на какое-то время один селегилин, а затем присоединяют леводопу.
Какой бы схеме вы ни следовали, целесообразно начинать с низких доз, осторожно и постепенно подбирая необходимую дневную дозу. По возможности нужно избегать резких изменений в схеме приема или быстрого увеличения дозы.
При развитии феномена «выключения» нередко, хотя и на непродолжительное время, может оказаться полезным разделение дневной дозы препарата на несколько более мелких приемов. Можно попробовать присоединить к леводопе селегилин и/или агонист допамина, а также использовать вместо леводопы (или чаще дополнительно к ней) лекарственные формы пролонгированного действия. Биодоступность подобных форм меньше, чем у обычных препаратов, и их доза обычно несколько больше. У отдельных пациентов хороший результат дает прием препарата до, а не после еды или сокращение потребления белка.
В случаях с ярко выраженным феноменом включения-выключения используют те же приемы, в сочетании с индивидуальным подбором наиболее эффективной схемы лечения.
| Не рекомендуется устраивать длительные перерывы между приемами препаратов |
При отсутствии успеха от перорального приема препарата можно использовать такие новые методы, как подкожное введение апоморфина. Правда, для этого требуется обученный персонал, лучше всего — специальная сиделка для больных паркинсонизмом.
Другой подход — нейрохирургия. Проводят стереотоксическую паллидотомию или стимуляцию таламуса при феномене включения-выключения, а также при упорном треморе [11]. Имеющиеся на сегодняшний день данные обнадеживают. Они свидетельствуют об уменьшении дискинезии и удлинении периода включения. Однако, как и трансплантацию фетальных тканей, подобные хирургические методы пока следует считать экспериментальными, требующими дальнейшего изучения и оценки.
Кроме дискинезий и тремора, у многих пациентов при прогрессировании заболевания развиваются когнитивные и психические расстройства. При этом необходимо снижать дозу препарата.
Небольшие перерывы в приеме лекарств, отмена допаминергических препаратов на короткое время — такие «каникулы» (один-два дня каждую неделю) позволяют снизить психотоксичность [10]. Отмена препаратов на длительный срок не рекомендуется, поскольку может повлечь серьезные или даже необратимые нарушения способности двигаться.
Болезнь Паркинсона сопровождается нарушениями сна, депрессией, задержкой мочи, запорами, болями, расстройствами автономной нервной системы и сексуальными отклонениями. Все это поддается лекарственной коррекции. Просто надо дать возможность пациенту подробно описать все, что его беспокоит. Ограниченное время консультации вместе с тяжелыми проблемами общения, от которых страдают многие пациенты, могут быть преодолены посредством заранее подготовленного самим пациентом или сиделкой описания его состояния.
1. Clarke C. E. Mortality from Parkinson’s disease in England and Wales 1921-89. J. Neurol. Neurosurg Psychiatry 1993; 56:690-3.
2. Quinn N. Parkinsonism — recognition and differential diagnosis. BMJ 1995; 310:447-52.
3. Hughes A. J., Lees A. J., Stern G. M. Challenge test to predict the dopaminergic response in untreated Parkinson’s disease. Neurology 1991; 41:1723-5.
4. Marsden C. D. Parkinson’s disease. J. Neurol. Neurosurg Psychiat 1994; 57:672-81.
5. Patti F., Reggio A., Nicoletti F. et al. Effects of rehabilitation therapy on Parkinsonians’ disability and functional independence. J. Neurol. Rehab 1996; 10:223-231.
6. Doshay L. J. Method and value of physiotherapy in Parkinson’s disease. N. Eng. J. Med. 1962; 266:878-80.
7. Parkinson Study Group. Effects of tocopherol and deprenyl on the progression of disability in early Parkinson’s disease. N. Eng. J. Med. 1993; 328:176-83.
8. Jankovic J., Shoulson I., Weiner W. J. Early-stage Parkinson’s disease: to treat or not to treat. Neurology 1994; 44(suppl1):S4-S7.
9. Pouttinen H. M., Rinne U. K. A double-blind pharmocokinetic and clinical dose-response study of entacapone as an adjuvant to levadopa therapy in advanced Parkinson’s disease. Clin. Neuropharmac 1996; 19:283-96.
10. Stocchi F., Nordera G., Marsden C. D. Strategies for treating patients with advanced Parkinson’s disease with disastrous fluctuations and dyskinesias. Clin. Neuropharmac 1997; 20:95-115.
11. Obeso J. A., Guridi J., Delong M. Surgery for Parkinson’s disease. J. Neurol. Neurosurg. Psychiat 1997; 62:2-8.
Болезнь Паркинсона
Болезнь Паркинсона – это хроническое дегенеративное заболевание нервной системы, сопровождающееся дрожанием рук и ног, обеднением движений и постепенным замедлением мыслительных процессов, и депрессией. Правильно подобранное и своевременно назначенное лечение способно затормозить патологический процесс и продлить жизнь пациента.
Общая информация
Болезнь Паркинсона вдвое чаще поражает мужчин, чем женщин. В большинстве случаев она развивается после 60 лет, но регистрируются случаи раннего начала заболевания (в 30-40 лет), а также ювенильные формы, развивающиеся у двадцатилетних людей.
Существует несколько гипотез формирования патологии. В настоящее время точно доказано, что одним из механизмов ее развития является постепенная дегенерация нейронов и снижение выработки дофамина. Это важный нейромедиатор, участвующий в передаче нервных импульсов. В результате формируется специфический комплекс нарушений, который позволяет легко поставить диагноз.
Причины
Точные причины возникновения болезни Паркинсона не выявлены. Ученые смогли определить лишь ряд факторов, повышающих риск развития нейродегенеративных процессов:
Симптомы
Болезнь Паркинсона проявляется специфическими признаками, которые в комплексе составляют четкую картину заболевания:
В отличие от других нейродегенеративных заболеваний, болезнь Паркинсона почти не влияет на интеллект на ранней и средней стадии развития. По мере прогрессирования патологии отмечается снижение скорости мышления и разговора, снижение настроения, депрессия и безучастность ко всему происходящему.
Формы болезни
В зависимости от преобладающей симптоматики, выделяют три формы болезни Паркинсона:
Стадии развития
В настоящее время врачи выделяют 5 стадий болезни Паркинсона, проявляющиеся определенным комплексом симптомов:
Диагностика
Диагноз болезни Паркинсона ставится на основании характерной клинической картины. Пациента осматривает невролог, который отмечает типичные признаки. В обязательном порядке уточняются жалобы, собирается анамнез заболевания (история появления признаков) и жизни (сведения о перенесенных травмах, хронических заболеваниях, хирургических вмешательствах). Лабораторная и инструментальная диагностика используется для уточнения сопутствующей патологии и исключения других причин неврологических нарушений.
Лечение болезни Паркинсона
В настоящий момент успешно подобранное лечение болезни Паркинсона может приостановить процесс деградации и снизить выраженность патологической симптоматики. Болезнь начинает прогрессировать медленнее, что позволяет пациентам дольше оставаться в хорошей форме.
Медикаментозное лечение
Медикаментозное лечение направлено на восстановление баланса дофамина в центральной нервной системе. Используются следующие препараты:
Существуют комбинированные средства, сочетающие несколько действующих веществ для максимально быстрого эффекта.
Немедикаментозное лечение
Медикаментозное лечение дополняется физиотерапией, ЛФК и массажем. Физиотерапия используется для активации процессов метаболизма и усиления кровотока в головном мозге. В зависимости от состояния пациента и сопутствующих заболеваний могут быть назначены:
Массаж направлен на улучшение двигательной активности. Интенсивное разминание мускулатуры и пассивная гимнастика снижает ригидность мышц и обладает общеукрепляющим действием.
Упражнения лечебной физкультуры позволяют:
Большинство упражнений направлены на тренировку чувства равновесия. Комплекс подбирается индивидуально в зависимости от состояния пациента, его возраста и сопутствующих заболеваний.
Хирургическое лечение
Помощь хирургов актуальна на последних стадиях развития заболевания. Наиболее эффективной и безопасной операцией является установка стимулятора головного мозга. Вмешательство не требует вскрытия черепной коробки. В мозг вводятся тонкие электроды, а под кожу ключицы помещается небольшой стимулятор. Прибор программируется на определенную частоту импульсов, кроме того, больной и его родственники могут менять настройки в зависимости от состояния. Использование стимулятора позволяет сократить дозировку препаратов и длительное время держать симптоматику под контролем.
Другие варианты хирургического лечения требуют работы на открытом мозге:
Осложнения
Ограничение работы мускулатуры при болезни Паркинсона неизбежно приводит к уменьшению интенсивности кровотока и снижению уровня обмена веществ. Уже на средних стадиях развития заболевания значительно повышается риск образования тромбов и развития опасных состояний:
Прикованные к постели пациенты нередко сталкиваются с тяжелыми осложнениями, связанные с лежачим положением:
Правильно подобранное лечение значительно снижает риск развития осложнений, вот почему важно своевременно обратиться к врачу.
Профилактика
Профилактика болезни Паркинсона включает:
Лечение в клинике «Энергия здоровья»
Неврологи клиники «Энергия здоровья» придут на помощь при любой стадии болезни Паркинсона. Мы предлагаем комплексное лечение в соответствии с современными стандартами:
Преимущества клиники
Болезнь Паркинсона начинается очень медленно, но остановить этот процесс практически невозможно. Если у Вас или Ваших родных появились подозрительные признаки, не затягивайте с обращением к врачу. Запишитесь на диагностику в клинику «Энергия здоровья».
Стандарты лечения болезни Паркинсона
Статья основана на положениях «Протокола ведения пациентов с болезнью Паркинсона», разработанного группой экспертов, в которую вошли ведущие отечественные специалисты по болезни Паркинсона (БП), и утвержденного Минздравсоцразвития РФ в 2005 г. Положения Протокола основаны на анализе в соответствии с принципами доказательной медицины контролируемых исследований, проведенных в нашей стране и за рубежом [1, 2, 4–7, 9–11, 13, 15], и в целом соответствуют недавно опубликованным рекомендациям по лечению БП Европейской федерации неврологических обществ [8] и Американской академии неврологии [12, 14, 16]. Текст Протокола опубликован в журнале «Проблемы стандартизации в здравоохранении» [3]. В Протоколе используется следующая шкала убедительности доказательств данных: А — доказательства убедительны (есть веские доказательства предлагаемому утверждению), B — относительная убедительность доказательств (есть достаточно доказательств в пользу того, чтобы рекомендовать данное предложение), C — достаточных доказательств нет (имеющиеся доказательства недостаточны для вынесения рекомендаций, но они могут быть даны с учетом иных обстоятельств).
Начальный этап лечения
Общие принципы. Поскольку на данный момент нейропротекторный потенциал ни одного средства при БП убедительно не доказан, лечение основывается главным образом на симптоматическом действии противопаркинсонических средств, которые принято назначать в том случае, когда хотя бы одно из проявлений заболевания приводит к ограничению жизнедеятельности пациента.
Лечение начинается с монотерапии. Если препарат оказался неэффективным (нет регресса симптоматики в течение месяца после достижения оптимальной дозы) или плохо переносится, его заменяют средством той же или другой фармакологической группы. При выборе препарата и его дозы следует стремиться не к полному устранению симптомов, а к существенному улучшению функций, позволяющему поддерживать бытовую и профессиональную активность. При частичном эффекте (недостаточное улучшение функций) к принимаемому препарату последовательно добавляют лекарственные средства иной фармакологической группы.
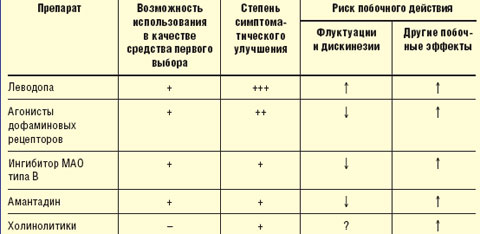
Принципы выбора противопаркинсонического препарата. Выбор препарата на начальном этапе лечения проводят с учетом возраста, выраженности двигательного дефекта, трудового статуса, состояния нейропсихологических функций, наличия сопутствующих соматических заболеваний, индивидуальной чувствительности пациента. Помимо достижения оптимального симптоматического контроля, выбор препарата определяется необходимостью отсрочить момент развития моторных флуктуаций и дискинезий (табл.).
 |
| Таблица Выбор препарата для начального лечения болезни Паркинсона |
У лиц моложе 50 лет при умеренной выраженности двигательных нарушений в отсутствие выраженных когнитивных нарушений назначают один из следующих препаратов: агонист дофаминовых рецепторов, ингибитор моноаминооксидазы (МАО) типа В (селегилин), амантадин, антихолинергические средства (тригексифенидил, бипериден).
Лечение предпочтительнее начинать с одного из агонистов дофаминовых рецепторов, которые хотя и не позволяют достичь того же уровня симптоматического контроля, как препараты леводопы, способны обеспечить поддержание уровня жизнедеятельности пациентов в течение длительного времени, отсрочить назначение леводопы и тем самым развитие осложнений долгосрочной терапии леводопой (уровень А). Индивидуальную эффективную дозу препаратов подбирают путем медленного титрования, стремясь получить адекватный эффект, необходимый для продолжения профессиональной деятельности, и избежать побочного действия (уровень С). Неэрголиновые агонисты (пирибедил, прамипексол) ввиду более благоприятного профиля побочных эффектов предпочтительнее, чем эрголиновые (бромокриптин).
Лечение пирибедилом начинают с дозы 50 мг 1 раз в день (днем или вечером — после основного приема пищи), в дальнейшем суточную дозу увеличивают на 50 мг 1–2 раза в неделю — до достижения необходимого эффекта, но не выше 250 мг/сут (50 мг 5 раз в день). Лечение прамипексолом начинают с дозы 0,125 мг 3 раза в день (после еды), затем еженедельно дозу последовательно увеличивают до 0,25 мг 3 раза в день, 0,5 мг 3 раза в день, при недостаточном эффекте — до 1 мг 3 раза в день и 1,5 мг 3 раза в день (максимальная доза — 4,5 мг/сут). Лечение бромокриптином начинают с дозы 2,5 мг 3 раза в день, в дальнейшем ее еженедельно последовательно увеличивают до 5 мг 3 раза в день, 7,5 мг 3 раза в день, 10 мг 3 раза в день, 10 мг 4 раза в день (максимальная доза — 40 мг/сут). При появлении тошноты в период титрования назначают домперидон. При неэффективности или плохой переносимости одного из агонистов дофаминовых рецепторов может быть испробован другой агонист дофаминовых рецепторов или препарат другой фармакологической группы (уровень С).
Антихолинергические средства показаны при наличии выраженного тремора покоя и сохранности нейропсихологических функций (уровень С). Хотя у этой категории лиц они могут применяться в качестве средств первого выбора, более целесообразно их добавление к агонисту дофаминовых рецепторов, если последний не обеспечивает достаточного подавления тремора. Лечение тригексифенидилом начинают с дозы 1 мг 2 раза в день, в дальнейшем дозу не чаще чем 1 раз в неделю последовательно увеличивают до 2 мг 2 раза в день, 2 мг 3 раза в день, 2 мг 4 раза в день (максимальная доза — 10 мг/сут). Лечение бипериденом начинают с дозы 1 мг 2 раза в день, в дальнейшем дозу не чаще чем 1 раз в неделю последовательно увеличивают до 2 мг 2 раза в день, 2 мг 3 раза в день, 2 мг 4 раза в день (максимальная доза — 10 мг/сут).
Лечение амантадином начинают с дозы 100 мг 2 раза в день, при недостаточном эффекте она может быть увеличена до 100 мг 3 раза в день, в дальнейшем — до 100 мг 4–5 раз в день (максимальная доза — 500 мг/сут). Лечение селегилином начинают с дозы 5 мг утром, через 1 нед ее увеличивают до 5 мг 2 раза в день.
Если указанные препараты и их комбинация в максимально переносимых дозах не обеспечивают адекватного состояния двигательных функций и социальной адаптации больных, назначают препарат, содержащий леводопу (стандартный препарат или препарат с замедленным высвобождением) в минимальной эффективной дозе (уровень А).
У лиц в возрасте 50–70 лет при умеренном двигательном дефекте и относительной сохранности нейропсихологических функций лечение начинают с одного из агонистов дофаминовых рецепторов. Если максимальные переносимые дозы одного из этих препаратов не обеспечивают достаточного функционального улучшения, к нему последовательно добавляют по указанным выше схемам один из следующих препаратов: селегилин, амантадин или холинолитик (при наличии тремора покоя). Больным после 65 лет тригексифенидил и другие антихолинергические средства не следует назначать из-за риска ухудшения познавательных функций и других побочных эффектов (уровень В). При недостаточной эффективности к комбинации из двух-трех указанных выше препаратов добавляют средство, содержащее леводопу, в минимальной эффективной дозе (200–400 мг/сут).
У лиц в возрасте 50–70 лет при выраженном двигательном дефекте, ограничивающем трудоспособность и/или возможность самообслуживания, а также при наличии выраженных когнитивных нарушений и необходимости получения быстрого эффекта, лечение начинают с препаратов, содержащих леводопу. Для лечения могут быть использованы как стандартные препараты, так и препараты с замедленным высвобождением. Если небольшие дозы леводопы (200–400 мг/сут) не обеспечивают необходимого улучшения, к ним последовательно добавляют по указанным выше схемам следующие препараты: агонист дофаминовых рецепторов, амантадин, селегилин.
У лиц старше 70 лет лечение следует начинать со средств, содержащих леводопу. Для лечения могут применяться как стандартные препараты, содержащие леводопу, так и препараты с замедленным высвобождением (уровень В).
Другие меры. Поскольку дофаминергические препараты у больных с глаукомой могут повысить внутриглазное давление, перед их назначением у всех пациентов старше 40 лет следует измерить внутриглазное давление. В дальнейшем его измерение проводят после подбора противопаркинсонической терапии (обычно на втором месяце лечения) либо при появлении жалоб на ухудшение зрения. Больным с запорами и другими проявлениями нарушения моторики желудочно-кишечного тракта показана диета с высоким содержанием пищевых волокон (уровень С); при снижении массы тела показана диета с повышенным содержанием белковых продуктов, а также продуктов, богатых витаминами и микроэлементами (уровень С); для подбора диеты назначается консультация врача-диетолога.
При ограничении подвижности и наличии скелетно-мышечных болей показано проведение лечебной физкультуры, включающей упражнение на растяжение мышц, поддержание гибкости и тренировку координации движений (уровень С), физиотерапии (уровень С), рефлексотерапии (уровень С); в связи с этим назначаются консультации врача лечебной физкультуры, физиотерапевта, рефлексотерапевта. Больному рекомендуется посильная двигательная активность с ежедневными занятиями лечебной гимнастикой, по показаниям — занятия с логопедом. В зависимости от тяжести двигательных расстройств больной может продолжать прежнюю работу, перейти на более легкую, изменить условия работы (неполный рабочий день). При стойкой утрате трудоспособности больному определяется группа инвалидности (вопросы трудоспособности определяются МСЭК).
Алгоритм лечения БП представлен на рисунке.
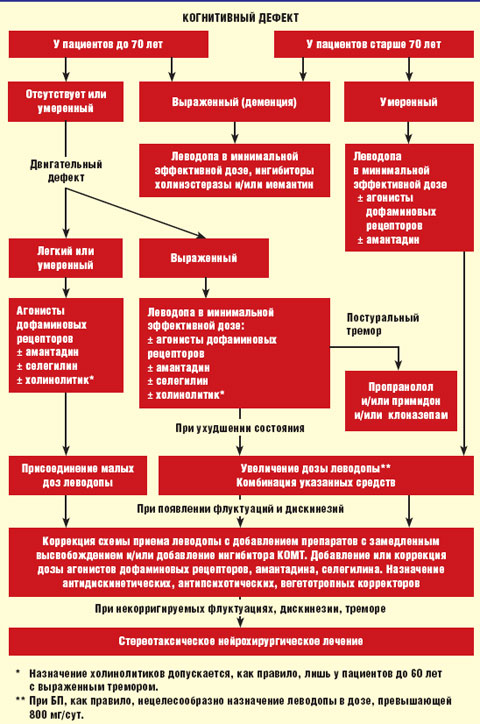 |
| Рисунок. Алгоритм лечения болезни Паркинсона |
Дальнейшая терапия при стабильной реакции на противопаркинсонические средства
Общие принципы лечения. Индивидуальную эффективную дозу препаратов подбирают путем медленного титрования, стремясь получить адекватный эффект, необходимый для продолжения профессиональной деятельности или поддержания повседневной активности, и избежать побочного действия. При необходимости для усиления эффекта противопаркинсонической терапии проводятся следующие мероприятия.
Особенности лечения больных с тремором. При выраженном дрожательном гиперкинезе, нарушающем функции конечностей, особенно если он имеет постурально-кинетический компонент, к противопаркинсоническим средствам при отсутствии противопоказаний добавляют пропранолол (уровень В). Лечение пропранололом начинают с дозы 10 мг 3 раза в день. В дальнейшем дозу последовательно увеличивают не чаще чем 1 раз в неделю до 20 мг 3 раза в день, 40 мг 3 раза в день, 40 мг 4 раза в день (максимально до 320 мг/сут в 3–4 приема). При наличии противопоказаний к применению пропранолола (брадиаритмия, сахарный диабет, заболевания периферических сосудов), непереносимости или неэффективности препарата назначают примидон (уровень С). Первоначально препарат назначают в дозе 31,25 мг на ночь, затем дозу последовательно увеличивают 1 раз в 7–10 дней до 62,5 мг на ночь, 125 мг на ночь, 250 мг на ночь (максимально до 750 мг/сут в 2–4 приема или однократно на ночь).
Если пропранолол вызвал недостаточное улучшение, то к нему добавляют примидон в указанных дозах (уровень С). Клоназепам может быть добавлен к пропранололу или примидону при наличии выраженного кинетического компонента тремора (уровень С). Клоназепам первоначально назначают в дозе 0,5 мг на ночь, затем 1 раз в 7–10 дней дозу последовательно увеличивают до 0,5 мг 2 раза в день, 1 мг 2 раза в день, 2 мг 2 раза в день, пока не будет достигнуто существенное ослабление дрожания. При выраженном треморе может быть также использован клозапин в дозе 12,5–50 мг/сут (уровень В).
Особенности лечения больных с аффективными нарушениями. При наличии аффективных нарушений назначается консультация врача-психотерапевта для решения вопроса о целесообразности проведения аутогенной тренировки или других методов психотерапии. При наличии депрессии у больных без выраженных нарушений познавательных функций лечение следует начинать с одного из агонистов дофаминовых рецепторов (прамипексол, пирибедил), способных корригировать легкую депрессивную симптоматику, или их сочетания с малыми дозами леводопы (уровень В). При выраженной депрессивной симптоматике после консультации с психиатром показано назначение одного из следующих антидепрессантов: амитриптилин (25–150 мг на ночь), имипрамин (50–150 мг/сут), циталопрам (20–40 мг/сут), флуоксетин (20–40 мг/сут), сертралин (50–100 мг/сут), пароксетин (10–20 мг/сут), миртазапин (7,5–30 мг/сут), венлафаксин (75–225 мг/сут). После получения лечебного эффекта продолжительность назначения антидепрессанта в эффективной дозе должна быть не менее 6 мес (уровень С).
Продолжение читайте в следующем номере.
О. С. Левин, доктор медицинских наук, профессор
РМАПО, Центр экстрапирамидных заболеваний, Москва