Чем лечится эта болезнь
Современные представления о периодической болезни и клинические рекомендации по диагностике и лечению
В статье представлены современные сведения о патогенезе, клинических проявлениях, диагностике и лечении периодической болезни. Обсуждаются клинические и лабораторные методы оценки активности заболевания и подходы к лечению больных, резистентных к колхицину, на основе подавления эффектов интерлейкина-1.
Периодическая болезнь (ПБ), более известная в англоязычной литературе под названием Средиземноморская лихорадка, является древнейшим заболеванием. Первые наблюдения ПБ были описаны еще на закате средневековья. Так, H. Reimann указывает, что в 1629 г. Aubrey сообщил о своем страдании, которое проявлялось ознобом, тошнотой, рвотой, болями в животе, длящимися до полусуток и возникающими сначала каждые 2 недели, позже ежемесячно, один раз в 3 месяца, один раз в полгода [1].
Как самостоятельная нозологическая единица ПБ была выделена только в середине ХХ столетия. В 1948 г. H. Reimann на основании 6 наблюдений объединил общим термином “периодическая болезнь” ряд синдромов, включающих периодическую лихорадку, доброкачественный пароксизмальный перитонит, циклическую нейтропению и перемежающуюся артралгию [2]. Основными критериями считали периодичность и доброкачественность течения. По этой причине понятие “периодическая болезнь” стало очень широким. Благодаря работам E. S):1–112. ohar и соавт. (1967) [3], а в нашей стране – О.М. Виноградовой (1964, 1973) [4], В.А. Аствацатрян и соавт. [5] клиническая картина ПБ была очерчена более отчетливо. После открытия гена MEFV, мутации которого приводят к развитию клинических проявлений ПБ, были сформулированы окончательные критерии ПБ.
Тем не менее, сохраняет актуальность выделение особого обобщающего термина для всех периодических синдромов, клинические проявления и принципы диагностики которых сходны. Учитывая их наследственный характер, широко применяется термин семейные периодические лихорадки, которые, помимо ПБ, включают в себя криопиринопатии (семейная холодовая крапивница, синдром Макла-Уэллса, NOMID-CINCA синдром), гипериммуноглобулинемию D (дефицит мевалонаткиназы), TRAPS):1–112. (синдром, обусловленный мутацией гена рецептора к фактору некроза опухоли [ФНО]-α) и некоторые другие. Все эти заболевания характеризуются беспричинно повторяющимися приступами лихорадки в сочетании с воспалением кожи, серозных оболочек и суставов [4]. В основе патогенеза ведущую роль играют генетически детерминированные нарушения врожденного иммунитета, а механизмы специфического иммунитета – гуморального, связанного с синтезом аутоантител, и Т-клеточного, не имеют значения [5].
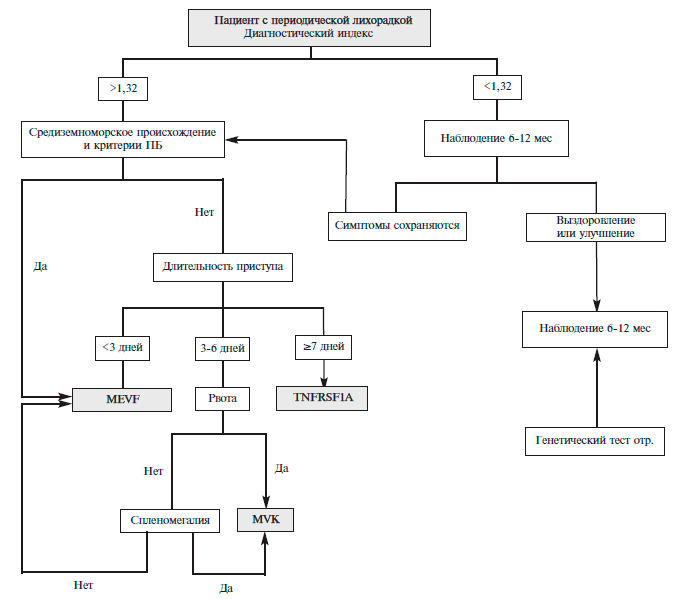
Клиническое предположение о наличии этих синдромов может возникать преимущественно у молодых пациентов с приступами болей в животе, грудной клетке в сочетании с афтозным стоматитом, диареей при наличии подобных признаков у родственников (табл. 1) [8]. Для оценки риска семейных периодических лихорадок предложен специальный индекс [9], автоматизированный расчет которого, предлагается на сайте Eurofever Project (https://www.printo.it/eurofever/index. asp). Паци ен там с высоким риском следует проводить генетическое тестирование для исключения семейных периодических лихорадок. У выходцев из Средиземно морья и Кавказа с непродолжительными приступами (менее 3 дней) в первую очередь следует исключать ПБ, у остальных пациентов с длительностью приступов до недели и эпизодами рвоты следует думать о дефиците мавалонаткиназы с развитием гипериммуноглобулинемии D, приступы длительностью более недели являются основанием для исключения TRAPS):1–112. (рис. 1). У пациентов с низким риском предлагается наблюдение за течением болезни с последующим повторным обсуждением показаний к генетическому исследованию на семейные периодические лихорадки.
Эпидемиология периодической болезни
Одним из признаков наследственной природы ПБ является этноассоциированный характер болезни – ее широкое распространение у народов, проживающих в бассейне Средиземного моря – армян, евреев-сефардов и, реже, арабов, турков, была показана разными авторами на больших группах больных. По данным О.М. Ви но градовой лица других национальностей среди больных ПБ встречались лишь в 2% случаев [4]. Среди 86 носителей гена ПБ, наблюдавшихся J. S):1–112. amuels и соавт. [10], необычно высоким было число итальянцев и евреев-ашкенази. Однако и в этой группе 96% пациентов оказались представителями средиземноморской популяции. В группе из 150 больных ПБ, обследованных О.М. Виноградовой [4], 88,6% составили армяне. В последние годы эту болезнь на территории России широко диагностируют у азербайджанцев, представителей разных народов Северного Кавказа, имеются также отдельные наблюдения ПБ среди русских и украинцев, преимущественно жителей южных регионов России. Болезнь наследуется по аутосомно-рецессивному пути. Это означает, что у родителей симптомы заболевания обычно отсутствуют, однако в больших семьях болезнь может проявиться у родных или двоюродных братьев/ сестер, дяди или дальнего родственника.
Ген, ответственный за ПБ, был клонирован в 1997 году и обозначен аббревиатурой MEFV (MEditerranean FEver) [11,12], в том же году были идентифицированы 8 основных мутаций гена. Ген MEFV располагается на коротком плече 16 хромосомы центромерно к гену гемоглобина- α, рядом с генами, ответственными за аутосомно-доминантный поликистоз почек и туберозный склероз 14. Показано, что среди евреев-сефардов, выходцев из Испании, частота носительства MEFV составляет от 1:16 до 1:8 (при распространенности ПБ в этой популяции от 1:250 до 1:1000) [15]. Частота носительства среди евреев-ашкенази Южной Европы почти на 2 порядка ниже – 1:135 (при распространенности ПБ 1:73000). Частота носительства среди американских армян составляет 1:7 [16].
Причина сохранения в современной средиземноморской популяции высокой частоты носительства MEFV остается неясной, однако сочетание ее с многочисленностью аллелей MEFV может свидетельствовать в пользу благоприятных условий для естественного отбора гетерозигот-носителей этих аллелей, по аналогии с распространенностью гена серповидноклеточной анемии в эндемичных очагах малярии.
Клиническая картина и диагноз
Продуктом MEFV является белок пирин, или маренострин (от латинского Mare Nostrum – Средиземное море) [11,12]. Одним из отличительных свойств пирина является наличие В30.2-домена. Кроме того, в молекуле пирина обнаружены 2 локуса потенциального связывания с ядром, а α-спиральный и В-box-домены могут обеспечивать взаимодействие с другими белками. Все выявленные в настоящее время мутации, ассоциирующиеся с ПБ, касаются изменений в В30.2-зоне пирина.
Экспрессия MEFV происходит почти исключительно в гранулоцитах и не наблюдается в лимфоцитах и моноцитах [11]. Не обнаруживают экспрессию гена и в других тканях. Согласно основной в настоящее время рабочей гипотезе пирин является базовым регулятором воспалительного ответа нейтрофилов. Соответ ственно, структурные изменения в молекуле пирина могут изменить функцию контроля и способствовать постоянному провоспалительному потенциалу нейтрофилов.
Немутантный пирин ингибирует адапторный белок AS):1–112. C, который кроме участия в апоптозе формирует ядро инфламмасомного комплекса путем гомотипического взаимодействия с белком NLRP и каспазой, что ведет к активации интерлейкина (ИЛ)-1 β. Инфламма сома – макромолекулярная платформа в цитоплазме, устойчивая к внутриклеточным механизмам деградации белков и, в силу этого, способная обеспечить реализацию провоспалительной активности клетки. Суще ствует несколько разновидностей инфламмасом. При ПБ и других семейных периодических лихорадках основное значение придают инфламмасоме на основе белка NLRP3 – криопирина. В качестве основной причины развития ПБ рассматривают утрату ингибиторного эффекта мутантного пирина на AS):1–112. C и, как следствие, активацию каспазы-1 [17], либо формирование пирином собственной инфламмасомы [18]. Однако роль мутаций домена B30.2 в развитии ПБ остается спорной; возможно, пирин может проявлять как про-,так и противовоспалительные свойства в зависимости от конкретных условий. Значение мутантного пирина в усилении секреции ИЛ-1 β при ПБ подтверждается купированием приступа ПБ при парентеральном введении ингибиторов ИЛ-1 [19].
Таким образом, в настоящее время несомненным диагностическим критерием ПБ является выявление гомозиготного носительства мутаций пирина. Однако у 20% больных клинические признаки ПБ развиваются при наличии только одной мутации. У таких пациентов сохраняют диагностическое значение клинические критерии болезни, в частности эффективность колхицина. Окончательный диагноз в этом случае может быть установлен только через 6-12 месяцев наблюдения за эффектом колхицина.
Важное значение имеет осмотр пациента во время периодических приступов заболевания, которые проявляются лихорадкой в сочетании с абдоминалгиями, торакалгиями, артралгиями и другими, более редкими, проявлениями. Указанные проявления могут возникать в различных сочетаниях или с разной периодичностью, обычно выделяют абдоминальный, торакальный, лихорадочный, реже суставной варианты ПБ.
Болезнь возникает преимущественно в детском или юношеском возрасте, чаще у мужчин, и характеризуется хроническим течением с обострениями и ремиссиями, возникающими от разнообразных причин и через различные сроки. Между приступами болезненные проявления отсутствуют, а во время приступа болезни многие пациенты сохраняют работоспособность. Приступы продолжаются от 12 ч до 3 суток, а затем самостоятельно разрешаются. Продолжительность межприступного периода у одного и того же пациента составляет от нескольких дней до нескольких месяцев, иногда приступы следуют один за другим с промежутками в 1-3 дня, но возможны и длительные ремиссии до нескольких лет. Характерный признак болезни, имеющий диагностическое значение, – стереотипность приступов. Пациенту, как правило, без труда удается отличить боль и лихорадку, вызванные приступом болезни, от подобных симптомов другого генеза.
Лихорадка, которая у нелеченных больных, как правило, достигает высоких значений и сопровождается потрясающими ознобами, является практически постоянным симптомом приступа. Выделение особой лихорадочной формы болезни обосновывается тем, что другие симптомы, включая абдоминалгии, встречаются реже. Однако В.М. Арутюнян и соавт. полагают, что острый асептический серозит, хотя бы и кратковременный, является облигатным проявлением болезни, в связи с чем нецелесообразно расширять классификацию болезни за счет лихорадочной и суставной форм, а достаточно ограничиться тремя формами – абдоминальной, торакальной и смешанной [20].
Абдоминальный вариант наблюдается у 91% больных [11,12]. В основе абдоминального варианта ПБ лежит рецидивирующее доброкачественное воспаление серозной оболочки брюшной полости с преобладанием экссудативной реакции над пролиферативной, что подтверждается малым количеством спаек, несмотря на частоту приступов. В воспалительный процесс вовлекаются брыжейка, серозная оболочка кишки, печени, селезенки, диафрагмы. Абдоминалгии обычно сопровождаются симптомами раздражения брюшины и вялой перистальтикой, что наряду с лихорадкой и лейкоцитозом периферической крови создает существенные дифференциально-диагностические сложности и ведет к необоснованной лапаротомии.
Торакальный вариант, в основе которого лежит асептический плеврит, наблюдается у 57% пациентов [11, 12]. При рентгеноскопии грудной клетки во время приступа отмечают ограничение подвижности купола диафрагмы, небольшой выпот в синусе над диафрагмой, реже дисковидные ателектазы, все эти явления затем полностью исчезают, но у трети больных возникают спайки.
Артрит и артралгии развиваются у 45% больных [11,12], очень редко как единственное проявление болезни. Суставные проявления имеют характер летучих артралгий, моноартрита, реже полиартрита, чаще вовлекаются коленные и голеностопные суставы. По окончании приступа эти явления полностью исчезают, не оставляя пролиферативных изменений. Ревматоид ный фактор, антистрептококковые антитела не определяются.
Редко (13%) встречается рожеподобная эритема в виде болезненных плотноватых пятен диаметром 10-15 см обычно в области голеностопных суставов [11,12].
Самым тяжелым осложнением является АА-амилоидоз, строящийся из циркулирующего белка-предшественника S):1–112. AA, близкого С-реактивному белку. Частота амилоидоза значительно отличается по данным разных авторов. О.М. Виноградова на примере популяции бывшего СССР указывает частоту амилоидоза 41,3%. Аме риканские авторы, обследовавшие популяцию армян, проживающих в США, сообщают о низкой частоте амилоидоза – 2% [8,21]. В любом случае, прогноз болезни определяется наличием и тяжестью амилоидоза. Клинические проявления амилоидоза характерны для АА-типа, при котором основным органом-мишенью являются почки. В течении амилоидной нефропатии обычно удается выделить три стадии – протеинурическую, нефротическую и стадию почечной недостаточности. Особенностью амилоидоза является сохранение высокой протеинурии на стадии хронической почечной недостаточности [22]. Нелеченный ААамилоидоз в рамках ПБ обычно прогрессирует быстрее, чем при других воспалительных заболеваниях: 5- и 10летняя выживаемость составляет соответственно 48% и 24%, соответственно, а при вторичном АА-амилоидозе другой этиологии – 77% и 44% [23].
Широко распространено мнение о наследственном характере амилоидоза при ПБ. Так, у больных ПБ с отягощенным по амилоидозу семейным анамнезом риск амилоидоза увеличивается в 6 раз [24]. Описан так называемый фенотип II ПБ (некоторые исследователи ставят под сомнение наличие фенотипа II, учитывая его исключительную редкость [25]), при котором клинически выраженных приступов не бывает, однако развивается АА-амилоидоз. При этом у родственников нередко регистрируется клиника несомненной ПБ.
Благодаря обнаружению в последние годы гена ПБ и его продукта – белка пирина показаны различные механизмы наследования ПБ и АА-амилоидоза. Пирин непосредственно не участвует в метаболизме S):1–112. AA, а гены обоих белков располагаются в разных хромосомах (гены S):1–112. AA обнаружены в 11 хромосоме). Таким образом, ПБ в настоящее время, подобно другим хроническим воспалительным процессам, рассматривают в качестве пускового фактора вторичного АА-амилоидоза.
У больных ПБ описаны единичные наблюдения асептического менингита, перикардита, миалгий, узелкового полиартериита, гломерулонефрита, пурпуры Шенлейн-Геноха, клиническое значение которых не вполне ясно [4]. Спленомегалия, как правило, сопутствует амилоидозу [4].
Оценка активности аутовоспалительных заболеваний
Первая попытка создания критериев активности аутовоспалительных заболеваний была предпринята группой ученых из Клиники Шиба (Израиль) в отношении ПБ [26]. В разработанной ими шкале учитываются возраст на момент начала заболевания, частота приступов, наличие артритов, рожеподобной эритемы и доза колхицина, необходимая для достижения ремиссии болезни. В 2005 г. ученые из той же клиники провели дополнительное исследование, в котором показали недостаточность этой шкалы для корректной оценки активности болезни [27]. С использованием статистических методов были разработаны новые критерии тяжести ПБ (модифицированные критерии Тель Хашомер), которые отличаются для больных, принимающих и не принимающих колхицин [27].
Эксперты рабочих групп EUROFEVER и EUROTRAPS):1–112. попытались разработать единые критерии активности семейных периодических лихорадок с использованием дельфийского метода и метода номинальных групп [28]. Для каждого заболевания были выделены симптомы, которые, по мнению экспертов и опрошенных больных, свидетельствуют о его высокой активности. В опроснике для больных содержатся ежедневные сведения о наличии и выраженности симптомов в баллах. По завершении месяца сумма баллов делится на количество дней в месяце (30 или 31): максимальной активности соответствует 13 баллов для криопиринопатий и 16 баллов для ПБ, HIDS):1–112. и TRAPS):1–112.
Традиционными методами подтверждения воспалительной природы заболевания и оценки его активности являются подсчет лейкоцитов крови и измерение показателей острофазового воспаления – СОЭ, уровня С-реактивного белка (СРБ), фибриногена и других.
Нередко при аутовоспалительных заболеваниях развивается анемия, как правило, нормохромная нормоцитарная, которая является следствием хронического воспаления (анемия хронических заболеваний). Веду щую роль в ее патогенезе играют провоспалительные цитокины – ФНО-α, ИЛ-1β, ИЛ-6 и интерферон-g [30,31]. Так, ФНО-α снижает эритропоэз за счет непосредственного блокирующего действия на рост эритроидных клеток-предшественниц и активации их апоптоза в костном мозге [32–34]. ИЛ-6 также подавляет костномозговую пролиферацию эритроидных клеток-предшественниц, снижает синтез эритропоэтина, через стимуляцию печеночной продукции гепсидина блокирует макрофагальное депо железа и его абсорбцию энтероцитами [35].
В последнее время исследователи стали уделять внимание новому показателю активности воспаления – отношению нейтрофилы/лимфоциты – ОНЛ (в норме оно равно 0,78-3,53 с медианой 1,65) [36]. Это надежный маркер, который может быть легко определен по результату клинического анализа крови. В настоящее время показана способность этого показателя отражать активность воспаления при ПБ. А. Ahsen и соавт. определяли ОНЛ и концентрацию СРБ у 62 больных ПБ в стадии ремиссии и 41 здорового человека [37]. Как ОНЛ, так и концентрация СРБ у больных с ремиссией ПБ были выше, чем у здоровых людей. Отмечена умеренная корреляция между этими параметрами (r=0,449, p
Лечение периодической болезни
Несмотря на наследственный характер ПБ в настоящее время существуют эффективные методы ее лечения. С 1970 г. в практику вошел колхицин, который позволил не только предупреждать приступы болезни, но также проводить лечение и профилактику амилоидоза, что существенно улучшило прогноз больных. Механизм противовоспалительного действия колхицина может быть связан с торможением дегрануляции полиморфноядерных лейкоцитов, способностью уменьшать продукцию ИЛ-1, снижать проницаемость сосудистой стенки. Известный цитостатический эффект колхицина в применяемых дозах, по-видимому, незначителен. Ежедневный прием 1-2 мг колхицина позволяет прово дить надежную профилактику приступов ПБ и амилоидоза. Терапевтическая доза при уже развившемся амилоидозе составляет 2 мг/сут. По данным клиники им. Е.М. Тареева колхицин эффективен даже у большинства больных с нефротическим синдромом, однако эффект наступает не сразу, спустя 2-4 года постоянного приема колхицина. Эффективность препарата при амилоидозе почек резко снижается на стадии почечной недостаточности, свидетельствующей о тяжести склеротических изменений.
Указанные дозы обычно хорошо переносятся, в том числе при многолетнем приеме. Нередко развивающаяся в начале лечения диарея носит преходящий характер и, как правило, не требует полной отмены препарата.
Приблизительно у 15-20% больных колхицин оказывается изначально неэффективным. Представление о ПБ как о внешней инфламмасомопатии позволило рекомендовать назначение ингибиторов ИЛ-1 пациентам, резистентным к лечению колхицином. В Рос сийской Федерации зарегистрирован канакинумаб (Иларис®) – человеческие моноклональные IgG1 антитела к ИЛ-1, которые связываются с цитокином и блокируют его взаимодействие с рецепторами. Канакинумаб обладает длительным периодом полувыведения (21-28 дней), что позволяет вводить его подкожно каждые 8 недель. Рекомендуемая стартовая доза у взрослых составляет 150 мг один раз в 4 недели, при необходимости ее можно увеличить до 300 мг.
Эффективность и безопасность канакинумаба изучались у больных с различными аутовоспалитель ными заболеваниями. В двойном слепом, плацебоконтролируемом, рандомизированном исследовании, состоявшем из 3 час тей, 35 пациентов с криопиринассоциированным периодическим синдромом (КАПС; синдром Макла-Уэллса у 33 и синдром NOMID/CINCA у 2) получали канакинумаб в течение 48 недель [52]. Во время части 1 всем пациентам вводили канакинумаб в дозе 150 мг подкожно. Если в течение 15 дней после введения препарата наблюдался полный ответ (отсутствие активности или минимальная активность по оценке исследователя и концентрации СРБ и S):1–112. AA ТАБЛИЦА 1. Эффективность канакинумаба в исследовании CLUSTER
Заключени
Представленная нами проблема ПБ демонстрирует достижения молекулярно-биологических исследований в современной практической медицине, показывает возможности диагностики и лечения на основе знаний о молекулярных механизмах ПБ. Последнее особенно важно с практических позиций, поскольку возможность выделения аутовоспалительных реакций с центральной ролью нейтрофила среди патофизиологических механизмов позволяет определить критерии индивидуального подхода к лечению с выбором патогенетически обоснованного средства подавления активности ПБ. Главным препятствием в диагностике и лечении больных ПБ остается низкая информированность врачей об этом заболевании, хотя в этнических группах высокого риска заболевание встречается с частотой 1-3 на 1000.
Болезнь Аддисона
Болезнь Аддисона (гипокортицизм, хроническая надпочечниковая недостаточность) — это редкое заболевание, характеризующееся недостаточной выработкой надпочечниками глюкокортикоидного гормона кортизола и минералокортикоидного гормона альдостерона.
Чаще всего гипокортизицм, которому подвержены как мужчины, так и женщины, возникает в 30-50 лет, однако дебют (первое клиническое проявление) заболевания может наблюдаться в любом возрасте.
Распространенность болезни Аддисона во всем мире составляет 40-60 пациентов с установленным диагнозом БА на 1 миллион человек.
Причины возникновения
Как правило, болезнь Аддисона возникает из-за повреждения или разрушения коры надпочечников в результате развития аутоиммунного процесса (иммунная система воспринимает кору надпочечников как чужеродную, атакует и разрушает ее) или другого аутоиммунного заболевания, имеющегося у пациента.
К другим причинам возникновения заболевания относятся:
Дефицит глюкокортикоидных и минералокортикоидных гормонов, вызванный снижением функции коры надпочечников, называют первичной надпочечниковой недостаточностью. Если надпочечники не способны продуцировать эти гормоны по другим причинам (например, из-за аномалий гипофиза или его дисфункции), речь идет о вторичной надпочечниковой недостаточности.
Симптомы
Болезнь Аддисона прогрессирует медленно, в течение нескольких месяцев. Симптомы могут варьироваться от человека к человеку. Первые клинические проявления часто неспецифичны, то есть сходны с симптомами других — распространенных — заболеваний.
Обычно на начальных стадиях заболевания пациент не ощущает никаких симптомов. К сожалению, дебют БА ассоциирован с 90% повреждения коры надпочечников.
К симптомам болезни Аддисона относятся:
Иногда болезнь Аддисона, не проявлявшая себя ранее, может возникнуть внезапно и остро — например, при отсутствии необходимого лечения или в результате воздействия стрессовых факторов (несчастный случай, травма, хирургическое вмешательство), инфекции, другого заболевания. В этом случае речь идет о жизнеугрожающем состоянии — т. н. аддисоническом кризе или острой надпочечниковой недостаточности. Характерные признаки: сильная слабость, спутанность сознания, боли в спине, ногах и животе, рвота и диарея, низкое артериальное давление, гиперкалиемия, гипонатриемия.
Диагностика
Диагноз устанавливается на основании анамнеза, жалоб и симптомов пациента, результатов лабораторной и инструментальной диагностики (КТ, МРТ).
Анализы крови направлены на определение уровня натрия, калия, кортизола и адренокортикотропного гормона (АКТГ), который стимулирует выработку гормонов корой надпочечников, а также на выявление специфических антител, ассоциированных с болезнью Аддисона.
Пациенту может быть назначена стимуляционная проба АКТГ, во время которой (для стимуляции выработки кортизола) вводится адренокортикотропный гормон. Если стимуляция не приводит к выработке нормального уровня кортизола, это указывает на повреждение надпочечников или нарушение их функции.
Также проводится инсулин-индуцированная гипогликемическая проба, которая помогает установить взаимосвязь характерных симптомов болезни Аддисона с аномалиями гипофиза или нарушениями его функции. Во время этого теста пациенту вводится быстродействующий инсулин, уровень сахара в крови замеряется до и после инъекции.
Для оценки функции надпочечников и их структурных особенностей дополнительно проводится визуализация с помощью КТ и МРТ. Эти исследования помогают уточнить характерные изменения, наблюдаемые при развитии болезни Аддисона.
Дифференциальный диагноз
Чаще всего болезнь Аддисона дифференцируют (различают) со следующими заболеваниями:
Лечение болезни Аддисона
Лечение болезни Аддисона основано на применении медикаментозной терапии, направленной на замещение глюкокортикоидного и минералокортикоидного гормонов. Рекомендуется пероральный прием гидрокортизона и флудрокортизона, дозировка препаратов подбирается индивидуально. Терапия проводится на протяжении всей жизни.
Некоторым пациентам может быть предложена андроген-заместительная терапия (тестостерон или андростендион). Больные, получающие такое лечение, сообщают о снижении проявлений усталости, улучшении настроения и психоэмоционального состояния в целом, повышении либидо (у женщин), однако эти подходы к лечению пока исследуются.
Лечение аддисонического криза включает внутривенное введение гидрокортизона, жидкостей, электролитов и препаратов, нормализующих артериальное давление.
Особенности и преимущества лечения болезни Аддисона в клинике Рассвет
Своевременная диагностика и эффективное лечение редких синдромов и болезней входят в область интересов всех врачей клиники Рассвет.
Наши эндокринологи — врачи высокой квалификации, прекрасно подготовлены и имеют большой практический опыт.
Пациентам с подозрением на болезнь Аддисона проводятся все необходимые диагностические исследования для подтверждения или исключения диагноза. При необходимости индивидуально подбирается адекватная схема терапии.
Рекомендации врача-эндокринолога клиники Рассвет пациентам с болезнью Аддисона
Помимо приема препаратов заместительной терапии, пациенту необходимо следить за тем, чтобы получать достаточное количество соли (натрия) из рациона, особенно во время физических нагрузок, при жаре или желудочно-кишечных расстройствах.
Дозировка принимаемых лекарств может быть временно увеличена, если пациент испытывает стресс, связанный с проведением операции, инфекционными и другими заболеваниями. Если из-за тошноты и рвоты пациент не может принимать необходимые препараты перорально, ему назначаются инъекции.
Пациентам с болезнью Аддисона важно знать, что прием стероидов в их случае не связан с серьезными побочными эффектами, поскольку осуществляется восполнение недостатка выработки гормонов. При правильном подборе дозировки лекарств побочные эффекты практически не наблюдаются.
Пациентам с болезнью Аддисона необходимо постоянно иметь при себе медицинский документ, свидетельствующий о наличии заболевания, для случаев оказания экстренной медицинской помощи.
Болезнь Аддисона нельзя предотвратить, но для нее существует эффективное лечение. При своевременной диагностике, правильном подборе терапии, соблюдении мер профилактики острой надпочечниковой недостаточности, ожидаемая продолжительность жизни у пациентов с этим заболеванием не снижается.
Современные представления о периодической болезни и клинические рекомендации по диагностике и лечению
В статье представлены современные сведения о патогенезе, клинических проявлениях, диагностике и лечении периодической болезни. Обсуждаются клинические и лабораторные методы оценки активности заболевания и подходы к лечению больных, резистентных к колхицину, на основе подавления эффектов интерлейкина-1.
Периодическая болезнь (ПБ), более известная в англоязычной литературе под названием Средиземноморская лихорадка, является древнейшим заболеванием. Первые наблюдения ПБ были описаны еще на закате средневековья. Так, H. Reimann указывает, что в 1629 г. Aubrey сообщил о своем страдании, которое проявлялось ознобом, тошнотой, рвотой, болями в животе, длящимися до полусуток и возникающими сначала каждые 2 недели, позже ежемесячно, один раз в 3 месяца, один раз в полгода [1].
Как самостоятельная нозологическая единица ПБ была выделена только в середине ХХ столетия. В 1948 г. H. Reimann на основании 6 наблюдений объединил общим термином “периодическая болезнь” ряд синдромов, включающих периодическую лихорадку, доброкачественный пароксизмальный перитонит, циклическую нейтропению и перемежающуюся артралгию [2]. Основными критериями считали периодичность и доброкачественность течения. По этой причине понятие “периодическая болезнь” стало очень широким. Благодаря работам E. S):1–112. ohar и соавт. (1967) [3], а в нашей стране – О.М. Виноградовой (1964, 1973) [4], В.А. Аствацатрян и соавт. [5] клиническая картина ПБ была очерчена более отчетливо. После открытия гена MEFV, мутации которого приводят к развитию клинических проявлений ПБ, были сформулированы окончательные критерии ПБ.
Тем не менее, сохраняет актуальность выделение особого обобщающего термина для всех периодических синдромов, клинические проявления и принципы диагностики которых сходны. Учитывая их наследственный характер, широко применяется термин семейные периодические лихорадки, которые, помимо ПБ, включают в себя криопиринопатии (семейная холодовая крапивница, синдром Макла-Уэллса, NOMID-CINCA синдром), гипериммуноглобулинемию D (дефицит мевалонаткиназы), TRAPS):1–112. (синдром, обусловленный мутацией гена рецептора к фактору некроза опухоли [ФНО]-α) и некоторые другие. Все эти заболевания характеризуются беспричинно повторяющимися приступами лихорадки в сочетании с воспалением кожи, серозных оболочек и суставов [4]. В основе патогенеза ведущую роль играют генетически детерминированные нарушения врожденного иммунитета, а механизмы специфического иммунитета – гуморального, связанного с синтезом аутоантител, и Т-клеточного, не имеют значения [5].

Клиническое предположение о наличии этих синдромов может возникать преимущественно у молодых пациентов с приступами болей в животе, грудной клетке в сочетании с афтозным стоматитом, диареей при наличии подобных признаков у родственников (табл. 1) [8]. Для оценки риска семейных периодических лихорадок предложен специальный индекс [9], автоматизированный расчет которого, предлагается на сайте Eurofever Project (https://www.printo.it/eurofever/index. asp). Паци ен там с высоким риском следует проводить генетическое тестирование для исключения семейных периодических лихорадок. У выходцев из Средиземно морья и Кавказа с непродолжительными приступами (менее 3 дней) в первую очередь следует исключать ПБ, у остальных пациентов с длительностью приступов до недели и эпизодами рвоты следует думать о дефиците мавалонаткиназы с развитием гипериммуноглобулинемии D, приступы длительностью более недели являются основанием для исключения TRAPS):1–112. (рис. 1). У пациентов с низким риском предлагается наблюдение за течением болезни с последующим повторным обсуждением показаний к генетическому исследованию на семейные периодические лихорадки.
Эпидемиология периодической болезни
Одним из признаков наследственной природы ПБ является этноассоциированный характер болезни – ее широкое распространение у народов, проживающих в бассейне Средиземного моря – армян, евреев-сефардов и, реже, арабов, турков, была показана разными авторами на больших группах больных. По данным О.М. Ви но градовой лица других национальностей среди больных ПБ встречались лишь в 2% случаев [4]. Среди 86 носителей гена ПБ, наблюдавшихся J. S):1–112. amuels и соавт. [10], необычно высоким было число итальянцев и евреев-ашкенази. Однако и в этой группе 96% пациентов оказались представителями средиземноморской популяции. В группе из 150 больных ПБ, обследованных О.М. Виноградовой [4], 88,6% составили армяне. В последние годы эту болезнь на территории России широко диагностируют у азербайджанцев, представителей разных народов Северного Кавказа, имеются также отдельные наблюдения ПБ среди русских и украинцев, преимущественно жителей южных регионов России. Болезнь наследуется по аутосомно-рецессивному пути. Это означает, что у родителей симптомы заболевания обычно отсутствуют, однако в больших семьях болезнь может проявиться у родных или двоюродных братьев/ сестер, дяди или дальнего родственника.
Ген, ответственный за ПБ, был клонирован в 1997 году и обозначен аббревиатурой MEFV (MEditerranean FEver) [11,12], в том же году были идентифицированы 8 основных мутаций гена. Ген MEFV располагается на коротком плече 16 хромосомы центромерно к гену гемоглобина- α, рядом с генами, ответственными за аутосомно-доминантный поликистоз почек и туберозный склероз 12. Показано, что среди евреев-сефардов, выходцев из Испании, частота носительства MEFV составляет от 1:16 до 1:8 (при распространенности ПБ в этой популяции от 1:250 до 1:1000) [15]. Частота носительства среди евреев-ашкенази Южной Европы почти на 2 порядка ниже – 1:135 (при распространенности ПБ 1:73000). Частота носительства среди американских армян составляет 1:7 [16].
Причина сохранения в современной средиземноморской популяции высокой частоты носительства MEFV остается неясной, однако сочетание ее с многочисленностью аллелей MEFV может свидетельствовать в пользу благоприятных условий для естественного отбора гетерозигот-носителей этих аллелей, по аналогии с распространенностью гена серповидноклеточной анемии в эндемичных очагах малярии.
Клиническая картина и диагноз
Продуктом MEFV является белок пирин, или маренострин (от латинского Mare Nostrum – Средиземное море) [11,12]. Одним из отличительных свойств пирина является наличие В30.2-домена. Кроме того, в молекуле пирина обнаружены 2 локуса потенциального связывания с ядром, а α-спиральный и В-box-домены могут обеспечивать взаимодействие с другими белками. Все выявленные в настоящее время мутации, ассоциирующиеся с ПБ, касаются изменений в В30.2-зоне пирина.
Экспрессия MEFV происходит почти исключительно в гранулоцитах и не наблюдается в лимфоцитах и моноцитах [11]. Не обнаруживают экспрессию гена и в других тканях. Согласно основной в настоящее время рабочей гипотезе пирин является базовым регулятором воспалительного ответа нейтрофилов. Соответ ственно, структурные изменения в молекуле пирина могут изменить функцию контроля и способствовать постоянному провоспалительному потенциалу нейтрофилов.
Немутантный пирин ингибирует адапторный белок AS):1–112. C, который кроме участия в апоптозе формирует ядро инфламмасомного комплекса путем гомотипического взаимодействия с белком NLRP и каспазой, что ведет к активации интерлейкина (ИЛ)-1 β. Инфламма сома – макромолекулярная платформа в цитоплазме, устойчивая к внутриклеточным механизмам деградации белков и, в силу этого, способная обеспечить реализацию провоспалительной активности клетки. Суще ствует несколько разновидностей инфламмасом. При ПБ и других семейных периодических лихорадках основное значение придают инфламмасоме на основе белка NLRP3 – криопирина. В качестве основной причины развития ПБ рассматривают утрату ингибиторного эффекта мутантного пирина на AS):1–112. C и, как следствие, активацию каспазы-1 [17], либо формирование пирином собственной инфламмасомы [18]. Однако роль мутаций домена B30.2 в развитии ПБ остается спорной; возможно, пирин может проявлять как про-,так и противовоспалительные свойства в зависимости от конкретных условий. Значение мутантного пирина в усилении секреции ИЛ-1 β при ПБ подтверждается купированием приступа ПБ при парентеральном введении ингибиторов ИЛ-1 [19].
Таким образом, в настоящее время несомненным диагностическим критерием ПБ является выявление гомозиготного носительства мутаций пирина. Однако у 20% больных клинические признаки ПБ развиваются при наличии только одной мутации. У таких пациентов сохраняют диагностическое значение клинические критерии болезни, в частности эффективность колхицина. Окончательный диагноз в этом случае может быть установлен только через 6-12 месяцев наблюдения за эффектом колхицина.
Важное значение имеет осмотр пациента во время периодических приступов заболевания, которые проявляются лихорадкой в сочетании с абдоминалгиями, торакалгиями, артралгиями и другими, более редкими, проявлениями. Указанные проявления могут возникать в различных сочетаниях или с разной периодичностью, обычно выделяют абдоминальный, торакальный, лихорадочный, реже суставной варианты ПБ.
Болезнь возникает преимущественно в детском или юношеском возрасте, чаще у мужчин, и характеризуется хроническим течением с обострениями и ремиссиями, возникающими от разнообразных причин и через различные сроки. Между приступами болезненные проявления отсутствуют, а во время приступа болезни многие пациенты сохраняют работоспособность. Приступы продолжаются от 12 ч до 3 суток, а затем самостоятельно разрешаются. Продолжительность межприступного периода у одного и того же пациента составляет от нескольких дней до нескольких месяцев, иногда приступы следуют один за другим с промежутками в 1-3 дня, но возможны и длительные ремиссии до нескольких лет. Характерный признак болезни, имеющий диагностическое значение, – стереотипность приступов. Пациенту, как правило, без труда удается отличить боль и лихорадку, вызванные приступом болезни, от подобных симптомов другого генеза.
Лихорадка, которая у нелеченных больных, как правило, достигает высоких значений и сопровождается потрясающими ознобами, является практически постоянным симптомом приступа. Выделение особой лихорадочной формы болезни обосновывается тем, что другие симптомы, включая абдоминалгии, встречаются реже. Однако В.М. Арутюнян и соавт. полагают, что острый асептический серозит, хотя бы и кратковременный, является облигатным проявлением болезни, в связи с чем нецелесообразно расширять классификацию болезни за счет лихорадочной и суставной форм, а достаточно ограничиться тремя формами – абдоминальной, торакальной и смешанной [20].
Абдоминальный вариант наблюдается у 91% больных [11,12]. В основе абдоминального варианта ПБ лежит рецидивирующее доброкачественное воспаление серозной оболочки брюшной полости с преобладанием экссудативной реакции над пролиферативной, что подтверждается малым количеством спаек, несмотря на частоту приступов. В воспалительный процесс вовлекаются брыжейка, серозная оболочка кишки, печени, селезенки, диафрагмы. Абдоминалгии обычно сопровождаются симптомами раздражения брюшины и вялой перистальтикой, что наряду с лихорадкой и лейкоцитозом периферической крови создает существенные дифференциально-диагностические сложности и ведет к необоснованной лапаротомии.
Торакальный вариант, в основе которого лежит асептический плеврит, наблюдается у 57% пациентов [11, 12]. При рентгеноскопии грудной клетки во время приступа отмечают ограничение подвижности купола диафрагмы, небольшой выпот в синусе над диафрагмой, реже дисковидные ателектазы, все эти явления затем полностью исчезают, но у трети больных возникают спайки.
Артрит и артралгии развиваются у 45% больных [11,12], очень редко как единственное проявление болезни. Суставные проявления имеют характер летучих артралгий, моноартрита, реже полиартрита, чаще вовлекаются коленные и голеностопные суставы. По окончании приступа эти явления полностью исчезают, не оставляя пролиферативных изменений. Ревматоид ный фактор, антистрептококковые антитела не определяются.
Редко (13%) встречается рожеподобная эритема в виде болезненных плотноватых пятен диаметром 10-15 см обычно в области голеностопных суставов [11,12].
Самым тяжелым осложнением является АА-амилоидоз, строящийся из циркулирующего белка-предшественника S):1–112. AA, близкого С-реактивному белку. Частота амилоидоза значительно отличается по данным разных авторов. О.М. Виноградова на примере популяции бывшего СССР указывает частоту амилоидоза 41,3%. Аме риканские авторы, обследовавшие популяцию армян, проживающих в США, сообщают о низкой частоте амилоидоза – 2% [8,21]. В любом случае, прогноз болезни определяется наличием и тяжестью амилоидоза. Клинические проявления амилоидоза характерны для АА-типа, при котором основным органом-мишенью являются почки. В течении амилоидной нефропатии обычно удается выделить три стадии – протеинурическую, нефротическую и стадию почечной недостаточности. Особенностью амилоидоза является сохранение высокой протеинурии на стадии хронической почечной недостаточности [22]. Нелеченный ААамилоидоз в рамках ПБ обычно прогрессирует быстрее, чем при других воспалительных заболеваниях: 5- и 10летняя выживаемость составляет соответственно 48% и 24%, соответственно, а при вторичном АА-амилоидозе другой этиологии – 77% и 44% [23].
Широко распространено мнение о наследственном характере амилоидоза при ПБ. Так, у больных ПБ с отягощенным по амилоидозу семейным анамнезом риск амилоидоза увеличивается в 6 раз [24]. Описан так называемый фенотип II ПБ (некоторые исследователи ставят под сомнение наличие фенотипа II, учитывая его исключительную редкость [25]), при котором клинически выраженных приступов не бывает, однако развивается АА-амилоидоз. При этом у родственников нередко регистрируется клиника несомненной ПБ.
Благодаря обнаружению в последние годы гена ПБ и его продукта – белка пирина показаны различные механизмы наследования ПБ и АА-амилоидоза. Пирин непосредственно не участвует в метаболизме S):1–112. AA, а гены обоих белков располагаются в разных хромосомах (гены S):1–112. AA обнаружены в 11 хромосоме). Таким образом, ПБ в настоящее время, подобно другим хроническим воспалительным процессам, рассматривают в качестве пускового фактора вторичного АА-амилоидоза.
У больных ПБ описаны единичные наблюдения асептического менингита, перикардита, миалгий, узелкового полиартериита, гломерулонефрита, пурпуры Шенлейн-Геноха, клиническое значение которых не вполне ясно [4]. Спленомегалия, как правило, сопутствует амилоидозу [4].
Оценка активности аутовоспалительных заболеваний
Первая попытка создания критериев активности аутовоспалительных заболеваний была предпринята группой ученых из Клиники Шиба (Израиль) в отношении ПБ [26]. В разработанной ими шкале учитываются возраст на момент начала заболевания, частота приступов, наличие артритов, рожеподобной эритемы и доза колхицина, необходимая для достижения ремиссии болезни. В 2005 г. ученые из той же клиники провели дополнительное исследование, в котором показали недостаточность этой шкалы для корректной оценки активности болезни [27]. С использованием статистических методов были разработаны новые критерии тяжести ПБ (модифицированные критерии Тель Хашомер), которые отличаются для больных, принимающих и не принимающих колхицин [27].
Эксперты рабочих групп EUROFEVER и EUROTRAPS):1–112. попытались разработать единые критерии активности семейных периодических лихорадок с использованием дельфийского метода и метода номинальных групп [28]. Для каждого заболевания были выделены симптомы, которые, по мнению экспертов и опрошенных больных, свидетельствуют о его высокой активности. В опроснике для больных содержатся ежедневные сведения о наличии и выраженности симптомов в баллах. По завершении месяца сумма баллов делится на количество дней в месяце (30 или 31): максимальной активности соответствует 13 баллов для криопиринопатий и 16 баллов для ПБ, HIDS):1–112. и TRAPS):1–112.
Традиционными методами подтверждения воспалительной природы заболевания и оценки его активности являются подсчет лейкоцитов крови и измерение показателей острофазового воспаления – СОЭ, уровня С-реактивного белка (СРБ), фибриногена и других.
Нередко при аутовоспалительных заболеваниях развивается анемия, как правило, нормохромная нормоцитарная, которая является следствием хронического воспаления (анемия хронических заболеваний). Веду щую роль в ее патогенезе играют провоспалительные цитокины – ФНО-α, ИЛ-1β, ИЛ-6 и интерферон-g [30,31]. Так, ФНО-α снижает эритропоэз за счет непосредственного блокирующего действия на рост эритроидных клеток-предшественниц и активации их апоптоза в костном мозге [32–34]. ИЛ-6 также подавляет костномозговую пролиферацию эритроидных клеток-предшественниц, снижает синтез эритропоэтина, через стимуляцию печеночной продукции гепсидина блокирует макрофагальное депо железа и его абсорбцию энтероцитами [35].
В последнее время исследователи стали уделять внимание новому показателю активности воспаления – отношению нейтрофилы/лимфоциты – ОНЛ (в норме оно равно 0,78-3,53 с медианой 1,65) [36]. Это надежный маркер, который может быть легко определен по результату клинического анализа крови. В настоящее время показана способность этого показателя отражать активность воспаления при ПБ. А. Ahsen и соавт. определяли ОНЛ и концентрацию СРБ у 62 больных ПБ в стадии ремиссии и 41 здорового человека [37]. Как ОНЛ, так и концентрация СРБ у больных с ремиссией ПБ были выше, чем у здоровых людей. Отмечена умеренная корреляция между этими параметрами (r=0,449, p
Лечение периодической болезни
Несмотря на наследственный характер ПБ в настоящее время существуют эффективные методы ее лечения. С 1970 г. в практику вошел колхицин, который позволил не только предупреждать приступы болезни, но также проводить лечение и профилактику амилоидоза, что существенно улучшило прогноз больных. Механизм противовоспалительного действия колхицина может быть связан с торможением дегрануляции полиморфноядерных лейкоцитов, способностью уменьшать продукцию ИЛ-1, снижать проницаемость сосудистой стенки. Известный цитостатический эффект колхицина в применяемых дозах, по-видимому, незначителен. Ежедневный прием 1-2 мг колхицина позволяет прово дить надежную профилактику приступов ПБ и амилоидоза. Терапевтическая доза при уже развившемся амилоидозе составляет 2 мг/сут. По данным клиники им. Е.М. Тареева колхицин эффективен даже у большинства больных с нефротическим синдромом, однако эффект наступает не сразу, спустя 2-4 года постоянного приема колхицина. Эффективность препарата при амилоидозе почек резко снижается на стадии почечной недостаточности, свидетельствующей о тяжести склеротических изменений.
Указанные дозы обычно хорошо переносятся, в том числе при многолетнем приеме. Нередко развивающаяся в начале лечения диарея носит преходящий характер и, как правило, не требует полной отмены препарата.
Приблизительно у 15-20% больных колхицин оказывается изначально неэффективным. Представление о ПБ как о внешней инфламмасомопатии позволило рекомендовать назначение ингибиторов ИЛ-1 пациентам, резистентным к лечению колхицином. В Рос сийской Федерации зарегистрирован канакинумаб (Иларис®) – человеческие моноклональные IgG1 антитела к ИЛ-1, которые связываются с цитокином и блокируют его взаимодействие с рецепторами. Канакинумаб обладает длительным периодом полувыведения (21-28 дней), что позволяет вводить его подкожно каждые 8 недель. Рекомендуемая стартовая доза у взрослых составляет 150 мг один раз в 4 недели, при необходимости ее можно увеличить до 300 мг.
Эффективность и безопасность канакинумаба изучались у больных с различными аутовоспалитель ными заболеваниями. В двойном слепом, плацебоконтролируемом, рандомизированном исследовании, состоявшем из 3 час тей, 35 пациентов с криопиринассоциированным периодическим синдромом (КАПС; синдром Макла-Уэллса у 33 и синдром NOMID/CINCA у 2) получали канакинумаб в течение 48 недель [52]. Во время части 1 всем пациентам вводили канакинумаб в дозе 150 мг подкожно. Если в течение 15 дней после введения препарата наблюдался полный ответ (отсутствие активности или минимальная активность по оценке исследователя и концентрации СРБ и S):1–112. AA ТАБЛИЦА 1. Эффективность канакинумаба в исследовании CLUSTER
Заключени
Представленная нами проблема ПБ демонстрирует достижения молекулярно-биологических исследований в современной практической медицине, показывает возможности диагностики и лечения на основе знаний о молекулярных механизмах ПБ. Последнее особенно важно с практических позиций, поскольку возможность выделения аутовоспалительных реакций с центральной ролью нейтрофила среди патофизиологических механизмов позволяет определить критерии индивидуального подхода к лечению с выбором патогенетически обоснованного средства подавления активности ПБ. Главным препятствием в диагностике и лечении больных ПБ остается низкая информированность врачей об этом заболевании, хотя в этнических группах высокого риска заболевание встречается с частотой 1-3 на 1000.
Чем лечится эта болезнь
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ)
Лечение и профилактика гастроэзофагеальной рефлюксной болезни (ГЭРБ)
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) встречается часто, но редко обнаруживается и, следовательно, не лечится или лечится самостоятельно и неправильно, что нежелательно, так как ГЭРБ обычно хорошо поддается лечению.
ГЭРБ лечится постепенно. Врач поможет подобрать необходимый курс лечения. Если заболевание находится в легкой форме, пациенту достаточно будет соблюдать определенную диету, отказаться от некоторых видов деятельности и иногда принимать медикаменты, отпускаемые без рецепта.
В случаях, когда симптомы более устойчивы (ежедневная изжога, симптомы, которые проявляются по ночам) может потребоваться приём лекарств, отпускаемых по рецепту. Операция является разумной альтернативой постоянному приёму лекарств, особенно если заболевание приобретается в раннем возрасте.
Операция также рекомендована, если лекарства не помогают. Однако сегодня появилось новое поколение препаратов, которые могут эффективно контролировать гастроэзофагеальный рефлюкс.
Если после приёма сильнодействующих препаратов, симптомы все еще причиняют дискомфорт, скорее всего их причиной является не ГЭРБ. Большинство гастроэнтерологов и хирургов не рекомендуют проводить операцию в подобных случаях, так как и после неё симптомы все равно продолжают беспокоить.
Изменения в образе жизни
Лечение гастроэзофагеального рефлюкса начинается с изменения образа жизни. Для начала нужно понять, что влияет на возникновение симптомов.
Если у Вас есть симптомы ГЭРБ, воспользуйтесь следующими советами:
Медикаментозное лечение гастроэзофагеального рефлюкса
Лечащий врач может назначить медикаментозное лечение ГЭРБ. Поскольку ГЭРБ часто является хроническим заболеванием, Вам придется принимать лекарства в течение всей жизни. В некоторых случаях длительное лечение не требуется.
Будьте терпеливы, для того, чтобы подобрать нужный препарат и дозировку, требуется время. Если симптомы не проходят даже после приёма препаратов или, если они возобновляются сразу после завершения курса, проконсультируйтесь у своего лечащего врача. Если симптомы ГЭРБ проявляются во время беременности, обратитесь к акушеру, перед тем как начать приём препаратов.
Ниже представлена информация о препаратах, которые обычно назначаются для лечения ГЭРБ:
Антациды, отпускаемые без рецепта
Такие средства помогают при легких и редко проявляющихся симптомах. Их действие заключается в нейтрализации кислого желудочного сока. Обычно антациды быстро действуют и могут приниматься по мере необходимости. Так как их действие не обладает долгим эффектом, они не предотвращают возникновение изжоги и менее эффективны при симптомах, которые часто проявляются.
В большинстве антацидов содержится карбонат кальция («Маалокс» Maalox) или гидроксид магния. Бикарбонат натрия или пищевая сода, помогает при изжоге и несварении желудка. Её надо смешать, по крайней мере, со 120 мл воды м принимать через один-два часа после еды, чтобы не перегружать полный желудок. Поговорите со своим лечащим врачом о необходимости такого лечения. Не используйте данный метод более двух недель и применяйте его только в крайних случаях, поскольку сода может привести к нарушению обмена веществ (pH) и образованию эрозий в пищеводе и желудке. Перед тем как применить его в отношении детей до 12 лет, проконсультируйтесь у врача.
Другой вид антацидов содержит альгинат или альгиновую кислоту (например, «Гевискон» Gaviscon). Преимуществом такого антацида является то, что он не позволяет жидкости просачиваться обратно в пищевод.
Антациды могут влиять на способность организма усваивать другие препараты, поэтому если Вы принимаете другие лекарства, проконсультируйтесь у своего лечащего врача перед тем, как начать приём антацидов.
В идеале, Вы должны принимать антациды, по крайней мере, через 2-4 часа после приёма других препаратов, чтобы максимально снизить вероятность их неусвоения. Людям с повышенным артериальным давлением лучше воздержаться от приёма антацидов с высоким содержанием натрия («Гевискон» Gaviscon).
И наконец, антациды не являются надежным средством для лечения эрозивного эзофагита, заболевания, которое нужно лечить другими препаратами.
Препараты подавляющие продукцию соляной кислоты
Эти препараты снижают количество кислоты, вырабатываемой желудком, и отпускаются как по рецепту, так и без него. Обычно по рецепту отпускаются те же самые препараты, но в большей дозировке. Они могут помочь тем, кому не помогают антациды. Большинству пациентов становится легче, если они принимают препараты подавляющие продукцию соляной кислоты и меняют образ жизни.
По механизму действия различают две группы таких препаратов:
— Блока́торы H2-гистами́новых реце́пторов
— Ингибиторы протонового насоса
Скорее всего, сначала врач рекомендует в течение нескольких недель принимать препарат в стандартной дозе, а затем если не удастся добиться желаемого эффекта, назначит препарат с большей дозировкой.
К традиционным H2-блокаторам относятся :
— низатидин («Аксид AR» Axid AR)
— фамотидин («Пепсид АС» Pepcid AC)
— циметидин («Тагамет HB» Tagamet HB)
— ранитидин («Зантак 75» Zantac 75)
К традиционным ингибиторам протонового насоса относятся :
— лансопразол («Превацид», Prevacid)
— омепразол («Прилосек», Prilosec)
— рабепразол («АципХекс», AcipHex, «Париет» Pariet)
— пантопразол («Протоникс» Protonix, «Нольпаза» Nolpaza)
— эзомепразол («Нексиум», Nexium)
— омепразол + бикарбонат натрия («Зегерид» Zegerid)
— декслансопразол («Дексилант» Dexilant)
Ингибиторы протонового насоса (ИПП) также понижают кислотность, но являются более мощным средством по сравнению с H2-блокаторами. Ингибиторы протонового насоса чаще всего назначаются для лечения изжоги и кислотного рефлюкса.
Эти средства блокируют выделение кислоты клетками слизистой оболочки желудка, и значительно снижают количство желудочной кислоты. Они действуют не так быстро как антациды, но могут облегчить симптомы рефлюкса на долгие часы.
ИПП также используются для лечения воспаления пищевода (эзофагита) и эрозий пищевода. Исследования показали, что большинство пациентов, страдающих эзофагитом, которые принимали такие препараты, выздоровели через 6-8 недель. Скорее всего, лечащий врач повторно оценит состояние Вашего здоровья через 8 недель приёма ингибиторов протонового насоса и в соответствии с полученными результатами уменьшит дозировку или прекратит лечение. Если симптомы не возобновляются в течение трех месяцев, Вам, придется принимать лекарства только время от времени. Перед приёмом данных препаратов люди, страдающие заболеваниями печени, должны проконсультироваться у своего лечащего врача.
Прокинетики
Прокинетики, например, метоклопрамид (Церукал, Реглан, Метозолв), повышают тонус нижнего пищеводного сфинктера, благодаря чему кислота не попадает в пищевод. Они также в некоторой степени усиливают сокращения пищевода и желудка, для того, чтобы желудок быстрее освобождался. Данные препараты могут использоваться в качестве дополнительного лечения людей с ГЭРБ.
Хирургическое лечение ГЭРБ
Операция является альтернативой консервативному лечению ГЭРБ. Операцию чаще всего назначают пациентам молодого возраста (поскольку в обратном случае им потребуется длительное лечение) с типичными симптомами ГЭРБ (изжога и отрыжка), которым помогает медикаментозное лечение, но они ищут альтернативу ежедневному приёму лекарств.
Пациентам с нетипичными симптомами или пациентам, которым не помогает медикаментозное лечение, операция назначается только в том случае, когда не возникает никаких сомнений по поводу поставленного диагноза ГЭРБ и взаимосвязь между проявляющимися симптомами и рефлюксом подтверждается результатами исследований.
В большинстве случаев применяется фундопликация. Во время данной операции верхняя часть желудка обворачивается вокруг нижнего пищеводного сфинктера, благодаря чему повышается его тонус. В наши дни, вместо традиционной «открытый» операции обычно применяются минимально инвазивные (лапароскопические) технологии. Одним из преимуществ фундопликации является то, что во время операции можно также избавиться от грыжы пищеводного отверстия.
Операция не всегда эффективна, и после её проведения некоторым пациентам все равно приходится принимать лекарства. Результаты этой операции обычно оказываются положительными, но, тем не менее, могут возникнуть осложнения, например, затрудненное глотание, вздутие и газообразование, тяжелое восстановление после операции и диарея, которая возникает из-за повреждения нервных окончаний, которые прилегают к желудку и кишечнику.
Профилактика ГЭРБ
Прежде всего, необходимо уделять внимание образу жизни и избегать ситуаций, которые могут спровоцировать появление болезни.
Помните, что ГЭРБ случается, когда происходит заброс желудочной кислоты в пищевод, который соединяет глотку с желудком.
Чтобы нижний пищеводный сфинктер нормально функционировал, следуйте следующим рекомендациям :
Не делайте наклоны и другие физические упражнения, во время которых увеличивается давление на брюшную полость. Не занимайтесь спортом на полный желудок.
Не носите одежду, которая тесно сидит вокруг пояса, например, эластичные пояса и ремни, которые могут увеличить давление на желудок.
Не ложитесь поле еды. Если Вы легли на спину после обильной еды, содержимому желудка будет легче попасть в пищевод. По схожей причине, не ешьте перед сном. Изголовье кровати должно возвышаться на 15-20см, чтобы под действием силы тяжести кислота оставалась в желудке, где она и должна находиться, пока Вы спите.
Не переедайте. Из-за того, что в желудке находится большое количество пищи, увеличивается давление на нижний пищеводный сфинктер, вследствие чего он размыкается.
Чтобы нижний пищеводный сфинктер и пищевод нормально функционировали, придерживайтесь следующих советов :
Бросьте курить и не употребляйте продукты, содержащие табак. Из-за курения происходит расслабление нижнего пищеводного сфинктера, а в ротовой полости и глотке снижается количество слюны, нейтрализующей кислоту, и происходит повреждение пищевода.
Не употребляйте продукты, которые обостряют симптомы, например, томатные соусы, мятные конфеты, цитрусовые, лук, кофе, жареное и газированные напитки.
Не употребляйте алкогольные напитки. Из-за алкоголя происходит расслабление нижнего пищеводного сфинктера, а пищевод может начать сокращаться неравномерно, вследствие чего произойдет заброс кислоты в пищевод и начнется изжога.
Проверьте препараты, которые Вы принимаете. Из-за приёма некоторых препаратов, симптомы могут обостряться. Не прерывайте назначенное лечение, не проконсультировавшись у врача. К препаратам, которые обладают таким эффектом, относятся препараты для лечения астмы и эмфиземы (например, теофиллин), антихолинергические средства для лечения болезни Паркинсона и астмы, содержащиеся, иногда, в препаратах, отпускаемых без рецепта, некоторые блокаторы кальциевых каналов, альфа-блокаторы и бета-блокаторы для лечения заболеваний сердца или повышенного артериального давления, некоторые препараты, которые влияют на работу нервной системы, препараты железа.
Несмотря на то, что одни препараты обостряют симптомы ГЭРБ, из-за приёма других может возникнуть лекарственный эзофагит, заболевание при котором возникают те же симптомы, что и при ГЭРБ, но не из-за рефлюкса. Лекарственный эзофагит случается, когда таблетка проглатывается, но не достигает желудка, так как прилипает к стенке пищевода. Из-за этого разъедается слизистая оболочка пищевода, возникает боль в груди, язвы пищевода и болезненные ощущения во время глотания.
К препаратам, провоцирующим лекарственный эзофагит, относится аспирин, негормональные противовоспалительные средства (НПВС), например, ибупрофен («Мортин» Motrin, «Алив» Aleve), алендронат («Фозамакс» Fosamax), калий и некоторые антибиотики (особенно тетрациклин и доксициклин).
Более подробную информацию о симптомах гастроэзофагеальной рефлюксной болезни Вы можете получить у гастроэнтерологов клиники «Здоровье 365» г. Екатеринбурга.
