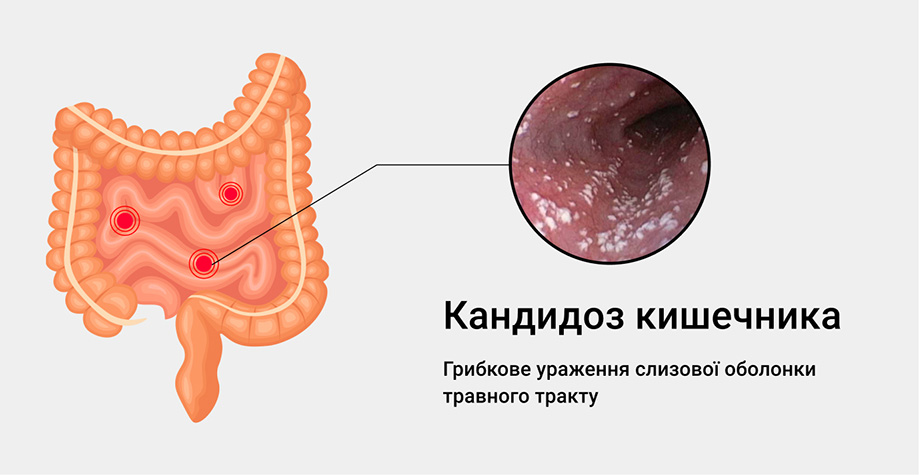
Чем лечится кандида в кишечнике
Как лечить кандидоз кишечника
При первых признаках кишечных расстройств обращайтесь в клинику МЕДИКОМ. Наши специалисты точно знают, как диагностировать и как лечить кандидоз кишечника, поэтому вы сможете получить эффективную квалифицированную помощь. Чтобы определить причину, вызвавшую кандидоз кишечника, и максимально быстро устранить ее, наши врачи используют новейшие технологии, большой опыт и все возможности медцентра: современное оснащение и лабораторную диагностику.
Кандидоз кишечника — это инфекционное заболевание, возникающее при ослабленном иммунитете. Кишечный кандидоз или молочница кишечника вызывается дрожжеподобными грибками рода кандида (Candida spp.) Как правило, это микроорганизмы из собственной флоры больного. Такое заболевание слизистой может проявиться в любом возрасте и причинить немало дискомфорта.
Виды и формы кандидоза кишечника
Кишечный кандидоз различают по причине возникновения:
Чаще всего диагностируется первый вид. Болезнь возникает при угнетенном иммунитете и нарушении микрофлоры. Тогда кишечная кандида распространяется в кишечном просвете, не прорастая вглубь. Спровоцировать диффузный кандидоз может онкология или иммунодефицитные состояния. Развивается этот вид заболевания с трансформацией возбудителя в нитчатую форму. Попадая в кровоток, грибок разносится по всему организму.
Кандидоз кишечника имеет три формы течения:
При инвазивном кишечном кандидозе могут поражаться печень и поджелудочная железа. Патология переходит в висцеральную форму.
Причины кандидоза кишечника
Когда иммунная система работает эффективно, то дрожжевой грибок в кишечнике не опасен для человека. Но если иммунитет ослаблен, условно патогенная микрофлора активизируется и начинает бурно размножаться, подавляя полезные микроорганизмы. Причинами кандидоза кишечника могут быть состояния, при которых происходит угнетение иммунитета. Чаще всего это:
Очень часто заболевание вызывается сочетанием нескольких условий. Носителями грибов кандида в кишечнике являются более 80 % людей. У людей с хорошо работающей иммунной системой инвазивный кандидоз кишечника не встречается.
Пути заражения кандидозом кишечника
Грибковые микроорганизмы в норме присутствуют в организме человека. Патогенной грибковая флора становится при увеличении ее количества. Заболевание возникает при дисбактериозе или кишечной инфекции: в процессе жизнедеятельности производятся определенные вещества, которые вместе с ферментами образовывают токсичные соединения, раздражающие внутреннюю оболочку кишечника.
В случае инвазии возбудитель кандидоза кишечника попадает в организм через пищеварительный тракт.
Симптомы и признаки кандидоза кишечника
Симптомы кандидоза кишечника неинвазивного и инвазивного вида существенно различаются. Диффузный кандидоз характеризуется яркими проявлениями интоксикации, лихорадкой, абдоминальными болями, жидким стулом с кровью.
Фокальный инвазивный кандидоз в кишечнике развивается, как правило, в результате осложнения неспецифического язвенного колита или язвы двенадцатиперстной кишки. В таком случае симптомы кандидоза кишечника совпадают с признаками основного заболевания.
Преимущественно диагностируется неинвазивная молочница в кишечнике. Самочувствие больного при этом удовлетворительное:
Попутно могут обостриться аллергические болезни. Признаками кандидоза в ЖКТ могут служить вялость, потеря аппетита. Кал при кандидозе кишечника может содержать слизь и беловатые хлопья, но это встречается редко.
Особенности кандидоза кишечника при беременности
Кишечный кандидоз у беременных встречается в 2–3 раза чаще, чем у небеременных. Это связано с гормональной перестройкой и снижением иммунитета под воздействием прогестерона. Молочница может протекать бессимптомно. Но грибковые поражения кишечника и влагалища взаимосвязаны. Поэтому проблема дисбактериоза кишечника в период вынашивания приобретает важное значение. Своевременное лечение кандидоза кишечника и дисбиотических состояний при беременности снижает риск осложнений в период гестации, во время и после родов.
Особенности кандидоза кишечника у детей
Присутствие Candida в кишечнике у ослабленных и недоношенных детей — явление распространенное. Поражение ЖКТ грибком у ребенка вызывает колики, запоры, боль и дискомфорт в животе. Пища плохо усваивается. Заражается новорожденный, проходя по родовым путям, пораженным молочницей. Факторами, вызывающими появление кандидоза кишечника у ребенка, могут стать недоношенность, недостаточная гигиена, время прорезывания зубов.
Осложнения кандидоза кишечника
При отсутствии лечения возникают такие последствия кандидоза кишечника, как:
Кроме того, запущенная патология становится источником инфекции для окружающих. И прежде всего — родных и близких.
Диагностика кандидоза кишечника
Инфицирование кишечника грибком довольно сложно дифференцируется с другими заболеваниями, так как специфической симптоматики у молочницы нет. Поэтому диагностика кандидоза кишечника невозможна без лабораторных анализов и методов инструментального исследования. Для определения болезни врач назначает:
Культуральное исследование позволяет выявить возбудителя и определить его чувствительность к антибиотикам.
Как лечить кандидоз кишечника
Анализы на кандидоз кишечника и грамотная оценка симптомов позволяют врачу назначить эффективное лечение заболевания. Основным принципом терапии есть нормализация микрофлоры ЖКТ. Для этого протокол лечения кандидоза кишечника предусматривает:
Диета при кандидозе кишечника исключает сладкое, жирное, жареное, сдобу. Народные средства (отвары, настои) применяют только с разрешения врача. Также показаны пребиотики и пробиотики для устранения нарушения микрофлоры кишечника.
Профилактика кандидоза кишечника
Профилактические меры предусматривают устранение вызывающих патологический процесс факторов. Этому способствует:
Нельзя заниматься самоназначением антибиотиков. Люди, находящиеся в группе риска, должны регулярно обследоваться.
Чем лечится кандида в кишечнике
Гастроэнтерология Санкт-Петербурга, 2006, №1-2, С.17-20.
Стандарты и перспективы фармакотерапии кандидоза органов пищеварения.
Увеличение числа пациентов с иммунодефицитными состояниями различного генеза привело к тому, что перед гастроэнтерологами и врачами других специальностей все чаще встает проблема выбора противогрибкового препарата для лечения кандидоза органов пищеварения.
При выборе антифунгального препарата для лечения кандидоза клиницисту приходится учитывать семь факторов: особенности патогенеза, локализацию поражения, чувствительность возбудителя, профиль безопасности антимикотика, состояние функции печени и почек пациента, возможное взаимодействие с другими лекарственными средствами, и, наконец, фармакоэкономические аспекты.
Патогенез и диагностика кандидоза верхних отделов пищеварительного тракта.
Патогенез кандидоза слизистых оболочек пищеварительного тракта характеризуется последовательным прохождением следующих этапов – адгезии, инвазии, кандидемии и висцеральных поражений. На первом этапе микромицеты адгезируются к эпителиоцитам какого-либо участка слизистой оболочки. В дальнейшем, дефекты в системе резистентности позволяют микромицетам через трансформацию в псевдомицелий внедряться (инвазироваться) в слизистую оболочку и подлежащие ткани. Цитопения – решающий фактор, который позволяет инвазирующимся грибам достигать стенки сосудов, разрушать ее и циркулировать в сосудистом русле. Такой этап называют кандидемией. В отсутствие адекватной терапии кандидемия приводит к образованию очагов инвазивного кандидоза в висцеральных органах, например, легких, эндокарде, центральной нервной системе, печени и др.
Лечение орофарингеального кандидоза и кандидоза пищевода.
Целью терапии этих форм кандидоза является устранение симптомов и клинических признаков заболевания, а также предотвращение рецидивов. Для части больных орофарингеальным кандидозом имеют значение «местные» факторы риска – ношение зубных протезов и ингаляции кортикостероидных средств. Симптомы орофарингеального кандидоза и кандидоза пищевода, кроме субъективного дискомфорта, могут нарушить глотание пищи и жидкостей и значительно снизить качество жизни.
Для лечения орофарингеального кандидоза можно применять как местнодействующие, так и системно действующие антифунгальные препараты. За рубежом для местной терапии применяют, например, пастилки с клотримазолом или суспензию нистатина или амфотерицина В. В нашей стране такие лекарственные формы не зарегистрированы, и обычно местная терапия представляет собой разжевывание или нанесение на слизистую оболочку размельченных таблеток нистатина или натамицина в дозах от 1 до 4 млн ЕД в сутки с продолжительностью курса до 2-4 недель (2). Эффективность такого «импровизированного» метода лечения в контролируемых исследованиях не изучалась. Местная антифунгальная терапия при кандидозе пищевода неэффективна.
При кандидозе слизистых оболочек верхних отделов пищеварительного тракта могут применяться системнодействующие азоловые антимикотики (кетоконазол, флуконазол, итраконазол или вориконазол), внутривенный амфотерицин B (особенно при азоло-рефрактерных инфекциях), а также – эхинокандиновые препараты (каспофунгин, микафунгин и др.). Для больных с нарушенным актом глотания разработаны парентеральные формы антимикотических средств.
Эффективность и безопасность азоловых и эхинокандиновых антимикотических препаратов изучена достаточно хорошо, накоплена большая база доказательств, основанных на контролируемых исследованиях, а результаты этих работ легли в основу терапевтических стандартов (3-5).
Эффективность антимикотической терапии орофарингеального кандидоза оценена в ходе многократных рандомизированных проспективных исследованиях как у больных со СПИДом, так и у больных со злокачественными новообразованиями. Большинство пациентов отвечают на лечение местнодействующими формами полиеновых антимикотических средств (пастилки и суспензия). Однако у ВИЧ-инфицированных больных рецидивы кандидоза полости рта могут произойти скорее после местной терапии, чем после лечения флуконазолом в дозе 100 мг в сутки, а резистентность возбудителя может развиться при применении любого варианта терапии. Так же было показано, что флуконазол по эффективности превосходит кетоконазол, а итраконазол в капсулах эквивалентен по эффективности кетоконазолу. Пероральный раствор итраконазола лучше абсорбируется в пищеварительном тракте, чем капсульная форма, и сопоставим по эффективности с флуконазолом. Доза раствора итраконазола 2,5 мг/кг 2 раза в день была рекомендована для лечения орофарингеального кандидоза у детей от 5 лет и старше. Эффективность орального раствора итраконазола может быть значительнее за счет суммирования местного и системного эффекта.
Рецидивирующее течение кандидоза обычно отмечают у больных с иммунодефицитами, особенно при СПИДе. Показано, что длительная поддерживающая терапия флуконазолом эффективна для предупреждения развития орофарингельного кандидоза как у онкологических, так и у больных со СПИДом. Длительная поддерживающая терапия флуконазолом ВИЧ-инфицированных больных снижает частоту инвазивного кандидоза, но не влияет на общую выживаемость. Постоянная поддерживающая антифунгальная терапия снижала частоту рецидивов кандидоза по сравнению с интермиттирующим лечением, но уровни развития микробиологической резистентности были одинаковыми в обеих группах.
Пероральные полиеновые средства, такие как амфотерицин B или нистатин, менее эффективны для предупреждения кандидоза слизистой оболочки. В тоже время было установлено, что итраконазол 200 мг в сутки был эффективен как противорецидивная терапия орофарингеального кандидоза в течение 6 месяцев. Показано, что 64-80% пациентов с флуконазол-рефрактерными инфекциями излечиваются от орофарингеального кандидоза при использовании перорального раствора итраконазола. Оральный раствор амфотерицина В был также успешно использован при лечении резистентного к флуконазолу кандидозу слизистой оболочки полости рта.
Микафунгин или каспофунгин внутривенно в дозе 50 мг в сутки могут быть обоснованным альтернативным лечением, особенно при лечении кандидоза, вызванного флуконазол-резистентными штаммами, однако их применение ограничивается высокой стоимостью лечения. Внутривенная антифунгальная терапия может иногда не понадобиться, если применяются или гамма-интерферон или гранулоцитарно-моноцитарный колониестимулирующий фактор в комбинации с пероральной антифунгальной терапией.
У больных со СПИДом рецидивы кандидоза пищевода встречаются довольно часто, и для предотвращения рецидивов эффективна длительная супрессивная терапия флуконазолом (100 мг/день).
Подводя итоги изложенному, сформируем следующие ключевые рекомендации:
Первичный эпизод орофарингеального кандидоза можно лечить назначением местно нистатина 500 тыс ЕД четыре раза в день или натамицина 100 мг 4 раза в день (рассасывание таблеток, нанесение на слизистую оболочку размельченных таблеток) в течение 7-14 дней, однако нужно быть готовым, что эффективность такого лечения ниже, чем лечение азоловыми препаратами.
Препаратами выбора для лечения орофарингеального кандидоза остаются пероральный флуконазол 100 мг/день в течение 7-14 дней или оральный раствор итраконазола 200 мг/день в течение 7-14 дней.
3. Кетоконазол и капсулы итраконазола менее эффективны для лечения орофарингеального кандидоза, чем флуконазол, из-за нестабильной абсорции в пищеварительном тракте.
Орофарингеальный кандидоз, ассоциированный с зубными протезами, для окончательного излечения требует полной дезинфекции последнего.
Резистентные к терапии флуконазолом случаи кандидоза пищевода необходимо лечить раствором итраконазола (не менее 200 мг/день per os ), вориконазолом (200 мг 2 раза в день) или каспофунгином (50 мг в день) или микафунгином (50 мг в день), или внутривенным амфотерицином B (0,3-0,7 мг/кг/день ) до получения клинического ответа.
Проведение in vitro тестов на чувствительность к антимикотикам не обязательно при первичных эпизодах как орофарингеального кандидоза, так и при кандидозе пищевода, но может быть полезным для выбора терапии у больных с резистентным или рецидивирующим течением заболевания.
У больных ВИЧ/СПИД лечение основной инфекции антиретровирусной терапией является важнейшим фактором предотвращения рецидивов и лечения кандидоза.
Диагностика и принципы лечения кандидоза кишечника.
Дифференциальный диагноз кандидоза и кандидоносительства в кишечнике может представлять определенные трудности. Довольно частая ошибка – постановка диагноза кандидоза только на основании выявления факта роста дрожжеподобных грибов в фекалиях. Между тем этот факт может отражать транзиторное кандидоносительство.
Для диагностики кандидоза, впрочем равно как и для любой другой оппортунистической инфекции, важно не только продемонстрировать возбудитель, но и доказать его участие в патологическом процессе. Один из принципиальных критериев диагноза оппортунистической инфекции – наличие поломов в системе антимикробной резистентности, а для рассматриваемой нами формы поражения это дефицит облигатной бактериобиоты – естественных конкурентов микромицетов. Таким образом, диагноз дисбиоза кишечника с избыточным ростом грибов рода Candida устанавливают при наличии следующих критериев (9):
синдром кишечной диспепсии,
лабораторно подтвержденный дисбиоз кишечника,
Эндоскопические исследования с цитологическим изучением препаратов мало информативны, так как чаще всего патологических изменений не выявляют. Дифференциальный диагноз кандидоза кишечника проводят так же с инфекционными колитами, гельминтозами и паразитарными поражениями кишечника, ферментопатиями, опухолями, синдромом раздраженной толстой кишки.
В плане лечения пациента с кандидозом кишечника необходимо предусмотреть следующие терапевтические направления (10):
Лечение основного заболевания согласно принятым стандартам
Селективная деконтаминация кишечника, направленная на устранение причины заболевания – грибов рода Candida
Назначение про- и пребиотиков и других препаратов, способствующих восстановлению естественной антимикробной резистентности слизистой оболочки кишечника с целью предотвращения рецидивов дисбиоза
Симптоматическая терапия и диетотерапия.
Для селективной деконтаминации при кандидозе кишечника чаще используют малорезорбируемые полиеновые антимикотики (нистатин и натамицин). Так же сообщается об антифунгальной активности некоторых синтетических (например, хинолоновых) и биологических энтеросептиков (например, включающих живые культуры Saccharomyces boulardi ). Эффективность этих препаратов как антимикотиков окончательно еще придется оценить в сравнительных исследованиях, однако уже сейчас можно говорить о некоторых преимуществах и недостатках этих средств. Хинолоновые препараты обладают широким спектром антибактериальной и антипротозойной активности, что делает их предпочтительными при микст-инфекциях кишечника. В то же время их выраженная антибактериальная активность может угнетающе сказываться на резидентной нормобиоте и на эффективности одновременно назначаемых пробиотических средств.
Препараты, содержащие живые штаммы Saccharomyces spp кроме энтеросептического, показали иммуномодулирующий эффект (за счет стимуляции выработки IgA слизистой оболочкой кишечника). Однако последние наблюдения демонстрируют серьезную опасность применения их в группах больных с выраженными иммунодефицитами. Так описано 92 случая инвазивных микозов, вызванных сахаромицетами у больных с типичными факторами риска (пациенты с цитопенией, а также получающие антибиотики и имеющие установленный внутривенный катетер), причем 40% больных получали биопрепараты, содержавшие Saccharomyces boulardi (11).
Нистатин, исторически один из первых антимикотических препаратов, по- прежнему широко применяется в нашей стране и за рубежом. Как показали результаты анализов ЦМИ «Фармэксперт», в 2001 г в натуральном выражении, то есть по числу проданных упаковок (единиц) препарата на отечественном рынке антимикотиков на 1-м месте оказался именно нистатин (12). Для селективной деконтаминации при кандидозе кишечника нистатин назначают внутрь в виде таблеток по 250 и 500 тыс ЕД, суточная доза обычно 3-4 млн ЕД, а курсы лечения продолжаются 2-3 недели. Однако нестабильность активного вещества (нистатин в значительной степени теряет активность после пребывания на солнечном свете и открытом воздухе) и раздражающее действие на слизистые оболочки (при приеме препарата иногда отмечают тошноту, рвоту и диарею) ограничивают применение этого препарата.
Успешное решение основной задачи – селективной деконтаминации – позволяет рассчитывать на успех в деле восстановления и консолидации эубиоза – т.е. стойкого устранения дефицита нормобиоты кишечника. С этой целью традиционно используют про- и пребиотики.
Возможно, именно биологическая несовместимость фармакопейных и резидентных штаммов нормобиоты является причиной побочных эффектов (усиление диареи и симптомов раздражения кишечника) и неэффективности лечения при применении пробиотиков. Нужно полагать, что при коррекции дисбиоза кишечника правильнее с патогенетических позиций не пытаться «привить» в кишечнике пробиотический штамм, а стимулировать «остатки» резидентных штаммов, которыми индивидуум был контаминирован еще со времени первых контактов с кожей и слизистыми оболочками матери. Вероятнее всего, именно эти резидентные штаммы нормобиоты наиболее благоприятны для здоровья человека, в том числе с позиций иммунологической совместимости. Если допустить, что каждый пациент в определенной степени «нормобиотически» индивидуален, то логичнее использовать для коррекции дисбиоза пребиотики.
Выбор пребиотиков, т.е. стимуляторов интестинального роста резидентной нормобиоты, не содержащих живые культуры нормобиоты, сегодня достаточно широк. Действующим началом таких средств может являться лактулоза, пектин, некоторые биологически-активные продукты обмена облигатных бактерий и другие.
Одним из наиболее эффективных современных отечественных средств с выраженным пребиотическим эффектом является Эубикор. Препарат содержит инактивированные нежизнеспособные дрожжи Saccharomyces cerevisiae ( vini ), пищевые волокна, витамины, аминокислоты, макро- и микроэлементы. Известно, что пищевые волокна, не подвергаясь изменениям ферментами пищеварительного тракта, легко достигают толстой кишки, где они метаболизируются анаэробной микробиотой до короткоцепочечных жирных кислот. Последние являются главными энергетическими источниками в слизистой оболочке толстой кишки, они стимулируют пролиферацию ее клеток, образование слизи и кровообращение.
Кроме того, пищевые волокна создают дополнительную площадь для адгезии различных бактерий кишечника. Таким образом, в просвете толстой кишки многократно возрастает число мест фиксации облигатных микроорганизмов, что приводит к значительному увеличению их количества и возрастанию метаболической активности кишечного содержимого. При этом на пищевых волокнах в первую очередь фиксируются именно бифидо- и лактобактерии. С другой стороны, хорошо известен детоксикационный эффект пищевых волокон в отношении патогенных микроорганизмов и их токсинов.
К настоящему времени накоплена обширная доказательная база поливалентной клинической эффективности Эубикора (16, 17). В результате повышения защитных и регуляторных свойств нормальной кишечной микрофлоры Эубикор оказывает иммуномодулирующее и антиоксидантное действие, способствует восстановлению ферментативной функции кишечника, защитного барьера его слизистой оболочки. Выраженные сорбционные свойства и метаболические эффекты Эубикора определяют характерное для него антитоксигенное и десенсибилизирующее действие. Назначают Эубикор по 1-2 пакетика 3 раза в день, добавляя в пищу, курсами по 3-4 недели. Эубикор может применяться вместе с препаратами для селективной деконтаминации кишечника, а также для профилактики дисбиоза кишечника.
В период терапии больным кандидозом кишечника рекомендуют пищевой рацион с ограничением продуктов, содержащих простые углеводы (сахар, сладкие фрукты и ягоды, кондитерские изделия, мед, молоко, белокочанная капуста, бобовые, квас, пиво).
Остается добавить, что больные кандидозом пищеварительного тракта, сложные с позиций диагностики и лечения, должны быть обследованы в специализированных микологических клиниках.
1. Шевяков М.А., Колб З.К., Борзова Ю.В. Рецидивирующий кандидоз пищевода у ВИЧ-неинфицированных больных. (Тезисы докладов 7-х Кашкинских чтений) // Проблемы медицинской микологии, 2004, Т.6., N 2, С.131.
2. Баранцевич Е.П., Баранцевич Н.Е., Богомолова Т.С., Колб З.К., Лебедева Т.С. Орофарингеальный кандидоз у больных гемобластозами. Проблемы медицинской микологии, 2005, Т.7, №1, С.19-20.
5. .Parente F., et al., Prevention of symptomatic recurrences of esophageal candidiasis in AIDS patient after the first episode: a prospective open study. American Journal of Gastroenterology, 1994, Vol. 89, N3, P.416-420.
6. Suleiman J., et al. Open label study of micafungin in the treatment of esophageal candidiasis. Abstracts of 42 nd ICAAC, September 27-30, 2002, San Diego, USA, (M-892).
7. Шевяков М.А., Мелехина Ю.Э., Выборнова И.В., Колб З.К., Богомолова Т.С., Климко Н.Н.. Видовая принадлежность и чувствительность к флуконазолу возбудителей рецидивирующего кандидоза пищевода у ВИЧ-негативных больных // Тезисы докладов научно-практической конференции по медицинской микологии ( VIII Кашкинские чтения), Проблемы медицинской микологии, 2005, Том 7, №2, С.81.
8. Mattheus R. Candida immunotherapy. Trends in Medical Mycology, Joint meeting of the 9 th Congress of the ECMM and the 7 th TIFI, 2003, S11.04, P.53.
9. Климко Н.Н и др. Перечень основных методов и критериев диагностики микозов (методические рекомендации). СП б МАПО, Санкт-Петербург, 2001, 24 с.
10. Шевяков М.А. Кандидоз органов пищеварения: клиника, диагностика и лечение: автореф. дис…докт.мед.наук. – СПб., 2000. – 41 с.
13. Кандидоз кишечника в общетерапевтической практике (клиническое значение, диагностика, лечение): Учебно-методическое пособие. – СПб., 2004. – 36 с.
14. Шевяков М.А., Колб З.К., Савельева О.Г., Борзова Ю.В. Характер нарушений интестинального микробоценоза у пациентов с синдромом раздраженного кишечника. (Тезисы докладов на 6 научно-практической конференции по медицинской микологии (6 Кашкинские чтения.) // Проблемы медицинской микологии, 2003, Т.5, №2, С. 43-44.
15. Глушанова Н.А., Блинов А.И. Биосовместимость пробиотических и резидентных лактобацилл. Тезисы 7-го Славяно-Балтийского научного форума «Санкт-Петербург – Гастро-2005» // Гастроэнтерология Санкт-Петербурга, №1-2, 2005, М31.
16. Гриневич В.Б. и др. Теоретическое и практическое обоснование клинического применения препарата «Эубикор» при заболеваниях органов пищеварения (методическое пособие), Санкт-Петербург, 2002, 22 С.
17. Гриневич В.Б. и др. Клинические аспекты диагностики и лечения дисбиоза кишечника в общетерапевтической практике (учебно-методическое пособие). Санкт-Петербург, 2003, 37 С.
Современные представления о грибковой патологии пищеварительного тракта
В гастроэнтерологии, как и в других областях медицины, динамично развиваются методы диагностики и лечения грибковых инфекций на основе изучения физиологии, микробиологии, фармакологии, молекулярной патологии и медицинской генетики. Детально изучаются уже
В гастроэнтерологии, как и в других областях медицины, динамично развиваются методы диагностики и лечения грибковых инфекций на основе изучения физиологии, микробиологии, фармакологии, молекулярной патологии и медицинской генетики. Детально изучаются уже известные варианты болезни и описываются редкие и новые нозологические формы.
Грибы, являясь нормальными комменсалами желудочно-кишечного тракта (ЖКТ), становятся патогенными при определенных условиях. Это касается в основном дрожжеподобных грибов Candida spp., виды и даже штаммы которых различаются по факторам агрессии, способности к адгезии и инвазии [15].
Candida albicans — наиболее частый возбудитель кандидоза ЖКТ. Однако в последние годы большую роль играют Candida non-albicans (C. krusei, C. tropicalis, C. kefyr, C. glabrata, C. parapsilosis); у лиц с иммунодефицитом их пропорция составляет более 50%, при «относительно нормальном» иммунитете — 15%.
Дрожжеподобный гриб Cryptococcus neoformans в патологии ЖКТ как этиологический фактор играет незначительную роль. Он чаще поражает нервную систему и, диссеминируя из первичного очага, вовлекает гастроинтестинальный тракт. Описаны единичные случаи (чаще посмертно) криптококкового эзофагита, стоматита, терминального илеита, колита, холецистита, панкреатита. Как правило, они относились к ВИЧ-серопозитивным больным, а также к пациентам, страдающим гипергаммаглобулинемией Е с рецидивирующими абсцессами печени и перианальной зоны.
Грибы Aspergillus spp. редко вызывают болезнь ЖКТ, только в случаях стойкой нейтропении, кахексии и при других отягощающих состояниях.
Грибы класса Zygomycetes могут привести к развитию интестинального зигомикоза, который, как правило, ассоциирован с амебиазом, голоданием, диабетическим кетоацидозом, почечным гемодиализом. Penicillium spp. и Geotrichum поражают ЖКТ также редко.
ЖКТ покрыт слизистой оболочкой, состоящей из двух компонентов — поверхностного скользкого, слизистого слоя, по которому микроорганизмы легко продвигаются вдоль всего ЖКТ, и более глубокого плотного гликопротеинового слоя с остатками сиаловой кислоты, который формирует физиологический барьер. Адгезия и последующая инвазия грибов через этот плотный слой возможны только благодаря продукции грибами протеолитических «ферментов инвазии»: коагулазы, каталазы, козеиназы, фосфолипазы, а также фибриллярных протеиновых комплексов и эндотоксинов [15].
При физиологическом благополучии между макро- и микроорганизмами существует определенное равновесие, в котором играют роль, с одной стороны, факторы устойчивости организма к микроскопическим грибам, а с другой — факторы патогенности грибов.
Устойчивость организма зависит от принадлежности к группам риска и состояния иммунной системы.
Перечислим факторы риска развития грибковых инфекций ЖКТ.
Важным компонентом защиты от инвазии ЖКТ является иммунная система, ассоциированная с кишечником. Клеточная часть этой системы включает в себя интраэпителиальные лимфоциты, которые препятствуют дисперсии возбудителя через lamina propria и агрегации в пейеровых бляшках. В-лимфоциты кишечника участвуют в продукции секреторных IgA и IgM, которые уменьшают способность грибов к адгезии.
Т-клетки здорового организма продуцируют защитный интерферон, усиливают фагоцитоз, активируют Т-цитотоксические лимфоциты. СД4 и СД8 укрепляют местный иммунитет в ЖКТ. Причем оказалось, что цитотоксичность СД8 играет более существенную роль в предотвращении заболевания, чем предполагали раньше.
В защите важны также макрофагальный и нейтрофильный фагоцитоз, препятствующие диссеминации грибковой, особенно кандидозной инфекции.
У ВИЧ-пациентов и больных с нейтропенией, у которых фагоцитоз резко подавлен, местная инвазия и диссеминация инфекции наступают очень быстро. Известно, что нейтрофилы хотя и не могут полностью защитить слизистую оболочку ЖКТ от «атаки» грибов, но благодаря собственной «киллерной» субстанции через специфический механизм запускают активацию комплемента, который усиливает фагоцитоз. Следует отметить, что фагоцитоз особенно важен при кандидозной инфекции, но «не работает» в тканях против капсулированных криптококков и большинства мицелиальных грибов.
Облигатные микроорганизмы желудка и кишечника (аэробные лактобациллы, анаэробные бифидум-бактерии, нормальная кишечная палочка и др.) также играют защитную роль. Применение антибиотиков убивает, наряду с патогенными, и эти «полезные» бактерии, открывая на слизистой оболочке рецепторы адгезии для грибов [2].
Нельзя не упомянуть также о Helicobacter pylori, который довольно часто обитает в желудке, вызывает гастрит, язвенную болезнь, а иногда оказывает канцерогенное воздействие. В свою очередь, лечение хеликобактериоза антибиотиками приводит к активации грибов Candida и кандидозу желудка [1]. Ассоциации грибов с Helicobacter pylori и другими бактериями в ЖКТ встречаются нередко, что требует продуманного адекватного подхода к тактике лечения.
В желудке могут также присутствовать Saccharomyces cerevisiae и некоторые виды Candida, способные сбраживать и ферментировать до винного спирта сахара, попадающие с пищей в желудок. Этот феномен называется синдромом «пивоваренного завода» [14].
Вирулентность грибов, патогенные факторы, как и полисахариды (маннаны), плазмокоагулаза, эндотоксины, липиды, глюкоконъюгаты, влияют на развитие заболевания. Даже от внутривидовых способностей грибов зависит, разовьются ли в каждом конкретном случае кандиданосительство или болезнь [13]. Например, серотип В Candida albicans считается более вирулентным и наиболее распространенным возбудителем орофарингеального кандидоза у ВИЧ-инфицированных больных, также он поражает генитоуринарную систему и нередко выделяется из зева у гомосексуалистов.
Диагностика
Тщательное изучение анамнеза, выявление факторов риска, хронических заболеваний ЖКТ, патогномоничных клинических симптомов играют большую роль в своевременности установления диагноза.
В последние годы за счет эндоскопических технологий расширились возможности диагностики грибкового эзофагита и гастрита. При эзофагогастродуоденоскопии обращают внимание на гиперемию и изъязвления слизистой, наличие белых налетов и «пленок», сужение просвета пищевода, скопление слизи. Во время этой процедуры в обязательном порядке следует брать материал для микробиологического исследования, так как не всегда этиология этих проявлений грибковая. Причем информативность исследования налетов выше, чем биоптатов (95% по сравнению с 39%).
Особенно перспективны видеоинформационные эндоскопические исследования с цифровой регистрацией и анализом изображения. Четкое разграничение неизмененных и патологических тканей, анализ гистохимических процессов в слизистой оболочке пищеварительного тракта возможны с помощью эндоскопической спектроскопии и флюоресцентной эндоскопии. Видео- и колоноскопия, хромоэндоскопия на фоне «лекарственного» сна по технологии «Диантек» имеют высокое качество исследования, безболезненность манипуляций и отсутствие стресса и страха у пациентов.
Следует, однако, подчеркнуть, что инвазивные манипуляции при воспаленной слизистой ЖКТ небезопасны, могут способствовать грибковой и бактериальной диссеминации, а иногда приводят к травме и перфорации стенки пищевода или желудка. Эндоскопическая ультрасонография с допплеровским картированием, контрастным усилением тканевых и сосудистых структур перспективна, она позволяет детально дифференцировать все слои стенки пищеварительного тракта. Неинвазивные методы — виртуальная эндоскопия, позволяющая получить трехмерное изображение, магнитно-резонансное исследование — имеют большое будущее [3].
Изучение гастродуоденальной моторики с помощью сцинтиграфии и электрогастрографии также важно для диагностики и назначения дополнительных лекарственных средств, так как нарушение двигательной функции желудка, «застой» в ЖКТ создают условия для размножения грибов и бактерий. Колоноскопия дает возможность оценить состояние слизистой кишечника, наличие белого налета, язвенных дефектов и т. д. В перспективе в гастроэнтерологии будут внедряться методы, в основе которых лежат новые научно-практические исследования: иммуноферментный анализ фекальных антигенов, ПЦР и даже генетическое тестирование [3].
Еще одним достаточно информативным методом в гастроэнтерологии является рентгенография пищевода, желудка и кишечника. Она дает возможность выявить дефекты наполнения (депо бария), изъязвления, деформацию, конвергенцию складок, изменения контуров и глубины перистальтики, сужение или расширение пищеводной трубки. С помощью рентгенографии желудка можно оценить его моторику, своевременность эвакуации пищевого комка, что важно для понимания патогенеза заболевания.
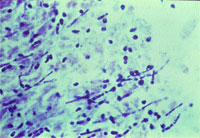 |
| Рисунок 1. Кандидозный эзофагит. Почкующиеся клетки и псевдогифы грибов Candida albicans на эзофагеальной язве |
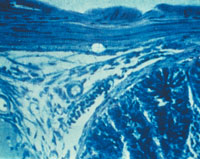 |
| Рисунок 2. Кандидозный энтерит. Утолщенные ворсинки и дефект слизистой тонкой кишки; псевдогифы грибов Candida |
Лабораторное подтверждение грибкового заболевания ЖКТ возможно при микроскопировании и/или культуральном исследовании смывов со слизистых оболочек полости рта и пищевода, содержимого желудка и кишечника, патологических «пленок», налетов и др. Количественная оценка грибов в биосубстратах должна проводиться в сопоставлении с клинической симптоматикой, с учетом наличия фоновых заболеваний, микст-инфекции и т. д. Например, обнаружение на слизистых единичных колоний Candida не является основанием для постановки диагноза «кандидоз» у иммунокомпетентных пациентов.
В кале диагностическую значимость приобретает количество колоний (более 10 5 –10 6 ). По-другому, с более низким диагностическим порогом, интерпретируются результаты посевов у иммуносупрессированных лиц, при нейтропении у больных СПИДом и в отделениях интенсивной терапии. Следует также обращать внимание на способность грибов к вегетации и образованию мицелия, так как это является одним из лабораторных признаков, подтверждающих диагноз кандидоза.
Гистологическое (окраска по Гомори–Гроккоту, ШИК-реакция) и цитологическое (окраска по Романовскому–Гимзе) исследования биоптатов позволяют обнаружить тканевые формы грибов. Многими авторами эти методы рассматриваются как наиболее достоверные. Кроме того, мицелий и псевдомицелий в тканях служат подтверждением наличия инвазивной формы грибковой инфекции ЖКТ (рис. 1, 2).
Кандидоз
Это наиболее распространенная грибковая оппортунистическая висцеральная патология. Агрессивные свойства грибов Candidа проявляются в их способности через стадию адгезии и инвазии поражать слизистые оболочки любых органов, в том числе и ЖКТ. Причем «атаке» подвергается чаще всего многослойный плоский эпителий полости рта и пищевода, реже — однослойный цилиндрический эпителий кишечника. Поэтому, как правило, в верхних отделах ЖКТ происходит инвазия грибов Candidа, а в отделах, расположенных ниже желудка, — колонизация. В то же время в кишечнике даже на стадии адгезии могут наблюдаться клинические симптомы — проявления неинвазивного кандидоза [10].
Язвенные дефекты пищевода, желудка и кишечника поддерживают грибковую колонизацию вплоть до инвазии. Желудочно-кишечный кандидоз нередко приводит к кандидемии.
Классификация кандидоза
I. Орофарингеальный кандидоз.
II. Кандидозный эзофагит.
III. Кандидоз желудка.
V. Кандидозный проктосигмоидит.
VI. Перианальный кандидоз.
VII. Секреторная диарея, ассоциированная с кандидозом.
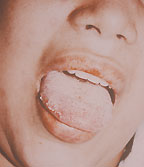 |
| Рисунок 3. Кандидозный глоссит. Типичные белые налеты и эрозии на воспаленной инфильтрированной слизистой |
Среди всех локализаций кандидоза пищеварительного тракта орофарингеальная занимает 1-е место (рис. 3).
О кандидозе полости рта упоминал еще Гиппократ, а впервые описал его хирург Лангенберк в 1839 г.
Кандидозный стоматит у новорожденных — распространенное заболевание. В первые дни после рождения слизистые ребенка устойчивы к грибам.
В дальнейшем недостаточная секреция IgA и постепенное снижение антимикробного иммунитета, переданного от матери, приводят к высокой заболеваемости. Патогномоничный синдром — белые творожистые налеты на слизистой полости рта, так называемая «молочница» [16].
Кандидоз ассоциирован также с ношением протезов. При этом развивается атрофический кандидоз, огромное количество грибов скапливается в щечных складках на фоне красного точечного воспаления слизистой; инвазия, как правило, отсутствует.
Кандидозный эзофагит в стационарах общего профиля встречается у 1,3–2,8% больных, в отделениях трансплантации — до 4%, при диссеминированном карциноматозе — от 2,8 до 6,7%. Это заболевание протекает часто без субъективных жалоб и выявляется случайно при «сплошных» исследованиях населения в 1–7% случаев [5, 17]. Иногда больные отмечают боль и дискомфорт при прохождении твердой и жидкой пищи, дисфагию, гиперсаливацию. По глубине поражения эндоскопически выделяют четыре типа — от легкого отека, гиперемии, единичных белых налетов
С. А. Бурова, доктор медицинских наук, профессор
Национальная академия микологии, ГКБ № 81, Москва
Как лечить кандидоз кишечника
При первых признаках кишечных расстройств обращайтесь в клинику МЕДИКОМ. Наши специалисты точно знают, как диагностировать и как лечить кандидоз кишечника, поэтому вы сможете получить эффективную квалифицированную помощь. Чтобы определить причину, вызвавшую кандидоз кишечника, и максимально быстро устранить ее, наши врачи используют новейшие технологии, большой опыт и все возможности медцентра: современное оснащение и лабораторную диагностику.
Кандидоз кишечника — это инфекционное заболевание, возникающее при ослабленном иммунитете. Кишечный кандидоз или молочница кишечника вызывается дрожжеподобными грибками рода кандида (Candida spp.) Как правило, это микроорганизмы из собственной флоры больного. Такое заболевание слизистой может проявиться в любом возрасте и причинить немало дискомфорта.
Виды и формы кандидоза кишечника
Кишечный кандидоз различают по причине возникновения:
Чаще всего диагностируется первый вид. Болезнь возникает при угнетенном иммунитете и нарушении микрофлоры. Тогда кишечная кандида распространяется в кишечном просвете, не прорастая вглубь. Спровоцировать диффузный кандидоз может онкология или иммунодефицитные состояния. Развивается этот вид заболевания с трансформацией возбудителя в нитчатую форму. Попадая в кровоток, грибок разносится по всему организму.
Кандидоз кишечника имеет три формы течения:
При инвазивном кишечном кандидозе могут поражаться печень и поджелудочная железа. Патология переходит в висцеральную форму.
Причины кандидоза кишечника
Когда иммунная система работает эффективно, то дрожжевой грибок в кишечнике не опасен для человека. Но если иммунитет ослаблен, условно патогенная микрофлора активизируется и начинает бурно размножаться, подавляя полезные микроорганизмы. Причинами кандидоза кишечника могут быть состояния, при которых происходит угнетение иммунитета. Чаще всего это:
Очень часто заболевание вызывается сочетанием нескольких условий. Носителями грибов кандида в кишечнике являются более 80 % людей. У людей с хорошо работающей иммунной системой инвазивный кандидоз кишечника не встречается.
Пути заражения кандидозом кишечника
Грибковые микроорганизмы в норме присутствуют в организме человека. Патогенной грибковая флора становится при увеличении ее количества. Заболевание возникает при дисбактериозе или кишечной инфекции: в процессе жизнедеятельности производятся определенные вещества, которые вместе с ферментами образовывают токсичные соединения, раздражающие внутреннюю оболочку кишечника.
В случае инвазии возбудитель кандидоза кишечника попадает в организм через пищеварительный тракт.
Симптомы и признаки кандидоза кишечника
Симптомы кандидоза кишечника неинвазивного и инвазивного вида существенно различаются. Диффузный кандидоз характеризуется яркими проявлениями интоксикации, лихорадкой, абдоминальными болями, жидким стулом с кровью.
Фокальный инвазивный кандидоз в кишечнике развивается, как правило, в результате осложнения неспецифического язвенного колита или язвы двенадцатиперстной кишки. В таком случае симптомы кандидоза кишечника совпадают с признаками основного заболевания.
Преимущественно диагностируется неинвазивная молочница в кишечнике. Самочувствие больного при этом удовлетворительное:
Попутно могут обостриться аллергические болезни. Признаками кандидоза в ЖКТ могут служить вялость, потеря аппетита. Кал при кандидозе кишечника может содержать слизь и беловатые хлопья, но это встречается редко.
Особенности кандидоза кишечника при беременности
Кишечный кандидоз у беременных встречается в 2–3 раза чаще, чем у небеременных. Это связано с гормональной перестройкой и снижением иммунитета под воздействием прогестерона. Молочница может протекать бессимптомно. Но грибковые поражения кишечника и влагалища взаимосвязаны. Поэтому проблема дисбактериоза кишечника в период вынашивания приобретает важное значение. Своевременное лечение кандидоза кишечника и дисбиотических состояний при беременности снижает риск осложнений в период гестации, во время и после родов.
Особенности кандидоза кишечника у детей
Присутствие Candida в кишечнике у ослабленных и недоношенных детей — явление распространенное. Поражение ЖКТ грибком у ребенка вызывает колики, запоры, боль и дискомфорт в животе. Пища плохо усваивается. Заражается новорожденный, проходя по родовым путям, пораженным молочницей. Факторами, вызывающими появление кандидоза кишечника у ребенка, могут стать недоношенность, недостаточная гигиена, время прорезывания зубов.
Осложнения кандидоза кишечника
При отсутствии лечения возникают такие последствия кандидоза кишечника, как:
Кроме того, запущенная патология становится источником инфекции для окружающих. И прежде всего — родных и близких.
Диагностика кандидоза кишечника
Инфицирование кишечника грибком довольно сложно дифференцируется с другими заболеваниями, так как специфической симптоматики у молочницы нет. Поэтому диагностика кандидоза кишечника невозможна без лабораторных анализов и методов инструментального исследования. Для определения болезни врач назначает:
Культуральное исследование позволяет выявить возбудителя и определить его чувствительность к антибиотикам.
Как лечить кандидоз кишечника
Анализы на кандидоз кишечника и грамотная оценка симптомов позволяют врачу назначить эффективное лечение заболевания. Основным принципом терапии есть нормализация микрофлоры ЖКТ. Для этого протокол лечения кандидоза кишечника предусматривает:
Диета при кандидозе кишечника исключает сладкое, жирное, жареное, сдобу. Народные средства (отвары, настои) применяют только с разрешения врача. Также показаны пребиотики и пробиотики для устранения нарушения микрофлоры кишечника.
Профилактика кандидоза кишечника
Профилактические меры предусматривают устранение вызывающих патологический процесс факторов. Этому способствует:
Нельзя заниматься самоназначением антибиотиков. Люди, находящиеся в группе риска, должны регулярно обследоваться.
Чем лечится кандида в кишечнике
Гастроэнтерология Санкт-Петербурга, 2006, №1-2, С.17-20.
Стандарты и перспективы фармакотерапии кандидоза органов пищеварения.
Увеличение числа пациентов с иммунодефицитными состояниями различного генеза привело к тому, что перед гастроэнтерологами и врачами других специальностей все чаще встает проблема выбора противогрибкового препарата для лечения кандидоза органов пищеварения.
При выборе антифунгального препарата для лечения кандидоза клиницисту приходится учитывать семь факторов: особенности патогенеза, локализацию поражения, чувствительность возбудителя, профиль безопасности антимикотика, состояние функции печени и почек пациента, возможное взаимодействие с другими лекарственными средствами, и, наконец, фармакоэкономические аспекты.
Патогенез и диагностика кандидоза верхних отделов пищеварительного тракта.
Патогенез кандидоза слизистых оболочек пищеварительного тракта характеризуется последовательным прохождением следующих этапов – адгезии, инвазии, кандидемии и висцеральных поражений. На первом этапе микромицеты адгезируются к эпителиоцитам какого-либо участка слизистой оболочки. В дальнейшем, дефекты в системе резистентности позволяют микромицетам через трансформацию в псевдомицелий внедряться (инвазироваться) в слизистую оболочку и подлежащие ткани. Цитопения – решающий фактор, который позволяет инвазирующимся грибам достигать стенки сосудов, разрушать ее и циркулировать в сосудистом русле. Такой этап называют кандидемией. В отсутствие адекватной терапии кандидемия приводит к образованию очагов инвазивного кандидоза в висцеральных органах, например, легких, эндокарде, центральной нервной системе, печени и др.
Лечение орофарингеального кандидоза и кандидоза пищевода.
Целью терапии этих форм кандидоза является устранение симптомов и клинических признаков заболевания, а также предотвращение рецидивов. Для части больных орофарингеальным кандидозом имеют значение «местные» факторы риска – ношение зубных протезов и ингаляции кортикостероидных средств. Симптомы орофарингеального кандидоза и кандидоза пищевода, кроме субъективного дискомфорта, могут нарушить глотание пищи и жидкостей и значительно снизить качество жизни.
Для лечения орофарингеального кандидоза можно применять как местнодействующие, так и системно действующие антифунгальные препараты. За рубежом для местной терапии применяют, например, пастилки с клотримазолом или суспензию нистатина или амфотерицина В. В нашей стране такие лекарственные формы не зарегистрированы, и обычно местная терапия представляет собой разжевывание или нанесение на слизистую оболочку размельченных таблеток нистатина или натамицина в дозах от 1 до 4 млн ЕД в сутки с продолжительностью курса до 2-4 недель (2). Эффективность такого «импровизированного» метода лечения в контролируемых исследованиях не изучалась. Местная антифунгальная терапия при кандидозе пищевода неэффективна.
При кандидозе слизистых оболочек верхних отделов пищеварительного тракта могут применяться системнодействующие азоловые антимикотики (кетоконазол, флуконазол, итраконазол или вориконазол), внутривенный амфотерицин B (особенно при азоло-рефрактерных инфекциях), а также – эхинокандиновые препараты (каспофунгин, микафунгин и др.). Для больных с нарушенным актом глотания разработаны парентеральные формы антимикотических средств.
Эффективность и безопасность азоловых и эхинокандиновых антимикотических препаратов изучена достаточно хорошо, накоплена большая база доказательств, основанных на контролируемых исследованиях, а результаты этих работ легли в основу терапевтических стандартов (3-5).
Эффективность антимикотической терапии орофарингеального кандидоза оценена в ходе многократных рандомизированных проспективных исследованиях как у больных со СПИДом, так и у больных со злокачественными новообразованиями. Большинство пациентов отвечают на лечение местнодействующими формами полиеновых антимикотических средств (пастилки и суспензия). Однако у ВИЧ-инфицированных больных рецидивы кандидоза полости рта могут произойти скорее после местной терапии, чем после лечения флуконазолом в дозе 100 мг в сутки, а резистентность возбудителя может развиться при применении любого варианта терапии. Так же было показано, что флуконазол по эффективности превосходит кетоконазол, а итраконазол в капсулах эквивалентен по эффективности кетоконазолу. Пероральный раствор итраконазола лучше абсорбируется в пищеварительном тракте, чем капсульная форма, и сопоставим по эффективности с флуконазолом. Доза раствора итраконазола 2,5 мг/кг 2 раза в день была рекомендована для лечения орофарингеального кандидоза у детей от 5 лет и старше. Эффективность орального раствора итраконазола может быть значительнее за счет суммирования местного и системного эффекта.
Рецидивирующее течение кандидоза обычно отмечают у больных с иммунодефицитами, особенно при СПИДе. Показано, что длительная поддерживающая терапия флуконазолом эффективна для предупреждения развития орофарингельного кандидоза как у онкологических, так и у больных со СПИДом. Длительная поддерживающая терапия флуконазолом ВИЧ-инфицированных больных снижает частоту инвазивного кандидоза, но не влияет на общую выживаемость. Постоянная поддерживающая антифунгальная терапия снижала частоту рецидивов кандидоза по сравнению с интермиттирующим лечением, но уровни развития микробиологической резистентности были одинаковыми в обеих группах.
Пероральные полиеновые средства, такие как амфотерицин B или нистатин, менее эффективны для предупреждения кандидоза слизистой оболочки. В тоже время было установлено, что итраконазол 200 мг в сутки был эффективен как противорецидивная терапия орофарингеального кандидоза в течение 6 месяцев. Показано, что 64-80% пациентов с флуконазол-рефрактерными инфекциями излечиваются от орофарингеального кандидоза при использовании перорального раствора итраконазола. Оральный раствор амфотерицина В был также успешно использован при лечении резистентного к флуконазолу кандидозу слизистой оболочки полости рта.
Микафунгин или каспофунгин внутривенно в дозе 50 мг в сутки могут быть обоснованным альтернативным лечением, особенно при лечении кандидоза, вызванного флуконазол-резистентными штаммами, однако их применение ограничивается высокой стоимостью лечения. Внутривенная антифунгальная терапия может иногда не понадобиться, если применяются или гамма-интерферон или гранулоцитарно-моноцитарный колониестимулирующий фактор в комбинации с пероральной антифунгальной терапией.
У больных со СПИДом рецидивы кандидоза пищевода встречаются довольно часто, и для предотвращения рецидивов эффективна длительная супрессивная терапия флуконазолом (100 мг/день).
Подводя итоги изложенному, сформируем следующие ключевые рекомендации:
Первичный эпизод орофарингеального кандидоза можно лечить назначением местно нистатина 500 тыс ЕД четыре раза в день или натамицина 100 мг 4 раза в день (рассасывание таблеток, нанесение на слизистую оболочку размельченных таблеток) в течение 7-14 дней, однако нужно быть готовым, что эффективность такого лечения ниже, чем лечение азоловыми препаратами.
Препаратами выбора для лечения орофарингеального кандидоза остаются пероральный флуконазол 100 мг/день в течение 7-14 дней или оральный раствор итраконазола 200 мг/день в течение 7-14 дней.
3. Кетоконазол и капсулы итраконазола менее эффективны для лечения орофарингеального кандидоза, чем флуконазол, из-за нестабильной абсорции в пищеварительном тракте.
Орофарингеальный кандидоз, ассоциированный с зубными протезами, для окончательного излечения требует полной дезинфекции последнего.
Резистентные к терапии флуконазолом случаи кандидоза пищевода необходимо лечить раствором итраконазола (не менее 200 мг/день per os ), вориконазолом (200 мг 2 раза в день) или каспофунгином (50 мг в день) или микафунгином (50 мг в день), или внутривенным амфотерицином B (0,3-0,7 мг/кг/день ) до получения клинического ответа.
Проведение in vitro тестов на чувствительность к антимикотикам не обязательно при первичных эпизодах как орофарингеального кандидоза, так и при кандидозе пищевода, но может быть полезным для выбора терапии у больных с резистентным или рецидивирующим течением заболевания.
У больных ВИЧ/СПИД лечение основной инфекции антиретровирусной терапией является важнейшим фактором предотвращения рецидивов и лечения кандидоза.
Диагностика и принципы лечения кандидоза кишечника.
Дифференциальный диагноз кандидоза и кандидоносительства в кишечнике может представлять определенные трудности. Довольно частая ошибка – постановка диагноза кандидоза только на основании выявления факта роста дрожжеподобных грибов в фекалиях. Между тем этот факт может отражать транзиторное кандидоносительство.
Для диагностики кандидоза, впрочем равно как и для любой другой оппортунистической инфекции, важно не только продемонстрировать возбудитель, но и доказать его участие в патологическом процессе. Один из принципиальных критериев диагноза оппортунистической инфекции – наличие поломов в системе антимикробной резистентности, а для рассматриваемой нами формы поражения это дефицит облигатной бактериобиоты – естественных конкурентов микромицетов. Таким образом, диагноз дисбиоза кишечника с избыточным ростом грибов рода Candida устанавливают при наличии следующих критериев (9):
синдром кишечной диспепсии,
лабораторно подтвержденный дисбиоз кишечника,
Эндоскопические исследования с цитологическим изучением препаратов мало информативны, так как чаще всего патологических изменений не выявляют. Дифференциальный диагноз кандидоза кишечника проводят так же с инфекционными колитами, гельминтозами и паразитарными поражениями кишечника, ферментопатиями, опухолями, синдромом раздраженной толстой кишки.
В плане лечения пациента с кандидозом кишечника необходимо предусмотреть следующие терапевтические направления (10):
Лечение основного заболевания согласно принятым стандартам
Селективная деконтаминация кишечника, направленная на устранение причины заболевания – грибов рода Candida
Назначение про- и пребиотиков и других препаратов, способствующих восстановлению естественной антимикробной резистентности слизистой оболочки кишечника с целью предотвращения рецидивов дисбиоза
Симптоматическая терапия и диетотерапия.
Для селективной деконтаминации при кандидозе кишечника чаще используют малорезорбируемые полиеновые антимикотики (нистатин и натамицин). Так же сообщается об антифунгальной активности некоторых синтетических (например, хинолоновых) и биологических энтеросептиков (например, включающих живые культуры Saccharomyces boulardi ). Эффективность этих препаратов как антимикотиков окончательно еще придется оценить в сравнительных исследованиях, однако уже сейчас можно говорить о некоторых преимуществах и недостатках этих средств. Хинолоновые препараты обладают широким спектром антибактериальной и антипротозойной активности, что делает их предпочтительными при микст-инфекциях кишечника. В то же время их выраженная антибактериальная активность может угнетающе сказываться на резидентной нормобиоте и на эффективности одновременно назначаемых пробиотических средств.
Препараты, содержащие живые штаммы Saccharomyces spp кроме энтеросептического, показали иммуномодулирующий эффект (за счет стимуляции выработки IgA слизистой оболочкой кишечника). Однако последние наблюдения демонстрируют серьезную опасность применения их в группах больных с выраженными иммунодефицитами. Так описано 92 случая инвазивных микозов, вызванных сахаромицетами у больных с типичными факторами риска (пациенты с цитопенией, а также получающие антибиотики и имеющие установленный внутривенный катетер), причем 40% больных получали биопрепараты, содержавшие Saccharomyces boulardi (11).
Нистатин, исторически один из первых антимикотических препаратов, по- прежнему широко применяется в нашей стране и за рубежом. Как показали результаты анализов ЦМИ «Фармэксперт», в 2001 г в натуральном выражении, то есть по числу проданных упаковок (единиц) препарата на отечественном рынке антимикотиков на 1-м месте оказался именно нистатин (12). Для селективной деконтаминации при кандидозе кишечника нистатин назначают внутрь в виде таблеток по 250 и 500 тыс ЕД, суточная доза обычно 3-4 млн ЕД, а курсы лечения продолжаются 2-3 недели. Однако нестабильность активного вещества (нистатин в значительной степени теряет активность после пребывания на солнечном свете и открытом воздухе) и раздражающее действие на слизистые оболочки (при приеме препарата иногда отмечают тошноту, рвоту и диарею) ограничивают применение этого препарата.
Успешное решение основной задачи – селективной деконтаминации – позволяет рассчитывать на успех в деле восстановления и консолидации эубиоза – т.е. стойкого устранения дефицита нормобиоты кишечника. С этой целью традиционно используют про- и пребиотики.
Возможно, именно биологическая несовместимость фармакопейных и резидентных штаммов нормобиоты является причиной побочных эффектов (усиление диареи и симптомов раздражения кишечника) и неэффективности лечения при применении пробиотиков. Нужно полагать, что при коррекции дисбиоза кишечника правильнее с патогенетических позиций не пытаться «привить» в кишечнике пробиотический штамм, а стимулировать «остатки» резидентных штаммов, которыми индивидуум был контаминирован еще со времени первых контактов с кожей и слизистыми оболочками матери. Вероятнее всего, именно эти резидентные штаммы нормобиоты наиболее благоприятны для здоровья человека, в том числе с позиций иммунологической совместимости. Если допустить, что каждый пациент в определенной степени «нормобиотически» индивидуален, то логичнее использовать для коррекции дисбиоза пребиотики.
Выбор пребиотиков, т.е. стимуляторов интестинального роста резидентной нормобиоты, не содержащих живые культуры нормобиоты, сегодня достаточно широк. Действующим началом таких средств может являться лактулоза, пектин, некоторые биологически-активные продукты обмена облигатных бактерий и другие.
Одним из наиболее эффективных современных отечественных средств с выраженным пребиотическим эффектом является Эубикор. Препарат содержит инактивированные нежизнеспособные дрожжи Saccharomyces cerevisiae ( vini ), пищевые волокна, витамины, аминокислоты, макро- и микроэлементы. Известно, что пищевые волокна, не подвергаясь изменениям ферментами пищеварительного тракта, легко достигают толстой кишки, где они метаболизируются анаэробной микробиотой до короткоцепочечных жирных кислот. Последние являются главными энергетическими источниками в слизистой оболочке толстой кишки, они стимулируют пролиферацию ее клеток, образование слизи и кровообращение.
Кроме того, пищевые волокна создают дополнительную площадь для адгезии различных бактерий кишечника. Таким образом, в просвете толстой кишки многократно возрастает число мест фиксации облигатных микроорганизмов, что приводит к значительному увеличению их количества и возрастанию метаболической активности кишечного содержимого. При этом на пищевых волокнах в первую очередь фиксируются именно бифидо- и лактобактерии. С другой стороны, хорошо известен детоксикационный эффект пищевых волокон в отношении патогенных микроорганизмов и их токсинов.
К настоящему времени накоплена обширная доказательная база поливалентной клинической эффективности Эубикора (16, 17). В результате повышения защитных и регуляторных свойств нормальной кишечной микрофлоры Эубикор оказывает иммуномодулирующее и антиоксидантное действие, способствует восстановлению ферментативной функции кишечника, защитного барьера его слизистой оболочки. Выраженные сорбционные свойства и метаболические эффекты Эубикора определяют характерное для него антитоксигенное и десенсибилизирующее действие. Назначают Эубикор по 1-2 пакетика 3 раза в день, добавляя в пищу, курсами по 3-4 недели. Эубикор может применяться вместе с препаратами для селективной деконтаминации кишечника, а также для профилактики дисбиоза кишечника.
В период терапии больным кандидозом кишечника рекомендуют пищевой рацион с ограничением продуктов, содержащих простые углеводы (сахар, сладкие фрукты и ягоды, кондитерские изделия, мед, молоко, белокочанная капуста, бобовые, квас, пиво).
Остается добавить, что больные кандидозом пищеварительного тракта, сложные с позиций диагностики и лечения, должны быть обследованы в специализированных микологических клиниках.
1. Шевяков М.А., Колб З.К., Борзова Ю.В. Рецидивирующий кандидоз пищевода у ВИЧ-неинфицированных больных. (Тезисы докладов 7-х Кашкинских чтений) // Проблемы медицинской микологии, 2004, Т.6., N 2, С.131.
2. Баранцевич Е.П., Баранцевич Н.Е., Богомолова Т.С., Колб З.К., Лебедева Т.С. Орофарингеальный кандидоз у больных гемобластозами. Проблемы медицинской микологии, 2005, Т.7, №1, С.19-20.
5. .Parente F., et al., Prevention of symptomatic recurrences of esophageal candidiasis in AIDS patient after the first episode: a prospective open study. American Journal of Gastroenterology, 1994, Vol. 89, N3, P.416-420.
6. Suleiman J., et al. Open label study of micafungin in the treatment of esophageal candidiasis. Abstracts of 42 nd ICAAC, September 27-30, 2002, San Diego, USA, (M-892).
7. Шевяков М.А., Мелехина Ю.Э., Выборнова И.В., Колб З.К., Богомолова Т.С., Климко Н.Н.. Видовая принадлежность и чувствительность к флуконазолу возбудителей рецидивирующего кандидоза пищевода у ВИЧ-негативных больных // Тезисы докладов научно-практической конференции по медицинской микологии ( VIII Кашкинские чтения), Проблемы медицинской микологии, 2005, Том 7, №2, С.81.
8. Mattheus R. Candida immunotherapy. Trends in Medical Mycology, Joint meeting of the 9 th Congress of the ECMM and the 7 th TIFI, 2003, S11.04, P.53.
9. Климко Н.Н и др. Перечень основных методов и критериев диагностики микозов (методические рекомендации). СП б МАПО, Санкт-Петербург, 2001, 24 с.
10. Шевяков М.А. Кандидоз органов пищеварения: клиника, диагностика и лечение: автореф. дис…докт.мед.наук. – СПб., 2000. – 41 с.
13. Кандидоз кишечника в общетерапевтической практике (клиническое значение, диагностика, лечение): Учебно-методическое пособие. – СПб., 2004. – 36 с.
14. Шевяков М.А., Колб З.К., Савельева О.Г., Борзова Ю.В. Характер нарушений интестинального микробоценоза у пациентов с синдромом раздраженного кишечника. (Тезисы докладов на 6 научно-практической конференции по медицинской микологии (6 Кашкинские чтения.) // Проблемы медицинской микологии, 2003, Т.5, №2, С. 43-44.
15. Глушанова Н.А., Блинов А.И. Биосовместимость пробиотических и резидентных лактобацилл. Тезисы 7-го Славяно-Балтийского научного форума «Санкт-Петербург – Гастро-2005» // Гастроэнтерология Санкт-Петербурга, №1-2, 2005, М31.
16. Гриневич В.Б. и др. Теоретическое и практическое обоснование клинического применения препарата «Эубикор» при заболеваниях органов пищеварения (методическое пособие), Санкт-Петербург, 2002, 22 С.
17. Гриневич В.Б. и др. Клинические аспекты диагностики и лечения дисбиоза кишечника в общетерапевтической практике (учебно-методическое пособие). Санкт-Петербург, 2003, 37 С.