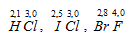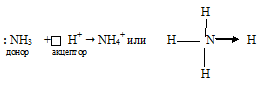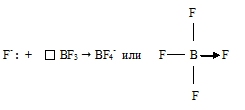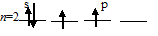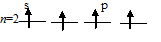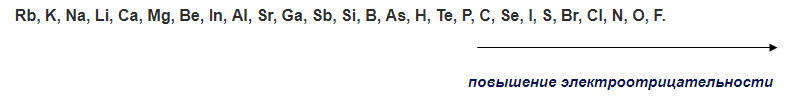Чем можно объяснить направленность ковалентной связи
Механизм образования ковалентной связи
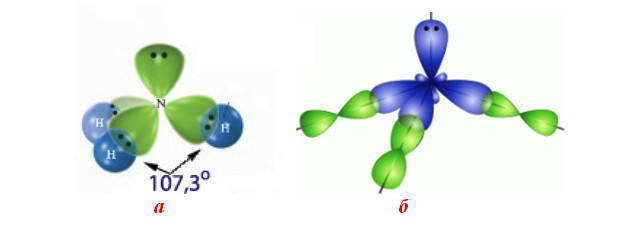
Ковалентная связь. Строение молекулы воды
Задание 61.
Какую химическую связь называют ковалентной? Чем можно объяснить направленность ковалентной связи? Как метод валентных связей (ВС) объясняет строение молекулы воды?
Решение:
Связь, осуществляемая за счёт образования электронных пар, в одинаковой мере принадлежащей обоим атомам, называется ковалентной неполярной. Ковалентные связи определённым образом ориентированы в пространстве, т. е. имеют направленность. Причина того, что молекулы могут иметь линейное плоское или какое-либо другое строение, заключается в использовании атомами для образования связей разные орбитали и разное их количество. Молекулы, которые имеют дипольный момент, не являются линейными, а молекулы, у которых нет дипольного момента – линейные.
Полярная ковалентная связь
Значения ЭО водорода, хлора, брома, йода, фтора соответственно равны: 2,1; 3,0; 2,8; 2,5; 4,0. Исходя из значений ЭО элементов в соединениях
наиболее полярная связь в молекуле ВгF, так как разница электроотрицательностей между фтором и бромом наибольшая – 1,2 (4,0 – 2,8 = 1,2), чем у HCl и IСl.
Донорно-акцепторная связь
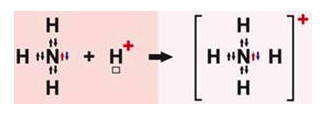
Катион аммония NH 4+ образуется по донорно-акцепторному механизму:
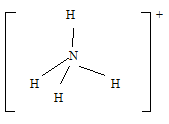
Он имеет форму правильного тетраэдра:
В ионе аммония каждый атом водорода связан с атомом азота общей электронной парой, одна из которых реализована по донорно-акцепторному механизму. Важно отметить, что связи H — N, образованные по различным механизмам, никаких различий не имеют, т. е. все они равноценны. Донором является атом азота, а акцептором – атом водорода.
Ион BF 4- образуется из BF3 и иона F-. Этот ион образуется за счёт того, что неподелённая электронная пара иона F- «встраивается» в валентную оболочку атома бора ковалентносвязанной молекулы BF3:
В ионе BF 4- донором является ион фтора, а акцептором атом бора молекулы BF3.
Донорно-акцепторная связь в структурных формулах изображается стрелкой 
Метод валентных связей (ВС)
Задание 64.
Как метод валентных связей (ВС) объясняет линейное строение молекулы ВеCl2 и тетраэдрическое СН4?
Решение
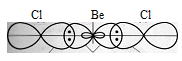
а) Представления метода валентных связей позволяют объяснить геометрию многих молекул. Так молекула BeCl2 состоит из одного атома бериллия и двух атомов хлора. Атом бериллия в возбуждённом состоянии имеет один s-электрон и один р-электрон. При образовании BeCl2 возникают две ковалентные связи. Одна из них должна быть s — p связью, образованная за счёт перекрывания s-облака атома бериллия и р-облака атома хлора, другая (р — р связь) за счёт перекрывания р-облака атома бериллия и р-облака атома хлора.
Рис. 1. Трёхатомная молекула BeCl2
В результате такого расположения гибридных облаков молекула BeCl2 имеет линейное строение.
б) Молекула СН4 состоит из одного атома углерода и четырёх атомов водорода, между которыми возникают четыре ковалентные связи. Атом углерода в возбуждённом состоянии имеет четыре неспаренных электрона, один из них на s-орбитали и три на р-орбиталях:
Заполнение внешнего энергетического уровня атома углерода в основном состоянии:
Заполнение внешнего энергетического уровня атома углерода в возбуждённом состоянии:
Рис. 2. Схема строения молекулы СН4;
Метан, несвязывающих электронных пар нет.
Образование сигма-связи и пи-связи
Задание 65.
Какую ковалентную связь называют 

Решение:
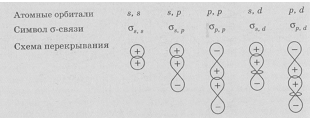
Связь, образующаяся за счёт перекрывания вдоль линии, соединяющей два атома, называют 

Варианты перекрывания атомных орбиталей, приводящие к образованию 
Связь, образованная за счёт перекрывания атомных орбиталей по обе стороны от межъядерной оси, называется 

Рис. 1.Схемы образования 
Ковалентная связь
Ковалентная связь — самый распространенный тип химической связи, осуществляемой при взаимодействии атомов элементов с одинаковыми или близкими значениями электроотрицательности.
Ковалентная связь — это связь атомов с помощью общих электронных пар.
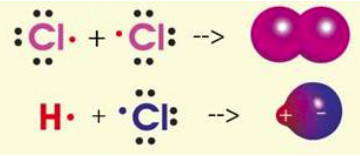
После открытия электрона проводилось много попыток разработать электронную теорию химической связи. Наиболее удачными стали работы Льюиса (1916 г.), который предложил рассматривать образование связи как следствие возникновения общих для двух атомов электронных пар. Для этого каждый атом предоставляет одинаковое количество электронов и пытается окружить себя октетом или дублетом электронов, характерным для внешней электронной конфигурации инертных газов. Графически образования ковалентных связей за счет неспаренных электронов по методу Льюиса изображают с помощью точек, обозначающих внешние электроны атома.
Механизм образования ковалентной связи
Основным признаком ковалентной связи является наличие общей электронной пары, принадлежащей обоим химически соединенным атомам, поскольку пребывание двух электронов в поле действия двух ядер энергетически выгоднее, чем нахождение каждого электрона в поле своего ядра. Возникновение общей электронной пары связи может проходить по разным механизмам, чаще — по обменному, а иногда — по донорно-акцепторных.
по принципу обменного механизма образования ковалентной связи каждый из взаимодействующих атомов поставляет на образование связи одинаковое количество электронов с антипараллельными спинами. К примеру:
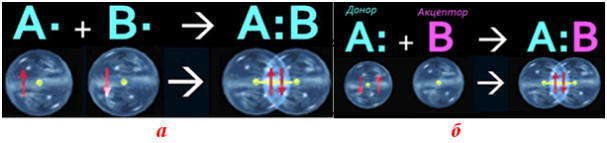
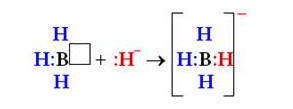
по донорно-акцепторному механизму двухэлектронная связь возникает при взаимодействии различных частиц. Одна из них — донор А: имеет неразделенную пару электронов (то есть такую, что принадлежит только одному атому), а другая — акцептор В — имеет вакантную орбиталь.
Частица, которая предоставляет для связи двухэлектронное облако (неразделенную пару электронов), называется донором, а частица со свободной орбиталью, которая принимает эту электронную пару, — акцептором.
Механизм образования ковалентной связи за счет двухэлектронного облака одного атома и вакантной орбитали другого называется донорно-акцепторным механизмом.
Донорно-акцепторный связь иначе называется семиполярной, поскольку на атоме-доноре возникает частичный эффективный положительный заряд δ+ (за счет того, что его неразделенная пара электронов отклонилась от него), а на атоме-акцепторе — частичный эффективный отрицательный заряд δ- (благодаря тому, что происходит смещение в его сторону неразделенной электронной пары донора).
Метод валентных связей
Первая квантово-механическая теория ковалентной связи была создана Гейтлером и Лондоном (в 1927 г.) для описания молекулы водорода, а затем была применена Полингом к многоатомным молекулам. Эта теория называется методом валентных связей, основные положения которого кратко можно изложить так:
Гибридизация атомных орбиталей
Несмотря на то, что в образовании ковалентных связей участвуют электроны s-, p- или d-орбиталей, имеющие различные форму и различную ориентацию в пространстве, во многих соединениях эти связи оказываются равноценными. Для объяснения этого явления было введено понятие «гибридизация».
Гибридизация — это процесс смешивания и выравнивания орбиталей по форме и энергии, при котором происходит перераспределение электронных плотностей близких по энергии орбиталей, в результате чего они становятся равноценными.
Основные положения теории гибридизации:
При образовании молекул (или отдельных фрагментов молекул) чаще всего встречаются такие типы гибридизации:
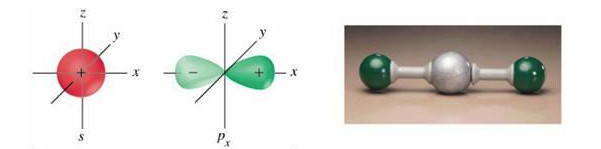
Следовательно, число несвязанных электронных пар центрального атома и их размещения на гибридизованных орбиталях влияет на геометрическую конфигурацию молекул.
Характеристики ковалентной связи
Ковалентная связь имеет набор определенных свойств, которые определяют ее специфические особенности, или характеристики. К ним, кроме уже рассмотренных характеристик «энергия связи» и «длина связи», относятся: валентный угол, насыщенность, направленность, полярность и тому подобное.
1. Валентный угол — это угол между соседними осями связей (то есть условными линиями, проведенными через ядра химически соединенных атомов в молекуле). Величина валентного угла зависит от природы орбиталей, типа гибридизации центрального атома, влияния неразделенных электронных пар, которые не участвуют в образовании связей.
2. Насыщенность. Атомы имеют возможности для образования ковалентных связей, которые могут формироваться, во-первых, по обменному механизму за счет неспаренных электронов невозбуждённого атома и за счет тех неспаренных электронов, которые возникают в результате его возбуждения, а во-вторых, по донорно акцепторному механизму. Однако общее количество связей, которые может образовывать атом, ограничено.
Насыщенность — это способность атома элемента образовывать с другими атомами определенное, ограниченное количество ковалентных связей.
Так, атомы элементов второго периода, которые имеют на внешнем энергетическом уровне четыре орбитали (одну s- и три р-), образуют связи, число которых не превышает четырех. Атомы элементов других периодов с большим числом орбиталей на внешнем уровне могут формировать больше связей.
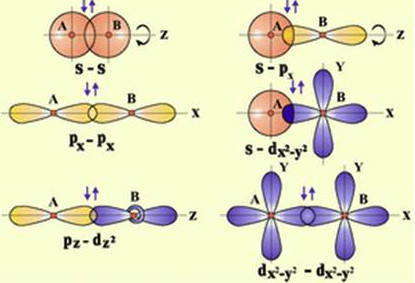
3. Направленность. В соответствии с методом, химическая связь между атомами обусловлена перекрытием орбиталей, которые, за исключением s-орбиталей, имеют определенную ориентацию в пространстве, что и приводит к направленности ковалентной связи.
Направленность ковалентной связи — это такое размещение электронной плотности между атомами, которое определяется пространственной ориентацией валентных орбиталей и обеспечивает их максимальное перекрытие.
Поскольку электронные орбитали имеют различные формы и различную ориентацию в пространстве, то их взаимное перекрытие может реализоваться различными способами. В зависимости от этого различают σ-, π- и δ- связи.
Сигма-связь (σ-связь) — это такое перекрытие электронных орбиталей, при котором максимальная электронная плотность концентрируется вдоль воображаемой линии, соединяющей два ядра.
Сигма-связь может образовываться за счет двух s-электронов, одного s- и одного р электрона, двух р-электронов или двух d-электронов. Такая σ-связь характеризуется наличием одной области перекрытия электронных орбиталей, она всегда одинарная, то есть образуется только одной электронной парой.
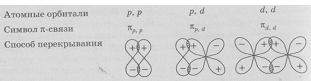
Разнообразие форм пространственной ориентации «чистых» орбиталей и гибридизованных орбиталей не всегда допускают возможность перекрывания орбиталей на оси связи. Перекрывания валентных орбиталей может происходить по обе стороны от оси связи — так называемое «боковое» перекрывания, которое чаще всего осуществляется при образовании π-связей.
Пи-связь (π-связь) — это перекрытие электронных орбиталей, при котором максимальная электронная плотность концентрируется по обе стороны от линии, соединяющей ядра атомов (т.е. от оси связи).
Пи-связь может образоваться при взаимодействии двух параллельных р-орбиталей, двух d-орбиталей или других комбинаций орбиталей, оси которых не совпадают с осью связи.
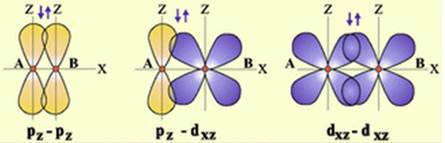
Кратность связи влияет на энергию: с повышением кратности растет ее прочность. Повышение кратности приводит к уменьшению межъядерного расстояния (длины связи) и увеличению энергии связи.
5. Полярность и поляризуемость. Электронная плотность ковалентной связи может по-разному располагаться в межъядерном пространстве.
Полярность — это свойство ковалентной связи, которое определяется областью расположения электронной плотности в межъядерном пространстве относительно соединенных атомов.
В зависимости от размещения электронной плотности в межъядерном пространстве различают полярная и неполярная ковалентные связи. Неполярной связью называется такая связь, при которой общее электронное облако размещается симметрично относительно ядер соединенных атомов и одинаково принадлежит обоим атомам.
Молекулы с полярной связью называются полярными, или гетероядерными. В молекулах с полярной связью обобщенная электронная пара смещается в сторону атома с большей электроотрицательностью. В результате на этом атоме возникает некоторый частичный отрицательный заряд (δ-), который называется эффективным, а у атома с меньшей электроотрицательностью — одинаковый по величине, но противоположный по знаку частичный положительный заряд ( δ+ ). Например, экспериментально установлено, что эффективный заряд на атоме водорода в молекуле хлорида водорода HCl — δH=+0,17, а на атоме хлора δCl=-0,17 абсолютного заряда электрона.
Чтобы определить, в какую сторону будет смещаться электронная плотность полярной ковалентной связи, необходимо сравнить электроны обоих атомов. По возрастанию электроотрицательности наиболее распространенные химические элементы размещаются в такой последовательности:
Полярные молекулы называются диполями — системами, в которых центры тяжести положительных зарядов ядер и отрицательных зарядов электронов не совпадают.
Диполь — это система, которая представляет собой совокупность двух точечных электрических зарядов, одинаковых по величине и противоположных по знаку, находящихся на некотором расстоянии друг от друга.
Расстояние между центрами притяжения называются длина диполя и обозначаются буквой l. Полярность молекулы (или связи) количественно характеризуется дипольным моментом μ, который в случае двухатомной молекулы равен произведению длины диполя на величину заряда электрона: μ=el.
Совместная электронное облако в молекуле может смещаться под действием внешнего электрического поля, в том числе и поля другой молекулы или иона.
Поляризуемость — это изменение полярности связи в результате смещения электронов, образующих связь, под действием внешнего электрического поля, в том числе и силового поля другой частицы.
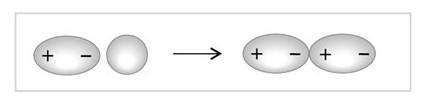
В отличие от постоянных, индуцированные диполи возникают лишь при действии внешнего электрического поля. Поляризация может вызывать не только поляризуемость связи, но и ее разрыв, при котором происходит переход связующего электронной пары к одному из атомов и образуются отрицательно и положительно заряженные ионы.
Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Свойства соединений с ковалентной связью
Вещества с ковалентными связями делятся на две неравные группы: молекулярные и атомные (или немолекулярные), которых значительно меньше, чем молекулярных.
Низкие температуры плавления, возгонки и кипения молекулярных веществ объясняются очень слабыми силами межмолекулярного взаимодействия в кристаллах. Именно поэтому для молекулярных кристаллов не присуща большая прочность, твердость и электрическая проводимость (лед или сахар). При этом вещества с полярными молекулами имеют более высокие температуры плавления и кипения, чем с неполярными. Некоторые из них растворимы в воде или других полярных растворителях. А вещества с неполярными молекулами, наоборот, лучше растворяются в неполярных растворителях (бензол, тетрахлорметан). Так, йод, у которого молекулы неполярные, не растворяется в полярной воде, но растворяется в неполярной CCl4 и малополярном спирте.
Кристаллы алмаза, кремния, кварца и подобные им по структуре — это атомные кристаллы, они представляют собой огромные «супермолекулы», поэтому их структурные формулы можно изобразить не полностью, а только в виде отдельного фрагмента, например:
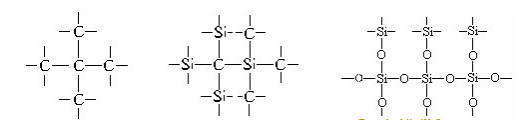
Немолекулярные (атомные) кристаллы, состоящие из соединенных между собой химическими связями атомов одного или двух элементов, относятся к тугоплавким веществам. Высокие температуры плавления обусловлены необходимостью затраты большого количества энергии для разрыва прочных химических связей при плавлении атомных кристаллов, а не слабого межмолекулярного взаимодействия, как в случае молекулярных веществ. По этой же причине многие атомные кристаллов при нагревании не плавятся, а разлагаются или сразу переходят в парообразное состояние (возгонка), например, графит сублимируется при 3700 o С.
Немолекулярные вещества с ковалентными связями нерастворимые в воде и других растворителях, большинство из них не проводит электрический ток (кроме графита, которому присуща электропроводность, и полупроводников — кремния, германия и др.).
Механизм образования ковалентной связи
Ковалентная связь. Строение молекулы воды
Задание 61.
Какую химическую связь называют ковалентной? Чем можно объяснить направленность ковалентной связи? Как метод валентных связей (ВС) объясняет строение молекулы воды?
Решение:
Связь, осуществляемая за счёт образования электронных пар, в одинаковой мере принадлежащей обоим атомам, называется ковалентной неполярной. Ковалентные связи определённым образом ориентированы в пространстве, т. е. имеют направленность. Причина того, что молекулы могут иметь линейное плоское или какое-либо другое строение, заключается в использовании атомами для образования связей разные орбитали и разное их количество. Молекулы, которые имеют дипольный момент, не являются линейными, а молекулы, у которых нет дипольного момента – линейные.
Полярная ковалентная связь
Значения ЭО водорода, хлора, брома, йода, фтора соответственно равны: 2,1; 3,0; 2,8; 2,5; 4,0. Исходя из значений ЭО элементов в соединениях
наиболее полярная связь в молекуле ВгF, так как разница электроотрицательностей между фтором и бромом наибольшая – 1,2 (4,0 – 2,8 = 1,2), чем у HCl и IСl.
Донорно-акцепторная связь
Катион аммония NH 4+ образуется по донорно-акцепторному механизму:
Он имеет форму правильного тетраэдра:
В ионе аммония каждый атом водорода связан с атомом азота общей электронной парой, одна из которых реализована по донорно-акцепторному механизму. Важно отметить, что связи H — N, образованные по различным механизмам, никаких различий не имеют, т. е. все они равноценны. Донором является атом азота, а акцептором – атом водорода.
Ион BF 4- образуется из BF3 и иона F-. Этот ион образуется за счёт того, что неподелённая электронная пара иона F- «встраивается» в валентную оболочку атома бора ковалентносвязанной молекулы BF3:
В ионе BF 4- донором является ион фтора, а акцептором атом бора молекулы BF3.
Донорно-акцепторная связь в структурных формулах изображается стрелкой 
Метод валентных связей (ВС)
Задание 64.
Как метод валентных связей (ВС) объясняет линейное строение молекулы ВеCl2 и тетраэдрическое СН4?
Решение
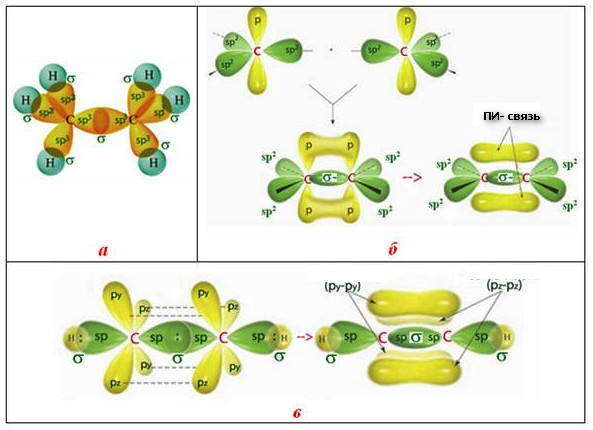
а) Представления метода валентных связей позволяют объяснить геометрию многих молекул. Так молекула BeCl2 состоит из одного атома бериллия и двух атомов хлора. Атом бериллия в возбуждённом состоянии имеет один s-электрон и один р-электрон. При образовании BeCl2 возникают две ковалентные связи. Одна из них должна быть s — p связью, образованная за счёт перекрывания s-облака атома бериллия и р-облака атома хлора, другая (р — р связь) за счёт перекрывания р-облака атома бериллия и р-облака атома хлора.
Рис. 1. Трёхатомная молекула BeCl2
В результате такого расположения гибридных облаков молекула BeCl2 имеет линейное строение.
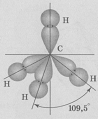
б) Молекула СН4 состоит из одного атома углерода и четырёх атомов водорода, между которыми возникают четыре ковалентные связи. Атом углерода в возбуждённом состоянии имеет четыре неспаренных электрона, один из них на s-орбитали и три на р-орбиталях:
Заполнение внешнего энергетического уровня атома углерода в основном состоянии:
Заполнение внешнего энергетического уровня атома углерода в возбуждённом состоянии:
Рис. 2. Схема строения молекулы СН4;
Метан, несвязывающих электронных пар нет.
Образование сигма-связи и пи-связи
Задание 65.
Какую ковалентную связь называют 

Решение:
Связь, образующаяся за счёт перекрывания вдоль линии, соединяющей два атома, называют 

Варианты перекрывания атомных орбиталей, приводящие к образованию 
Связь, образованная за счёт перекрывания атомных орбиталей по обе стороны от межъядерной оси, называется 

Рис. 1.Схемы образования