Чем можно объяснить возможное различие в значении удельной теплоемкости
Разница между удельной теплоемкостью и теплоемкостью
Главное отличие
Тепло — это одна из форм энергии, когда два объекта взаимодействуют, передача этой энергии от одного тела к другому весьма вероятна. Тепловая энергия прямо пропорциональна температуре, это означает, что повышение температуры автоматически приводит к увеличению тепловой энергии внутри тела и наоборот. Оба эти термина, удельная теплоемкость и теплоемкость, широко используются в термодинамике, поскольку оба относятся к энергии, необходимой для повышения температуры объекта. Удельная теплоемкость и теплоемкость очень похожи друг на друга с разницей в дополнительной переменной в удельной теплоемкости. Хотя многие люди используют эти термины как синонимы, поскольку их концепция в совокупности описывается как «удельная теплоемкость». Чтобы понять разницу между обоими этими терминами, необходимо знать о дополнительной переменной удельной теплоемкости. C ) или 1 Кельвин, тогда как удельная теплоемкость — это количество тепла, необходимое для повышения температуры вещества массой 1 кг или 1 г на 1 градус Цельсия (° C ) или 1 Кельвин.
Сравнительная таблица
Что такое удельная теплоемкость?
где
Q — добавленное тепло,
C — удельная
теплоемкость, ∆T — изменение температуры.
Это соотношение не остается в силе, когда происходит фазовый переход, что означает преобразование воды в газообразное состояние (точка кипения) или когда лед превращается в жидкое состояние (точка плавления. Это происходит потому, что тепло, отводимое или добавляемое во время фазового перехода, не приводить к изменению температуры.Когда речь идет о теоретической или лабораторной работе, используется удельная теплоемкость, а не теплоемкость, поскольку она также измеряет массу вещества или объекта.
Что такое теплоемкость?
Теплоемкость — это количество тепла, необходимое для повышения температуры вещества до 1 градуса Цельсия (° C) или 1 Кельвина. Втянутое тепло или повышение температуры не имеют ничего общего с массой вещества. Тепловая энергия прямо пропорциональна температуре, это означает, что повышение температуры автоматически приводит к увеличению тепловой энергии внутри тела и наоборот. Теплоемкость можно определить с помощью этого уравнения:
Где
Δ «> Δ Q — количество добавленного тепла,
C — удельная ТЕПЛО,
Δ «> Δ T — изменение температуры.
Количество теплоты и удельная теплоемкость
Вместо словосочетания «тепловая энергия» физики говорят сокращенно: «теплота».
Удобно сравнивать между собой величины, которые измерены численно. Поэтому, физики говорят о количестве тепловой энергии, или количестве теплоты.
Что такое количество теплоты
Рассмотрим чашку, в которой находится обыкновенная вода комнатной температуры.
Вычислим внутреннюю энергию холодной воды в чашке, получим число, которое можно обозначить так:
\(\large U_<\text<хол>> \left( \text <Дж>\right) \) – внутренняя энергия холодной воды.
Нагреем воду в чашке. Молекулы нагретой воды будут двигаться быстрее. Значит, горячая вода обладает большим количеством внутренней энергии.
Теперь посчитаем внутреннюю энергию горячей воды в чашке. Полученное число обозначим, как
\(\large U_<\text<горяч>> \left( \text <Дж>\right) \) – внутренняя энергия горячей воды.
Найдем разницу внутренней энергии для горячей и холодной воды.
Примечание: Вместо слова «разница» математики скажут «разность».
Мы получим еще одно число. Обозначим его символом Q. Число Q называют количеством теплоты. Именно эту тепловую энергию вода получила во время нагревания.
Примечание: Когда горячая вода остынет, она отдаст ровно столько тепловой энергии, сколько получила во время нагревания. Потому, что выполняется закон сохранения тепловой энергии.
\(\large Q \left( \text <Дж>\right) \) – тепловая энергия, количество теплоты.
Теплота, как и любая энергия, измеряется в системе СИ в Джоулях, в честь английского физика Джеймса Джоуля.
Примечание: Количество теплоты, так же, измеряют в Калориях.
Калория – это тепловая энергия, затраченная на нагревание 1 грамма воды на 1 градус Цельсия.
Джоуль и Калория связаны так:
От чего зависит количество теплоты
Количество теплоты, требуемое для нагревания тела, зависит от нескольких параметров.
От массы вещества
Нальем в одну кастрюльку 1 кг воды, а в другую, точно такую же кастрюльку – 2 килограмма воды.
Пусть, начальная температура воды о обеих кастрюльках равна +20 градусам Цельсия.
Будем нагревать эти кастрюльки по очереди на газовой плите, не меняя интенсивность огня конфорки.
Предположим, нам нужно повысить на 50 градусов Цельсия температуру воды в каждой кастрюльке.
Примечание: После нагревания воды на 50 градусов, конечная температура воды в каждой кастрюльке будет равна 70 градусам.
Чтобы нагреть на 50 градусов 1 килограмм воды, потребуется время. Однако, чтобы нагреть на этой же конфорке 2 килограмма воды на 50 градусов, потребуется больше времени.
Значит, количество теплоты, полученное водой, зависит от массы вещества, которое мы хотим нагреть.
Математики запишут фразу «количество теплоты зависит от массы» так:
Символом f обозначается зависимость.
\(\large m \left( \text <кг>\right) \) – масса нагреваемого вещества.
От разницы температур
Теперь возьмем две кастрюльки, и нальем в них по 1 кг воды. Начальная температура воды в кастрюльках одинаковая и равна +20 градусов Цельсия.
Одну кастрюльку будем нагревать дольше другой. Поэтому, температура воды будет выше в той кастрюльке, которую дольше нагревали.
Так как температура повысилась больше в кастрюльке, которую дольше нагревали, то физики скажут, что воде в этой кастрюльке передали большее количество теплоты.
Значит, количество теплоты зависит от разницы (т. е. разности) между начальной и конечной температурой.
\(\large t_<\text<конеч>> \left( \text <град>\right) \) – температура после нагревания;
\(\large t_<\text<нач>> \left( \text <град>\right) \) – температура до нагревания;
\(\large \Delta t \left( \text <град>\right) \) – разность температуры;
Математики фразу «количество теплоты зависит от разности температур» запишут так:
Символ f обозначает, что Q зависит от разницы температур.
От вида вещества
Теперь будем нагревать 1 килограмм воды и 1 килограмм подсолнечного масла.
Первоначальная температура каждого вещества +20 градусов Цельсия.
Измерим через 5 минут нагревания температуру воды и температуру масла.
Оказывается, за 5 минут масло нагреется до более высокой температуры. При этом и масло, и вода, получили одинаковое количество теплоты.
Значит, количество теплоты зависит от того, из какого вещества состоит тело.
Какие величины называют удельными
Физики часто применяют удельные величины, так как они достаточно удобны для вычислений.
Удельная величина – величина, приходящаяся на единицу массы, длины, площади, или объема.
В обычной жизни мы, так же, пользуемся удельными величинами. К примеру, цена товара – это удельная величина, так как она приходится на единицу товара. Зная количество товара, легко посчитать общую цену покупки.
Например, булочка стоит 20 рублей. Нужно купить 3 булочки. Общую сумму денег найдем, перемножив цену одной булочки (удельную величину) на количество штук.
Известно, что при горении топлива выделяется энергия. Удельная теплота сгорания и количество сгоревших килограммов топлива помогут посчитать выделившуюся тепловую энергию.
Что такое удельная теплоемкость
Возьмем 1 килограмм вещества и нагреем его на 1 градус Цельсия. Тепловая энергия, которую мы для этого затратили, называется удельной теплоемкостью.
Удельная теплоемкость – это энергия, затраченная для нагревания 1 килограмма на 1 градус.
Эту энергию обозначают латинским символом «c». Измеряют ее в Джоулях, деленных на килограмм и градус.
\(\large c \left( \frac<\text<Дж>> <\text<кг>\cdot \text<град>> \right) \) – удельная теплоемкость;
Примечания:
Удельные теплоемкости воды в различных агрегатных состояниях
В твердом состоянии (лед), вода будет иметь такую теплоемкость:
В жидком состоянии (вода), такую:
В газообразном состоянии (пар) при температуре 100 градусов Цельсия, такую:
Примечание: Удельные теплоемкости различных веществ можно найти в школьном справочнике физики.
Как связаны и чем отличаются количество теплоты и удельная теплоемкость
Будем рассматривать такие процессы, как нагревание и охлаждение.
Благодаря процессам нагревания и охлаждения мы можем обогреваться зимой с помощью русской печи. Сначала печь получит количество теплоты (тепловую энергию) от сгорающего топлива — дров. А затем, будет остывать и отдавать это количество теплоты всем телам, находящимся в помещении.
Отличия удельной теплоемкости от количества теплоты
Запомнить, что такое количество теплоты, и чем оно отличается от удельной теплоемкости, можно так (рис. ):
Связь количества теплоты и удельной теплоемкости — формула
то легко посчитать общую тепловую энергию – т. е. количество теплоты.
Для этого используем формулу:
\(\large Q \left( \text <Дж>\right) \) – количество теплоты, т. е. общая тепловая энергия;
\(\large c \left( \frac<\text<Дж>> <\text<кг>\cdot \text<град>> \right) \) – удельная теплоемкость;
\(\large m \left( \text <кг>\right) \) – масса вещества;
\(\large t_<\text<конеч>> \left( \text <град>\right) \) – температура после нагревания;
\(\large t_<\text<нач>> \left( \text <град>\right) \) – температура до нагревания;
Как по графику нагревания или охлаждения определить удельную теплоемкость
На примере покажем, как находить удельную теплоемкость по графику нагревания или охлаждения тела.
Дано твердое тело массой 2 килограмма. На рисунке 5 указано, как зависит температура этого тела от полученного количества теплоты. По горизонтали отложено количество теплоты, а по вертикали – температура некоторого тела, находящегося в твердом состоянии.
Определить удельную теплоемкость вещества, из которого состоит данное твердое тело.
Решение:
Тело нагрелось от \(\large t_ <1>= 0 \left( С \right) \) до температуры \(\large t_ <2>= 60 \left( С \right) \);
Разность температур равна 60 градусам Цельсия.
Масса тела 2 килограмма.
Полученное количество теплоты \(\large Q = 15000 \left( \text <Дж>\right) \).
Выпишем формулу, по которой можно посчитать тепловую энергию Q:
Подставим теперь значения в эту формулу для определения количества теплоты:
\[\large 15000 = c \cdot 2 \cdot 60 \]
Разделим обе части уравнения на число 10:
\[\large 1500 = c \cdot 2 \cdot 6 \]
Теперь разделим обе части уравнения на число 6:
\[\large 250 = c \cdot 2 \]
Разделив обе части на число 2, получим удельную теплоемкость твердого вещества:
Ответ: Удельная теплоемкость твердого вещества \(\large 125 \left( \frac<\text<Дж>> <\text<кг>\cdot \text<град>> \right) \)
Примечание: Тела могут обмениваться тепловой энергией с другими телами. Обмен энергией прекратится при наступлении теплового равновесия. Для решения задач нужно использовать удельные теплоемкости материалов, из которых изготовлены тела. А чтобы рассчитать переданное или полученное телом количество теплоты, нужно уметь применять закон сохранения энергии и составлять уравнение теплового баланса.
Лабораторная работа № 2
Лабораторная работа № 2 _____________________
Измерение удельной теплоёмкости твёрдого тела.
Цель: Экспериментально определить удельную теплоемкость твердого тела
Оборудование: калориметр, мензурка, термометр, весы, гири, металлические цилиндры на нитях, салфетка, сосуд с холодной водой, кипящая вода (один сосуд на весь класс).
Правила техники безопасности. Внимательно прочитайте правила и распишитесь в том, что обязуетесь их выполнять.
Осторожно! Горячая вода! Стекло! Будьте осторожны при работе с кипятком и нагретым телом. Не разливайте воду – возможны ожоги. Будьте осторожны при работе со стеклянной посудой (термометр, стакан, мензурка). Помните, стекло – хрупкий материал, легко трескается при ударах и резкой перемене температуры. Ртуть, содержащаяся в термометре, ядовита! Снимайте данные, не вынимая термометр из жидкости! На столе не должно быть никаких посторонних предметов.
С правилами ознакомлен(а), обязуюсь выполнять. ________________________
Налейте во внутренний стакан калориметра 100 – 150 мл воды комнатной температуры. Масса этой воды m 1 будет соответственно равна 100 – 150 г.
m 1 = ____________ г = _________________ кг
Нагрейте цилиндр в сосуде с горячей водой. Измерьте её температуру (эта температура и будет начальной температурой цилиндра t 2 ).
Измерьте температуру воды t в калориметре после опускания цилиндра.
С помощью весов определите массу m 2 металлического цилиндра,
предварительно осушив его салфеткой.
m 2 = ________ г = ______________ кг
Результаты измерений занесите в таблицу.
Масса воды в калориметре
Начальная температура воды
Начальная температура цилиндра
Общая температура воды и цилиндра
Q 1 = __________________________________________________________________________ Дж.
10. В полученном уравнении неизвестной величиной является удельная
теплоемкость с 2. Вычислим удельную теплоемкость цилиндра.

11. Сравните полученное значение удельной теплоемкости цилиндра с таблицей и
определите, из какого материала сделан цилиндр. ________________________
На каком законе основан данный метод определения удельной теплоёмкости вещества? _________________________________________________________
Чем можно объяснить возможное различие в значении удельной теплоёмкости, определённом экспериментально, с табличным? ____________ ______________________________________________________________________________________________________________________________________
акие способы повышения точности проведенных исследований вы можете предложить? ________________________________________________________ _________________________________________________________________________________________________________________________________________________________________________________________________________
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Ищем педагогов в команду «Инфоурок»
Номер материала: ДВ-519362
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
При детском омбудсмене в России создадут платформу для взаимодействия с родителями
Время чтения: 2 минуты
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
В Минпросвещения рассказали о формате обучения школьников после праздников
Время чтения: 1 минута
Поставщики интернета для школ будут работать с российским оборудованием
Время чтения: 1 минута
В России утвердили новый порядок формирования федерального перечня учебников
Время чтения: 1 минута
АСИ организует конкурс лучших управленческих практик в сфере детского образования
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Удельная теплоемкость вещества
Статья находится на проверке у методистов Skysmart.
Если вы заметили ошибку, сообщите об этом в онлайн-чат
(в правом нижнем углу экрана).
Нагревание и охлаждение
Эти два процесса знакомы каждому. Вот нам захотелось чайку, и мы ставим чайник, чтобы нагреть воду. Или ставим газировку в холодильник, чтобы охладить.
Логично предположить, что нагревание — это увеличение температуры, а охлаждение — ее уменьшение. Все, процесс понятен, едем дальше.
Но не тут-то было: температура меняется не «с потолка». Все завязано на таком понятии, как количество теплоты. При нагревании тело получает количество теплоты, а при нагревании — отдает.
В процессах нагревания и охлаждения формулы для количества теплоты выглядят так:
Нагревание
Охлаждение
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
В этих формулах фигурирует и изменение температуры, о котором мы сказали выше, и удельная теплоемкость, речь о которой пойдет дальше.
А вот теперь поговорим о видах теплопередачи.
Виды теплопередачи
Здесь все совсем несложно, их всего три: теплопроводность, конвекция и излучение.
Теплопроводность
Тот вид теплопередачи, который можно охарактеризовать, как способность тел проводить энергию от более нагретого тела к менее нагретому.
Речь о том, чтобы передать тепло с помощью соприкосновения. Признавайтесь, грелись же когда-нибудь возле батареи. Если вы сидели к ней вплотную, то согрелись вы благодаря теплопроводности. Обниматься с котиком, у которого горячее пузо, тоже эффективно.
Порой мы немного перебарщиваем с возможностями этого эффекта, когда на пляже ложимся на горячий песок. Эффект есть, только не очень приятный. Ну а ледяная грелка на лбу дает обратный эффект — ваш лоб отдает тепло грелке.
Конвекция
Когда мы говорили о теплопроводности, мы приводили в пример батарею. Теплопроводность — это когда мы получаем тепло, прикоснувшись к батарее. Но все вещи в комнате к батарее не прикасаются, а комната греется. Здесь вступает конвекция.
Дело в том, что холодный воздух тяжелее горячего (холодный просто плотнее). Когда батарея нагревает некий объем воздуха, он тут же поднимается наверх, проходит вдоль потолка, успевает остыть и спуститься обратно вниз — к батарее, где снова нагревается. Таким образом, вся комната равномерно прогревается, потому что все более горячие потоки сменяют все менее холодные.
Излучение
Пляж мы уже упоминали, но речь шла только о горячем песочке. А вот тепло от солнышка — это излучение. В этом случае тепло передается через волны.
Обоими способами. То тепло, которое мы ощущаем непосредственно от камина (когда лицу горячо, если вы расположились слишком близко к камину) — это излучение. А вот прогревание комнаты в целом — это конвекция.
Удельная теплоемкость: понятие и формула для расчета
Формулы количества теплоты для нагревания и охлаждения мы уже разбирали, но давайте еще раз:
Нагревание
Охлаждение
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
В этих формулах фигурирует такая величина, как удельная теплоемкость. По сути своей — это способность материала получать или отдавать тепло.
С точки зрения математики удельная теплоемкость вещества — это количество теплоты, которое надо к нему подвести, чтобы изменить температуру 1 кг вещества на 1 градус Цельсия:
Удельная теплоемкость вещества
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
Также ее можно рассчитать через теплоемкость вещества:
Удельная теплоемкость вещества
c — удельная теплоемкость вещества [Дж/кг*˚C]
C — теплоемкость вещества [Дж/˚C]
Величины теплоемкость и удельная теплоемкость означают практически одно и то же. Отличие в том, что теплоемкость — это способность всего вещества к передаче тепла. То есть формулу количества теплоты для нагревания тела можно записать в таком виде:
Количество теплоты, необходимое для нагревания тела
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
Онлайн-курсы физики в Skysmart не менее увлекательны, чем наши статьи!
Таблица удельных теплоемкостей
Удельная теплоемкость — табличная величина. Часто ее указывают в условии задачи, но при отсутствии в условии — можно и нужно воспользоваться таблицей. Ниже приведена таблица удельных теплоемкостей для некоторых (многих) веществ.
Фазовые переходы и уравнение теплового баланса
теория по физике 🧲 термодинамика
Фазовые переходы — это термодинамические процессы, приводящие к изменению агрегатного состояния вещества.
Плавление и отвердевание
Для расчета количества теплоты, необходимого для процесса плавления, следует применять формулу:
m — масса вещества, λ (Дж/кг) — удельная теплота плавления.
Плавление каждого вещества происходит при определенной температуре, которую называют температурой плавления. Все проводимое тепло идет на разрушение кристаллической решетки, при этом увеличивается потенциальная энергия молекул. Кинетическая энергия остается без изменения и температура в процессе плавления не изменяется.
Удельная теплота плавления показывает, какое количество теплоты необходимо сообщить 1 кг данного вещества, чтобы перевести его из твердого состояния в жидкое при условии, что оно уже нагрето до температуры плавления. В процессе отвердевания 1 кг данной жидкости, охлажденной до температуры отвердевания, выделится такое же количество теплоты.
Внимание! Удельная теплота плавления — табличная величина.
Определение Отвердевание, или кристаллизация — переход состояния из жидкого состояния в твердое (это процесс, обратный плавлению).
Отвердевание происходит при той же температуре, что и плавление. В процессе отвердевания температура также не изменяется. Количество теплоты, выделяемое в процессе отвердевания:
Парообразование и конденсация
Количество теплоты, необходимое для процесса кипения, вычисляют по формуле:
m — масса вещества, r (Дж/кг) — удельная теплота парообразования.
Парообразование происходит при определенной температуре, которую называют температурой кипения. В отличие от испарения, процесс парообразования идет со всего объема жидкости. Несмотря на то, что к кипящему веществу подводят тепло, температура не изменяется. Все затраты энергии идут на увеличение промежутком между молекулами. Температура кипения зависит от рода вещества и внешнего атмосферного давления.
Удельная теплота парообразования показывает, какое количество теплоты необходимо затратить, чтобы перевести в пар 1 кг жидкости, нагретой до температуры кипения. Такое же количество теплоты выделится в процессе конденсации 1 кг пара, охлажденного до температуры конденсации.
Внимание! Удельная теплота парообразования — табличная величина.
Определение Конденсация — процесс, обратный кипению. Это переход вещества из газообразного состояния в жидкое.
Конденсация происходит при температуре кипения, которая также не изменяется во время всего процесса. Количество теплоты, выделяемое в процессе конденсации:
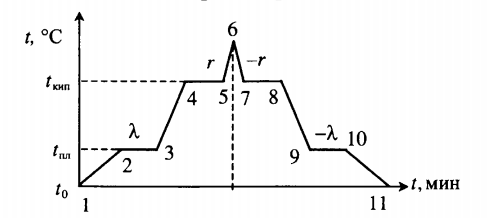
Тепловые процессы при нагревании и охлаждении
Все фазовые переходы, а также процессы нагревания и остывания вещества можно отобразить графически. Посмотрите на график фазовых переходов вещества:
Он показывает зависимость температуры вещества от времени в процессе его нагревания и остывания. Опишем процессы, отображаемые на графике, в таблице.
| Процесс | Что происходит | Количество выделенной теплоты | ||||||||||||||||||||||||||||||||||||||||||
| 1–2 | Нагревание твердого тела | |||||||||||||||||||||||||||||||||||||||||||
| 6–7 | Охлаждение пара |
| Что происходит | График | Формула количества теплоты | |||||||||||||||||||||||||||||||
| Полностью растопили лед, имеющий отрицательную температуру. | 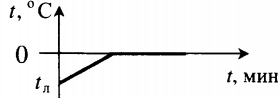 | ||||||||||||||||||||||||||||||||
| Лед, взятый при отрицательной температуре, превратили в воду при комнатной температуре. | 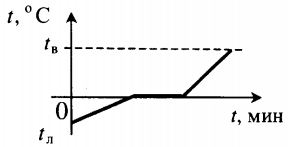 | ||||||||||||||||||||||||||||||||
| Взяли лед при температуре 0 о С и полностью испарили. | 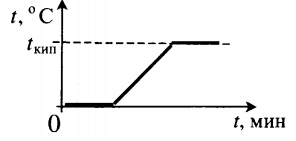 | ||||||||||||||||||||||||||||||||
| Взяли воду при комнатной температуре и половину превратили в пар. | 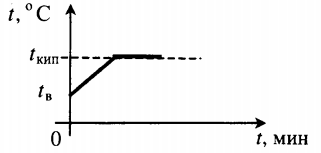 |
| Единицы измерения | Температуру можно оставлять в градусах Цельсия, так как изменение температуры в градусах Цельсия равно изменению температуры в Кельвинах. |
| Кипяток | Вода, которая при нормальном атмосферном давлении имеет температуру в 100 о С. |
| Объем воды 5 л | m = 5 кг, так как: m = ρ V =10 3 · 5 · 10 − 3 м 3 = 5 к г Внимание! Равенство V (л) = m (кг) справедливо только для воды. |
Пример №1. Какое количество теплоты нужно сообщить льду массой 2 кг, находящемуся при температуре –10 о С, чтобы превратить его в воду и нагреть ее до температуры +30 о С?
Можно выделить три тепловых процесса:
Поэтому количество теплоты будет равно сумме количеств теплоты для каждого из этих процессов:
Q = c л m ( 0 − t 1 ) + λ m + c в m ( t 2 − 0 )
Удельные теплоемкости и удельную теплоту плавления смотрим в таблицах:
Уравнение теплового баланса
Суммарное количество теплоты, которое выделяется в теплоизолированной системе равно количеству теплоты (суммарному), которое в этой системе поглощается.
Математически уравнение теплового баланса с учетом знаков количества теплоты записывается так:
Отданное количество теплоты меньше нуля (Qотд 0).
Подсказки к задачам на уравнение теплового баланса
| Теплообмен происходит в калориметре | Потерями энергии можно пренебречь. |
| Жидкость нагревают в некотором сосуде | Начальные и конечные температуры жидкости и сосуда совпадают. |
| В жидкость опускают термометр | Через некоторое время он покажет конечную температуру жидкости и термометра. |
| Мокрый снег | Содержит воду и лед при 0 о С. Учтите, что лед плавится, если он находится при температуре 0 о С и получает энергию от более нагретого тела. Вода кристаллизируется при температуре 0 о С, если она отдает энергию более холодному телу. Если лед и вода находятся при температуре 0 о С, то никаких агрегатных переходов между ними не происходит. |
Частные случаи теплообмена
| В воду комнатной температуры бросили ком снега, содержащий некоторое количество воды, после чего установилась некоторая положительная температура. | 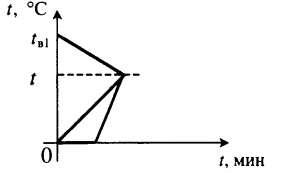 Уравнение теплового баланса: Уравнение теплового баланса:c в m в 1 ( t − t в 1 ) + c в m в 2 ( t − 0 ) + λ m л + c в m л ( t − 0 ) = 0 | ||||||||
| Для получения некоторой положительной температуры воды используют горячую воду и лед, имеющий отрицательную температуру. | 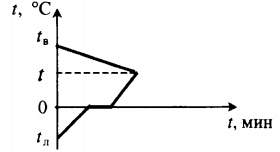 Уравнение теплового баланса: Уравнение теплового баланса:c в m в ( t − t в ) + c л m л ( 0 − t л ) + λ m л + c в m л ( t − 0 ) = 0 | ||||||||
| В воду комнатной температуры бросают раскаленное твердое тело, в результате часть воды испаряется. | 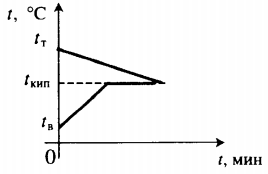 Уравнение теплового баланса: Уравнение теплового баланса:c т m т ( 100 − t т ) + c в m в ( 100 − t в ) + r m п = 0 | ||||||||
| Воду комнатной температуры нагревают до кипения, вводя пар при t = 100 о С. | 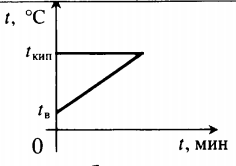 Уравнение теплового баланса: Уравнение теплового баланса:− r m п + c в m в ( 100 − t в ) = 0 | ||||||||
| Лед, имеющий температуру плавления, нагревают до положительной температуры, вводя пар при t = 100 о С. | 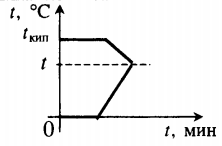 Уравнение теплового баланса: Уравнение теплового баланса:− r m п + c в m п ( t − t к и п ) + λ m л + c в m л ( t − t п л ) = 0 Пример №2. В кастрюлю, где находится вода объемом 2 л при температуре 25 о С, долили 3 л кипятка. Какая температура воды установилась? Количество теплоты, отданное кипятком, равно количеству теплоты, принятому более прохладной водой. Поэтому: c m 1 ( t − t 0 ) = − c m 2 ( t − t к и п ) m 1 ( t − t 0 ) = − m 2 ( t − t к и п ) m 1 t + m 2 t = m 1 t 0 + m 2 t к и п ( m 1 + m 2 ) t = m 1 t 0 + m 2 t к и п Взаимные превращения механической и внутренней энергииЕсли в тексте задачи указан процент одного вида энергии, перешедший в другой, то он указывается в виде десятичной дроби перед этой энергией, которой тело обладало вначале. Частные случаи закона сохранения энергии
|











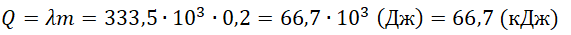
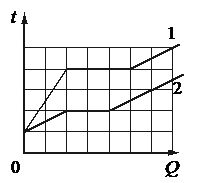 На рисунке представлены графики зависимости температуры t двух тел одинаковой массы от сообщённого им количества теплоты Q. Первоначально тела находились в твёрдом агрегатном состоянии.
На рисунке представлены графики зависимости температуры t двух тел одинаковой массы от сообщённого им количества теплоты Q. Первоначально тела находились в твёрдом агрегатном состоянии.