Чем можно заменить амиодарон
Обзор таблеток от повышенного давления нового поколения
Частое повышение показателей артериального давления (АД) – причина развития серьезных заболеваний (инсульт, инфаркт миокарда и пр.). Гипертоническая болезнь в России диагностируется у каждого третьего человека преклонного возраста. Для борьбы с гипертонией многим пациентам приходится принимать препараты на протяжении всей жизни, чтобы исключить осложнения.
Современные фармакологические компании предлагают большой выбор лекарственных средств, эффективных при гипертонии. Если не знаете, как выбрать таблетки от повышенного давления, ознакомьтесь с рейтингом, представленным ниже. В ТОП вошли лучшие медикаменты с учетом эффективности, стоимости и отзывов.
Классификация препаратов от повышенного давления
Причины гипертонии
Когда нужно вызвать врача на дом при повышении давления?
Общепринятые показатели АД – 120/80. Параметры могут незначительно варьировать в зависимости от времени суток, физической активности и возраста человека.
Таблица – Показатели артериального давления и рекомендации
Удлинение интервала QT
Статья посвящена врождённому и приобретённому ЭКГ-синдрому удлинённого интервала QТ, а также Амиодарону, как наиболее частой медикаментозной причине данного состояния.
Синдром удлинения QT интервала представляет собой сочетание удлиненного интервала QT стандартной ЭКГ и угрожающих жизни полиморфных желудочковых тахикардий (torsade de pointes – «пируэт»). Пароксизмы желудочковых тахикардий типа «пируэт» клинически проявляются эпизодами потери сознания и нередко заканчиваются фибрилляцией желудочков, являющихся непосредственной причиной внезапной смерти.
Длительность интервала QT зависит от частоты сердечных сокращений и пола пациента. Поэтому используют не абсолютную, а корригированную величину интервала QT (QTc), которую рассчитывают по формуле Базетта:
где: RR – расстояние между соседними зубцами R на ЭКГ в сек. ;
К = 0, 37 для мужчин и К = 0, 40 для женщин.
Удлинение интервала QT диагностируют в том случае, если длительность QTc превышает 0, 44 с.
Установлено, что как врожденные, так и приобретенные формы удлинения интервала QT являются предикторами фатальных нарушений ритма, которые, в свою очередь, приводят к внезапной смерти больных.
Так, отсутствует единое мнение о верхней границе нормальных значениях дисперсии корригированного интервала QT. По мнению одних авторов, предиктором желудочковых тахиаритимий является QTcd более 45, другие исследователи предлагают считать верхней границей нормы QTcd 70 мс и даже 125 мс.
Cуществуют два наиболее изученных патогенетических механизма аритмий при синдроме удлиненного QT интервала. Первый – механизм «внутрисердечных нарушений» реполяризации миокарда, а именно, повышенная чувствительность миокарда к аритмогенному эффекту катехоламинов. Второй патофизиологический механизм – дисбаланс симпатической иннервации (снижение правосторонней симпатической иннервации вследствие слабости или недоразвития правого звездчатого ганглия). Эта концепция подтверждается на моделях с животными (удлинение QT интервала после правосторонней стеллэктомии) и результатами левосторонней стеллэктомии в лечении резистентных форм удлинения QT интервала.
Частота выявления удлинения интервала QT у лиц с пролапсами митрального и/или трикуспидального клапанов достигает 33%. По мнению большинства исследователей, пролапс митрального клапана является одним из проявлений врожденной дисплазии соединительной ткани. Среди других проявлений «слабости соединительной ткани» – повышенная растяжимость кожи, астенический тип телосложения, воронкообразная деформация грудной клетки, сколиоз, плоскостопие, синдром гипермобильности суставов, миопия, варикозное расширение вен, грыжи. Рядом исследователей выявлена взаимосвязь увеличенной варибельности QT интервала и глубины пролабирования и/или наличия структурных изменений (миксоматозная дегенерация) створок митрального клапана. Одной из главных причин формирования удлинения интервала QT у лиц с пролапсом митрального клапана является генетически предопределенный или приобретенный дефицит магния
Приобретенное удлинение QT интервала может возникнуть при атеросклеротическом или постинфарктном кардиосклерозе, при кардиомиопатии, на фоне и после перенесенного мио– или перикардита. Увеличение дисперсии интервала QT (более 47 мс) может также являться предиктором развития аритмогенных синкопальных состояний у больных с аортальными пороками сердца.
Удлинение интервала QT может наблюдаться и при синусовой брадикардии, атриовентрикулярной блокаде, хронической цереброваскулярной недостаточности и опухоли головного мозга. Острые случаи удлинения интервала QT могут также возникать при травмах (грудной клетки, черепно–мозговых).
Автономная нейропатия также увеличивает величину интервала QT и его дисперсию, поэтому данные синдромы имеют место у больных сахарным диабетом I и II типов.
Удлинение интервала QT может иметь место при нарушениях электролитного баланса с гипокалиемией, гипокальциемией, гипомагнезиемией. Подобные состояния возникают под воздействием многих причин, например, при длительном приеме диуретиков, особенно петлевых (фуросемид). Описано развитие желудочковой тахикардии типа «пируэт» на фоне удлинения интервала QT cо смертельным исходом у женщин, находившихся на малобелковой диете с целью снижения массы тела.
Общеизвестно удлинение QT при острой ишемии миокарда и инфаркте миокарда. Стойкое (более 5 дней) увеличение интервала QT, особенно при сочетании с ранними желудочковыми экстрасистолами, прогностически неблагоприятно. У этих пациентов выявлено значительное (в 5–6 раз) повышение риска внезапной смерти.
В патогенезе удлинения QT при остром инфаркте миокарда, несомненно, играет роль гиперсимпатикотония, именно этим многие авторы объясняют высокую эффективность b–блокаторов у этих пациентов. Кроме того, в основе развития данного синдрома лежат и электролитные нарушения, в частности, дефицит магния. Результаты многих исследований свидетельствуют о том, что до 90% больных с острым инфарктом миокарда имеют дефицит магния. Выявлена также обратная корреляционноая взаимосвязь уровня магния в крови (сыворотке и эритроцитах) с величиной интервала QT и его дисперсией у пациентов с острым инфарктом миокарда.
У пациентов с идиопатическим пролапсом митрального клапана лечение следует начинать с применения пероральных препаратов магния (Магнерот по 2 табл. 3 раза в день в течение не менее 6 месяцев), поскольку тканевой дефицит магния считают одним из основных патофизиологических механизмов формирования как синдрома удлинения QT интервала, так и «слабости» соединительной ткани. У этих лиц после лечения препаратами магния не только нормализуется величина интервала QT, но и уменьшаются глубина пролабирования створок митрального клапана, частота желудочковых экстрасистол, выраженность клинических проявлений (синдрома вегетативной дистонии, геморрагических симптомов и др. ). Если лечение пероральными препаратами магния через 6 месяцев не оказало полного эффекта показано добавление b–блокаторов.
Другой важной причной удлинёния интервала QT является приём специальных медикаментов, одним из таких препаратов, чаще всего используемых в клинической практике является Амиодарон (Кордарон).
Амиодарон относится к III классу антиаритмических препаратов (класс ингибиторов реполяризации) и обладает уникальным механизмом антиаритмического действия, так как помимо свойств антиаритмиков III класса (блокада калиевых каналов) он обладает эффектами антиаритмиков I класса (блокада натриевых каналов), антиаритмиков IV класса (блокада кальциевых каналов) и неконкурентным бета-блокирующим действием.
Кроме антиаритмического действия у него имеются антиангинальный, коронарорасширяющий, альфа- и бета-адреноблокирующий эффекты.
Антиаритмические свойства:
— увеличение продолжительности 3-ей фазы потенциала действия кардиомиоцитов, в основном за счет блокирования ионного тока в калиевых каналах (эффект антиаритмика III класса по классификации Вильямса) ;
— уменьшение автоматизма синусового узла, приводящее к уменьшению частоты сердечных сокращений;
— неконкурентная блокада альфа- и бета- адренергических рецепторов;
Описание
— замедление синоатриальной, предсердной и атриовентрикулярной проводимости, более выраженное при тахикардии;
— отсутствие изменений проводимости желудочков;
— увеличение рефрактерных периодов и уменьшение возбудимости миокарда предсердий и желудочков, а также увеличение рефрактерного периода атриовентрикулярного узла;
— замедление проведения и увеличение продолжительности рефрактерного периода в дополнительных пучках предсердно-желудочкового проведения.
Другие эффекты:
— отсутствие отрицательного инотропного действия при приеме внутрь;
— снижение потребления кислорода миокардом за счет умеренного снижения периферического сопротивления и частоты сердечных сокращений;
— увеличение коронарного кровотока за счет прямого воздействия на гладкую мускулатуру коронарных артерий;
— поддержания сердечного выброса за счет снижения давления в аорте и снижения периферического сопротивления;
— влияние на обмен тиреоидных гормонов: ингибирование превращения Тз в Т4 (блокада тироксин-5-дейодиназы) и блокирование захвата этих гормонов кардиоцитами и гепатоцитами, приводящее к ослаблению стимулирующего влияния тиреоидных гормонов на миокард.
Терапевтические эффекты наблюдаются в среднем через неделю после начала приема препарата (от нескольких дней до двух недель). После прекращения его приема амиодарон определяется в плазме крови на протяжении 9 месяцев. Следует принимать во внимание возможность сохранения фармакодинамического действия амиодарона в течение 10-30 дней после его отмены.
Каждая доза амиодарона (200 мг) содержит 75 мг йода.
Показания к применению
Профилактика внезапной аритмической смерти у больных группы высокого риска
Для больных хронической сердечной недостаточностью амиодарон является единственным разрешенным к применению антиаритмиком. Это связано с тем, что прочие препараты у этой категории пациентов или увеличивают риск внезапной середечной смерти, или угнетают гемодинамику.
При наличии ишемической болезни сердца препаратом выбора является соталол, на 1/3 являющийся, как известно, b–адреноблокатором. Но при его неэффективности в нашем распоряжении вновь только амиодарон. Что же касается больных с артериальной гипертензией, то из их числа, в свою очередь, выделяются пациенты с выраженной и невыраженной гипертрофией левого желудочка. Если гипертрофия невелика (в Руководстве 2001 г. – толщина стенки левого желудочка менее 14 мм), препарат выбора – пропафенон, но при его неэффективности – как всегда, амиодарон (наряду с соталолом). Наконец, при выраженной гипертрофии левого желудочка, как и при хронической сердечной недостаточности, амиодарон – единственный возможный препарат.
Источник: Остроумова О. Д. Удлинение интервала QT. РМЖ №18 2001 С 750-54
Статья добавлена 11 апреля 2015 г.
Кордарон или амиодарон в лечении и профилактике аритмий?
Опубликовано:
Клиническая фармакология и терапия, 2010, 19 (3)
С.В.Моисеев
ММА им. И.М.Сеченова, МГУ им. М.В.Ломоносова Критерии биоэквивалентности, на основании которых регистрируют дженерики, не всегда обеспечивают их терапевтическую эквивалентность оригинальному препарату. В клинической практике замена оригинальных антиаритмических препаратов, в том числе амиодарона, на воспроизведенные иногда приводила к изменению концентраций действующего вещества и/или его метаболитов в крови и серьезным клиническим последствиям (рецидиву аритмий или аритмогенному действию). Следует избегать замены Кордарона на его копии, особенно при серьезных аритмиях.
Ключевые слова. Амиодарон, дженерики, биоэквивалентность.
Cordarone or amiodarone for the treatment and prevention of arrhythmias?
На первый взгляд вопрос в заголовке статьи выглядит бессмысленным, так как Кордарон – это торговое название антиаритмического препарата амиодарон. Однако в литературе последних лет активно дискутируется терапевтическая эквивалентность (не путать с биоэквивалентностью) оригинальных препаратов и их копий и, соответственно, их взаимозаменяемость в клинической практике. Применительно к амиодарону этот вопрос имеет особую актуальность по двум причинам. Во-первых, амиодарон применяется для лечения практически всех наджелудочковых и желудочковых аритмий и относится к числу самым популярных кардиологических препаратов. В 1998 году его доля среди всех выписанных рецептов на антиаритмические средства составила 34,5% в Европе, 32,8% в Северной Америке и 73,8% в Латинской Америке [1]. В 2010 г. были опубликованы первые результаты международного проспективного регистра RecordAF, цель которого – изучение тактики лечения пациентов с фибрилляцией предсердий в обычной клинической практике [2]. Во всех странах амиодарон был основным антиаритмическим препаратом, который применяли для контроля ритма у больных с органическими заболеваниями сердца. Его часто (21,7% случаев) назначали и пациентам с изолированной фибрилляцией предсердий. Судить о частоте применения амиодарона в России сложно, учитывая отсутствие достоверных фармако-эпидемиологических данных. Очевидно, что в нашей стране этот препарат применяется не реже, чем в странах Европы (в частности при фибрилляции предсердий). Во-вторых, амиодарон часто назначают для профилактики и лечения серьезных и угрожающих жизни аритмий, в том числе у больных сердечной недостаточностью, когда особое значение имеет надежность антиаритмического эффекта, а его ухудшение может привести к тяжелым последствиям. Результаты клинических исследований и описания случаев свидетельствуют о том, что замена оригинальных антиаритмических препаратов, включая амиодарон, на дженерики иногда сопровождается рецидивом аритмии или аритмогенным действием [3].
Необходимо подчеркнуть, что в данной публикации не подвергается сомнению целесообразность воспроизводства оригинальных лекарственных средств, утративших патентную защиту. С одной стороны, этот процесс повышает доступность лекарственных препаратов для социально незащищенных пациентов, с другой стороны, появление более дешевых аналогов создает условия для конкуренции и побуждает производителей разрабатывать новые оригинальные препараты. Однако при наличии на рынке большого числа копий оригинального препарата, в том числе произведенных мало известными фармацевтическими компаниями, неизбежно возникает вопрос об их качестве. Конечно, качество регистрируемых лекарств должно гарантироваться контролирующими органами, но могут ли они дать такие гарантии?
Особенности регистрации оригинальных препаратов и дженериков
Чтобы ответить на последний вопрос, необходимо иметь общие представления о процессе регистрации оригинальных препаратов и их копий. Для получения разрешения на применение нового препарата его эффективность и безопасность необходимо подтвердить в многочисленных доклинических (острая и хроническая токсичность, генотоксичность, репродуктивная токсичность и т.п.) и клинических исследованиях. Последние включают в себя исследования у здоровых добровольцев, относительно небольшие исследования II фазы и более крупные исследования III фазы, которые и служат главным основанием для регистрации лекарственного средства. Это процесс занимает много времени (например, длительность исследований онкогенности на лабораторных животных достигает 1-2 лет) и требует больших затрат, которые в конечном итоге включаются в стоимость препарата. Понятно, что для регистрации копии оригинального препарата повторение всех этих исследований не имеет смысла. Чтобы получить разрешение на применение дженерика, достаточно подтвердить его фармацевтическую эквивалентность и биоэквивалентность стандартному препарату, который к моменту утраты патентной защиты уже достаточно хорошо известен и давно применяется в клинической практике. Фармацевтическая эквивалентность предполагает соответствие дженерика определенным стандартам качества (содержание действующего вещества, состав примесей и т.п.). Критерием биоэквивалентности является сходство параметров фармакокинетики, отражающих биодоступность действующего вещества, например, скорость и степень его абсорбции после приема внутрь (максимальная концентрация в плазме – Cmax, площадь под фармакокинетической кривой – AUC, время достижения Cmax – tmax). Исследования биоэквивалентности проводятся у небольшой группы здоровых добровольцев (обычно не более 30-35 человек) и предполагают прием только одной дозы исследуемых препаратов натощак. При этом методы анализа действующего вещества могут отличаться по чувствительности от методов, которые использовались при разработке оригинального препарата. Сравнительные клинические исследования оригинального и воспроизведенного препарата официально не требуются. Да и после регистрации последнего они проводятся редко.
Идентичны ли оригинальный препарат и его копии?
Очевидно, что обеспечить полную идентичность двух препаратов невозможно, поэтому определенные различия показателей фармакокинетики считаются допустимыми. Например, в соответствии с рекомендациями комитета по медицинским препаратам Европейского агентства по лекарствам (ЕМЕА) 90% доверительный интервал отношений AUC и Cmax оригинального препарата и его копии должен находиться в интервале от 80 до 125%. На практике это означает, что воспроизведенный препарат может отличаться по фармакокинетике от своего прототипа на 20-25%. Во многих случаях эти отличия не имеют клинического значения, так как показатели фармакокинетики самого оригинального препарата характеризуются определенной вариабельностью (следует отметить, что вариабельность свойств разных партий оригинального препарата обычно не превышает ±5%). Однако для некоторых препаратов с узким “терапевтическим индексом” (т.е. при наличии небольшой разницы между терапевтической и токсической концентрацией) диапазон 80-125% явно велик. Классическими примерами подобных лекарственных веществ (critical dose drugs) являются циклоспорин и фенитоин, которые рекомендуют применять под контролем концентраций в крови. Однозначного ответа на вопрос о том, следует ли считать таковыми антиаритмические препараты, нет [4]. В соответствии с критериями Американской администрации по контролю пищевых продуктов и лекарств (FDA; 21 CFR 320.33Lc) терапевтический индекс следует считать узким в следующих случаях: (1) медиана летальной дозы (LD50) отличается от медианы эффективной дозы (ED50) менее чем в 2 раза; (2) минимальная токсическая концентрация менее чем в 2 раза выше минимального эффективного уровня; (3) безопасное и эффективное лечение предполагает тщательное титрование дозы и наблюдение пациента. Если ориентироваться на третий критерий, то антиаритмические средства следует относить к препаратам с узким терапевтическим индексом [5]. Любые антиаритмические средства, в том числе амиодарон, могут вызывать серьезные побочные эффекты, риск которых зависит от концентрации. Например, уровни амиодарона в плазме >2,5 мг/дл ассоциировались с увеличением частоты токсических эффектов [4]. С другой стороны, снижение концентрации действующего вещества в плазме может привести к рецидиву аритмии. Некоторые пациенты, например, пожилые люди или больные с сопутствующими заболеваниями, могут оказаться более чувствительными даже к небольшим изменениям уровней антиаритмических средств.
Дженерики сравнивают только с оригинальным препаратом, поэтому они могут существенно отличаться друг от друга [6]. Например, концентрации одного дженерика могут быть на 0-20% ниже таковых оригинального препарата, а другого – на 0-25% выше. Соответственно, разница между ними теоретически может достигнуть 45%, хотя оба считаются биоэквивалентными. Если зарегистрировано несколько копий оригинального препарата, то переход с одного дженерика на другой может привести к значительным колебаниям уровней лекарственного вещества в плазме.
Свойства лекарственных веществ могут меняться при хранении, что отражается на показателях фармакокинетики. Например, в одном исследовании [7] были сопоставлены свойства оригинального рамиприла (Тритаце) и 22 его зарегистрированных копий до и после 3-месячного хранения в стрессорных условиях. Через 3 месяца значительное число дженериков не соответствовали спецификациям оригинального препарата.
Действующие вещества считают одинаковыми, если они имеют идентичное химическое строение, хотя их физико-химические свойства могут отличаться в зависимости от пути синтеза, источника и качества сырья, условий производства, используемых реактивов и растворителей и т.п. [8]. Важное значение имеют форма препарата (аморфная или кристаллическая), размер частиц действующего вещества, наличие определенных примесей, состав наполнителей и другие факторы. Некоторые “активные” наполнители лекарственного препарата могут оказывать существенное влияние на скорость и/или степень его всасывания, в частности различные сахара изменяют транзит по желудочно-кишечному тракту и, возможно, биодоступность действующего вещества [9]. Даже финальный этап производства, например, изготовление таблеток, может определять различия “идентичных» препаратов. Так, срок хранения таблеток зависел от давления, использующегося при их производства, скорости цикла и типа оборудования [10].
Следует учитывать также психологические аспекты применения лекарственных веществ, которые не имеют отношения к их фармакологической/фармацевтической эквивалентности. Например, изменение упаковки препарата сопровождается увеличением числа жалоб на снижение эффективности, особенно при переходе с оригинального препарата на воспроизведенный [4].
Некоторые изменения свойств лекарственного препарата (снижение содержания действующего вещества, ухудшение его биодоступности) могут отразиться на эффективности, другие (например, появление необычных примесей или продуктов распада) – на безопасности и переносимости лечения. Учитывая неидентичность оригинального препарата и его копий, их терапевтическую эквивалентность желательно подтвердить в прямых сравнительных клинических исследованиях. Однако на практике подобные исследования проводятся редко. Кроме того, если инициатором сравнительного исследования является фармацевтическая компания, то нельзя исключить, что свет увидят только результаты, представляющие интерес для спонсора (publication bias).
По мнению А.Genazzani и соавт. [4], трудности, с которыми приходится сталкиваться при анализе дженериков, заставляют отдавать предпочтение оригинальному препарату в тех случаях, когда по стоимости он не намного превосходит свои копии. При этом опыт разработчика a priori гарантирует известное качество оригинального препарата. Следует отметить, что дженерики могут существенно отличаться по цене не только от прототипа, но и друг от друга. Хотя низкая стоимость препарата может показаться привлекательной, она может определяться отсутствием необходимых затрат на производство (сомнительное сырье, невыполнение правил GMP – Good Manufacturing Practice).
Исследования воспроизведенных препаратов амиодарона
После появления первых дженериков амиодарона в литературе были опубликованы сообщения о фармакологических и клинических аспектах замены оригинального препарата на его копии. S.Sauro и соавт. [11] сопоставили равновесные концентрации амиодарона и дезэтиламиодарона у 138 пациентов, принимавших Кордарон в стабильной дозе, а затем перешедших на лечение дженериком амиодарона. Равновесные уровни амиодарона и его метаболита достоверно не изменились после замены оригинального препарата дженериком, однако вариабельность концентрации препарата в плазме увеличилась. По мнению авторов, в течение 1-3 месяцев после смены препарата целесообразно контролировать концентрации действующего вещества в плазме (в России эта рекомендация практически не выполнима).
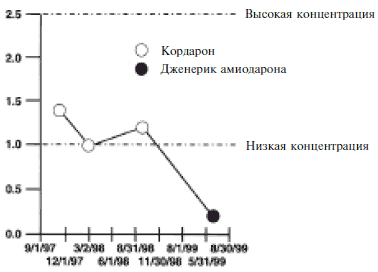
J.Reiffel и P.Kowey [3] провели опрос 130 ведущих американских аритмологов, которым предлагали сообщить, наблюдали ли они рецидивы аритмий при замене оригинальных антиаритмических препаратов на дженерики. На поставленные вопросы ответили 64 специалиста. Около половины из них наблюдали эпизоды аритмий (включая фибрилляцию желудочков, желудочковую тахикардию, фибрилляцию предсердий и предсерную тахикардию), которые были определенно или вероятно связаны с заменой оригинального препарата. В целом было зарегистрировано 54 рецидива аритмий, включая 32 случая при замене Кордарона на дженерик амиодарона. Три пациента умерли (в том числе пациент, получавший амиодарон). Кроме того, эксперты наблюдали 7 случаев аритмогенного действия дженериков (один из них был зарегистрирован при применении дженерика амиодарона, хотя этот препарат характеризуется низкой аритмогенной активностью). В части случаев связь между рецидивами аритмий и заменой антиаритмического препарата была подтверждена при повторной провокации или анализе сывороточных уровней лекарственных веществ в плазме (рис. 1). Таким образом, около половины респондентов сталкивались с проблемами при смене антиаритмического препарата, причем во всех этих случаях оригинальный препарат заменяли на его копию.
Рис. 1. Изменение сывороточной концентрации амиодарона (мг/л) после замены Кордарона на дженерик у 28-летнего мужчины с желудочковой тахикардией
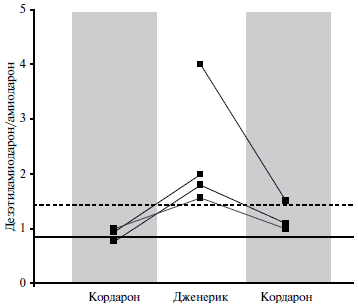
P.Pollak [12] определял концентрации амиодарона и его активного метаболита десэтиламиодарона у 77 пациентов, длительно принимавших Кордарон. После начала лечения отношение концентраций метаболита и амиодарона увеличивалось примерно до 0,9 и не зависело от дозы препарата. Этот показатель редко превышал 1,4, а его увеличение ассоциировалось с токсическими изменениями со стороны легких. У 4 пациентов замена оригинального Кордарона на дженерик сопровождалась значительным увеличением отношения уровней дезэтиламиодарона и амиодарона (рис. 2). Например, у 42-летнего мужчины, принимавшего Кордарона по поводу предсердной тахикардии, через 1 месяц после назначения дженерика указанный коэффициент увеличился с 0,8 до 1,8. После возобновления приема Кордарона он снизился до 1,1. Еще одна попытка замены оригинального препарата вновь привела к увеличению отношения уровней метаболита и амиодарона до 1,6. Следует отметить, что во всех 4 случаях относительные изменения концентраций метаболита существенно превышали 20% (максимальный показатель для биоэквивалентного дженерика). Для подтверждения биоэквивалентности дженериков амиодарона не требуется анализ активного метаболита этого препарата, хотя изменения его уровня могут отражаться на эффективности и безопасности лечения.
Рис. 2. Изменения отношения уровней дэзэтиламиодарона/амиодарона при замене Кордарона на джененики.
Сплошная линия – средний показатель у 77 пациентов, пунктирная – 95-й перцентиль.
Сходные проблемы наблюдались и при применении других антиаритмических препаратов. B.Grubb [13] описал рецидив желудочковой тахикардии после замены оригинального прокаинамида на дженерик. При обследовании было выявлено снижение сывороточной концентрации действующего вещества до 2,4 мг/мл (эффективный уровень – около 10 мг/мл). Т.Ozahowski и соавт. [14] наблюдали 2 случая рецидивирующей наджелудочковой тахикардии у пациентов с имплантированным кардиовертером-дефибриллятором, получавших дженерик прокаинамида замедленного высвобождения. Контроль аритмии был восстановления после возобновления приема оригинального препарата. В описанном выше исследовании J.Reiffel и P.Kowey [3], которые проводили опрос американских аритмологов, рецидивы аритмий или аритмогенные эффекты отмечались при смене препаратов не только амиодарона, но и прокаинамида, хинидина, дизопирамида.
Приведенные данные могут показаться не очень убедительными. На самом деле они представляют собой описания отдельных случаев, а не результаты рандомизированных контролируемых исследований. Однако известно, что именно постмаркетинговое наблюдение позволяет выявить серьезные нежелательные последствия или взаимодействия лекарственных средств, которые могут быть даже причиной прекращения их маркетинга (примерами могут служить антигистаминные препараты терфенадин и астемизол, статин церивастатин и др.). Последнее обычно происходит, если имеются более безопасные представители того же класса. Распознать нежелательные эффекты замены оригинального антиаритмического препарата на дженерики в клинической практике очень сложно, особенно при отсутствии четкой хронологической зависимости. Врачи обычно не придают особого значения тому, какой препарат применяется – оригинальный или воспроизведенный. При этом рецидив аритмии скорее всего будет расценен как следствие прогрессирования основного заболевания, а не смены препарата. Подтверждением этой связи могут быть изменения концентрации действующего вещества и/или его метаболитов в крови, однако на практике врачу проще отменить соответствующий препарат, чем провести эти исследования.
J.Reiffel [6] предложил следующие рекомендации по замене оригинальных антиаритмических препаратов на воспроизведенные:
Если выполнять все эти рекомендации, то от применения воспроизведенных антиаритмических препаратов пришлось бы полностью отказаться как при легких (из-за невозможности мониторирования концентраций в крови), так и серьезных нарушениях ритма. На практике следует, вероятно, придерживаться следующей тактики ведения. Если пациент получает антиаритмическую терапию оригинальным препаратом с хорошим эффектом, то заменять его на воспроизведенный препарат не следует. Если по экономическим причинам замена оригинального антиаритмического препарата все же необходима, то пациент должен находиться под наблюдением, чтобы убедиться в сохранении достигнутого ранее эффекта. При рецидиве аритмии или ухудшении переносимости можно попытаться возобновить прежнюю терапию. В любом случае целесообразно избегать частых замен копий оригинального препарата.
Единственным основанием для замены оригинального препарата на воспроизведенный являются экономические соображения. Соответственно, возникает вопрос – какова экономия затрат при замене Кордарона на дженерики? Розничная стоимость упаковки Кордарона (30 таблеток по 200 мг), которой достаточно на месяц поддерживающей терапии, составляет около 250 рублей. Стоимость дженериков примерно в 2-3 раза ниже. Следовательно, экономия составит не более 150-180 рублей в месяц. Вряд ли, указанная сумма оправдывает возможные последствия подобной модификации антиаритмической терапии. Необходимо учитывать, что ухудшение эффективности и переносимости лечения приводит к росту затрат (госпитализации, дополнительные визиты к врачу, вызов скорой помощи и т.п.), поэтому в конечном итоге общая стоимость лечения может даже увеличиться. По мнению P.Pollak [12], если только 5% больных, получающих амиодарон в США и Канаде, потребуется одна госпитализация, связанная с заменой оригинального препарата на воспроизведенный, то общее число таких госпитализаций составит 20000 в год.
Заключение