Чем можно заменить гентамицин в ампулах
Гентамицин аналоги
На данной странице представлен список всех аналогов Гентамицин по составу и показанию к применению. Список дешевых аналогов, а также сможете сравнить цены в аптеках.
| # | Название | Цена в России | Цена в Украине |
|---|---|---|---|
| 1 | Канамицина сульфат канамицин Аналог по показанию и способу применения | 10 руб | 11 грн |
| 2 | Гентамицина сульфат гентамицин Аналог по составу и показанию | 28 руб | 16 грн |
| 3 | Тобрисс тобрамицин Аналог по показанию и способу применения | 73 руб | 250 грн |
| 4 | Канамицин канамицин Аналог по показанию и способу применения | 100 руб | 10 грн |
| 5 | Амицил Аналог по показанию и способу применения | 200 руб | 14 грн |
При расчетах стоимости дешевых аналогов Гентамицин учитывалась минимальная цена, которая была найдена в прайс листах предоставленных аптеками
| # | Название | Цена в России | Цена в Украине |
|---|---|---|---|
| 1 | Меркацин Амикацин Аналог по показанию и способу применения | — | — |
| 2 | Гентамицин-к Гентамицина сульфат Аналог по составу и показанию | — | — |
| 3 | Канамицин канамицин Аналог по показанию и способу применения | 100 руб | 10 грн |
| 4 | Брамитоб тобрамицин Аналог по показанию и способу применения | 21000 руб | 59163 грн |
| 5 | Амикацина сульфат амикацин Аналог по показанию и способу применения | 400 руб | 22 грн |
Данный список аналогов лекарства основывается на статистике наиболее запрашиваемых лекарственных препаратов
Все аналоги Гентамицин
Аналоги по составу и показанию к применению
| Название | Цена в России | Цена в Украине |
|---|---|---|
| Гентамицин-к Гентамицина сульфат | — | — |
| Гентамицина сульфат гентамицин | 28 руб | 16 грн |
| Гентамицин-Здоровье гентамицин | — | 16 грн |
| Гентамицина Сульфат-Дарница гентамицин | — | 19 грн |
Вышеуказанный список аналогов лекарств, в котором указаны заменители Гентамицин, является наиболее подходящим, поскольку имеют одинаковый состав действующих веществ и совпадают по показанию к применению
Аналоги по показанию и способу применения
| Название | Цена в России | Цена в Украине |
|---|---|---|
| Браксон тобрамицин | 2600 руб | 204 грн |
| Зотеон Подхайлер тобрамицин | — | — |
| Тобрисс тобрамицин | 73 руб | 250 грн |
| Тоби Подхалер | 24050 руб | 35852 грн |
| Тобрамицин-Гобби тобрамицин | 95000 руб | — |
| Брамитоб тобрамицин | 21000 руб | 59163 грн |
| Канамицин канамицин | 100 руб | 10 грн |
| Канамицина сульфат канамицин | 10 руб | 11 грн |
| Амицил | 200 руб | 14 грн |
| Лорикацин амикацин | — | 76 грн |
| Флекселит амикацин | — | 58 грн |
| Амибиотик | — | — |
| Меркацин Амикацин | — | — |
| Амикацина сульфат амикацин | 400 руб | 22 грн |
| Амикацин-Виал Амикацин | — | — |
| Нетромицин нетилмицин | 2900 руб | — |
Разный состав, могут совпадать по показанию и способу применения
Чтобы найти недорогой аналог лекарству, дженерик или синоним, впервую очередь мы рекомендуем обращать внимание на состав, а именно на одинаковые действующие вещества и показания к применению. Одинаковые действующие вещества лекарства и будут свидетельствовать о том, что препарат является синонимом лекарственного средства, фармацевтически эквивалентным или фармацевтической альтернативой. Однако не стоит забывать и о неактивных компонентах аналогичных лекарств, которые могут оказать влияние на безопасность и эффективность. Не забывайте о наставлении врачей, самолечение может навредить вашему здоровью, поэтому перед употрблением любого медицинского препарата всегда консультируйтесь с врачом.
Гентамицин цена
На нижеприведенных сайтах вы сможете найти цены на Гентамицин и узнать о наличии в аптеке поблизости
Гентамицин
Replekpharm [Реплекфарм]/Березовский ФЗ
Лабесфал Лабораториос Алмиро С.А.
Инструкция по применению
Фармакологические свойства
Гентамицин – антибиотическое средство, обладающее широким спектром действия в отношении патогенных микроорганизмов. Входит в группу аминогликозидных веществ. В процессе проникновения через мембраны клеток бактерий, образует рибосомальные необратимые связи, что действует угнетающе на синтезирование белковых соединений микробов.
Препарат проявляет высокую активность при воздействии на аэробные грамотрицательные микроорганизмы: кишечную палочку (Escherichia coli), шигеллу (Shigella spp), ацинетобактерии (Acinetobacter spp), сальмонеллу (Salmonella spp), клебсиеллу (Klebsiella spp), синегнойную палочку (Pseudomonas aeruginosa), энтеробактерии (Enterobacter spp), серации (Serratia spp), протеус (Proteus spp). Активно действует на аэробные грамположительные кокки: стафилококк (Staphylococcus spp) и некоторые стрептококки (Streptococcus spp).
Резистентность к антибиотику проявляют менингококки (Neisseria meningitidis), бледная трепонема (Treponema pallidum), некоторые виды стрептококков и патогенные микроорганизмы, которые относятся к анаэробной группе.
Медицинское средство обладает свойствами активного всасывания при внутримышечном введении, максимальная концентрация проявляется через полчаса – час после проведения инъекции. Неактивно связывается с белковыми плазматическими соединениями крови. Распределение действующего вещества проходит во всех тканях и жидкостях организма, включая проникновение через плацентарный барьер. Лекарство не проходит стадию метаболизма.
Показания к использованию
Показаниями для использования лекарственного препарата Гентамицин являются инфекционно-воспалительные процессы, которые вызываются патогенными микроорганизмами, чувствительными к активному веществу.
Противопоказания
Дозировка и способ использования
Прежде чем начинать использование лекарственного средства следует проконсультироваться с лечащим врачом и внимательно прочитать инструкцию по применению.
Терапевтическую дозировку Гентамицина рассчитывают в индивидуальном порядке, учитывая тяжесть заболевания, резистентность возбудителя инфекции и состояние больного.
Стандартная одноразовая дозировка при внутривенном или внутримышечном введении, для пациентов взрослого возраста составляет от 1 до 1,7 мг на килограмм веса. При суточном количестве вещества – от 3 до 5 м/кг. Прием проводится дважды – четырежды в день. Протяженность терапевтического курса составляет семь – десять суток.
Длительность внутривенного введения – шестьдесят – сто двадцать минут.
Пациенты детского возраста, не моложе двухлетнего возраста, могут употреблять лекарственный препарат в суточной дозировке 3 – 5 мг на килограмм веса трижды в день. При недоношенности или новорожденности возможно использование лекарства в суточной дозе: 2 – 5 мг/кг, дважды в день. Пациентам младше двух лет можно употреблять дозу 2 – 3 мг/кг, трижды в сутки.
Пациентам, имеющим в анамнезе нарушения почечных функций, следует изменить дозу препарата.
Если лекарственный препарат используется местным способом, закапывания производятся по 1 – 2 капли в конъюнктивальный мешок инфицированного глаза. Интервал между процедурами составляет от одного до четырех часов.
В случае наружного использования употребление активного вещества происходит трижды – четырежды в сутки.
Максимальным количеством употребляемого препарата в сутки, при внутримышечных и внутривенных инъекциях, является 5 мг на килограмм веса пациента.
Передозировка
При превышенном употреблении медицинского средства Гентамицин, возможны негативные проявления побочных эффектов в виде остановки дыхания.
Для терапии пациентам взрослого возраста внутривенным способом вводят прозерин или ему подобные средства антихолинэстеразного действия, а также лекарства, содержащие кальций. До проведения инъекции прозерина, необходимо ввести внутривенным способом атропин.
Пациентам детского возраста вводят калийсодержащие средства.
При проявлениях тяжелого характера возможно применение искусственной вентиляции легких и гемодиализа.
Симптомы побочных эффектов
Поскольку данная инструкция по применению не может описать все негативные проявления, которые могут возникнуть при использовании лекарственного средства Гентамицин, необходимо о любых возникающих дискомфортных ощущениях сообщать лечащему врачу.
Особенности использования
В период проведения терапевтического курса необходимо производить исследования уровня активного вещества в сыворотке крови, максимальным определяемым количеством может быть 8 мкг/мл.
При внутривенном и внутримышечном введении лекарства следует следить за возможными проявлениями мышечной релаксации, которая возникает за счет нарушений нервно-мышечной проводимости.
При наличии у пациента патологий мочевыводящей системы, следует употреблять большое количество жидкости.
Возможность нефротоксичных проявлений, при наличии в анамнезе пациента заболеваний почек или при назначении высокой дозы антибиотика, повышается. Исходя из этого, при наличии усугубляющих факторов, необходимо контролировать состав крови и активность почечных функций.
Поскольку в процессе терапии медицинским средством Гентамицин, могут возникать слуховые расстройства. Необходимо контролировать слуховые функции пациента.
Во время терапии могут развиваться резистентные качества у возбудителей инфекции, в связи с этим при длительном лечении необходимо проводить исследования в виде антибиотикограммы.
Использование в период вынашивания плода и кормления грудью
Использование лекарственного препарата Гентамицин у беременных пациенток может оказать негативное воздействие на внутриутробное развитие плода. Поэтому при крайней необходимости употребления лекарства решение о его приеме зависит от лечащего врача.
Если требуется использование средства в период лактации, кормление грудью требуется прервать.
Управление различными видами транспорта
Поскольку при проведении терапевтического курса могут возникать негативные симптомы в виде головокружения и расстройств мышечных функций, рекомендовано ограничить возможность управления автомобилем и другими транспортными средствами. Также не следует проводить работы, требующие повышенного внимания и концентрации, в период лечения.
Употребление алкоголя
Не рекомендовано использовать алкогольные средства во время использования описываемого лекарственного препарата, поскольку повышается возможность токсического эффекта в отношении печени и других органов.
Инструкция по хранению
Требования к хранению медицинского средства Гентамицин предписывают температурный режим до двадцати пяти градусов тепла. Средство необходимо сохранять в производственной упаковке в местах, недоступных детям и животным. При соблюдении правил хранения, срок годности раствора для инъекций составляет 5 лет, мази для наружного применения и глазных капель – двадцать четыре месяца. По истечению этого периода лекарство нельзя использовать и необходимо утилизировать.
Продажа в аптечной сети
Медицинское средство Гентамицин можно приобрести в аптечной сети по предъявлению рецепта от врача.
Аминогликозиды с позиций современной практики лечения инфекций дыхательных путей
Появление аминогликозидных антибиотиков ведет свое начало с открытия исследовательской группой Зельмана Ваксмана в 1943 году стрептомицина — первого препарата, активного в отношении Mycobacterium tuberculosis [1].
Появление аминогликозидных антибиотиков ведет свое начало с открытия исследовательской группой Зельмана Ваксмана в 1943 году стрептомицина — первого препарата, активного в отношении Mycobacterium tuberculosis [1]. За столь выдающееся открытие Ваксман в 1952 году был удостоен Нобелевской премии, при вручении которой было отмечено, что «в отличие от открытия пенициллина профессором Александером Флемингом, которое было в значительной степени обусловлено случаем, получение стрептомицина было результатом длительного, систематического и неутомимого труда большой группы ученых».
Впоследствии на основе природных структур, продуцируемых различными представителями актиномицетов (природные антибиотики), и в ряду их полусинтетических производных была разработана большая группа антибактериальных препаратов, которые составили класс аминогликозидов. В настоящее время выделяют три поколения аминогликозидов (табл. 1). К первому поколению относят стрептомицин, неомицин, канамицин и мономицин, применение которых на современном этапе ограничено вследствие их токсичности. Второе поколение составляют гентамицин, тобрамицин, сизомицин и нетилмицин. Амикацин и исепамицин входят в третье поколение аминогликозидов.
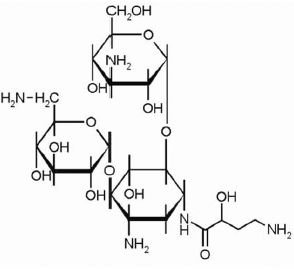
Название данной группы антибиотиков обусловлено молекулярной структурой, в основе которой присутствуют аминосахара, связанные гликозидной связью с агликоновой частью молекулы (рис. 1).
Механизм действия аминогликозидов связан с необратимым угнетением синтеза белка на уровне рибосом у чувствительных к ним микроорганизмов. В отличие от других ингибиторов синтеза белка аминогликозидные антибиотики оказывают не бактериостатическое, а именно бактерицидное действие. Аминогликозиды II и III поколений обладают широким спектром антимикробного действия, в первую очередь, в отношении большинства грамотрицательных микроорганизмов семейства Enterobacteriaceae (Escherichia coli, Proteus spp., Klebsiella spp., Enterobacter spp., Serratia spp. и др.), а также неферментирующих грамотрицательных палочек (Pseudomonas aeruginosa, Acinetobacter spp.) [2, 3, 4]. Аминогликозиды также проявляют свою активность в отношении Staphylococcus aureus, кроме метициллинрезистентных штаммов (MR). Отдельные представители класса различаются между собой по активности и спектру действия. В частности, аминогликозиды I поколения (стрептомицин, канамицин) проявляют наибольшую активность в отношении M. tuberculosis, мономицин обладает эффективностью против некоторых простейших. Все аминогликозиды II и III поколения активны в отношении P. aeruginosa, при этом тобрамицин проявляет наивысшую активность. Сизомицин характеризуется большей активностью, чем гентамицин в отношении Proteus spp., Klebsiella spp., Enterobacter spp. (табл. 2).
Одним из наиболее эффективных аминогликозидов является амикацин, что связано с устойчивостью к действию ферментов, инактивирующих другие аминогликозиды, поэтому антибиотик может оставаться активным в отношении штаммов P. aeruginosa, устойчивых к тобрамицину, гентамицину и нетилмицину [2, 5, 12]. Другой представитель III поколения — изепамицин дополнительно активен в отношении Aeromonas spp., Citrobacter spp., Listeria spp. и Nocardia spp.
Все представители класса аминогликозидов неактивны в отношении S. pneumoniae, S. maltophilia, B. cepacia и анаэробов (Bacteroides spp., Clostridium spp. и др.). Более того, следует помнить, что резистентность S. pneumoniae, S. maltophilia и B. cepacia к аминогликозидам используется при идентификации этих микроорганизмов. Аминогликозиды in vitro активны в отношении шигелл, сальмонелл, легионелл, однако их назначение при данных инфекциях недопустимо, так как они клинически неэффективны в отношении возбудителей, локализованных внутриклеточно [2].
В ряде случаев аминогликозиды оказывают постантибиотический эффект, который зависит от штамма микроорганизма и концентрации препарата в очаге инфекции.
Все аминогликозиды характеризуются практически одинаковой фармакокинетикой (табл. 3). Молекулы антибиотиков являются высокополярными соединениями, в связи с чем плохо растворяются в липидах и при приеме внутрь практически не всасываются из желудочно-кишечного тракта (в системный кровоток поступает менее 2%). Вследствие этого основной путь введения аминогликозидов парентеральный (кроме неомицина). Связывание аминогликозидов с белками крови низкое и колеблется для разных антибиотиков от 0 до 30% (например, тобрамицин практически не связывается с белками). Время достижения Cmax при в/м введении составляет 1–1,5 ч. Аминогликозиды практически не подвергаются биотрансформации, выводятся почками путем клубочковой фильтрации в неизмененном виде, создавая высокие концентрации в моче. Скорость экскреции зависит от возраста, функции почек и сопутствующей патологии пациента (например, при лихорадке она увеличивается, с большой скоростью препарат элиминируется у наркоманов, с меньшей — у беременных, при понижении функции почек скорость экскреции значительно замедляется). Период полувыведения всех аминогликозидов у взрослых с нормальной функцией почек составляет 2–4 ч, при почечной недостаточности период может возрастать до 70 ч и более. Пиковые концентрации аминогликозидов варьируют у различных пациентов и зависят от массы тела, объема жидкости и жировой ткани, состояния пациента. Например, у пациентов с обширными ожогами, асцитом объем распределения аминогликозидов повышен. Наоборот, при дегидратации или мышечной дистрофии он уменьшается.
Аминогликозиды способны создавать высокие концентрации в органах с хорошим кровоснабжением: печени, легких, почках, напротив, низкие концентрации отмечаются в мокроте, бронхиальном секрете, желчи, грудном молоке. Аминогликозиды плохо проходят через гематоэнцефалический барьер, однако при воспалении мозговых оболочек их проницаемость увеличивается.
Учитывая особенности фармакокинетики аминогликозидов, а также потенциальную специфическую токсичность данного класса антибиотиков, необходимо правильно рассчитывать дозу применяемых препаратов. Доза аминогликозидов (не только у детей, но и у взрослых!) должна рассчитываться исходя из массы тела с обязательным учетом индивидуальных особенностей пациента (возраст, функция почек, локализация инфекции).
Факторами, определяющими дозу аминогликозидов, являются [2]:
Дозы у взрослых и детей старше 1 месяца: стрептомицин, канамицин, амикацин по 15–20 мг/кг/сутки в 1–2 введения; гентамицин, тобрамицин — 3–5 мг/кг/сутки в 1–2 введения; нетилмицин — 4–6,5 мг/кг/сутки в 1–2 введения.
Современная практика применения аминогликозидов предусматривает введение препарата 1 раз в сутки, что оправдано как с микробиологической точки зрения (дозозависимый, быстро наступающий бактерицидный эффект; длительный постантибиотический эффект), так и с клинической (меньшая токсичность аминогликозидов при однократном введении при аналогичной эффективности терапии) [2, 3]. В настоящее время однократное в сутки введение аминогликозидов применяется при большинстве показаний (исключение составляют эндокардит и менингит). При однократном введении аминогликозиды лучше всего вводить внутривенно капельно в течение 15–20 мин.
Чрезвычайно важно, что аминогликозиды характеризуются вариабельностью фармакокинетических показателей. При введении одинаковой дозы потенциально токсические уровни в крови (10–14 мкг/мл) для природных аминогликозидов могут быть обнаружены в среднем у 10% больных, концентрации ниже необходимых для адекватной терапии выявляются у 25% больных и более [3]. В этой связи наиболее предпочтительными являются полусинтетические препараты — амикацин и нетилмицин, обладающие наименьшей вариабельностью показателей. Кроме того, данной группе препаратов свойствен узкий коридор безопасности, т. е. незначительный разрыв между эффективным и токсическим уровнем концентраций в крови. В этой связи единственным средством оптимизации лечения аминогликозидами является постоянный фармакокинетический мониторинг, который позволяет исключать создание токсических или субтерапевтических уровней препарата в крови (табл. 4).
При проведении терапевтического мониторинга определяют: 1) пиковую концентрацию аминогликозидов в сыворотке крови — через 60 мин после внутримышечного введения препарата или через 15 мин после окончания внутривенного введения; 2) остаточную концентрацию — перед введением очередной дозы. Установление пиковой концентрации не ниже порогового значения свидетельствует о достаточности используемой дозы аминогликозида, при этом ее высокие уровни не представляют опасности для пациента. Величина остаточной концентрации, превышающая терапевтический уровень, свидетельствует о кумуляции препарата и об опасности развития токсических эффектов. В этом случае снижают суточную дозу или удлиняют интервал между разовыми дозами. При однократном введении всей суточной дозы достаточно определять только остаточную концентрацию [2].
Аминогликозиды относятся к препаратам с низким уровнем общей токсичности. Однако для них характерны специфические нежелательные реакции, а именно ото- и нефротоксичность. Частота развития этих реакций варьирует в зависимости от препарата. В клинических исследованиях было показано, что частота развития нефротоксических явлений при применении нетилмицина составляет 2,8%, амикацина — 8,5%, гентамицина — 11,1% и тобрамицина — 11,5% [9]. Ототоксические реакции наблюдаются у 2,3% пациентов, получавших нетилмицин, у 7,7%, получавших гентамицин, 9,7% — тобрамицин и 13,8% — амикацин [9]. Ототоксичность проявляется как в виде вестибулярных нарушений (чаще при применении стрептомицина, гентамицина, тобрамицина), так и в виде нарушения слуха (амикацин, нетилмицин). Нарушение слуха и поражение преддверно-улиткового нерва могут оказаться необратимыми, вероятность данных реакций возрастает с повышением дозы препарата, при длительных курсах лечения, у больных пожилого возраста и пациентов с исходными нарушениями функции слухового аппарата. Нарушения функции почек при применении аминогликозидов, напротив, чаще всего обратимы. Высокой нефротоксичностью обладает гентамицин, наиболее безопасными препаратами являются амикацин и нетилмицин. В ряде случаев применение аминогликозидов сопровождается нарушением нервно-мышечной проводимости, развитием парестезий, периферических нейропатий.
С точки зрения профилактики развития побочных реакций наибольшее значение имеет отмеченный ранее контроль основных фармакокинетических параметров, которые должны быть ограничены заданными пределами (табл. 3 и 4). Одновременное применение аминогликозидов с другими лекарственными препаратами, выводящимися из организма путем почечной экскреции, также относится к числу факторов риска, влияющих на частоту или степень проявления нежелательных реакций. Аминогликозиды не рекомендуется применять вместе с амфотерицином В, цисплатином, миорелаксантами и ванкомицином.
На протяжении длительного времени аминогликозиды относятся к широко применяемым антибактериальным препаратам и входят в стандарты лечения инфекций различной локализации (табл. 5). На современном этапе практическое значение данной группы антибиотиков, в первую очередь, связано с лечением нозокомиальных инфекций, вызываемых преимущественно грамотрицательными микроорганизмами. Основными показаниями к применению аминогликозидов II и III поколения являются тяжелые инфекции: сепсис, септический эндокардит, остеомиелит, инфекции кожи и мягких тканей, нозокомиальная пневмония, генерализованные формы раневой и ожоговой инфекции, перитонит, послеоперационные гнойные осложнения, инфекции почек и мочеполовых путей и др. В большинстве случаев аминогликозиды назначаются в комбинации с бета-лактамными и антианаэробными антибиотиками. Следует отметить, что в качестве средства эмпирической терапии может служить только амикацин, поскольку к нему сохраняют высокую чувствительность более 70% штаммов грамотрицательных бактерий. Назначение других аминогликозидов рекомендовано после подтверждения чувствительности к гентамицину или конкретному антибиотику выделяемых возбудителей.
Резистентность микроорганизмов к аминогликозидам
К сожалению, более чем полувековое использование аминогликозидов, в том числе по необоснованным показаниям (внебольничные инфекции дыхательных путей и пр.), привело к возникновению и распространению устойчивых к ним штаммов микроорганизмов [10]. В частности, в России уровень резистентности к аминогликозидам, прежде всего к гентамицину, превышает таковой в большинстве других стран [11].
Формирование устойчивости к аминогликозидам обусловлено в первую очередь ферментативной инактивацией антибиотиков путем модификации [11, 12]. Модифицированные молекулы теряют способность связываться с рибосомами и подавлять синтез белка микроорганизмов. Известны три группы аминогликозидмодифицирующих ферментов (АМФ): ацетилтрансферазы (ААС), присоединяющие молекулу уксусной кислоты, фосфортрансферазы (АРН), присоединяющие молекулу фосфорной кислоты, нуклеотидил- или аденилилтрансферазы (ANT), присоединяющие молекулу нуклеотида аденина (табл. 6). В целом именно гентамицин является субстратом для значительно большего количества АМФ, чем другие аминогликозиды II и III поколения, что определяет высокий уровень резистентности к данному антибиотику. Напротив, возможность модифицирования амикацина обуславливает наименьшее среди аминогликозидов количество АМФ, поэтому к нему сохраняют чувствительность ряд бактерий, резистентных к гентамицину, нетилмицину и другим препаратам этой группы.
Согласно данным по антибиотикорезистентности в России за период 2002–2004 гг., чрезвычайно высокая резистентность нозокомиальных штаммов P. aeruginosa и Klebsiella pneumoniae наблюдалась к гентамицину, составляя 74,9% и 76,5% соответственно — рис. 2, рис. 3 [13]. Наиболее активен в отношении данных возбудителей амикацин, к которому нечувствительны до 35,8% штаммов K. pneumoniae и 42,9% P. aeruginosa.
В другом же исследовании (Micromax), проведенном в стационарах Москвы, Смоленска и Екатеринбурга частота выделения нечувствительных к амикацину штаммов P. aeruginosa и K. pneumoniae составила 11% и 10,8% соответственно [14]. В этой связи чрезвычайно важно руководствоваться именно локальными данными по антибиотикорезистентности возбудителей.
Применение аминогликозидов в лечении инфекций дыхательных путей
В связи с тем, что аминогликозиды не обладают активностью в отношении основного возбудителя внебольничных инфекций дыхательных путей — S. pneumoniae, их нельзя использовать для лечения внебольничной пневмонии (как в амбулаторной, так и стационарной практике) и других внебольничных инфекций верхних и нижних отделов респираторного тракта. Пожалуй, единственной клинической ситуацией, оправдывающей назначение аминогликозидов, является тяжелая внебольничная пневмония, вызванная P. aeruginosa. В данном случае применяются цефтазидим, цефепим, цефоперазон/сульбактам, тикарциллин/клавуланат, пиперациллин/тазобактам, карбапенемы (меропенем, имипенем) или ципрофлоксацин либо в режиме монотерапии или комбинации с аминогликозидами II–III поколения (предпочтительным является применение амикацина) [15].
Абсцесс легкого и эмпиема плевры
Потенциальными возбудителями абсцесса легкого являются анаэробные микроорганизмы — Fusobacterium nucleatum, Peptostreptococcus spp., Bacteroides spp. либо ассоциации анаэробных и аэробных бактерий (в первую очередь, представители семейства Enterobacteriacea — K. pneumoniae и K. оxytoca) [16]. Российские эксперты в качестве препаратов выбора рекомендуют применение ингибиторозащищенных аминопенициллинов (амоксициллин/клавуланат, ампициллин/сульбактам) либо цефоперазон/сульбактама. При отсутствии этих антибиотиков либо их неэффективности могут использоваться карбапенемы, ингибиторозащищенные пенициллины (тикарциллин/клавуланат, пиперациллин/тазобактам) либо комбинации клиндамицина с аминогликозидами II и III поколения [17].
В этиологии эмпиемы плевры ведущую роль занимают грамотрицательные бактерии (15–32%) и анаэробы (5–19%). На долю S. aureus приходится от 7 до 15% случаев, S. pneumoniae выделяется у 5–7% больных, еще реже встречается H. influenzae. В 20–25% случаев обнаруживают микробные ассоциации, прежде всего, анаэробов и аэробов, представленных грамотрицательными бактериями [18]. Антибактериальная терапия должна, по возможности, проводится целенаправленно, т. е. с учетом данных микробиологического исследования содержимого плевральной полости. При острой постпневмонической эмпиеме плевры, вызванной S. pneumoniae и S. pyogenes, в качестве препаратов выбора используются цефалоспорины ІІ–ІV поколений в режиме монотерапии. Альтернативой им являются линкосамиды или ванкомицин. При стафилококковой острой постпневмонической эмпиеме применяют оксациллин либо цефазолин, в качестве альтернативы рассматриваются линкосамиды, фузидиевая кислота, ванкомицин и линезолид. В случае острой постпневмонической эмпиемы плевры, вызванной Haemophilus influenzae, препаратами выбора являются цефалоспорины III или IV поколения. Альтернативой им являются «защищенные» аминопенициллины (амоксициллин/клавуланат, ампициллин/сульбактам) или фторхинолоны.
В этиологии подострой и хронической эмпиемы плевры ведущую роль занимают анаэробные стрептококки, бактероиды, часто в ассоциации с микроорганизмами семейства Enterobacteriaceae. Препаратами первой линии в данном случае являются «защищенные» аминопенициллины — амоксициллин/клавуланат или ампициллин/сульбактам. В качестве препаратов альтернативы рекомендуются линкосамид в сочетании с аминогликозидом II или III поколения, либо цефалоспорины II–IV генерации, либо карбапенемы (имипенем, меропенем), либо тикарциллин/клавуланат или пиперациллин/тазобактам [17]. При эмпиеме плевры, как правило, без хирургического вмешательства невозможно добиться излечения пациента, и в большинстве случаев требуется торакотомическое дренирование, реже применяется торакоскопия и декортикация.
Нозокомиальная пневмония
Нозокомиальная пневмония (НП) занимает второе место среди всех нозокомиальных инфекций (13–18%) и является самой частой инфекцией (≥ 45%) в отделениях реанимации и интенсивной терапии (ОРИТ) [19, 23]. НП развивается в среднем у 0,5–1% всех госпитализированных больных и у 10–20% госпитализированных в ОРИТ. Особая категория НП у пациентов, находящихся на искусственной вентиляции легких (вентиляторассоциированная пневмония — ВАП), развивается у 9–27% от общего числа интубированных. По показателю смертности НП лидирует среди нозокомиальных инфекций, вызывая летальные исходы в среднем от 30 до 70% пациентов [20, 21].
НП наиболее часто вызывается аэробными грамотрицательными микроорганизмами — P. aeruginosa, E. coli, K. pneumoniae и Acinetobacter spp. (рис. 4). В последнее время отмечается увеличение частоты обнаружения S. aureus, в том числе МR (MRSA) [21]. Большинство случаев НП имеет полимикробную этиологию [22]. Частота встречаемости полирезистентных возбудителей зависит от популяции пациентов (чаще всего у больных с тяжелыми хроническими заболеваниями, факторами риска развития пневмонии и поздним развитием пневмонии > 5 дней), стационара и типа отделения, что свидетельствует о крайней необходимости получения локальных данных.
При выборе антибиотиков для эмпирической антибактериальной терапии НП необходимо ориентироваться в первую очередь на локальные данные по антибиотикорезистентности возбудителей. Необходимо помнить, что эти данные нуждаются в периодическом обновлении, так как устойчивость бактерий может изменяться с течением времени в зависимости от структуры и частоты использования антибиотиков.
В настоящее время рекомендован подход к антибиотикотерапии НП в зависимости от сроков развития заболевания. При ранней НП (≤ 5 дней), развившейся у пациентов без факторов риска, применяют цефалоспорины III и IV поколения, амоксициллин/клавуланат, левофлоксацин, моксифлоксацин, ципрофлоксацин и эртапенем в режиме монотерапии.
Напротив, у пациентов с поздней (> 5 дней) НП или при наличии факторов риска полирезистентных возбудителей рекомендована комбинированная терапия — антисинегнойный цефалоспорин или карбапенем или цефоперазон/сульбактам в сочетании с амикацином или фторхинолоном с синегнойной активностью.
Аминогликозиды также применяются в комбинации с карбапенемом при НП установленной этиологии, в частности, вызванной E. coli, K. pneumoniae, другими грамотрицательными микро-
организмами (Enterobacter spp., Morganella spp., Serratia spp.), P. aeruginosa или Acinetobacer spp. (табл. 7).
Традиционная длительность терапии НП составляет 14–21 день, однако современная тактика ведения пациентов с ВП предусматривает сокращение длительности антибиотикотерапии до 7 дней в случае эффективной начальной эмпирической терапии [21]. При использовании аминогликозидов для комбинированной эмпирической терапии, их применение может быть прекращено через 5–7 дней у пациентов с клинической эффективностью лечения.
В заключение необходимо еще раз отметить, что применение аминогликозидов для лечения внебольничных инфекций дыхательных путей недопустимо, при внутрибольничных инфекциях аминогликозиды (нетилмицин, амикацин) должны использоваться только лишь в определенных клинических ситуациях и только в комбинации с другими антибактериальными препаратами.