Чем можно заменить серную кислоту
Содержание материала
До настоящего времени не было пока, найдено полного заменителя сернистой кислоты, хотя имеется ряд веществ, в комплексе до некоторой степени обладающих свойствами сернистой кислоты. Используют их главным образом не с целью полной замены сернистой кислоты, а для частичного снижения ее доз. К этим веществам относятся сорбиновая и аскорбиновые кислоты, а также диэтиловый эфир пироугольной кислоты. Недавно испытана 5-нитро- фурилакриловая кислота (5НФА). Обычно применяют ее натриевую соль (Νa-5НФА) в количестве от 5 до 10 мг/л [114].
Сорбиновая кислота. В последнее время в СССР, а также за рубежом для консервирования фруктовых соков и вин применяется сорбиновая кислота. Эта кислота более интенсивно ингибирует развитие, дрожжей, чем сернистая. Так, например, 200 мг/л сорбиновой кислоты задерживает брожение, как 300 мг/л сернистой кислоты.
Сорбиновая кислота слабее действует на микрофлору виноградного сусла и не действует на молочнокислые и уксуснокислые бактерии. Антисептическое действие ее зависит от содержания спирта, от концентрации водородных ионов, возраста дрожжей и температуры вина. Сорбиновая кислота при pH 2,8 заметно уменьшает дыхание дрожжей, а при pH 3,6 слабо влияет на их дыхание. В кислой среде она быстрее диффундирует в клетку дрожжей и сильнее ингибирует дыхание. При pH 2,8 она блокирует энзимы, содержащие SH-группы, например алкогольдегидрогеназу, фумаразу и энолазу.
Сорбиновая кислота имеет две двойные связи, вследствие чего легко распадается в водных растворах, а также и в винах. Обнаружено, что при хранении вина с сорбиновой кислотой в течение 6—7 месяцев она распадается на карбонильные соединения, которые выделены с помощью 2,4-динитрофенилгидразина. Для некоторых микроорганизмов сорбиновая кислота является источником углеродного питания. В результате действия микроорганизмов содержание ее в вине уменьшается и создаются благоприятные условия для развития других микроорганизмов [108].
Кроме того, сорбиновая кислота не обладает антиоксидантным действием. Поэтому ее рекомендуют применять совместно с сернистой кислотой. Е. Пейно рекомендует брать 200 мг/л сорбиновой кислоты и не более 50 мг/л сернистой. Доза сорбиновой кислоты не должна превышать 300 мг/л, так как повышенное ее количество ухудшает вкус вина.
Рекомендуют также применять сорбиновую кислоту совместно с диэтиловым эфиром пироугольной кислоты или с витамином К5. Диэтиловый эфир пироугольной кислоты. Недавно было показано, что в качестве вещества, подавляющего деятельность не только дрожжей, но и других микроорганизмов, можно применять диэтиловый эфир пироугольной кислоты, который в количестве 160—200 мг/л подавляет рост дрожжей.
При повышенной спиртуозности доза может быть уменьшена до 50 мг/л. Ингибирующее действие диэтилпирокарбоната заключается в том, что он способен реагировать с аминогруппами дыхательных ферментов дрожжей.
Диэтилпирокарбонат — очень неустойчивое соединение, в винах с pH 3,3 через 2 ч распадается на этиловый спирт и углекислоту на 50%, а через 10—12 ч полностью разрушается, теряя антисептические свойства.
С увеличением кислотности гидролиз диэтилпирокарбоната усиливается.
Исследования показали, что диэтилпирокарбонат, содержащий меченый углерод (С14), способен связываться с компонентами вина.
Наряду с распадом диэтилпирокарбоната протекают и побочные реакции, в результате образуются карбоксиэтилпроизводные аминокислот, пептидов, гликозидов. В винах эти побочные реакции составляют 5—6% первоначальной активности. Сравнительна сильно реагируют продукты распада диэтилпирокарбоната с гидроксильными группами и аминогруппами, содержащимися в аминокислотах С повышением pH реакция обмена С14 подавляется, и наоборот.
Диэтилпиркарбонат как ингибитор задерживает брожение слабоалкогольных вин с несброженным сахаром. Лучшие результаты получаются при совместном применении 200 мг/л диэтилпирокарбоната и не более 50 мг/л сернистой кислоты. При этом эффективность действия препарата увеличивается на 60%.
Для достижений стерилизации рекомендуется обрабатывать вино перед розливом в бутылки диэтиловым эфиром пироугольной кислоты, который следует диспергировать в вино посредством азота или нейтральных газов или — в виде спиртового раствора. Перемешивание вина надо производить в атмосфере азота.
Диэтил пирокарбонат обладает легким фруктовым ароматом и не искажает естественный букет и вкус вина. Кроме того, при распаде диэтилового эфира пироугольной кислоты образуется незначительное количество этилкарбоната, который обладает фруктовым запахом.
Диэтилпирокарбонат не токсичен и представляет собой бесцветную прозрачную жидкость. Растворимость его в воде 0,6%, хорошо растворим в этиловом спирте.
Испытан также диметилдикарбонат, который, гидролизуясь в вине, образует метанол, поэтому непригоден для виноделия.
Аскорбиновая кислота. Установлено, что эта кислота обладает большим антиокислительным действием, чем сернистая. При совместном действии эффективность значительно увеличивается. В присутствии сернистой кислоты антисептическое действие аскорбиновой увеличивается, поэтому ее применяют совместно с сернистой кислотой не только для предупреждения окисления, но и для предохранения от развития микроорганизмов.
Аскорбиновая и сернистая кислоты ведут себя различно. Если сернистая кислота, окисляясь, акцептирует кислород воздуха или кислород перекиси водорода, то аскорбиновая, дегидрируясь, отдает два водорода и восстанавливает окисленные вещества, как например, хиноны. При неферментативном окислении, т. е. ионами меди и железа, она образует дегидроаскорбиновую кислоту и перекись водорода.
Последняя в присутствии следов тяжелых металлов окисляет компоненты вина, например, винную, яблочную кислоты, аминокислоты, а также сернистую.
Первый продукт окисления аскорбиновой кислоты — это монодегидроаскорбиновая кислота, которая также обладает окислительной способностью.
Таким образом, аскорбиновая кислота не может быть рекомендована для совместного введения с сернистой кислотой в сусло и вино в присутствии кислорода. Кроме того, первый продукт окисления аскорбиновой кислоты — дегидроаскорбиновая кислота — легко распадается в треоновую и щавелевую кислоты, портящие вкус и букет вина.
При избытке кислорода в вине аскорбиновая кислота, окисляясь, образует перекись водорода; последняя в присутствии тяжелых металлов настолько усиливает окислительные процессы, что может появиться мышиный тон.
Так, продукты распада аскорбиновой кислоты вызывают каталитический распад не только компонентов вина, но и сернистой кислоты, введенной извне. Согласно данным Е. Кильхофера и Г. Вюрдига, содержание сернистой кислоты в вине за 15 дней уменьшается на 22—25 мг/л, а в присутствии Аскорбиновой кислоты сернистая окисляется в 5 раз быстрее и/ составляет за это время до 100 мг/л. Это свидетельствует о том, что аскорбиновую кислоту не рекомендуется применять в аэробных условиях.
Исходя из этого, А. С. Вечер и В. М. Лоза (1957) удачно применили аскорбиновую кислоту в производстве шампанского. При шампанизации вина как бутылочным, так и резервуарным методом протекают восстановительные процессы вследствие вторичного брожения, вызываемого дрожжами, поэтому аскорбиновая кислота сохраняется в шампанском при отсутствии кислорода.
Аскорбиновая кислота снижает редокспотенциал в вине, она восстанавливает окисленные вещества, которые участвуют в образовании букета, поэтому вкус и букет шампанского намного улучшаются, а шампанское приобретает свежесть.
Несмотря на сильное восстановительное действие, аскорбиновая кислота не может полностью заменить сернистую кислоту в виноделии, так как не обладает антисептическими свойствами. Она частично может заменить сернистую кислоту как сильный восстановитель.
Исходя из этого, аскорбиновую кислоту применяют совместно с сернистой в анаэробных условиях для предупреждения вин от окисления и от микробиальных заболеваний. Оптимальная доза аскорбиновой кислоты 50—70 мг/л при содержании 15—20 мг/л SO2 без доступа кислорода воздуха.
Таким образом, равноценные эффективные заменители сернистой кислоты до настоящего времени не найдены.
Сернистая кислота пока является единственным средством, обладающим как антисептическим, так и антиоксидантным действием.
Серная кислота – полное руководство
Определение
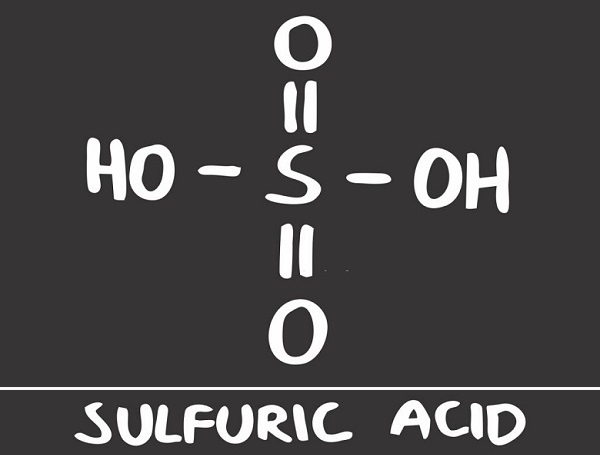
Серная кислота (серная кислота) является едкой минеральной кислотой с маслянистым, стекловидным внешним видом, что дало ей более раннее название масла купороса. Другие названия – сульфиновая кислота, аккумуляторная кислота и сероводород. Формула серной кислоты H2SO4 указывает на присутствие атома серы, окруженного двумя гидроксидными соединениями и двумя атомами кислорода. Эта мощная кислота используется в различных отраслях промышленности, прежде всего в производстве удобрений и химических веществ.
Короче говоря, Производство серной кислоты делится на пять этапов – извлечение серы из земли или в качестве побочного продукта других производственных процессов, превращение серы в диоксид серы, дальнейшее превращение диоксида серы в триоксид серы и окончательное добавление воды для превращения триоксида серы в дымящую серную кислоту и добавление концентрированной серной кислоты для получения еще большего количества молекул.
Серная кислота в производстве удобрений
Производство удобрений использует серную кислоту для добавления серы в почву. Большая часть сельскохозяйственных земель требует источника серы для замены того, что использовалось зерновыми культурами или выщелачивалось в дождливые периоды. Недостаток серы приводит к лист пожелтение, лист и ткань некроз и задержка развития. Пока растения не могут использовать элементарную серу, почвы бактерии окисляют это, чтобы сформировать сульфат. Сульфат является наиболее важным источником питания для всех растение Жизнь и растения могут легко поглотить его через свои корни.
Во время переработки ископаемого топлива сера извлекается в качестве побочного продукта из угля, сырой нефти и природного газа, которые содержат его в небольших или больших количествах. Во время переработки ископаемого топлива эта сера удаляется и чаще всего отправляется в виде серной кислоты на заводы по производству удобрений. Сера не только добавляется в почву, но и необходима для производства суперфосфата извести, где фосфат породы смешивается с серной и фосфорной кислотой. Суперфосфат извести позволяет растениям поглощать фосфаты. Другим важным удобрением является сульфат аммония, получаемый в результате реакции между аммонием и серной кислотой. Серная кислота, производимая для производства удобрений, имеет техническую чистоту или загрязнена и слабо окрашена с концентрацией от 78 до 93%.
Серная кислота в химическом производстве
Использование серной кислоты в химическом производстве включает производство капролактама для нейлоновых волокон и диоксида титана, который представляет собой ярко-белый пигмент. Кроме того, серная кислота необходима для производства плавиковой кислоты, которая заменила хлорфторуглероды (ХФУ) для использования в холодильниках или системах кондиционирования воздуха.
Сульфатные соли, такие как сульфат кальция (гипс и гипс) и гидросульфат, являются производными этой конкретной кислоты. Хотя сульфиты металлов, как правило, нелегко растворяются в воде, другие сульфатные соли, наоборот, образуют серную кислоту один из самых доступных и лучших растворителей для использования в широком спектре отраслей промышленности, Минеральные добавки в секторе здравоохранения и лауретсульфат натрия в шампуне и туалетных принадлежностях являются другими примерами сульфатных солей. Именно эти частицы способствуют кислотному дождю, но в то же время они могут играть незначительную защитную роль в качестве частиц в воздухе по отношению к диффузия солнечной радиации.
Серная кислота также используется для производства взрывчатых веществ. Добавление азотной и серной кислот в целлюлозу делает легковоспламеняющейся нитроцеллюлозой. По этой причине покупка серной кислоты в больших количествах требует лицензии. Коммерческая серная кислота продается с минимальной концентрацией 95%.
Серная кислота в лаборатории
В лаборатории серная кислота используется в качестве осушающего агента и в количественном анализе, где концентрация решение рассчитывается с использованием метода, известного как титрование. Всякий раз, когда к кислоте добавляют воду (остерегайтесь реакции с серной кислотой и всегда добавляйте кислоту в воду, а не наоборот), положительно заряженные ионы водорода высвобождаются из кислоты путем донорства протонов. Основания или щелочи, такие как гидроксид натрия, производят отрицательно заряженные гидроксид-ионы в присутствии воды из-за принятия протонов. В зависимости от количества кислоты или щелочи в растворе, можно рассчитать его концентрацию, сложив противоположные и выяснив, когда отрицательные и положительные заряды нейтрализуют друг друга и объединяются, образуя воду молекула, Например, когда серная кислота и гидроксид натрия (NaOH) смешиваются, они реагируют и образуют молекулы воды. Однако такой металл, как натрий, в присутствии серы и воды будет дополнительно производить сульфат натрия (Na2SO4) и воду.
Примером использования титрования может быть определение концентрации раствора серной кислоты. Титрование кислоты требует известной концентрации щелочного реагента (титранта) – в данном случае гидроксида натрия. Добавляя небольшие известные количества основания к кислоте и проверяя реакцию нейтрализации с помощью индикатора pH, можно определить, сколько молей NaOH требуется для реакции с H2SO4, и таким образом рассчитать концентрацию в молях на литр.
Серная кислота в автомобильной промышленности
Серная кислота является электролитом; электролит – это раствор, в котором присутствуют ионы. Свинцово-кислотные аккумуляторы в автомобилях состоят из наборов положительно заряженных пластин из оксида свинца, погруженных в электролит, и отрицательно заряженных пластин из чистого свинца, погруженных аналогичным образом. Этот электролит представляет собой разбавленную серную кислоту (примерно 33%). Вот почему серная кислота часто упоминается как аккумуляторная кислота,
Автомобильные аккумуляторы накапливают химическую энергию и преобразуют ее в электрическую энергию посредством реакций водорода, кислорода, свинца и серы друг с другом. Присутствие дистиллированной (чистой) воды в серной кислоте производит водород и сульфат. Отпущенные отрицательные электроны перемещаются от отрицательной к положительной пластине, в то время как сульфат-ионы замещают эту потерю в отрицательно заряженной пластине (электроде), впоследствии реагируя со свинцом с образованием сульфата свинца. Серная кислота идеально подходит для этой реакции, поскольку она является дипротоновой кислотой, способной высвобождать два своих протона одновременно.
Эта реакция также происходит в положительной пластине, где связи оксида свинца разрываются, и атомы кислорода растворяются в растворе серной кислоты, оставляя атомы свинца в пластине для связи с сульфатом. Присутствие кислорода и водорода в растворе приводит к образованию воды, понижающей концентрацию серной кислоты. Когда эта концентрация слишком низкая, батарею необходимо заменить или перезарядить.
Перезарядка является противоположностью вышеописанного процесса, возвращая аккумулятор в исходное состояние положительной пластины сульфата свинца, отрицательной пластины чистого свинца и исходной концентрации сернокислого электролита; Однако, ионы медленно теряются со временем Именно поэтому срок службы батареи, даже когда она перезаряжаемая, ограничен.
Что касается энергетики, серная кислота также является компонентом литий-серно-хлоридных (Li-SO2Cl2) и литий-серно-диоксидных батарей (Li-SO2). Литий-серные батареи в настоящее время вызывают большой интерес, поскольку теоретически они могут хранить значительно больше энергии, чем литий-ионные альтернативы; Тем не менее, много исследований еще предстоит сделать.
Серная кислота в пищевой промышленности
Серная кислота часто используется в пищевой промышленности для обезвоживания некоторых пищевых продуктов, таких как фрукты, или для остановки роста бактерий и других вредных микробов, которые ускоряют процесс распада. Используется в форме спрея для сохранения мяса или птицы. Серная кислота также является пищевой добавкой общего назначения, используемой в алкогольных напитках и сыре.
Для сушки фруктов высоко ценится способность серной кислоты удалять воду. В присутствии воды серная кислота вступает в реакцию с образованием H3O + (гидроний) и HSO4– (сероводород). Последующая реакция объединяет сероводород с водой для получения большего количества H3O + и SO42- или сульфата. В виде реакция гидратации серной кислоты не требует энергии – это термодинамически выгодно – и так как в нем много атомов водорода (протонов), которые она с радостью жертвует, серная кислота быстро снижает pH любой ткани, с которой она вступает в контакт. Однако, в процессах сушки фруктов концентрированная серная кислота не находится в прямом контакте с фруктами но вместо этого используется для сушки воздуха вокруг него, удаляя влагу и тем самым помогая и ускоряя процесс обезвоживания.
Серная кислота в организме человека
В организме человека только аминокислоты цистеин (необязательно) и метионин (обязательно) содержат серу. Это означает, что многие белки, содержащие их, способны производить небольшое количество серной кислоты при метаболизме. Когда эта нелетучая (метаболическая) серная кислота не расщепляется и не используется, она выводится через почки.
Сера является одним из самых распространенных минералов в организме человека. и легко доступны в пищевых источниках от чеснока до мяса. Большинство волос и кожа Лечение, диетические добавки и совместное лечение фармацевтическими препаратами содержат большое количество этого элемента.
H2SO4 + 2NaHCO3 → Na2SO4 + 2H2O + CO2
Производство CO2 позволяет организму быстро регулировать pH посредством вентиляции легких, в то время как почки регулируют ионы водорода и бикарбоната посредством экскреция и реабсорбция в более неторопливом темпе.
Кислотные ожоги являются результатом обезвоживания тканей, Коррозионные характеристики сильного раствора серной кислоты обусловлены его способностью отдавать ионы водорода, вызывая мощную реакцию окисления. Кожа содержит большое количество воды, и взаимодействие H2SO4 с H20 приводит к образованию положительно заряженных ионов гидрония (H3O +) и отрицательно заряженного сероводорода (HSO4–), что соответствует реакции, описанной в разделе, описывающем дегидратацию плодов. Когда эта реакция происходит, она также генерирует тепло, которое увеличивает любой ущерб.
Приток серной кислоты в кожу связан с немедленной диссоциацией ее ионов водорода; рН пораженной ткани быстро падает. В этой сильно кислой среде окружающие клетки погибают, что приводит к некрозу коагуляции, образованию капилляров и образованию тромба и тромбов в капиллярах и более крупных размерах. кровь сосуды при ожогах второй и третьей степени.
Добавление воды к концентрированному сжиганию серной кислоты или даже раствора, превышающего 20%, не только добавляет дополнительный ингредиент, с которым может реагировать серная кислота, но и последующая реакция генерирует еще больше тепла и, таким образом, больше ущерба. Полоскание под проточной водой должно производиться только сразу после контакта смыть кислоту с кожи но это не лечение или терапия. Прежде чем проводить какое-либо лечение, кислоту необходимо нейтрализовать. Вот почему иногда рекомендуется мыть немедленно с мылом, поскольку большинство мыл являются щелочными. При сжигании серной кислоты время имеет большое значение. Старая информация об упаковке, изображенная ниже, говорит вам, чтобы вы использовали много мыла, а затем покрыли магнезией или пищевой содой. Все эти вещества являются щелочными. Для приема серной кислоты в этих инструкциях рекомендуется пить мел, мыло или даже настенную штукатурку, еще раз щелочи, которые будут принимать диссоциированные протоны. В обоих случаях несчастному человеку рекомендуется обратиться за медицинской помощью.
Структура серной кислоты
Структура серной кислоты состоит из одного атома серы, связанного с двумя атомами кислорода посредством двойных связей, и двух гидроксильные группы (ОН) присоединяется через одинарные связи. Это хорошо видно на изображении ниже.
Факты о серной кислоте
Вот некоторые факты о серной кислоте, которые дадут вам дополнительное представление об этой едкой, опасной, но важной кислоте.
Молярная масса серной кислоты составляет 98,08 г / моль. Это рассчитывается в соответствии с атомными массами его атомов: два атома водорода (2 х 1,008 г / моль), один атом серы (1 х 32,065 г / моль) и четыре атома кислорода (4 х 16 г / моль). Для общего веса одной молекулы серной кислоты расчет такой же, но результаты приведены в аму или единицах атомной массы. Именно когда вы хотите знать молекулярную массу более чем одного моля, результат молекулярной массы отличается от молярной массы. Например, когда у вас есть 2 грамма диоксида серы (SO2 с молярной массой 64,065 г / моль) и вы хотите знать, сколько это молей. Чтобы рассчитать этот результат, сначала нужно разделить 1 (моль) с молярной массой вещества. Затем вы умножаете результат на 2 (граммы), как показано в приведенном ниже уравнении.
Плотность серной кислоты зависит от ее силы (концентрации) и температуры. Например, 13% раствор H2SO4 при комнатной температуре имеет плотность 9,09 г / см3. 96% раствор при той же температуре имеет плотность 15,37 г / см3. Температура кипения серной кислоты составляет 639 ° F, 337 ° C или 610 К; температура замерзания составляет 37 ° F, а температура плавления – 50 ° F.
Серная кислота и автопротолиз
Чистая H2SO4 или безводная H2SO4 является очень полярной жидкостью, что означает, что она содержит молекулы, в которых полярные связи – связи между двумя атомами, которые распределены неравномерно – имеют очень слегка отрицательный и положительный заряд на противоположных концах. Эти заряженные концы могут притягивать или отталкивать противоположно заряженные почти соприкасающиеся молекулы посредством очень слабых диполь-дипольные силы, Серная кислота полностью ионизируется в присутствии воды на ионы гидрония (H30 +) и ионы сероводорода (HSO4–). Однако, без воды серная кислота ионизирует сама с собойгде две молекулы серной кислоты автопротолизуются с образованием одного протонированного иона серной кислоты H3SO4 + и одного иона сероводорода (HSO4–), как видно из уравнения ниже:
2 H2SO4 ⇌ H3SO4 + + HSO4-
Этот высокий уровень ионизации делает серную кислоту превосходной растворитель для широкого спектра реакций и хорошо превосходит свойства растворителя воды.
Серная кислота в нашей среде
Серная кислота является составной частью кислотный дождь и образуется в результате атмосферного окисления газообразного диоксида серы в присутствии влаги. Поскольку диоксид серы образуется, когда ископаемое топливо сжигается либо на производственных предприятиях, для производства электроэнергии и отопления, либо на транспортных средствах, кислотные дожди – это прежде всего антропогенное явление. Сухое осаждение в форме кислых частиц означает, что кислоты могут оседать, а затем вымываться дождевыми осадками, принося кислую воду в пресноводные и морские экосистемы, а также в наземную среду. Это может нанести вред жизни растений и животных.
Результирующие потоки кислой воды, вызванные кислотными дождями, могут привести к дренажу кислых пород (ARD). ARD на самом деле является результатом образования разбавленной серной кислоты в результате минеральных реакций в породе, которые несут значительный ущерб окружающей среде. Регулирующие органы пытаются ограничить воздействие ОРЗ, не допуская попадания воды в промышленные отходы серы, добавляя щелочи в сточные воды и следя за тем, чтобы сточные воды очищались до того, как они попадут в природные источники воды. Кислая вода растворяет различные металлы, присутствующие в сульфидных рудах, и производит яркие, но очень токсичные потоки.
Серная кислота — Все что необходимо знать
Вещество серная кислота – токсичный и смертельно опасный реагент. Но без него современное человечество обойтись не может. используют при производстве лекарственных препаратов, химической продукции, металлургии, удобрений, нефтепродуктов. Вещество не имеет особого запаха, бесцветно, вязкой консистенции, но имеет привкус меди. Отлично взаимодействует с водой в любых пропорциях. Из-за хорошего взаимодействия с другими веществами и водой имеет неофициальное название «кровь химии».
Где применяется серная кислота
За год во всем мире используют более 200 миллионов тонн вещества. В основном оно уходит на производство удобрений и химической продукции:
Разбавленная серная кислота – 7 типов солей
Серная кислота используется в концентрированном виде и в виде растворов точнее солей. Смеси различных химических веществ:
Еще разбавленная серная кислота используется при производстве аккумуляторов в виде дистиллята. Так же такой вид раствора как Олеум. Он чаще всего необходим для транспортировки, так как не воздействует со сталью в отличие от концентрированной серной кислоты.
История. Кто начал использовать раствор серной кислоты
Всем, кто имеет дачный участок или дом в деревне известен медный купорос. Изучением и производством растворов с содержанием серной кислоты активно начали заниматься в 13 веке. Химики того времени придумали нагревать алюмокалиевые квасцы. В 15 веке химики продвинулись и придумали «купоросное масло». В 16 веке Иоганн Глаубер придумал другой способ добычи вещества. С помощью горения нитрата калия серы в присутствии водных паров, он получил Серную кислоту. Уже в это время Серную кислоту использовали химики, фармацевты и ювелиры.
В дальнейшем в Англии ученый Джон Робак решил удешевить производство и заменил стеклянные резервуары на освинцованные. Этим способом он получал 65% раствор вещества Н2SO4.
Современный метод добычи открыли в 19 веке. Он получил название «Нитрозный». К концу 19 века в Европе выпускали за год 1 миллион тонн серной кислоты.
В России первые фабрики по производству открылись в Москве в 1805 году.
Как производят серную кислоту в наше время
На сегодняшний день используют два метода Контактный и Нитрозный.
Контактный метод используется по всему миру. Его распространённость обусловлена следующими преимуществами:
При Контактном методе используют следующие виды сырья:
Пирит измельчают для ускорения прохождения химической реакции. Далее измельченные пирит смешивают с водой. Это позволяет удалить не нужные примеси, они остаются на поверхности. Далее под воздействием высокой температуры (800 °C) вода испаряется не нужные взвеси сгорают. Далее Добавляют катализатор и уменьшают температуру (420-550 °C) Происходит процесс окисления и диоксид серы превращается в ангидрид серной кислоты. Далее в поглотительной башне ангидрит отделяется и появляется чистая серная кислота. В процессе производства вырабатывается огромное количество тепла, которое используют как вспомогательный источник энергии. При использовании данного метода получения Н2SO4 почти нет отходов.
Нитрозный метод представлен в двух вариантах камерный и башенный. При его использовании получится 75% серная кислота. В составе остается железо оксид азота, и иных примесей. Данный способ вреден для экологии, но до сих пор достаточно часто применяется, так как он проще и дешевле Контактного метода.
Основные производители серной кислоты в России
В России ежегодно производят около 10 миллионов тонн серной кислоты. Заводы представляют собой комплекс различных производств и поэтому в основном самостоятельно перерабатывают почти все полученное вещество. В основном это производители удобрений, но так же выпускают следующие виды серной кислоты:
Основные крупнейшие производители серной кислоты в России:
Не маловажную роль играют поставщики вещества пирит. В России их добывают на двух горно-обогатительных комбинатах Талнахский и Норильский.
Транспортировка вещества серная кислота
Серная кислота вещество повышенной опасности и требует определенных мер при транспортировке. Вещество взрывоопасно и имеет 8 класс опасности в перевозке грузов. В случае ошибки водителя и аварии велика вероятность разлива серной кислоты и нанесения вреда экологии.
Поэтому для перевозки опасных грузов требуются особе правила. Подпирается специальная устойчивая емкость для перевозки. Цистерны или специальные бочки и ёмкости, которые изготовлены из определённых сплавов, на которые не оказывает воздействие кислоты и яды.
Транспорт обязательно должен иметь соответствующую маркировку предупреждающую других водителей об опасном грузе. Водитель проходит специальное обучение и получает свидетельство АДР. Для каждой транспортировки разрабатывается специальный маршрут следования, которые исключает места большого количества людей и крупные производственные объекты. Чтобы избежать экологической катастрофы в случае ДТП и воздействия опасных химических веществ на людей.
В чем опасность серной кислоты для человека
Н2SO4 очень токсичное вещество. Легко растворяется в воде и вступает в контакт с другими химическими веществами. В чистом виде сильно поглощает влагу и может распространиться в газообразной форме, в случае аварии на производстве или при транспортировке. Серная кислота в большой концентрации взрывоопасна.
В случае если на человека попадут капли вещества на кожу либо он вдохнет пары или что еще хуже каким-то образом выпьет даже несколько капель последствия могут очень плачевными. Серная кислота очень агрессивна плюс в её состав входит мышьяк, который усиливает отравление организма человека. Но существует безвредная доза серной кислоты, содержащаяся в воздухе, 0.3мг на 1 кв. метр. При воздействии серной кислоты на человека часто возникает трахеит, бронхит, ларингит. Если кислота попала на кожный покров, то кожа разъедается, и рана очень долго заживает. При этом если не обратиться за профессиональной медицинской помощью место ожога может разрастись и привести к летальному исходу пострадавшего. Какие признаки отравления серной кислотой бывают:
Последний пункт очень опасный симптом. Человек в этом случае очень близок к удушью и летальному исходу.
Варианты первой помощи при отравлении серной кислотой
Если вы находитесь в зоне, где в воздухе скапливается серная кислота, необходимо немедленно выйти на чистый воздух. Далее обратиться к мед. работникам, вызвать скорую помощь. В момент ожидание помощи, можно попробовать облегчить свое состояние после отравления серной кислотой. Если раствор вещества попал внутрь, то нужно сделать промывание желудка большим количеством теплой воды. Если Н2SO4 попало на слизистую, то необходимо сразу промыть ее чистой водой в большом количестве. Дальнейшую помощь и последующее лечение окажут профессиональные сотрудники мед. учреждений. Самолечение невозможно, так как это может привести к ухудшению состояния человека и к летальному исходу.
Ликвидация разлива серной кислоты
В случае аварии на производстве либо в момент транспортировки может произойти возгорание или разлив серной кислоты. Устранение аварии производят в специальных костюмах химической защиты, например, изолирующие костюмы Стрелец. Газоспасатели в костюмах химзащиты эвакуируют пострадавших в безопасную зону. Устраняют течь и с помощью большого количества воды гасят серную кислоту. В дальнейшем собирают жидкость в специальные емкости и утилизируют. Газоспасателям оказывают помощь пожарные, им так же приходится работать в костюмах химзащиты.