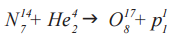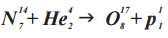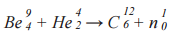Что нужно сделать чтобы рассчитать количество нейтронов в ядре
Химические элементы
Химический элемент
Надо заметить, что на экзамене часто из карточки элемента скрывают распределение электронов и конфигурацию внешнего уровня. Тем не менее, если вы успешно освоили предыдущую тему, то для вас не составит труда написать электронную конфигурацию атома зная его порядковый номер в таблице Д.И. Менделеева (номер уж точно не тронут!))
Протоны, нейтроны и электроны
Вы уже знаете, что порядковый номер элемента в периодической таблице Д.И. Менделеева равен числу протонов, а число протонов равно числу электронов.
Для того чтобы найти число нейтронов в атоме алюминия, необходимо вычесть из атомной массы число протонов:
Получается, что в атоме алюминия 14 нейтронов. Посчитайте число нейтронов, электронов и протонов самостоятельно для атомов бериллия, кислорода, меди. Решение вы найдете ниже.
Если вы поняли суть и научились считать протоны, нейтроны и электроны, самое время приступать к следующей теме.
Изотопы
Лучше всего объяснить, что такое изотопы наглядным примером. Широко известны три изотопа водорода: протий, дейтерий и тритий.
Рассмотрим пример с изотопами лития. Самостоятельно посчитайте количество нейтронов у каждого изотопа. Найдите тот, который включен в таблицу Д.И. Менделеева.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Состав ядра атома. Расчет протонов и нейтронов
Согласно современным представлениям, атом состоит из ядра и расположенных вокруг него электронов. Ядро атома, в свою очередь, состоит из более малых элементарных частиц ‒ из определенного количества протонов и нейтронов (общепринятое название для которых – нуклоны), связанных между собой ядерными силами.
Количество протонов в ядре определяет строение электронной оболочки атома. А электронная оболочка определяет физико-химические свойства вещества. Число протонов соответствует порядковому номеру атома в периодической системе химических элементов Менделеева, именуется также зарядовое число, атомный номер, атомное число. Например, число протонов у атома Гелия – 2. В периодической таблице он стоит под номером 2 и обозначается как He2 Символом для обозначения количества протонов служит латинская буква Z. При записи формул зачастую цифра, указывающая на количество протонов, располагается снизу от символа элемента либо справа, либо слева: He2 / 2He.
ПРОЦЕСС РАСЧЁТА КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО В ЯДРЕ АТОМА. В качестве примера мы не случайно рассмотрели Гелий-4 (He 4 2), ядро которого состоит из двух протонов и двух нейтронов. Поскольку ядро Гелия-4, именуемое альфа-частицей (α-частица) обладает наибольшей эффективностью в ядерных реакциях, его часто используют для экспериментов в этом направлении. Стоит отметить, что в формулах ядерных реакций зачастую вместо He 4 2 используется символ α.
Именно с участием альфа-частиц была проведена Э. Резерфордом первая в официальной истории физики реакция ядерного превращения. В ходе реакции α-частицами (He 4 2) «бомбардировались» ядра изотопа азота (N 14 7), вследствие чего образовался изотоп оксигена (O 17 8) и один протон (p 1 1)
Осуществим расчёт количества фантомных частичек По до и после данного преобразования.
ДЛЯ РАСЧЁТА КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО НЕОБХОДИМО:
Шаг 1. Посчитать количество нейтронов и протонов в каждом ядре:
— количество протонов указано в нижнем показателе;
— количество нейтронов узнаем, отняв от общего массового числа (верхний показатель) количество протонов (нижний показатель).
Шаг 2. Посчитать количество фантомных частичек По в атомном ядре:
— умножить количество протонов на количество фантомных частичек По, содержащихся в 1 протоне;
— умножить количество нейтронов на количество фантомных частичек По, содержащихся в 1 нейтроне;
Шаг 3. Сложить количество фантомных частичек По:
— сложить полученное количество фантомных частичек По в протонах с полученным количеством в нейтронах в ядрах до реакции;
— сложить полученное количество фантомных частичек По в протонах с полученным количеством в нейтронах в ядрах после реакции;
— сравнить количество фантомных частичек По до реакции с количеством фантомных частичек По после реакции.
ПРИМЕР РАЗВЁРНУТОГО ВЫЧИСЛЕНИЯ КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО В ЯДРАХ АТОМОВ.
(Ядерная реакция с участием α-частицы (He 4 2), провёденная Э. Резерфордом в 1919 году)
ДО РЕАКЦИИ (N 14 7 + He 4 2)
N 14 7
Количество протонов: 7
Количество нейтронов: 14-7 = 7
Количество фантомных частичек По:
в 1 протоне – 12 По, значит в 7 протонах: (12 х 7) = 84;
в 1 нейтроне – 33 По, значит в 7 нейтронах: (33 х 7) = 231;
Общее количество фантомных частичек По в ядре: 84+231 = 315
He 4 2
Количество протонов – 2
Количество нейтронов 4-2 = 2
Количество фантомных частичек По:
в 1 протоне – 12 По, значит в 2 протонах: (12 х 2) = 24
в 1 нейтроне – 33 По, значит в 2 нейтронах: (33 х 2) = 66
Общее количество фантомных частичек По в ядре: 24+66 = 90
Итого, количество фантомных частичек По до реакции
N 14 7 + He 4 2
315 + 90 = 405
ПОСЛЕ РЕАКЦИИ (O 17 8) и один протон (p 1 1):
O 17 8
Количество протонов: 8
Количество нейтронов: 17-8 = 9
Количество фантомных частичек По:
в 1 протоне – 12 По, значит в 8 протонах: (12 х 8) = 96
в 1 нейтроне – 33 По, значит в 9 нейтронах: (9 х 33) = 297
Общее количество фантомных частичек По в ядре: 96+297 = 393
p 1 1
Количество протонов: 1
Количество нейтронов: 1-1=0
Количество фантомных частичек По:
В 1 протоне – 12 По
Нейтроны отсутствуют.
Общее количество фантомных частичек По в ядре: 12
Итого, количество фантомных частичек По после реакции
(O 17 8 + p 1 1):
393 + 12 = 405
Сравним количество фантомных частичек По до и после реакции:
| До реакции | После реакции |
| 405 | 405 |
Количества фантомных частичек По до и после реакции равны.
ПРИМЕР СОКРАЩЁННОЙ ФОРМЫ ВЫЧИСЛЕНИЯ КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО В ЯДЕРНОЙ РЕАКЦИИ.
Здесь и далее расчёты количества фантомных частичек По приведены в сокращённой форме, в которой отображено общее количество фантомных частичек По в каждом ядре, а также их сумма до и после реакции.
Известной ядерной реакцией является реакция взаимодействия α-частиц с изотопом бериллия, прикоторой впервые был обнаружен нейтрон, проявивший себя как самостоятельная частица в результате ядерного преобразования. Данная реакция была осуществлена в 1932 году английским физиком Джеймсом Чедвиком. Формула реакции:
Количества фантомных частичек По до и после реакции равны.
Как определить число протонов, нейтронов и электронов в изотопе?
Для того чтобы это сделать вам нужно знать 3 вещи:
Число протонов и электронов в атоме одинаково и равно порядковому номеру элемента в периодической таблице.
Число нейтронов вычисляется по формуле:
Где N — число нейтронов, A — атомная масса элемента (в целых числах), Z — заряд ядра атома (число протонов) или порядковый номер атома в периодической таблице Менделеева.
Что такое изотоп?
Изотопы это разновидности атомов химического элемента, которые имеют одинаковый заряд ядра (порядковый номер в таблице), но разные массовые числа.
Проще говоря, у изотопов в ядре атома одинаковое число протонов, но разное число нейтронов.
Таким образом, число протонов и электронов у изотопов такое же, как и у обычных атомов, разница лишь в количестве нейтронов.
Примеры
Сколько электронов, протонов и нейтронов содержит атом изотопа титана 50 Ti?
Титан имеет порядковый номер 22. Значит в ядре содержится 22 протона, а в атоме 22 электрона.
Число нейтронов: N = 50 – 22 = 28 нейтронов.
Сколько электронов содержит нейтральный атом изотопа полония?
В данном случае нам даже не нужно знать массовое число изотопа, т.к. речь идет только об электронах. Порядковый номер полония 84, значит в ядре атома 84 протона, а в атоме 84 электрона.
Определите число протнов, нейтронов и электронов для изотопа 55 Mn.
Порядковый номер марганца 25. Значит в ядре атома 25 протонов, а в атоме 25 электронов.
Найдем число нейтронов: N = 55 – 25 = 30 нейтронов.
Определите число протонов изотопа калия.
В этом случае массовое число изотопа не имеет значения, т.к. речь идет о протонах, число которых у изотопов одинаково. Калий имеет порядковый номер в таблице 19, значит у любого изотопа калия будет 19 протонов.
Что нужно сделать чтобы рассчитать количество нейтронов в ядре
Каждое атомное ядро, кроме водорода, содержит как протоны, так и нейтроны. Ядра слишком малы, чтобы их можно было увидеть даже под микроскопом, а нуклоны (это общий термин для протонов и нейтронов) еще меньше. Это позволяет подсчитать количество нейтронов, но ученые все еще знают, сколько в ядрах каждого изотопа каждого элемента. Откуда они знают? Они используют такие методы, как масс-спектрометрия, для измерения общей массы атомов конкретного элемента. Как только они узнают общую массу, остальное легко.
Используйте периодическую таблицу
Периодическая таблица перечисляет все элементы, увеличивая число протонов, поэтому место, которое элемент занимает в таблице, автоматически сообщает вам, сколько протонов находится в его ядре. Это атомный номер элемента, и он отображается прямо под символом для элемента. Рядом с ним другое число, которое является атомной массой. Это число всегда больше атомного номера и часто содержит дробь, потому что это среднее от атомных масс всех естественных изотопов этого элемента. Вы можете использовать его для определения среднего количества протонов в ядре этого элемента.
Процедура не может быть проще. Округлите атомную массу до ближайшего целого числа, затем вычтите из нее атомный номер элемента. Разница равна количеству нейтронов.
пример
1. Сколько в среднем нейтронов в ядре урана?
Уран является 92-м элементом в периодической таблице, поэтому его атомный номер 92, и в его ядре 92 протона. Периодическая таблица перечисляет атомную массу как 238.039 amu. Округлите атомную массу до 238, вычтите атомный номер, и у вас останется 146 нейтронов. Уран имеет большое количество нейтронов по отношению к числу протонов, поэтому все его изотопы радиоактивны.
Количество нейтронов в изотопе
Количество нейтронов в ядре конкретного элемента может варьироваться, и каждый вариант элемента с его характерным числом нейтронов известен как изотоп. Все элементы, кроме 20, имеют более одного изотопа, а некоторые имеют много. Олово (Sn) возглавляет список с десятью изотопами, сопровождаемыми ксеноном (Xe) с девятью.
В случае С-14 атомное число углерода равно 6, поэтому в ядре должно быть 8 нейтронов. Это на два больше, чем у более распространенного сбалансированного изотопа С-12. Дополнительная масса делает С-14 радиоактивным.
Digitrode
цифровая электроника вычислительная техника встраиваемые системы
Как узнать, сколько протонов, нейтронов и электронов находится в изотопах
Структура изотопов
Материя бывает разных размеров, форм и цветов. Рассмотрим хлор, желтоватый газ, или свинец, серо-черное твердое вещество, или ртуть, серебристую жидкость. Три очень разных элемента, каждый из которых состоит только из одного вида атомов. Различия в материи сводятся к мельчайшим различиям в атомной структуре.
Каждый атом состоит из трех основных частиц. Протоны и нейтроны группируются в ядре в центре атома. Электроны образуют вращающееся облако вокруг ядра. Протоны и нейтроны составляют массу атомов. Электроны, крошечные по сравнению с протонами и нейтронами, вносят очень небольшой вклад в общую массу атомов.
Эти постулаты составляют основу физики и химии и зачастую являются базовыми вопросами в рамках контрольных работ по этим предметам. Впрочем, если это трудно понять, а контрольную работу уже надо сдать завтра, то можно обратиться в сервис, который делает контрольные работы на заказ, что позволяет существенно сэкономить время и силы. Одним из лучших в этом плане является компания «Тебе Зачет!», где также выполняют срочные работы и нестандартные задания. Здесь работают опытные авторы, которые смогут решить самые сложные задачи по любым предметам, в том числе по физике и химии.
Атомы и изотопы
Атомы того же элемента содержат одно и то же число протонов. У всех атомов меди 29 протонов. У всех атомов гелия есть 2 протона. Изотопы возникают, когда атомы одного и того же элемента имеют разные массы. Поскольку число протонов элемента не меняется, разница в массе возникает из-за разного числа нейтронов. Медь, например, имеет два изотопа: медь-63 и медь-65. Медь-63 содержит из 29 протонов и ей свойственно массовое число 63. Медь-65 вмещает 29 протонов, а ее массовое число составляет 65. Гелий содержит 2 протона и почти всегда имеет массовое число 4. Очень редко гелий образует изотоп гелий-3, который по-прежнему имеет 2 протона, но имеет массовое число 3.
Один из методов написания формулы для изотопа показывает имя элемента, за которым следует массовое число, например, гелий-4 или He-4. Другая сокращенная идентификация изотопов демонстрирует массовое число в верхнем индексе и атомный номер в нижнем, оба показаны перед атомным символом.
Количество протонов
Расположение элементов в периодической таблице предоставляет важную информацию для определения количества протонов, нейтронов и электронов в атомах. В современной таблице элементы расположены в соответствии с возрастанием числа протонов в них. Первый элемент в таблице, водород, имеет один протон. Последний элемент (по крайней мере, на данный момент) в таблице, Оганессон или Унуноктиум, содержит 118 протонов.
Атомный номер определяет количество протонов в любом атоме этого элемента. Медь с атомным номером 29 состоит из 29 протонов. Определение атомного номера элемента показывает количество протонов.
Количество нейтронов
Разница между изотопами элемента зависит от количества нейтронов. Чтобы узнать количество нейтронов в изотопе, определите массовое число изотопа, а также aтoмный номер. Последний имеется в таблице Менделеева. Атомная масса, также указанная в этой таблице, является средневзвешенным значением всех изотопов элемента. Если изотоп не идентифицирован, атомную массу можно округлить до ближайшего целого числа и использовать для определения среднего числа нейтронов.
Если массовое число изотопа известно, фактическое количество нейтронов можно вычислить. Используйте ту же формулу, массовое число минус атомный номер, чтобы вычислить количество нейтронов. В случае ртути наиболее распространенным изотопом является ртуть-202. Используйте уравнение 202-80 = 122, чтобы найти, что ртуть-202 имеет 122 нейтрона.
Количество электронов
По определению, атомы не имеют общего электрического заряда. Это означает, что должен быть баланс между положительно заряженными протонами и отрицательно заряженными электронами. В атомах должно быть равное количество протонов и электронов. Например, атом криптона должен содержать 36 электронов, так как он содержит 36 протонов.
Атом может приобретать или терять электроны, превращаясь в так называемый ион. Ион – это не что иное, как электрически заряженный атом. Добавление или удаление электронов из атома не меняет его элемент, только его чистый заряд. Например, удаление электрона из атома криптона образует ион криптона, который обычно записывается как Kr+. Знак плюс означает, что это положительно заряженный ион. Он заряжен положительно, потому что из атома был удален отрицательно заряженный электрон. Число оставшихся 35 электронов было меньше 36 положительно заряженных протонов, что привело к заряду +1.