Что обозначает м большая в химии
Что такое молярная масса? Молярная масса в химии и физике газов
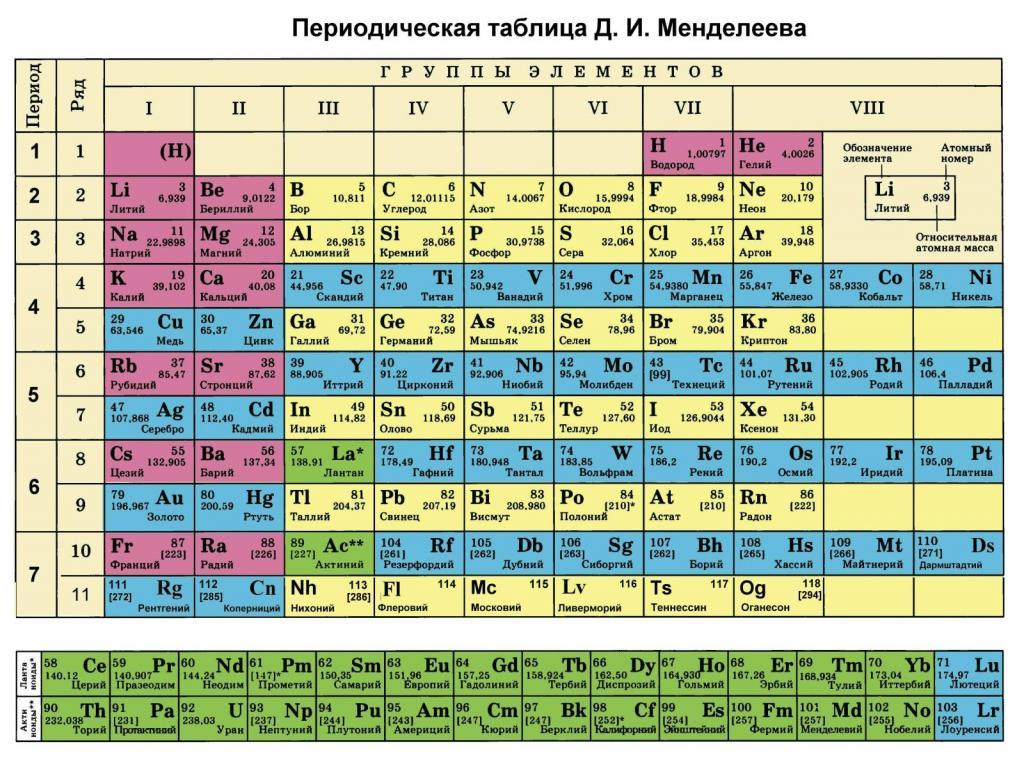
Каждый школьник, который внимательно изучал таблицу Менделеева, наверняка заметил, что, помимо номера химического элемента, в ней присутствует информация о весе его атома. В данной статье рассмотрим, что такое молярная масса и где она используется.
Что такое моль?
Прежде чем ответить на вопрос «что такое молярная масса», необходимо разобраться с такой важной величиной в химии, как моль.
В XIX веке Амедео Авогадро, внимательно изучая закон Гей-Люссака для идеальных газов при изохорном процессе, пришел к умозаключению, что в одинаковых объемах разных веществ при идентичных условиях (температура и давление) содержится равное число атомов или молекул. Идеи Авогадро противоречили теориям того времени о химическом строении и поведении газовых субстанций, поэтому они были приняты только спустя полвека.

В начале XX века с помощью более современных технологий удалось определить количество молекул водорода в 2 граммах этого газа. Это количество получило название «моль». Сам термин был введен Вильгельмом Оствальдом, с латыни он переводится как «куча», «скопление».
В 1971 году моль стал одной из 7 основных единиц измерения в системе СИ. В настоящее время под 1 молем понимают такое количество атомов кремния, которое содержится в идеальной сфере массой 0,028085 кг. Само число частиц, соответствующее 1 моль, называется числом Авогадро. Равно оно приблизительно 6,02*1023.
Что такое молярная масса?
Как было отмечено во введении статьи, каждый элемент в периодической таблице содержит информацию о его атомной массе. Она представляет собой вес в граммах на моль. Очевидно, чтобы получить молярную массу в кг/моль, следует табличное значение разделить на 1000. Например, для ниобия под номером 41 мы видим цифру 92,9, то есть 1 моль его атомов имеет вес 92,9 грамма.
Где используется величина M в химии?
Зная теперь, что такое молярная масса, рассмотрим, где ее применяют в химии.
Понятие количества вещества и молярного веса играет важную роль при составлении химических реакций, поскольку они идут только при строгом соотношении реагентов. Для примера ниже приведена реакция сгорания водорода с образованием молекулы воды:
Видно, что 2 моль водорода, которые имеют массу 4 грамма, реагируют без остатка с 1 моль кислорода весом 32 грамма. В результате образуется 2 моль молекул воды, с показателем в 36 граммов. Из этих цифр ясно, что в процессе химических превращений масса сохраняется. В действительности же вес реагентов и продуктов превращения немного отличается. Эта небольшая разница связана с тепловым эффектом реакции. Разницу в массах можно рассчитать, если использовать формулу Эйнштейна для связи веса и энергии.
В химии понятие молярной массы также тесно связано с одноименной концентрацией. Обычно твердые вещества, которые растворимы в жидкостях, характеризуют количеством молей в одном литре, то есть молярной концентрацией.
Газы и их молярный объем
Молярная масса также связана с физикой идеальных газов. В частности, ей пользуются во время определения объема газовой системы при конкретных внешних условиях, если известно количество вещества.
Идеальные газы описываются уравнением Клапейрона-Менделеева, которое имеет вид:
Объем газа можно определить, если известны его m, температура T и давление P, по следующей формуле:
Молярным объемом называется такой, который при 0 oC и давлении в одну атмосферу занимает 1 моль любого газа. Из формулы выше можно рассчитать эту величину, она составляет 22,4 литра.
Что обозначает м большая в химии
Моль, молярная масса
В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль.
Моль — это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное постоянной Авогадро
Постоянная Авогадро NA определяется как число атомов, содержащееся в 12 г изотопа 12 С:
Таким образом, 1 моль вещества содержит 6,02 • 10 23 частиц этого вещества.
Исходя из этого, любое количество вещества можно выразить определенным числом молей ν (ню). Например, в образце вещества содержится 12,04 • 10 23 молекул. Следовательно, количество вещества в этом образце составляет:
где N – число частиц данного вещества;
NA – число частиц, которое содержит 1 моль вещества (постоянная Авогадро).
Молярная масса вещества (M) – масса, которую имеет 1 моль данного вещества.
Эта величина, равная отношению массы m вещества к количеству вещества ν, имеет размерность кг/моль или г/моль. Молярная масса, выраженная в г/моль, численно равна относительной относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar).
Например, молярная масса метана CH4 определяется следующим образом:
M(CH4)=16 г/моль, т.е. 16 г CH4 содержат 6,02 • 10 23 молекул.
Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) ν, по формуле:
Соответственно, зная массу и молярную массу вещества, можно рассчитать число его молей:
или найти массу вещества по числу молей и молярной массе:
Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т.е. зависит от Mr и Ar. Поэтому разные вещества при одинаковом количестве молей имеют различные массы m.
Пример 
Решение
Молярная масса метана M(CH4) равна 16 г/моль;
молярная масса этана M(С2Н6) = 2 • 12+6=30 г/моль.
Отсюда:
Таким образом, моль – это порция вещества, содержащая одно и то же число частиц, но имеющая разную массу для разных веществ, т.к. частицы вещества (атомы и молекулы) не одинаковы по массе.
Вычисление ν используется практически в каждой расчетной задаче.
Образцы решения задач
Задача №1. Вычислите массу (г) магния, взятого количеством вещества 0, 5 моль?
M (Mg ) = Ar ( Mg ) = 24 г/моль (из периодической системы)
m ( Mg ) = 24 г/моль · 0,5 моль = 12 г
Задача №2. Вычислите массу (г) 12,04 · 10 23 молекул оксида цинка Zn О ?
n (Zn O )= 12,04 * 10 23 молекул
следовательно, формула для расчёта
M(ZnO) = Ar(Zn) + Ar(O) = 65 + 16 = 81 г / моль
m = 81 г/моль · (12,04 * 10 23 /6.02 · 10 23 1/моль) = 162 г
Задания для закрепления
Заполните таблицу (округляя числа до целых )
Химический словарь или справочная тетрадь по химии
Разделы: Химия
Решение о необходимости ведения такой тетради пришло не сразу, а постепенно, с накоплением опыта работы.
Вначале это было место в конце рабочей тетради – несколько страниц для записи наиболее важных определений. Затем туда же были вынесены наиболее важные таблицы. Потом пришло осознание того, что большинству учеников для того, чтобы научиться решать задачи, необходимы строгие алгоритмические предписания, которые они, прежде всего, должны понять и запомнить.
Материал в этой тетради мы располагаем следующим образом: в начале – наиболее важные определения, которые ребята выписывают из учебника или записывают под диктовку учителя. Например, на первом уроке в 8-м классе это определение предмета “химия”, понятие “химические реакции”. В течение учебного года в 8-м классе их накапливается более тридцати. По этим определениям на некоторых уроках я провожу опросы. Например, устный вопрос по цепочке, когда один ученик задает вопрос другому, если тот ответил правильно, значит, уже он задает вопрос следующему; или, когда одному ученику задают вопросы другие ученики, если он не справляется с ответом, значит, отвечают сами. По органической химии это в основном определения классов органических веществ и главных понятий, например, “гомологи”, “изомеры” и др.
В конце нашей справочной тетради представлен материал в виде таблиц и схем. На последней странице располагается самая первая таблица “Химические элементы. Химические знаки”. Затем таблицы “Валентность”, “Кислоты”, “Индикаторы”, “Электрохимический ряд напряжений металлов”, “Ряд электроотрицательности”.
Особенно хочу остановиться на содержании таблицы “Соответствие кислот кислотным оксидам”:
| Соответствие кислот кислотным оксидам | ||||
| Кислотный оксид | Кислота | |||
| Название | Формула | Название | Формула | Кислотный остаток, валентность |
| оксид углерода (II) | CO2 | угольная | H2CO3 | CO3(II) |
| оксид серы (IV) | SO2 | сернистая | H2SO3 | SO3(II) |
| оксид серы (VI) | SO3 | серная | H2SO4 | SO4(II) |
| оксид кремния (IV) | SiO2 | кремниевая | H2SiO3 | SiO3(II) |
| оксид азота (V) | N2O5 | азотная | HNO3 | NO3(I) |
| оксид фосфора (V) | P2O5 | фосфорная | H3PO4 | PO4(III) |
Без понимания и запоминания этой таблицы затрудняется составление учениками 8-х классов уравнений реакций кислотных оксидов со щелочами.
При изучении теории электролитической диссоциации в конце тетради записываем схемы и правила.
Правила составления ионных уравнений:
1. В виде ионов записывают формулы сильных электролитов, растворимых в воде.
2. В молекулярном виде записывают формулы простых веществ, оксидов, слабых электролитов и всех нерастворимых веществ.
3. Формулы малорастворимых веществ в левой части уравнения записывают в ионном виде, в правой – в молекулярном.
| Физические величины | |||
| Обозначение | Название | Единицы | Формулы |
 | количество вещества | моль |  = N / NA; = N / NA;  = m / М; = m / М; |

атомы и другие частицы

 ; / М/ = М r
; / М/ = М r ; m =
; m =  • V
• V (для газов) ;
(для газов) ;V = m /

г / л
 = m / V;
= m / V; 
За 25 – летний период преподавания химии в школе мне пришлось работать по разным программам и учебникам. При этом всегда удивляло то, что практически ни один учебник не учит решать задачи. В начале изучения химии для систематизации и закрепления знаний в словаре мы с учениками составляем таблицу “Физические величины” с новыми величинами:
Приведу примеры некоторых из них.
Алгоритм решения задач по химическим уравнениям.
1. Записать кратко условие задачи и составить химическое уравнение.
2. Над формулами в химическом уравнении надписать данные задачи, под формулами пописать число моль (определяют по коэффициенту).
3. Найти количество вещества, масса или объём которого даны в условии задачи, по формулам:


Полученное число надписать над формулой в уравнении.
4. Найти количество вещества, масса или объём которого неизвестны. Для этого провести рассуждение по уравнению: сравнить число моль по условию с числом моль по уравнению. При необходимости составить пропорцию.
5. Найти массу или объём по формулам: m = M • 

Данный алгоритм – это основа, которую должен освоить ученик, чтобы в дальнейшем он смог решать задачи по уравнениям с различными усложнениями.
Задачи на избыток и недостаток.
Если в условии задачи известны количества, массы или объёмы сразу двух реагирующих веществ, то это задача на избыток и недостаток.
1. Нужно найти количества двух реагирующих веществ по формулам:
2. Полученные числа моль надписать над уравнением. Сравнив их с числом моль по уравнению, сделать вывод о том, какое вещество дано в недостатке.
3. По недостатку производить дальнейшие расчёты.
Задачи на долю выхода продукта реакции, практически полученного от теоретически возможного.
m практ. или V практ. всегда меньше теоретически рассчитанных данных. Долю выхода обозначают буквой 



Выражают её в долях от единицы или в процентах. Можно выделить три типа задач:
Если в условии задачи известны данные для исходного вещества и доля выхода продукта реакции, при этом нужно найти 
Порядок решения:
1. Произвести расчёт по уравнению, исходя из данных для исходного вещества, найти 
2. Найти массу или объём продукта реакции, практически полученного, по формулам:
m практ. = m теор.




Если в условии задачи известны данные для исходного вещества и 
Порядок решения:
1. Произвести расчёт по уравнению, исходя из данных для исходного вещества, найти

2. Найти долю выхода продукта реакции по формулам:



Если в условии задачи известны 
Порядок решения:
1. Найти 
2. Произвести расчёт по уравнению, исходя из 
Конечно, эти три типа задач мы рассматриваем постепенно, отрабатываем умения решения каждого из них на примере целого ряда задач.
Задачи на смеси и примеси.
Массовую долю чистого вещества находят по формуле: 
Если в условии задачи дана массовая доля чистого вещества ил массовая доля примесей, значит, при этом дана масса смеси. Слово “технический” тоже означает наличие смеси.
Порядок решения:
1. Найти массу чистого вещества по формуле: m ч.в.= 
2. Исходя из массы чистого вещества, производить дальнейшие расчёты по уравнению.
Порядок решения:
1. Произвести расчёт по уравнению, исходя из данных для продукта реакции, и найти n ч.в. и m ч.в.
Закон объёмных отношений газов.
Объёмы газов относятся так же, как их количества веществ:
V1 / V2 = 

Этот закон применяют при решении задач по уравнениям, в которых дан объём газа и нужно найти объём другого газа.
Объёмная доля газа в смеси.


Vг – объём газа, Vcм – объём смеси газов.
Если в условии задачи даны объёмная доля газа и объём смеси, то, прежде всего, нужно найти объём газа: Vг = 
Объём смеси газов находят по формуле: Vсм = Vг / 
Объём воздуха, затраченный на сжигание вещества, находят через объём кислорода, найденный по уравнению:
Вывод формул органических веществ по общим формулам.
Органические вещества образуют гомологические ряды, которые имеют общие формулы. Это позволяет:
1. Выражать относительную молекулярную массу через число n.
2. Приравнивать Mr, выраженную через n, к истинной Mr и находить n.
3. Составлять уравнения реакций в общем виде и производить по ним вычисления.
Вывод формул веществ по продуктам сгорания.
1. Проанализировать состав продуктов сгорания и сделать вывод о качественном составе сгоревшего вещества: Н2О —> Н, СО2 —> С, SO2 —> S, P2O5 —> P, Na2CO3 —> Na, C.
Наличие кислорода в веществе требует проверки. Обозначить индексы в формуле через x, y, z. Например, СxНyОz (?).
2. Найти количество веществ продуктов сгорания по формулам:
n = m / M и n = V / Vm.
3. Найти количества элементов, содержавшихся в сгоревшем веществе. Например:
4. Если сгорело вещество неизвестного состава, то обязательно нужно проверить, содержался ли в нём кислород. Например, СxНyОz (?), m (O) = m в–ва – (m (C) + m(H)).
Предварительно нужно найти: m(C) = n (C) • 12 г / моль, m(H) = n (H) • 1 г / моль.
6. Найти количество сгоревшего вещества по формулам.
7. Найти соотношения индексов по отношению количеств элементов, включив в соотношение и количество сгоревшего вещества. Например:





Числа привести к целым, разделив их наименьшее.
Написать истинную формулу.
Вывод формул веществ по массовым долям элементов.
1. Написать формулу, обозначив индексы через x, y, z.
2. Найти соотношение индексов, для этого массовую долю каждого элемента разделить на его атомную массу: x : y : z = 


3. Полученные числа привести к целым, разделив их на наименьшее из них. При необходимости после деления домножить на 2, 3, 4, 5.
Этим способом решения определяют простейшую формулу. Для большинства неорганических веществ она совпадает с истинной, для органических – наоборот.
Вывод формул веществ по массовым долям элементов, если известны данные для нахождения молярной массы вещества.
Найти молярную массу вещества по формулам:
a) если известна плотность газа: М = 


b) если известна относительная плотность: М1 = D2 • М2, M = DH2 • 2, M = DO2 • 32,
M = D возд. • 29, М = DN2 • 28 и т.д.
Далее эту задачу можно решать разными способами. Например:
1 способ: найти простейшую формулу вещества (см. предыдущий алгоритм) и простейшую молярную массу. Затем сравнить истинную молярную массу с простейшей и увеличить индексы в формуле в нужное число раз.
2 способ: найти индексы по формуле n = 
Если неизвестна массовая доля одного из элементов, то её нужно найти. Для этого из 100 % или из единицы вычесть массовую долю другого элемента.
Постепенно в курсе изучения химии в химическом словаре происходит накопление алгоритмов решения задач разных типов. И ученик всегда знает, где ему найти нужную формулу или нужные сведения для решения задачи.
Многим учащимся нравится ведение такой тетради, они сами дополняют её различными справочными материалами.
Что касается факультативных занятий, то мы с учениками тоже заводим отдельную тетрадь для записи алгоритмов решения задач, выходящих за рамки школьной программы. В этой же тетради для каждого типа задач записываем 1-2 примера, остальные задачи они решают уже в другой тетради. И, если вдуматься, то среди тысяч разных задач, встречающихся на экзамене по химии во всех ВУЗах, можно выделить задачи 25 – 30 различных типов. Конечно, среди них – множество вариаций.
Умение решать задачи по химии это основной критерий творческого усвоения предмета. Именно через решение задач различных уровней сложности может быть эффективно усвоен курс химии.
Если ученик имеет чёткое представление о всех возможных типах задач, прорешал большое количество задач каждого типа, то ему по силам справиться со сдачей экзамена по химии в виде ЕГЭ и при поступлении в вузы.