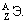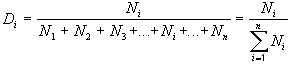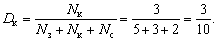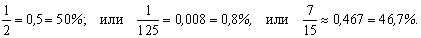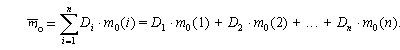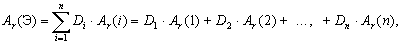Что обозначает массовое число
Что такое массовое число атомного ядра
Что такое массовое число атомного ядра? Массовое число численно равно сумме нейтронов и протонов ядра. Его обозначают буквой А. Понятие «массовое число» появилось в связи с тем, что масса ядра обусловлена числом ядерных частиц. Как связаны между собой масса ядра и количество частиц? Давайте выяснять.
Строение атома
Строение ядра

Ядро состоит из двух видов частиц – протонов и нейтронов. Протоны заряжены положительно, нейтроны не имеют заряда. Таким образом, заряд ядру дают протоны. Заряд каждого протона принят за +1. То есть, сколько протонов содержится в ядре, такой и будет заряд всего ядра. К примеру, в ядре углерода 6 протонов, заряд ядра +6.
В периодической системе элементов Менделеева все элементы расположены в порядке увеличения именно заряда ядра. У водорода заряд ядра +1, он расположен первым; у гелия +2, он второй в таблице; у лития +3, он третий и так далее. То есть заряд ядра соответствует порядковому (атомному) номеру элемента в таблице.
В целом любой атом электронейтрален. Это значит, что количество электронов равно заряду ядра, то есть количеству протонов. А поскольку количество протонов определяет атомный номер элемента, то зная этот атомный номер, мы, таким образом, знаем и количество электронов, и количество протонов, и заряд ядра.
Масса атома
Когда нужно знать массовое число?
Зная массовое число (A) и атомный номер элемента в периодической системе (Z), можно определить число нейтронов. Для этого нужно вычесть из массового числа протоны.
Зная массовое число, можно вычислить массу ядра или всего атома. Поскольку масса ядра обусловлена массой частиц, входящих в его состав, то она равна произведению количества этих частиц и массы этих частиц, то есть произведению массы нейтрона и массового числа. Масса нейтрона равна массе протона, в целом их обозначают как масса нуклона (ядерная частица).
К примеру, рассчитаем массу атома алюминия. Как видно из периодической системы элементов Менделеева, относительная атомная масса алюминия равна 26,992. Округлив, получаем массовое число ядра алюминия 27. То есть его ядро состоит из 27 частиц. Масса одной частицы – постоянная величина, равная 1,67 ∙ 10-24 г. Тогда, масса ядра алюминия равна: 27 ∙ 1,67 ∙ 10-24 г = 4,5 ∙ 10-23 г.
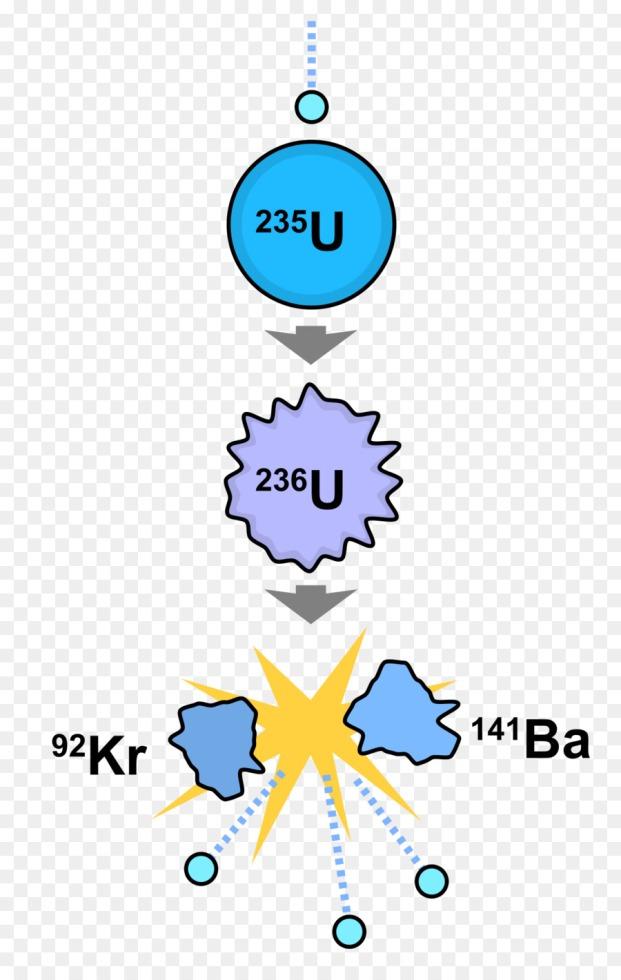
Что такое массовое число ядер элементов нужно знать при составлении реакций радиоактивного распада или ядерных реакций. Например, при делении ядра урана 235U, захватившего один нейтрон 1n, образуются ядра бария 141Ba и криптона 92Kr, а также три свободных нейтрона 1n. При составлении таких реакций пользуются правилом: сумма массовых чисел в правой и левой частях уравнения не меняется. 235+1 = 92+141+3.
Массовое число: что это такое и как получить (с примерами)
Содержание:
Примеры массовых чисел
Вот несколько примеров массовых чисел для хорошо известных элементов:
Водород
Самый стабильный и многочисленный атом водорода также самый простой: 1 протон и один электрон. Поскольку ядро водорода не имеет нейтронов, верно, что A = Z = 1.
Кислород
В ядре кислорода 8 нейтронов и 8 протонов, поэтому A = 16.
Углерод
Жизнь на Земле основана на химии углерода, легкого атома с 6 протонами в ядре плюс 6 нейтронов, поэтому A = 6 + 6 = 12.
Уран
Этот элемент, намного тяжелее предыдущих, хорошо известен своими радиоактивными свойствами. В ядре урана 92 протона и 146 нейтронов. Тогда его массовое число A = 92 + 146 = 238.
Как получить массовое число?
Посмотрим: все перечисленные элементы легкие, кроме урана. Атом водорода, как мы уже сказали, самый простой. В нем нет нейтронов, по крайней мере, в его наиболее распространенной версии, а в кислороде и углероде есть равное количество протонов и нейтронов.
То же самое происходит и с другими легкими элементами, такими как азот, еще один очень важный для жизни газ, который имеет 7 протонов и 7 нейтронов. Однако по мере того, как ядро становится более сложным, а атомы становятся тяжелее, количество нейтронов увеличивается с другой скоростью.
В отличие от легких элементов, уран с 92 протонами имеет примерно в 1 ½ раза больше нейтронов: 1 ½ x 92 = 1,5 x 92 = 138.
Все это становится очевидным на кривой на рисунке 2. Это график зависимости N от Z, известный каккривая ядерной устойчивости. Там вы можете увидеть, как легкие атомы имеют такое же количество протонов, что и нейтроны, и как с Z = 20 количество нейтронов увеличивается.
Таким образом, большой атом становится более стабильным, так как избыток нейтронов уменьшает электростатическое отталкивание между протонами.
Обозначения для атомов
Очень полезная запись, которая быстро описывает тип атома, следующая: символ элемента и соответствующие атомные и массовые числа записываются, как показано ниже на этой диаграмме:
В этих обозначениях атомы в предыдущих примерах будут:
Изотопы
Число протонов в ядре определяет природу элемента. Например, каждый атом, ядро которого содержит 29 протонов, является атомом меди, несмотря ни на что.
Предположим, атом меди по какой-то причине теряет электрон, это все равно медь. Однако теперь это ионизированный атом.
Атомному ядру сложнее получить или потерять протон, но в природе это может происходить. Например, внутри звезд более тяжелые элементы непрерывно образуются из легких элементов, поскольку звездное ядро ведет себя как термоядерный реактор.
И прямо здесь, на Земле, есть феномен радиоактивный распад, в котором некоторые нестабильные атомы изгоняют нуклоны и излучают энергию, превращаясь в другие элементы.
Наконец, существует вероятность того, что атом определенного элемента имеет другое массовое число, в данном случае это изотоп.
Углерод-14 менее распространен, чем углерод-12, стабильный изотоп, а также радиоактивен. Это означает, что со временем он распадается, выделяя энергию и частицы, пока не станет стабильным элементом, которым в его случае является азот.
Изотопы углерода
Углерод существует в природе как смесь нескольких изотопов, наиболее распространенными из которых являются уже упомянутые 12 6С или углерод-12. А кроме углерода-14 есть 13 6C с дополнительным нейтроном.
Это обычное явление в природе, например, известно 10 стабильных изотопов олова. С другой стороны, из бериллия и натрия известен только один изотоп.
Каждый изотоп, природный или искусственный, имеет разную скорость превращения. Таким же образом можно создавать искусственные изотопы в лаборатории, которые, как правило, нестабильны и радиоактивно распадаются за очень короткий период долей секунды, в то время как для других требуется гораздо больше времени, равное возрасту Земли или больше.
Таблица природных изотопов углерода
| Изотопы углерода | Атомный номер Z | Массовое число A | Изобилие% |
|---|---|---|---|
| 12 6 C | 6 | 12 | 98.89 |
| 13 6 C | 6 | 13 | 1.11 |
| 14 6 C | 6 | 14 | Следы |
Примеры работы
— Пример 1
В чем разница между 13 7 N и 14 7 N?
Ответить
— Пример 2
Сколько нейтронов находится в ядре атома ртути, обозначаемого как 201 80 Hg?
Ответить
Поскольку A = 201 и Z = 80, а также зная, что:
И делается вывод, что в атоме ртути 121 нейтрон.
Ссылки
Сернистая кислота: состав, свойства, номенклатура, применение
Что обозначает массовое число
Ключевые слова конспекта: строение атома, элементарные частицы, протоны и электроны в атомах, атомный номер, массовой число, число нейтронов, нуклид, изотопы, ионы, катионы, заряд иона.
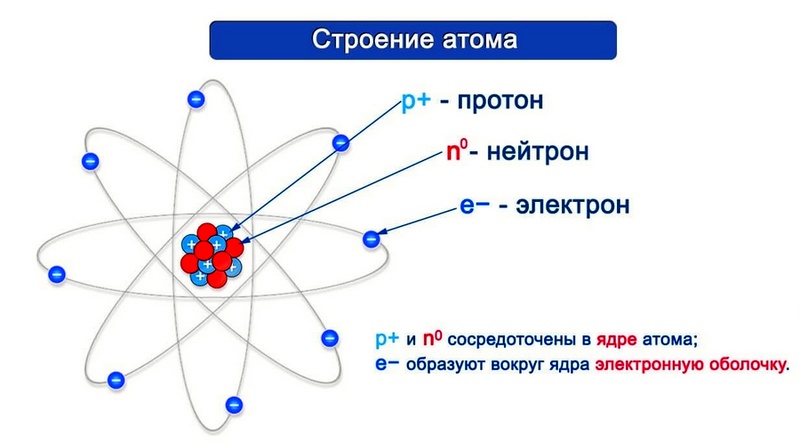
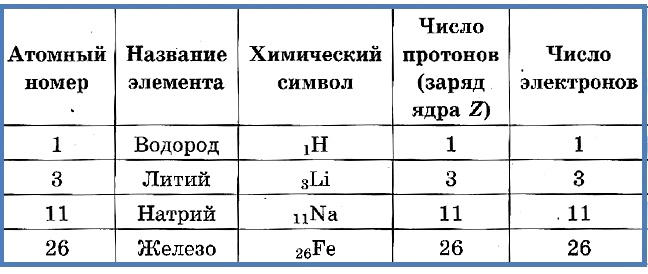
Согласно модели Резерфорда каждый атом состоит из находящегося в его центре ядра и электронной оболочки. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре. Электроны движутся вокруг ядра. Число электронов атома равно положительному заряду ядра.
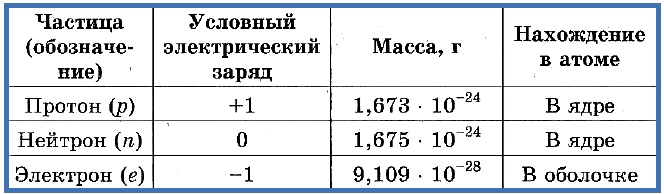
Элементарные частицы — это протоны, электроны и нейтроны, из них состоят все атомы.
Таблица 1. «Элементарные частицы атома»
Число протонов разное у атомов различных видов, оно определяет заряд ядра атома и равно атомному номеру элемента в таблице Менделеева. Поскольку атом — электро-нейтральная частица, число электронов в нем равно числу протонов.
Таблица 2. «Протоны и электроны в атомах»
Атомный номер указывают слева внизу от символа элемента, например: 1Н, 26Fe. Обозначение атомного номера — прописная латинская буква Z.
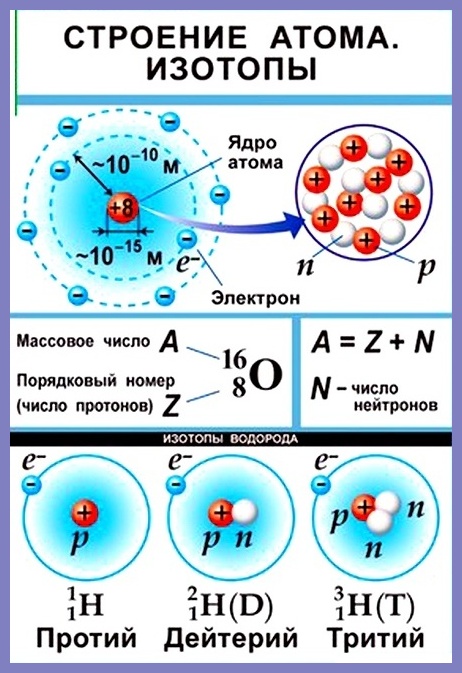
Массовое число атома А — это сумма чисел его протонов и нейтронов в ядре. Массовое число указывают слева вверху от символа элемента или добавляют к названию элемента через дефис, например: 23 Na или натрий-23.
Массовое число кислорода, А( 16 О) = 16 = (8р + 8n).
Число нейтронов N в ядре атома определяют по формуле: N = A — Z. Например, для атома натрия с массовым числом 23, 23 Na: А = 23, Z = 11, N = А – Z = 23 — 11 = 12.
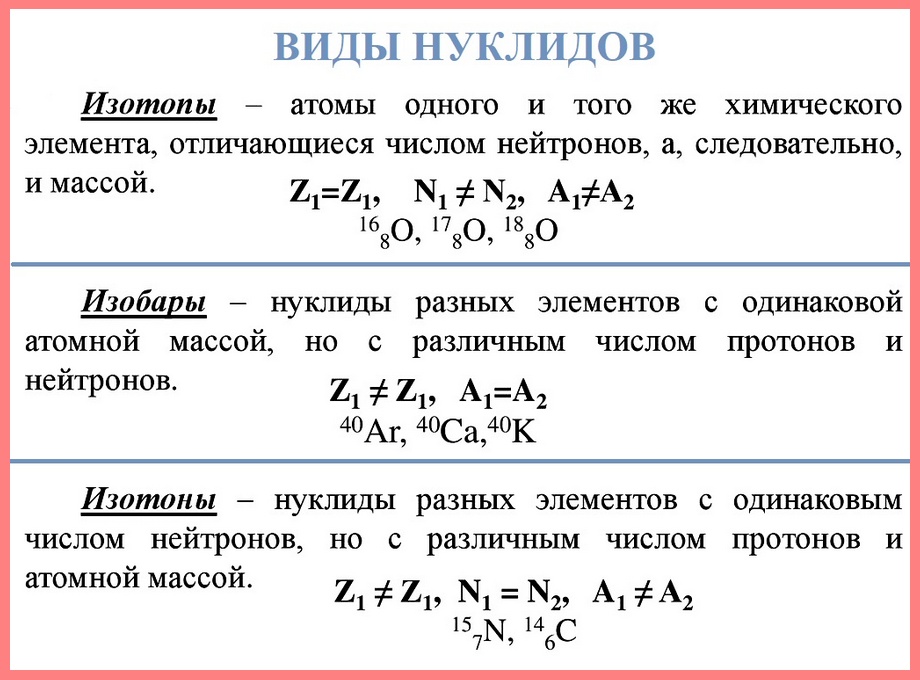
Нуклид — это вид атомов с определенным числом протонов и нейтронов в ядре. Например, в природе встречается три вида нуклидов кислорода: 16 О, 17 О и 18 О.
Изотопы — это атомы одного вида с одинаковым числом протонов, но разным числом нейтронов. Так, атомы 16 О, 17 О и 18 О — это изотопы. Природные изотопы урана — 234 U, 235 U и 238 U.
Таблица 3. «Обозначение и название ионов»
Конспект урока по химии «Строение атома».
Состав атомного ядра: массовое и зарядовое число
Как известно в настоящее время общепринятой является планетарная модель атома, по которой атом представляет собой ядро, обладающее положительным зарядом, вокруг которого на довольно большом по сравнению с размерами ядра расстоянии вращаются отрицательно заряженные электроны.
Состав атомного ядра
Исследования показали, что ядро атома – это не единое цельное образование, оно состоит из более мелких частиц. Когда-то полагали, что эти частицы – только положительно заряженные протоны. Однако, в первой половине ХХ века сначала теоретически, а потом и практически было открыто существование нейтронов, которые наряду с протонами входят в состав ядра.
При этом нейтроны не обладают электрическим зарядом, они нейтральны, а также нейтроны обладают немного большей массой, чем протоны. В большинстве случаев этой разницей пренебрегают и считают их массу примерно равной.
Массовое число и зарядовое число
Массовое число, соответственно, характеризует массу атома. Так как масса протонов и нейтронов практически равна, поэтому приняли среднее значение массы нуклона, примерно равное 1 а.е.м. (атомной единице массы). A численно равно массе атома, выраженной в а.е.м.
Число протонов в ядре называют зарядовым числом и обозначают буквой Z. Массовое число и зарядовое число каждого химического элемента ставится перед буквенным обозначением элемента. То есть ядра любых элементов можно обозначить так: (Z^A)X. Причем массовое число всегда ставят сверху, а зарядовое – снизу.
Например: (7^14)N – азот, (26^56)Fe – железо, (92^235)U – уран. Соответственно массовое число и масса ядра азота: A = 14, m ≈ 14 а.е.м., железа: A = 56, m ≈ 56 а.е.м., урана: A = 235, m ≈ 235 а.е.м., зарядовое число азота: Z = 7, железа: Z = 26, урана: Z = 92.
Заряд любого протона равен одному зарядовому числу, а также одному элементарному электрическому заряду. Следовательно, зарядовое число Z, которое отображает количество протонов в ядре, численно равно положительному заряду ядра, который в данном случае выражен в элементарных зарядовых единицах.
Следует отметить еще, что зарядовое число атома любого вещества всегда равно порядковому (атомному) номеру химического элемента данного вещества в периодической системе Менделеева.
Что обозначает массовое число
Таким образом, атом представляет собой материальную систему, состоящую из ядра и электронной оболочки.
Атомы очень маленькие – так, по толщине бумажного листа укладываются сотни тысяч атомов. Размеры атомных ядер – еще в сто тысяч раз меньше размеров атомов.
Ядра атомов заряжены положительно, но состоят они не только из протонов. Ядра содержат еще и нейтральные частицы, открытые в 1932 году и названные нейтронами. Протоны и нейтроны вместе носят название нуклоны – то есть ядерные частицы.
Любой атом в целом электронейтрален, а это значит, что число электронов в электронной оболочке атома равно числу протонов в его ядре.
Нейтрон
1932
Джозеф Джон Томсон
Джеймс Чедвик
n o
значение

2.Во сколько раз (приближенно) масса любого нуклона больше массы электрона?
3.Определите, какую часть от массы атома составит масса его электронов, если в состав атома входят 8 протонов и 8 нейтронов. 4.Как вы думаете, удобно ли использовать единицы международной системы единиц измерений (СИ) для измерений масс атомов?
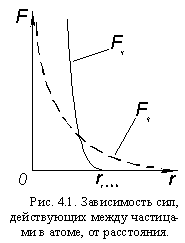
Между всеми заряженными частицами атома действуют электрические (электростатические) силы: электроны атома притягиваются к ядру и вместе с тем отталкиваются друг от друга. Действие заряженных частиц друг на друга передается электрическим полем.
Вам знакомо уже одно поле – гравитационное. Подробнее о том, что такое поля, и о некоторых их свойствах вы узнаете из курса физики.
Все протоны в ядре заряжены положительно и за счет электрических сил отталкиваются друг от друга. Но ядра же существуют! Следовательно, в ядре, кроме электростатических сил отталкивания, действует еще какое-то взаимодействие между нуклонами, за счет сил которого они притягиваются друг к другу, причем это взаимодействие – значительно сильнее электростатического. Эти силы называются ядерными силами, взаимодействие – сильным взаимодействием, а поле, передающее это взаимодействие – сильным полем.
В отличие от электростатического, сильное взаимодействие ощущается только на коротких расстояниях – порядка размеров ядер. Но силы притяжения, вызванные этим взаимодействием (Fя). во много раз больше электростатических (Fэ). Отсюда – » прочность» ядер во много раз больше » прочности» атомов. Поэтому в химических явлениях изменяется только электронная оболочка, а ядра атомов остаются неизменными.
Атомное ядро – сложная положительно заряженная частица, состоящая из нуклонов, связанных между собой ядерными силами.
Плотность вещества ядер огромна: она примерно равна 100 миллионам тонн на кубический сантиметр, что несоизмеримо с плотностью любого химического вещества.

Для обозначения нуклидов используют символы элементов (вы помните, что они могут обозначать и один атом) с левыми индексами: верхний равен массовому числу, нижний – числу протонов. Примеры обозначения нуклидов:
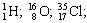
Так как заряд ядра определяется числом протонов, то химическим элементом можно назвать совокупность нуклидов с одинаковым числом протонов.Вспомнив сказанное в начале параграфа, мы можем уточнить один из важнейших химических законов.
При химических реакциях (и при физических взаимодействиях, не затрагивающих ядра) нуклиды не возникают, не исчезают и не превращаются друг в друга.
Итак, массовое число равно сумме числа протонов и числа нейтронов: А = Z + N. У нуклидов одного элемента заряд ядра одинаков (Z = const), а число нейтронов N? У нуклидов одного элемента число нейтронов в ядре может быть одинаковым, а может и отличаться. Поэтому и массовые числа нуклидов одного элемента могут быть разными. Примеры нуклидов одного элемента с разными массовыми числами – различные устойчивые нуклиды олова, характеристики которых приведены в табл. 12. У нуклидов с одинаковыми массовыми числами масса одинакова, а у нуклидов с разными массовыми числами – разная. Отсюда следует, что атомы одного элемента могут отличаться по массе.
Изотоп – совокупность нуклидов одного элемента с одинаковым массовым числом.
Следовательно, у нуклидов одного изотопа одинаковое число протонов (так как это один элемент), одинаковое число нейтронов (так как это один изотоп) и, естественно, одинаковая масса. Такие нуклиды совершенно одинаковы и потому принципиально неразличимы. (В физике под словом «изотоп» иногда подразумевают и одинт нуклид данного изотопа)
Нуклиды разных изотопов одного элемента отличаются массовыми числами, то есть числами
нейтронов, и массой.
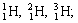 | 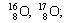 | 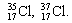 |
| Изотопы элемента водорода | Изотопы элемента кислорода | Изотопы элемента хлора |
Общее число известных ученым нуклидов приближается к 2000. Из них устойчивы, то есть существуют в природе, около 300. Элементов в настоящее время, включая искусственно полученные, известно 110.(Среди нуклидов физики выделяют изобары— нуклиды с одинаковой массой(независимо от заряда))
Многие элементы имеют по одному природному изотопу, например, Be, F, Nа, Al, P, Mn, Co, I, Au и некоторые другие. Но большинство элементов имеют по два, по три и более устойчивых изотопа.
Для описания состава атомных ядер иногда рассчитывают доли протонов или нейтронов в этих ядрах.
| Доля – отношение числа тех объектов, долю которых мы определяем, к общему числу объектов. |
где Di – доля интересующих нас объектов (например, седьмых),
N1 – число первых объектов,
N2 – число вторых объектов,
N3 – число третьих объектов,
Ni – число интересующих нас объектов (например, седьмых),
Nn – число последних по счету объектов.
Для сокращения записи формул в математике знаком 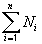
Пример. В коробке лежат 5 зеленых карандашей, 3 красных и 2 синих; требуется определить долю красных карандашей.
Доля может выражаться простой или десятичной дробью, а также в процентах, например:
Из количественных характеристик атома вам уже знакомы массовое число, число нейтронов в ядре, число протонов в ядре и заряд ядра.
Так как заряд протона равен элементарному положительному заряду, то число протонов в ядре (Z) и заряд этого ядра (qя), выраженный в элементарных электрических зарядах, численно равны. Поэтому, как и число протонов, заряд ядра обычно обозначают буквой Z.
Число протонов одинаково для всех нуклидов какого-либо элемента, поэтому оно может использоваться как характеристика этого элемента. В этом случае оно называется атомным номером.
| Атомный номер элемента – характеристика химического элемента, равная числу протонов в ядре любого нуклида этого элемента. |
Атомная единица массы с точностью, достаточной в химии, равна массе любого нуклона и близка к массе атома водорода, ядро которого состоит из одного протона. В 11-м классе из курса физики вы узнаете, почему она в действительности несколько меньше массы любой из этих частиц. Из соображений удобства измерений атомная единица массы определяется через массу нуклида самого распространенного изотопа углерода.
Обозначается атомная масса нуклида буквами Аr с указанием символа нуклида, например:
Аr( 16 O) – атомная масса нуклида 16 O,
Ar( 35 Cl) – атомная масса нуклида 35 Сl,
Ar( 27 Аl) – атомная масса нуклида 27 Аl.
Если у элемента есть несколько изотопов, то этот элемент состоит из нуклидов с разной массой. В природе изотопный состав элементов обычно постоянен, поэтому для каждого элемента можно посчитать среднюю массу атомов этого элемента (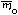
Атомная масса элемента – средняя масса атомов элемента в природной смеси изотопов этого элемента, выраженная в атомных единицах массы (дальтонах).
Так как атомная масса элемента и средняя масса атома этого элемента – одна и та же физическая величина, выраженная в разных единицах измерений, то и формула для вычисления атомной массы элемента аналогична формуле для вычисления средней массы атомов этого элемента:

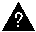
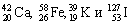
Какова доля протонов в ядре каждого из этих атомов?
2)Изотопами каких элементов являются нуклиды, содержащие в ядре

6)Принимая атомную массу нуклида численно равной массовому числу, рассчитайте атомные массы следующих элементов, если доли их изотопов в природной смеси (изотопный состав) составляют: а) 24 Mg – 0,796 25 Mg – 0,091 26 Mg – 0,113
б) 28 Si – 92,2 % 29 Si – 4,7 % 30 Si – 3,1 %
в) 63 Cu – 0,691 65 Cu – 0,309
7)Определите изотопный состав природного таллия (в долях соответствующих изотопов), если в природе встречаются изотопы таллий-207 и таллий-203, а атомная масса таллия равна 204,37 Дн.
8)Природный аргон состоит из трех изотопов. Доля нуклидов 36 Аr составляет 0,34%. Атомная масса аргона – 39,948 Дн. Определите, в каком соотношении встречаются в природе 38 Аr и 40 Аr.
9)Природный магний состоит из трех изотопов. Атомная масса магния – 24,305 Дн. Доля изотопа 25 Mg – 9,1%. Определите доли остальных двух изотопов магния с массовыми числами 24 и 26.
10)В земной коре (атмосфере, гидросфере и литосфере) атомы лития-7 встречаются примерно в 12,5 раз чаще, чем атомы лития-6. Определите атомную массу лития.
11)Атомная масса рубидия – 85,468 Дн. В природе встречаются 85 Rb и 87 Rb. Определите, во сколько раз легкого изотопа рубидия больше, чем тяжелого.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору