Что образует жировая соединительная ткань
Жировая ткань
Содержание
Жировая ткань [ править | править код ]
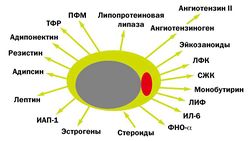
Жировая ткань является местом интенсивного метаболизма половых стероидов и сложным гормонально активным органом, играющим важнейшую роль в регуляции энергетического баланса и гомеостаза всего организма в целом (рис.1).
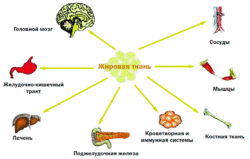
Секретируемые жировой тканью вещества — адипокины — обладают разнообразными метаболическими эффектами. Оказывая воздействие ауто/паракринным способом, они регулируют рост, развитие и метаболизм адипоцитов. Поступая в общую циркуляцию, адипокины действуют как эндокринные сигналы, оказывая влияние на функцию различных органов и систем организма: мозг, печень, мышцы, почки, эндотелий, иммунную систему и др. Так же адипоциты секретируют важные регуляторы липопротеинового метаболизма, такие как липопротеиновая липаза, аполипопротеин Е, переносящий эфиры холестерина протеин.
Выявлены новые носители информации в жировой ткани – молекулы микроРНК. В организме микроРНК участвует в регуляции работы генов при помощи механизма так называемой РНК-интерференции. Между клетками молекулы микроРНК путешествуют в экзосомах, небольших образованиях из цитоплазмы, имеющих мембрану. Когда экзосома достигает своей цели, микроРНК попадает в нужную клетку и работа генов в этой клетке корректируется.
Содержащиеся в жировой ткани нервные, стромальные и иммунные клетки обладают определенной секреторной активностью. Многие гормоны — катехоламины, инсулин, кортикостероиды, андрогены и др. в свою очередь оказывают влияние как на функцию адипоцитов, так и на эффекты адипокинов.
Таким образом, помимо депонирования энергии, жировая ткань через адипокины обладает способностью взаимодействовать с различными органами и системами, включая и ЦНС, и тем самым участвовать в регуляции разнообразных функций организма (рис. 2), а через взаимодействие с нейроэндокринной системой в адаптации организма к различным внешним воздействиям, таким как голод, стресс, переедание.
Избыточное развитие жировой ткани, особенно в висцеральной области, прямо коррелирует с инсулинорезистентностью, гипергликемией, дислипидемией, артериальной гипертензией, протромботическим и провоспалительным состояниями.
Адипокины, секретируемые жировой тканью:
Строение жировой ткани [ править | править код ]
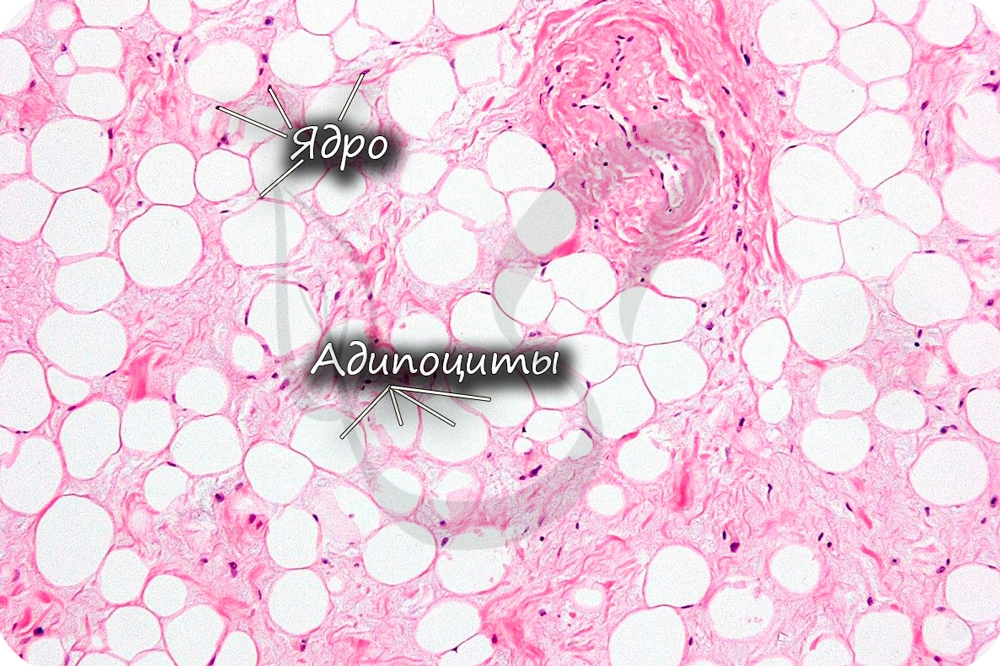
Это скопление жировых клеток. В соответствии наличию 2 типов жировых клеток различают 2 разновидности жировой ткани:
Функции белого жира: запас энергетического материала и воды;
механическая защита; участие в терморегуляции (теплоизоляция).
Ожирение и эндокринная функция жировой ткани [ править | править код ]
Жировая ткань является органом, поскольку секретирует молекулы, обладающие аутокринными, паракринными и эндокринными свойствами.
Ожирение характеризуется увеличением размеров (гипертрофия) и числа (гиперплазия) адипоцитов, приводящим к количественным и качественным изменениям продукции цитокинов, способствующим развитию инсулинорезистентности и изменений системного метаболизма. Как инсулинорезистентность, так и происходящие при этом изменения липолиза и липогенеза, функциональной активности нейроэндокринной системы, например, активация гипоталамо-гипофизарно-надпочечниковой оси, в начальных стадиях развития ожирения носят адаптационный характер, в процессе же постоянного нарастания веса они становятся дезадаптивными, патологическими и приводят к развитию осложнений, наблюдаемых у лиц с избыточным весом или ожирением.
Практически все цитокины, секретируемые адипоцитами, оказывают прямое или косвенное влияние на реализацию эффектов инсулина в периферических тканях. Можно сказать, что цитокины образуют «систему», регулирующую действие инсулина в организме. Развивающееся при ожирении снижение чувствительности тканей к инсулину (инсулинорезистентность) имеет исключительное значение в механизмах развития сахарного диабета и сердечно-сосудистых заболеваний, являющихся спутниками избыточного отложения жира в организме.
Так, имеющиеся при ожирении гиперлептинемия и лептинорезистентность могут быть одним из ведущих факторов в развитии инсулинорезистентности, а также нарушении функции р-клеток и ускорении процессов атерогенеза. Сочетание периферической леп-тинорезистентности, повышенной концентрации в плазме свободных жирных кислот, триглицеридов, липопротеинов низкой плотности и хиломикронов, развивающееся на фоне гиперкортизолемии, приводят при ожирении к развитию липотоксических нарушений, конечным результатом которых являются проявления метаболического синдрома: инсулинорезистентность, гиперлипидемия, гипергликемия, повышение АД, кардиомиопатия.
В условиях лептинорезистентности усиливается также влияние лептина на кальцификацию сосудов, аккумуляцию холестерина макрофагами, инициацию оксидативного стресса, повышение тонуса симпатической нервной системы, повышение АД. Все эти процессы в совокупности способствуют ускоренному развитию атеросклеротических изменений сосудов при ожирении.
Нарастание жировой массы в организме сопровождается повышением секреции ФНО-α, ИАП-1, ИЛ-6, способствующих, в свою очередь, также развитию инсулинорезистентности, активации клеточного транскрипционного фактора каппа В (ЯТФ-КВ), воспалительных реакции в сосудистой стенке, внутриклеточной адгезии моноцитов и всего каскада оксидативного стресса. Протективные механизмы адипонектина в отношении развития атеросклероза вследствие снижения его секреции также утрачиваются при ожирении, особенно при его висцеральной форме. Увеличение секреции ангиотензина II, являющегося проатерогенным белком, стимулирующим внутриклеточную адгезию молекул в сосудистую стенку, образование свободных радикалов, нарушение целостности сосудистой стенки, также провоцирует развитие эндотелиальной дисфунции.
Наблюдаемая при ожирении повышенная секреция ИЛ-6, хотя и способствует снижению активности ЛПЛ и тем самым некоторому ограничению нарастания веса, в то же время через воздействие на печень содействует развитию дислипидемии и нарушениям свертывающей системы крови.
Жировая ткань различной локализации отличается по уровню экспрессии и секреции как адипокинов, так и специфических рецепторов. Например, экспрессия и секреция ИЛ-6, ИАП-1 и адипонектина, экспрессия ангиотензиновых рецепторов 1 типа, βЗ-адренергических, глюкокортикоидных и андрогенных рецепторов, а также 11βГДГ относительно выше в висцеральной жировой ткани, лептина — в подкожной. Более того, адипокины, секретируемые висцеральной жировой тканью, вследствие ее топографических особенностей поступают преимущественно в портальную систему и печень, тогда как из подкожных депо в системный кровоток. В связи с этим, висцеральная жировая ткань оказывает, главным образом, влияние на метаболические процессы, происходящие в печени. Увеличенное поступление свободных жирных кислот в печень приводит к снижению связывания инсулина гепатоцитами, обуславливая развитие инсулинорезистентности на уровне печени, снижение экстракции инсулина печенью и развитие системной гиперинсулинемии. Свободные жирные кислоты также подавляют тормозящее действие инсулина на глюконеогенез, способствуя увеличению продукции глюкозы печенью; обуславливают увеличение синтеза триглицеридов липопротеинов очень низкой плотности и нарушения метаболизма липидов.
Топографические и функциональные особенности различных компартментов жировой ткани лежат в основе известных метаболических различий между висцеральным и глютеофеморальным типами ожирения. Однако важно учитывать, что размеры различных депо жировой ткани могут определять их относительный вклад в развитие нарушений метаболизма при ожирении и даже нивелировать метаболические различия между основными типами ожирения
Висцеральная жировая ткань менее эффективна, чем подкожная в регуляции энергетического баланса, осуществляемой через продукцию лептина.
Имеющаяся функциональная гетерогенность различных депо жировой ткани позволяет высказать предположение, что жировая ткань может быть не единым, а, возможно, группой схожих, но единственных в своем роде эндокринных органов.
Развивающиеся эндокринные и метаболические изменения по мере развития ожирения нарушают энергетический гомеостаз. Причем при ожирении увеличивается не только продукция адипокинов, но и происходят изменения биоактивности цитокинов через нарушение выделения растворимых рецепторов.
Таким образом, профиль цитокинов и жирных кислот, выделяемых жировой тканью, определяется метаболическими нуждами организма (характером питания, уровнем стресса, физической активностью, репродуктивной активностью), он также формируется и зависит от степени развития и особенностей распределения жировой ткани в организме, качественных и количественных изменений ее функциональной активности.
При постоянном, избыточном поступлении энергии развивается дисфункции жировой ткани, которая и лежит в основе прогрессирования ожирения и развития совокупности метаболических нарушений и заболеваний, сопровождающих избыточное накопление жира в организме.
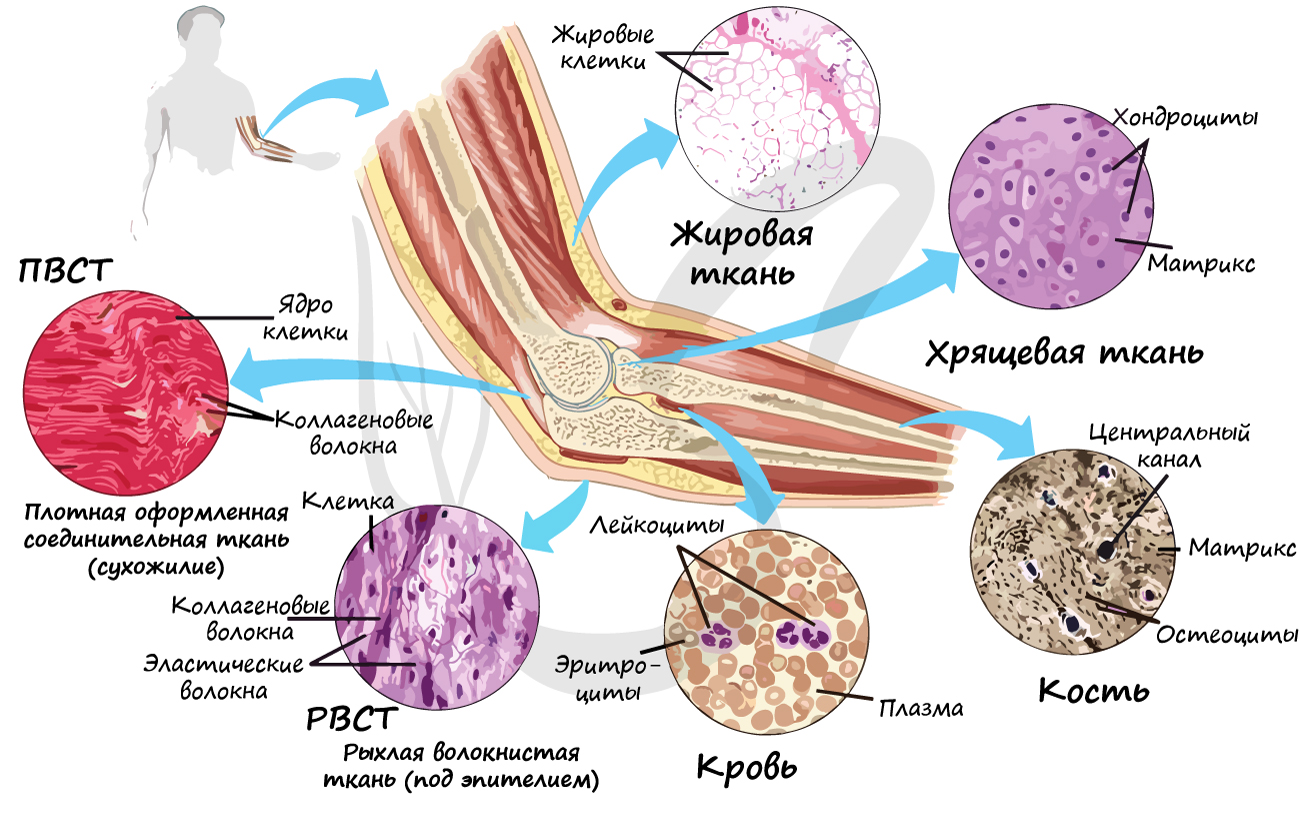
Соединительные ткани
Группа соединительных тканей объединяет собственно соединительные ткани (РВСТ и ПВСТ), соединительные ткани со специальными свойствами (ретикулярная, жировая, слизистая, пигментная), скелетные соединительные ткани (хрящевая и костная). В рамках школьного курса к соединительным тканям относят жидкую подвижную кровь, строение которой мы изучим в разделе «Кровеносная система».
Что же общего между жидкой подвижной кровью и плотной неподвижной костью? Общим оказываются три основополагающих признака соединительных тканей:
Межклеточное вещество соединительных тканей состоит из волокон и основного аморфного вещества (неволокнистый компонент). Волокна могут быть коллагеновыми, эластическими и ретикулярными.
Очевидно, что соединительная ткань образована тремя компонентами: клетки, волокна, основное аморфное вещество.
Собственно соединительные ткани
Собственно соединительные ткани объединяет то, что они содержат коллагеновые волокна (одни или вместе с эластическими), не отличаются высоким содержанием минеральных соединений.
Рыхлая волокнистая соединительная ткань (РВСТ) содержит клетки разной формы: фибробласты (юные), фиброциты (зрелые). РВСТ содержится во всех внутренних органах (образует строму большинства органов), она располагается по ходу прохождения кровеносных, лимфатических сосудов и нервов, образует соединительнотканные прослойки, сосочковый слой дермы.
Особенности рыхлой волокнистой соединительной ткани: преобладает основное аморфное вещество (отсюда «рыхлая», не плотная), коллагеновые и эластические волокна лежат произвольно, не ориентированы в одном направлении.
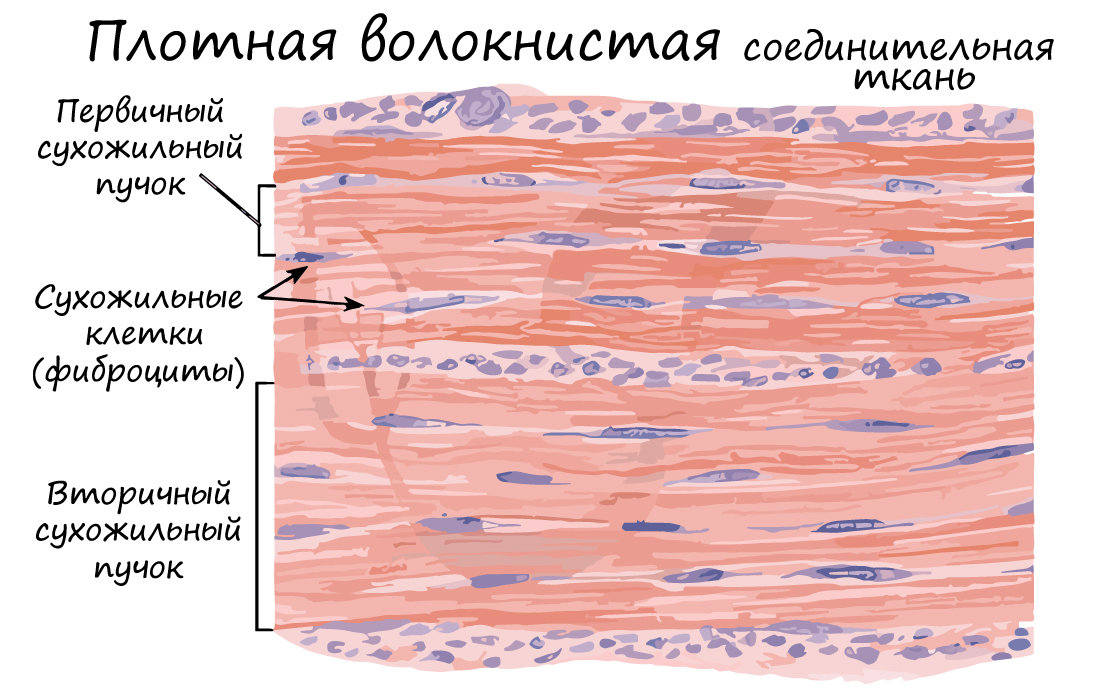
Волокна могут быть ориентированы в одном направлении (оформленная ПВСТ) или нет (неоформленная ПВСТ).
Неоформленной ПВСТ образован сетчатый (глубокий) слой дермы. Оформленной ПВСТ образованы связки, сухожилия, фасции мышц, капсулы внутренних органов.
Соединительные ткани со специальными свойствами
Функции жировой ткани:
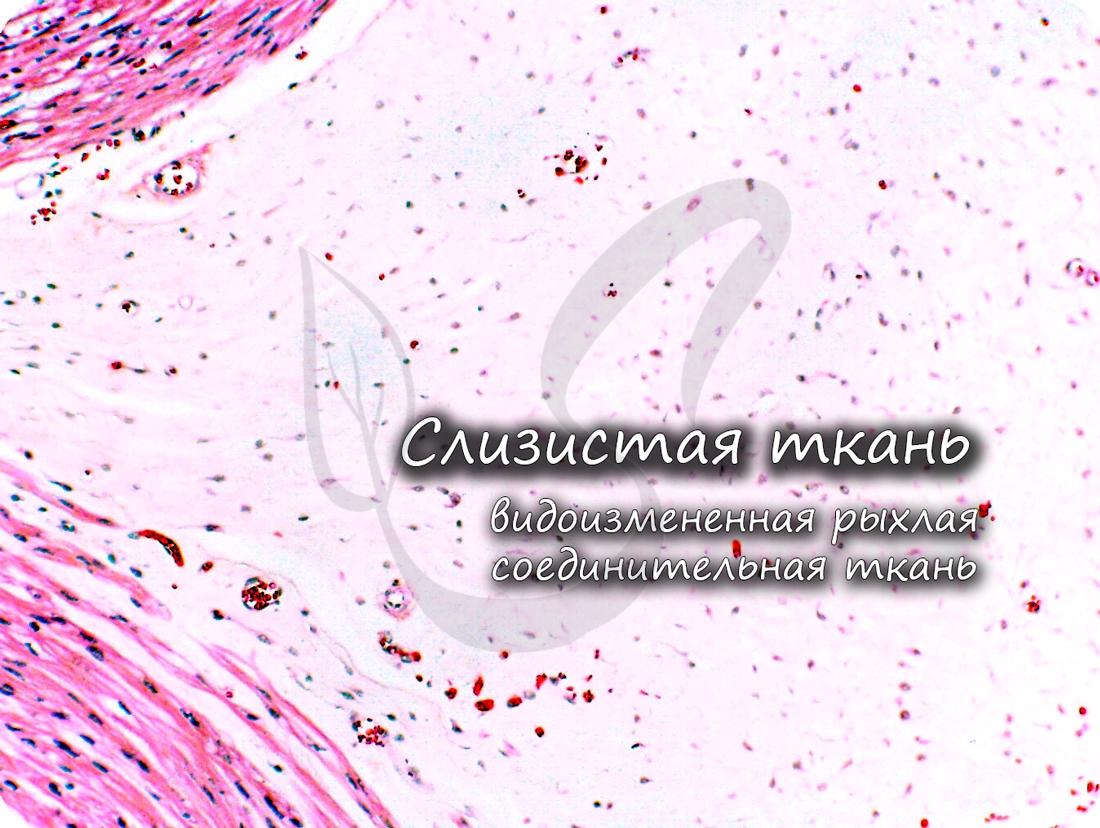
Слизистая (студенистая) ткань встречается в норме только между плодными оболочками и в составе пупочного канатика зародыша. Ее относят к эмбриональным тканям, на постэмбриональном этапе развития она отсутствует.
Скелетные соединительные ткани
К скелетным тканям относятся хрящевая и костная ткани, которые создают опорно-двигательный аппарат, выполняют защитную, механическую и опорную функции, принимают активное участие в минеральном обмене (обмен кальция, фосфора). Играют формообразующую роль в процессе эмбриогенеза и постэмбрионального развития (на месте многих будущих костей вначале образуется хрящ).
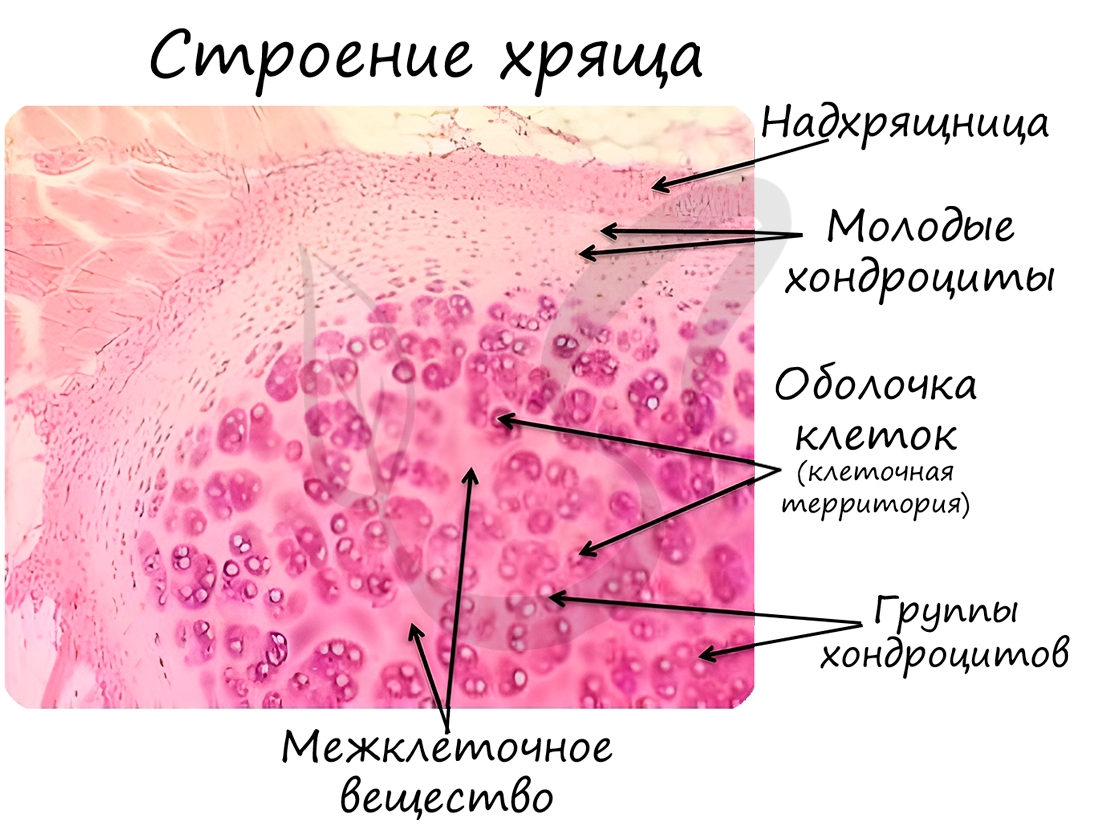
Хрящевая ткань может быть 3 видов: гиалиновая, эластическая и волокнистая.
Гиалиновая хрящевая ткань образует суставные поверхности костей, метафизы трубчатых костей в период их роста, хрящи воздухоносных путей (гортани, трахеи и крупных бронхов), передние отделы ребер. Эластическая хрящевая ткань образует ушные раковины, хрящи носа, средних бронхов, надгортанник. Волокнистая хрящевая ткань формирует межпозвоночные диски.
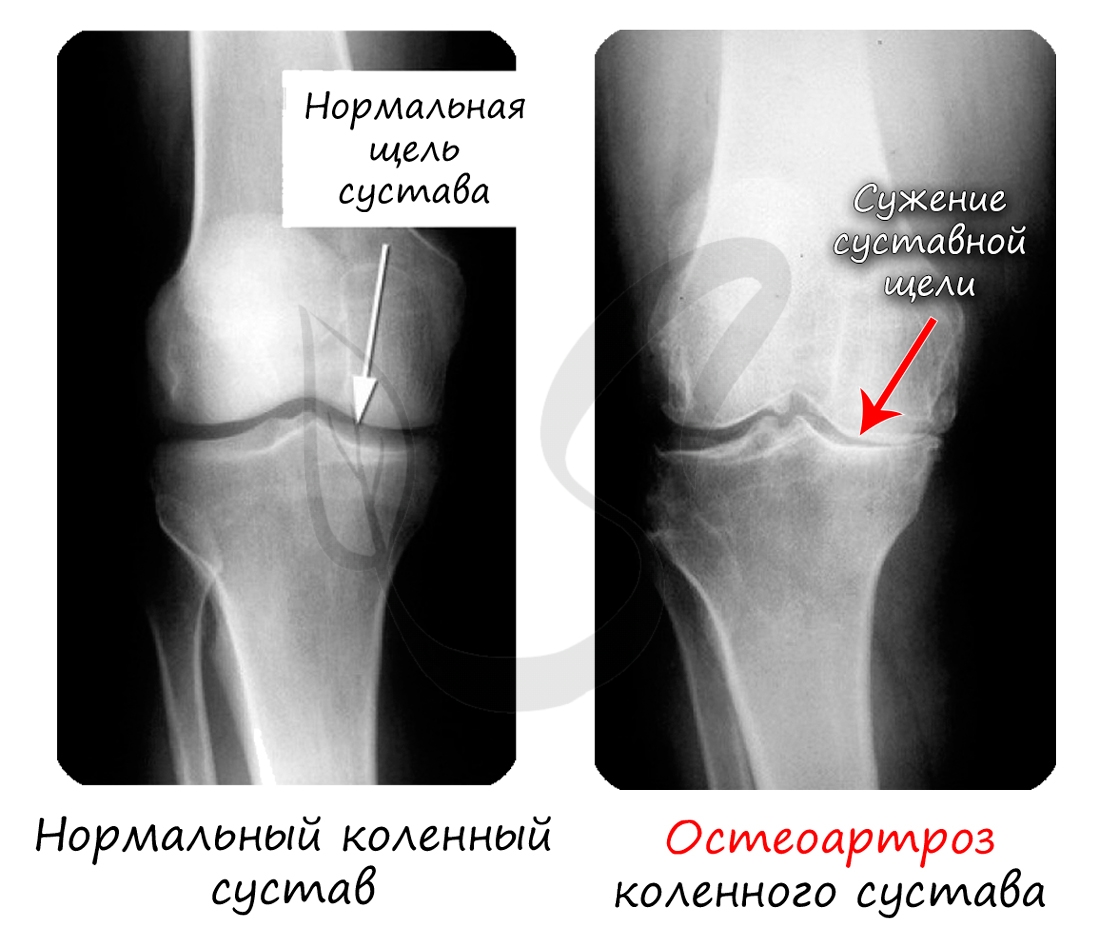
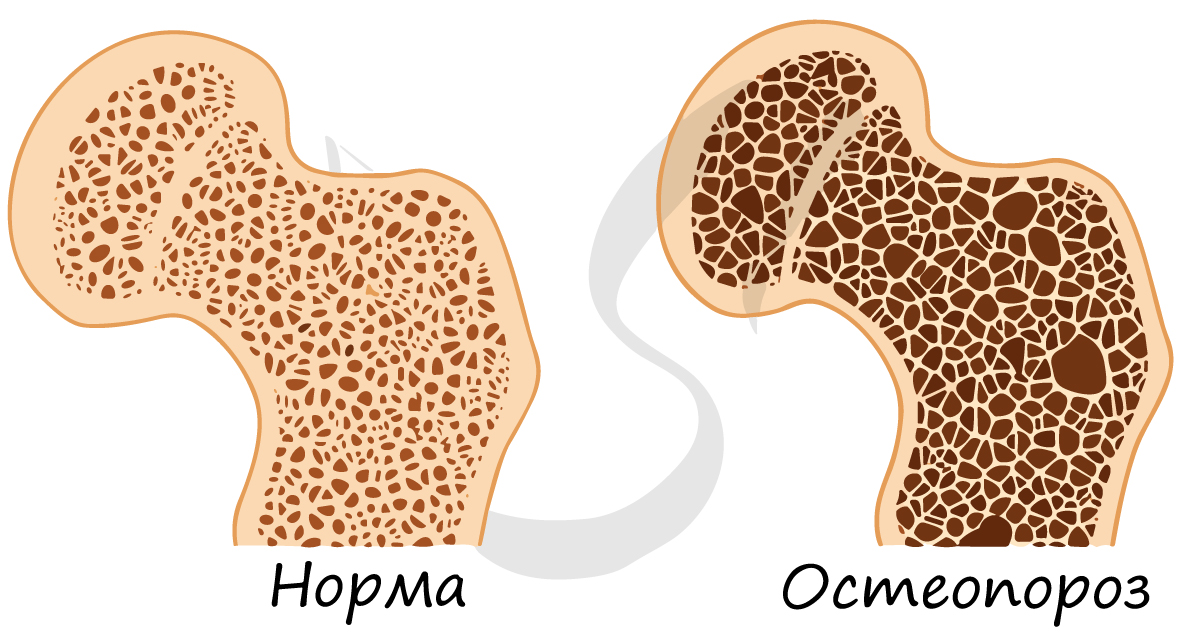
Хрящевая ткань выстилает поверхность костей в месте образования суставов. При нарушении в ней обменных процессов хрящевая ткань начинает заменяться костной, что сопровождается скованностью и болезненностью движений, возникает артроз.
Костная ткань состоит из клеток и хорошо развитого межклеточного вещества, пропитанного минеральными солями (составляют около 60-70%), преобладающим из которых является фосфат кальция Ca3(PO4)2.
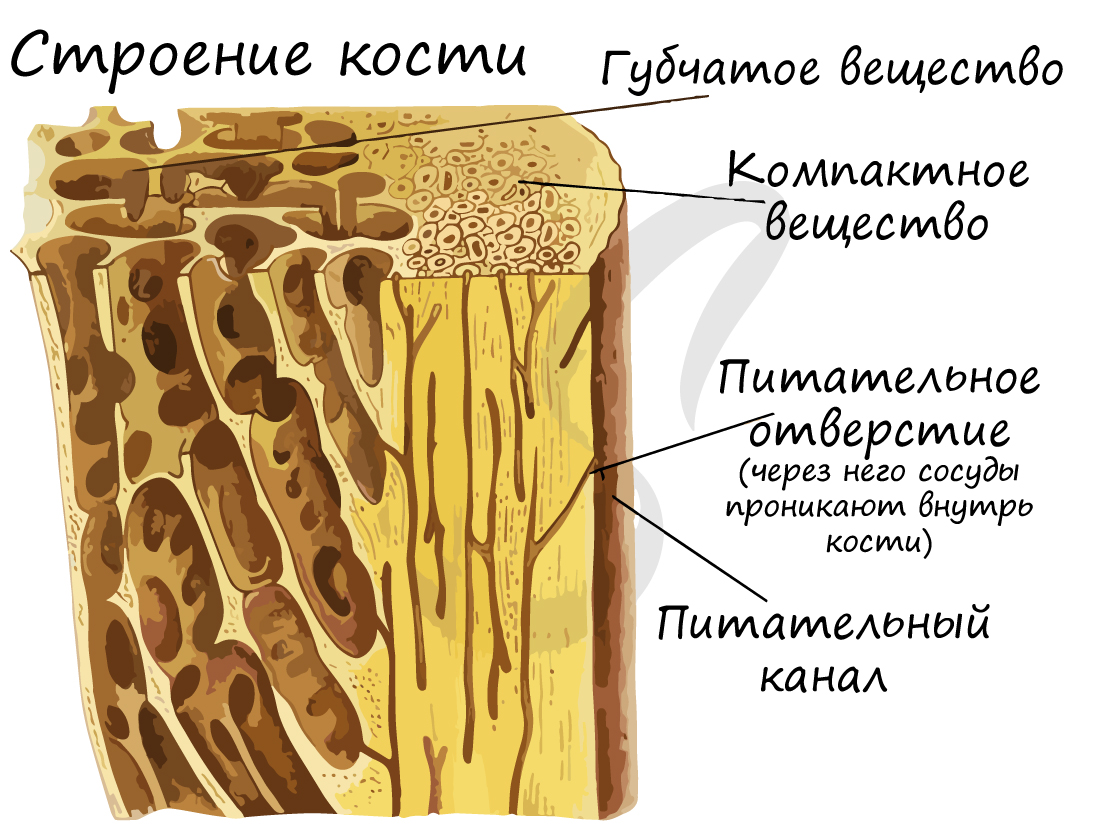
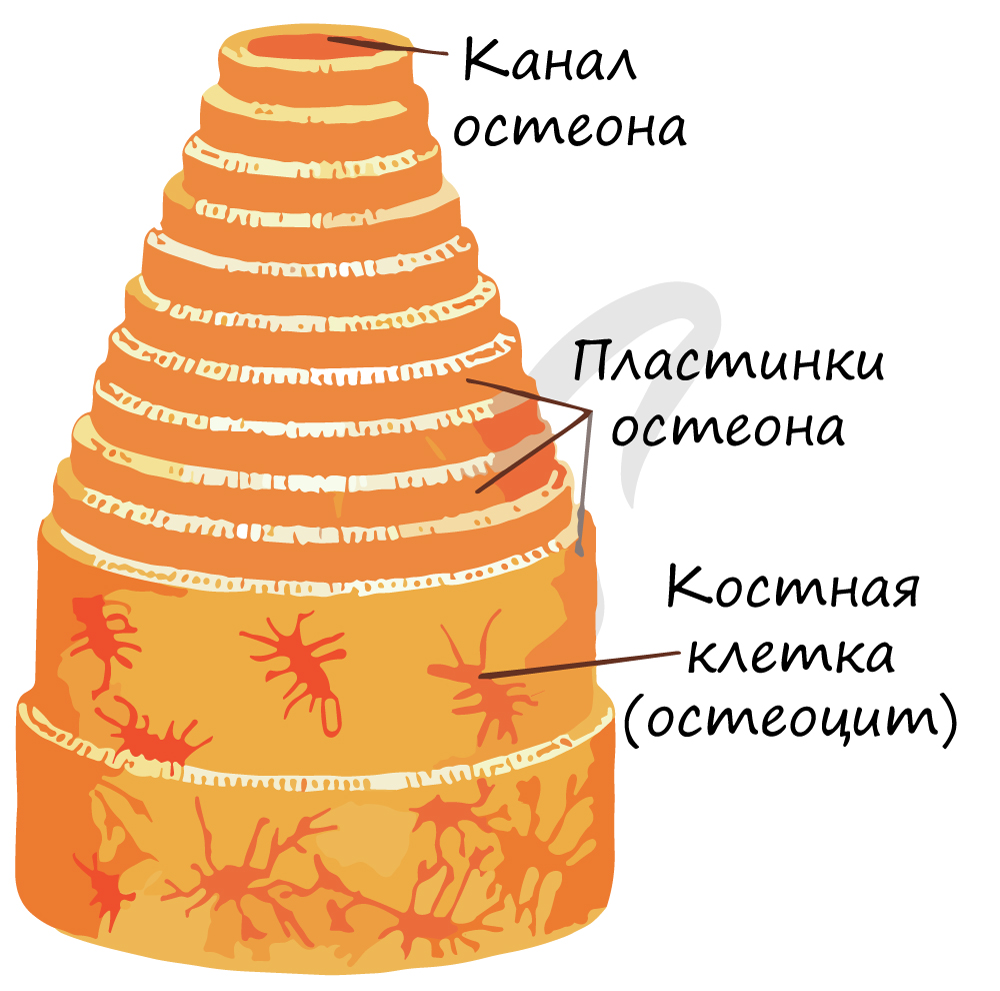
Компактное вещество почти не имеет промежутков, костные пластинки имеют концентрическую форму (полые цилиндры, вложенные друг в друга). Компактное вещество образует поверхности плоских и губчатых костей, поверхностный слой эпифиза и основную часть диафиза.
Минеральный компонент обеспечивает прочность кости. Благодаря нему костная ткань выполняет опорную функцию и способна выдерживать значительные нагрузки.
Органический компонент превалирует в костях новорожденных. Их кости очень эластичные. Постепенно минеральные соли накапливаются, и кости становятся твердыми, способными выдержать значительные физические нагрузки.
Происхождение
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Что образует жировая соединительная ткань
Челябинский областной клинический онкологический диспансер
Кафедра пластической и эстетической хирургии, косметологии и клеточных технологий ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздравсоцразвития России
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
МАУЗ ОЗП «Городская клиническая больница», Челябинск, Россия
Биологическая характеристика жировой ткани
Журнал: Пластическая хирургия и эстетическая медицина. 2019;(2): 33-42
Васильев В. С., Мантурова Н. Е., Васильев С. А., Терюшкова Ж. И. Биологическая характеристика жировой ткани. Пластическая хирургия и эстетическая медицина. 2019;(2):33-42.
Vasil’ev V S, Manturova N E, Vasil’ev S A, Teryushkova Zh I. Biological features of adipose tissue. Plastic Surgery and Aesthetic Medicine. 2019;(2):33-42.
https://doi.org/10.17116/plast.hirurgia201902133
Челябинский областной клинический онкологический диспансер
Жировая ткань представляет собой биологически активную субстанцию. Помимо депонирования энергетических запасов и участия в формировании контуров тела, определяющих внешний вид человека, жировая ткань является ключевым компонентом системы терморегуляции, оказывает регулирующее влияние на иммунную систему, секретирует большое количество биологически активных веществ. Жировая ткань является динамически функционирующим эндокринным органом, высвобождающим ряд гормонов, напрямую взаимодействующих с гипоталамусом. Стволовые клетки жировой ткани обладают высоким дифференцировочным потенциалом. Они могут дифференцироваться в клетки хрящевой, нервной, костной, мышечной, кардиальной, сосудистой, эндокринной, печеночной, гемопоэтической тканей. Эти свойства стволовых клеток жировой ткани открывают широкие возможности их клинического применения не только по косметическим, но и по реконструктивным показаниям. Доступность жировой ткани для забора из организма человека позволяет рассматривать ее в качестве перспективного субстрата для регенеративной медицины и тканевой инженерии.
Челябинский областной клинический онкологический диспансер
Кафедра пластической и эстетической хирургии, косметологии и клеточных технологий ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздравсоцразвития России
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
МАУЗ ОЗП «Городская клиническая больница», Челябинск, Россия
Введение
Жировая ткань является биологической субстанцией, вызывающей всевозрастающий научный интерес. В течение продолжительного времени функция жировой ткани сводилась к сохранению энергетических запасов организма, получаемых с пищей. Однако оказалось, что жировая ткань секретирует молекулы, напрямую взаимодействующие с головным мозгом, и является компонентом иммунной системы. Эта ткань формирует форму человеческого организма, определяя сексуальную привлекательность, тем самым выполняя еще и социальную функцию. Большинство исследований жировой ткани было проведено на животных, что не позволяет экстраполировать эти данные на человека. Доступность жировой ткани для забора из организма человека открывает широкие возможности ее применения в качестве субстрата для клеточной терапии по различным показаниям.
Различают две разновидности жировой ткани человека: коричневую жировую ткань (brown adipose tissue — BAT) — КЖТ и белую жировую ткань (white adipose tissue — WAT) — БЖТ. Эти две разновидности выполняют различные функции, но по содержанию запасов итрацеллюлярного триглицерида относятся к жировой ткани [1, 2]. КЖТ участвует в механизме выработки энергии для организма, в то время как БЖТ имеет несколько функций: обеспечение термосбережения; определение формы тела, что особенно важно для сексуальной привлекательности женщин; сбережение энергии; амортизация при механических ударах; выполнение эндокринной функции; заполнение свободных пространств организма; облегчение скольжения мышц при их движении. КЖТ и БЖТ обычно не имеют четких границ, а существуют в виде смешанной субстанции [1, 3]. У женщин и мужчин с нормальной комплекцией жировая ткань составляет 22 и 15% от массы тела соответственно. Жировая ткань широко распространена по всему организму, при этом существуют различия в ее распределении у мужчин и женщин. Количество жировой ткани в организме может изменяться в зависимости от особенностей питания и энергозатрат. При поступлении в организм избыточной энергии жировая ткань может образовывать вокруг кровеносных сосудов недифференцированные клетки. На начальной стадии адипогенеза клетки не содержат жировых включений. Затем в стадии жировой пролиферации происходит аккумуляция жира, и преадипоциты дифференцируются в адипоциты с формированием островков жировой ткани. Если адипоцит теряет свою массу (в результате голодания и потери массы тела), клетка становится морфологически неравномерной, с увеличенными митохондриями в цитоплазме. Эти потерявшие жировое наполнение адипоциты (постадипоциты) окружены плотным коллагеновым матриксом, который может вызвать фиброз жировой ткани. Дольки жировой ткани окружаются соединительной тканью с формированием капсулы. Коллагеновая фрагментация продолжается до тех пор, пока каждый адипоцит не будет окружен коллагеновым матриксом (scaffold). Соединительнотканные перегородки внедряются в жировую ткань и разделяют ее на несколько более мелких фрагментов [1, 3].
Жировая ткань имеет два типа нервных волокон: симпатические и чувствительные. Доказано, что симпатическая иннервация подавляет увеличение количества жировых клеток. Это может служить подтверждением связи некоторых синдромов ожирения со сниженной симпатической иннервацией [1, 3]. У мышей и крыс не обнаружено парасимпатической иннервации жировой ткани [4]. Прямая нейронная связь между паравентрикулярными ядрами гипоталамуса и жировой тканью установлена только в придатке яичка [5]. Такая же прямая гипоталамическая связь существует с печенью, что может обеспечивать контроль за метаболическими процессами в организме. Если учесть, что гипоталамус имеет множественные нейронные связи с другими отделами головного мозга, можно понять возможность непредсказуемых биологических взаимодействий. В межлопаточной области хомяков обнаружены прямые нейронные пути между центральной нервной системой и КЖТ. Нейроны средней преоптической области, гипоталамические ядра, вентромедиальные гипоталамические ядра, супрахиазматические и латеральные гипоталамические ядра соединяются с межлопаточной КЖТ через пути спинномозговых волокон, а также со стволом головного мозга, средним и передним мозгом [2].
В зависимости от анатомической локализации жировая ткань демонстрирует различные свойства. Основная масса ткани локализуется в двух отделах: подкожном слое и сальнике. Этот массив ткани легко увеличивается или уменьшается в зависимости от питания. Половые различия также влияют на количество и распределение жировой ткани. В то же время некоторые фрагменты жировой ткани, такие как периокулярные, ладонные, подошвенные, не вовлечены в метаболический процесс организма и их масса не изменяется даже в результате строгого поста. [1, 3]. Самые маленькие адипоциты, которые располагаются в брыжейке, наименее чувствительны к адреналину. Жировая ткань брыжейки имеет более богатые иннервацию и кровоснабжение. Кровоснабжение жировой ткани меняется в зависимости от индекса массы тела (ИМТ). Сердечный выброс в жировую ткань варьирует от 3—7% у худых людей, до 15—30% — при выраженном ожирении. Такое увеличение сердечного выброса может вызывать гемодинамические эффекты с возможным развитием кардиомегалии и выраженной сердечной недостаточности. Процентное содержание макрофагов в ткани также зависит от ИМТ: с увеличением массы тела увеличивается количество макрофагов, которые фагоцитируют жировые фрагменты погибших адипоцитов.
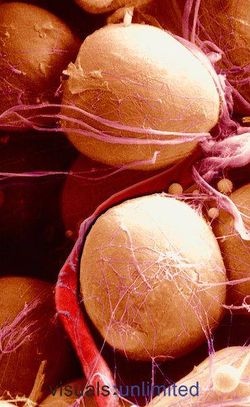
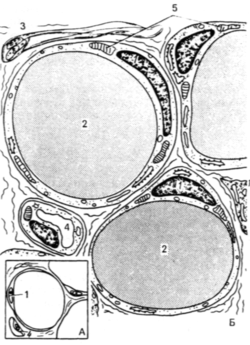
Адипоциты БЖТ содержат одну большую каплю жира в каждой клетке. Эта капля не имеет четкой дифференцировки, но у нее есть однослойная мембрана, отделяющая ее от цитоплазмы. Клетки бывают круглой или полигональной формы, и их размер варьирует от 25 до 200 мкм. Они содержат много органелл, однако трудноразличимы на фоне крупного жирового фрагмента, который выдавливает внутриклеточные структуры вместе с ядром к периферии, где они находятся в тонкой прослойке цитоплазмы под плазмолеммой. В процессе гистологической обработки жировой фрагмент исчезает, оставляя пустое пространство, которое под микроскопом визуализируется как кольцо. Большое скопление пиноцитотических везикул расположено возле плазматической мембраны. Для прокраски адипоцитов используют Sudan III или Scarlet Red staining. БЖТ содержит множество сосудов, обычно каждый адипоцит контактирует с кровеносным сосудом. Жировая ткань представлена зрелыми адипоцитами, преадипоцитами, постадипоцитами, мезенхимальными стволовыми клетками, клетками эндотелия, перицитами, мастовскими клетками, макрофагами, фибробластами, циркулирующими кровяными клетками, ретикулоцитами, нервными клетками. При этом зрелые адипоциты составляют ½ всей клеточной популяции.
КЖТ относят к жировой ткани, поскольку ее клетки содержат в цитоплазме триглицеридные депозиты. Коричневый цвет этой ткани обусловлен высоким содержанием цитохромной оксидазы в митохондриях, которая в избыточном количестве находится в цитоплазме. Различают две разновидности клеток КЖТ. Первая популяция эмбриологически образуется из того же источника, что и мышечные клетки, и составляет основу всех классических депозитов КЖТ. Вторая популяция формируется из клеток БЖТ [6] и распределяется среди белых жировых клеток, поэтому именуется как «коричневая в белом» («beige or brite»). Анатомическое распределение КЖТ и БЖТ различно. В течение первых 10 лет человеческой жизни КЖТ можно обнаружить практически в тех же местах, где находится БЖТ, например в межлопаточной области и на передней брюшной стенке. Однако с течением времени КЖТ исчезает из периферических отделов и концентрируется во внутренних отделах организма: в средостении, вокруг почек, надпочечников, аорты, сохраняясь там вплоть до восьмой декады жизни. Результаты недавних исследований, включающих 3604 пациента и основанных на исследовании 18F-FDG-PET/CT, показали, что объем и активность КЖТ более выражены у женщин. Мужской организм с возрастом теряет объем и активность КЖТ. Предполагается, что это связано с гормональными различиями, а именно — тестостероновой ингибицией экспрессии UCP1 mRNA в дозозависимом порядке. Коричневые адипоциты имеют полигональную или эллипсовидную форму, их диаметр варьирует от 15 до 50 мк. Большое количество жировых капель различных размеров располагается в цитоплазме, что придает адипоцитам мультиокулярый вид [2]. КЖТ продуцирует тепло (термогенезис), которое распространяется по всему организму за счет циркуляции крови. Регуляция термогенеза в основном осуществляется гипоталамусом. Поступающие от гипоталамуса сигналы вызывают высвобождение норэпинефрина, который индуцирует метаболизм жировых кислот в митохондриях коричневых адипоцитов. Выработка тепла происходит за счет функционирования высвобожденного протеина 1 (UCP1) во внутренней мембране митохондрий. Этот протеин в литературе также называют «термогенин». Он присутствует только в клетках КЖТ, являясь их маркером. UCP1 активируется в присутствии свободных жировых кислот, высвобождаемых из триглицеридов в результате воздействия неэпинефрин-активированных β-адренергических рецепторов, и подавляет генерацию АТФ в процессе оксидирования жира. В результате свободная энергия выделяется в виде тепла. Механизм выработки тепла до сих пор изучается. UCP1 скорее всего является переносчиком триглицеридов, а не протонов. Свободные протоны выбрасываются в цитоплазму из митохондрий, где они соединяются с жировыми кислотами, переводя их в растворимое состояние. Эти растворимые жировые кислоты возвращаются в митохондрии. При этом (согласно концепции расщепления) протоны не используются для продукции АТФ, а тепло генерируется за счет высвобождения протонов. Таким образом, жировые кислоты вновь переходят в нерастворимое состояние и транспортируются в цитоплазму с помощью UCP1. Остаточные продукты оксигенированного жира, вероятно, подавляют активность UCP1. КЖТ иннервируется симпатическими нервными волокнами. Выработка тепла зависит от особенностей воздействия секретируемого из нервной ткани норэпинефрина на рецепторы КЖТ. При активации β3-рецепторов происходит активация термогенеза, а при активации β2-рецепторов — его ингибиция. Хотя очевидно, что механизм терморегуляторного баланса существует, однако он нуждается в дальнейшем изучении. Сигналы от кожных терморецепторов по нервным путям поступают в ростральный отдел гипоталамуса, который является предмозговым центром системы КЖТ-терморегуляции [1, 3]. Помимо термогенерирующей функции, коричневые адипоциты секретируют ряд молекулярных элементов, а именно компоненты экстрацеллюлярного матрикса (ЭЦМ) (collagen IV, laminin, heparan sulphate, proteoglycan, fibronectin), аутокринные молекулы (adipsin, FGF-2, IGF-I, prostaglandins E2, prostaglandin Fa, adenosine), паракринные молекулы (NGF, VEGF-A, VEGF-B, VEGF-C, nitric oxide, angiotensinogen), эндокринные молекулы (fatty acids, leptin, adiponectin).
ЭЦМ жировой ткани представлен коллагеновыми, ретикулярными, эластическими волокнами, сосудами, стромальной и лимфатической системой. ЭЦМ ткани очень важен для выживания зрелых адипоцитов, включающих большие жировые капли. Масса этих жировых капель намного превышает массу остальных структур клетки, поэтому механическая поддержка ЭЦМ предохраняет клетки от разрушения [7]. Кроме того, сама архитектура ЭЦМ перераспределяет векторы давления окружающих тканевых структур, что также снижает опасность разрушения [8]. ЭЦМ можно разделить на две части: базальную мембрану и межклеточную субстанцию. Каждый адипоцит имеет свою собственную базальную мембрану, состоящую из сети коллагеновых волокон 4-го типа, пластинки, гепарансульфат полигликана (heparan sulphate proteoglycan), перликана и энтактина. Основным компонентом межклеточной субстанции является коллаген 6-го типа [7]. Детальное рассмотрение этого протеина необходимо для лучшего понимания специфики жировой ткани.
Жировая ткань не только выполняет депонирующую функцию, но также является эндокринным органом [9]. Это ткань состоит из адипоцитов, преадипоцитов, фибробластов, стромально-васкулярных клеток, мастовских клеток, и все эти клетки секретируют биологические молекулы и могут вырабатывать как однотипные, так и дифференцированные вещества. При этом один секретируемый продукт может вырабатываться только строго определенным типом клеток, в то время как другой — тремя или четырьмя типами. Постоянная миграция макрофагов и мастовских клеток приводит к изменению общего количества клеток, что затрудняет оценку секретирующей функции жировой ткани. На существующий в БЖТ клеточный трафик влияет целый ряд параметров. Секретируемые жировой тканью продукты могут быть классифицированы в зависимости от их специфики следующим образом: компоненты ЭЦМ (collagen I, III, VI, V, laminin, heparan sulphate, proteoglycan, perlecan, entactin), аутокринные (glycerol, NEFA, monoglyceride, eicosanoids, oleoyl-esttrone, prostagalandin E2, I2, lipoprotein lipase, acylation-stimulating protein, fasting-induced adipose factor, cholestery1 ester transfer protein, tumor necrosis factor a, interleukin-6, complement components, angiotensinogen, VEGF, metalloproteinase inhibitors, matrix metalloproteinases, secreted protein acidic), паракринные (NEFA, monoglyceride, eicosanoids, oleoy1-estrone, prostaglandin E2,12, acylation-stimulating protein, fasting-induced adipose factor, cholesteryl ester transfer protein, tumor necrosis factor α, interleukin-6, IL-1β, IL-8, IL-10, IL-18, IL-17D, transforming growth factor-β, monocyte chemoattractant protein 1, macrophage migration inhibiting factor, complement components, haptoglobin, serum amyloid A3, plasmogen activator inhibitor-1, angeotensinigen, pigment epithelian-derived factor, adrenomedullin, VEGF, apelin, NGF, fibroblast growth factors, metalloproteinase inhibitors, matrix metalloproteniases, secreted protein acid), эндокринные (NEFA, leptin, resistin, omentin, estrogen, oleoy1-oestrogen, androgens, cortisol, cortisone, adiponectin, vistafin, vaspin, fasting-induced adipose factor, retinol binding protein, interleukin-6, IL-1β, IL-8, IL-10, IL-18, IL-17D, transforming growth factor-β, monocyte chemoattractant protein 1, macrophage migration inhibiting factor, complement components, haptoglobine, serum amyloid A3, plasminogen activator inhibitor-1, pigment epithelian-derived factor, adrenomedullin, VEGF, apelin