Что образуется при растворении аммиака в воде
Аммиак: получение и свойства
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Гидроксид меди (II) растворяется в избытке аммиака:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
Пероксид водорода также окисляет аммиак до азота:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Что образуется при растворении аммиака в воде
§ 24. Аммиачная вода
Водородные соединения уже изученных нами неметаллов растворяясь в воде, реагируют с нею с образованием ионов гидроксония. Реагирует с водой при растворении в ней и аммиак, но иначе.
Опустим в кристаллизатор с водой сосуд, наполненный аммиаком, отверстием вниз. Вода быстро заполнит сосуд доверху, то показывает, что аммиак очень хорошо растворяется в воде. В 1 объеме воды ПРИ обычной температуре растворяется до 700 объемов аммиака. Водный раствор аммиака называется аммиачной водой.
Водородные соединения изученных вами неметаллов диссоциируют в растворе, как кислоты. Исследуем и аммиачную воду при помощи прибора для обнаружения электропроводности растворов (рис. 1). При погружении в нее электродов лампочка засветится. Следовательно, в растворе содержатся ионы
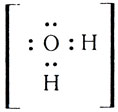
Одна электронная пара при атоме азота остается свободной, не участвующей в образовании химической связи. Молекулу же воды мы уже рассматривали как ион кислорода 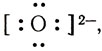
Не участвуют в образовании связей у атома кислорода две электронные пары. Атомы неметаллов в таких водородных соединениях могут за счет свободных электронных пар связывать дополнительные ионы Н + (вспомните ион гидроксония).
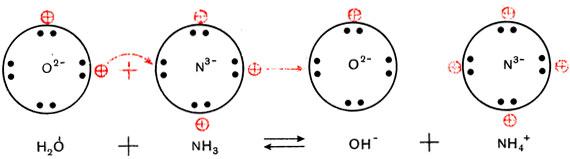
Трехзарядный ион азота в молекуле аммиака сильнее удерживает связанные с ним протоны и сильнее притягивает добавочный протон, чем двухзарядный ион кислорода в молекуле воды. Поэтому при взаимодействии аммиака с водой происходит перемещение протонов из молекул воды в молекулы аммиака:
Образуются ионы гидроксила ОН
Упрощенно реакция между аммиаком и водой изображается так:
Эта реакция обратимая. Лишь малая доля растворенного аммиака присутствует в растворе в виде ионов аммония, большая часть его содержится в виде молекул NH3. Потому аммиачная вода пахнет аммиаком и при стоянии на открытом воздухе или при нагревании выделяет весь растворенный в ней аммиак.
В медицине и в быту разбавленный раствор аммиака называется аммиачной водой или нашатырным спиртом. Его дают нюхать при обмороке для приведения в сознание. В домашнем хозяйстве он применяется в качестве слабой щелочи при стирке белья и выведении пятен.
В сельском хозяйстве концентрированную аммиачную воду используют в качестве жидкого удобрения.
Урок №30. Аммиак. Физические и химические свойства. Получение и применение
Аммиак – NH 3
Строение молекулы
Физические свойства аммиака
При нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. Растворимость NH 3 в воде чрезвычайно велика — около 1200 объёмов (при 0°C) или 700 объёмов (при 20°C) в объёме воды.
Получение аммиака
В лаборатории
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
NH 4 Cl + NaOH = NH 3 ↑ + NaCl + H 2 O
(NH 4 ) 2 SO 4 + Ca(OH) 2 = 2NH 3 ↑ + CaSO 4 + 2H 2 O
Внимание! Гидроксид аммония неустойчивое основание, разлагается:
NH 4 OH ↔ NH 3 ↑ + H 2 O
В промышленности
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
N 2(г) + 3H 2(г) ↔ 2NH 3(г) + 45,9 кДж
катализатор – пористое железо
температура – 450 – 500 ˚С
давление – 25 – 30 МПа
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).
Химические свойства аммиака
Реакции с изменением степени окисления атома азота (реакции окисления)
N -3 → N 0 → N +2
NH 3 – сильный восстановитель
4NH 3 + 3O 2 = t = 2N 2 + 6H 2 О
2. Каталитическое окисление аммиака
4NH 3 + 5O 2 = t, кат. Pt – Rh = 4NO + 6H 2 O
3. С оксидами металлов
2NH 3 + 3CuO = 3Cu + N 2 + 3H 2 O
4. С сильными окислителями
2NH 3 + 3Cl 2 = t = N 2 + 6HCl
5. Аммиак – непрочное соединение, при нагревании разлагается
2NH 3 = t = N 2 + 3H 2
Реакции без изменения степени окисления атома азота
(NH 4 ) n А – соли аммония
NH 4 ОН – гидроксид аммония (правильная запись NH 3 •H 2 O )
1. С водой образуется аммиачная вода (нашатырный спирт), обладающий основными свойствами – фенолфталеин в таком растворе окрашивается в малиновый цвет, а красная лакмусовая бумага – в синий:
NH 3 +H 2 SO 4 = NH 4 HSO 4 – гидросульфат аммония
2NH 3 +H 2 SO 4 = (NH 4 ) 2 SO 4 – сульфат аммония
Применение аммиака
Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека из обморочного состояния. Для человека аммиак в такой дозе не опасен.
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Осуществить превращения по схеме:
а) Азот→ Аммиак → Оксид азота (II)
б) Нитрат аммония → Аммиак → Азот
в) Аммиак → Хлорид аммония → Аммиак → Сульфат аммония
Для ОВР составить е-баланс, для РИО полные, ионные уравнения.
№2. Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.
Аммиак, получение, свойства, химические реакции
Аммиак, получение, свойства, химические реакции.
Аммиак, NH3 – химическое соединение азота и водорода, состоящее из одного атома азота и трех атомов водорода, нитрид водорода.
Аммиак, формула, газ, характеристики:
Аммиак – химическое соединение азота и водорода, состоящее из одного атома азота и трех атомов водорода, нитрид водорода.
Аммиак (NH3) – наиболее простое и устойчивое соединение азота с водородом.
Химическая формула аммиака NH3. Изомеров не имеет.
Строение молекулы аммиака:
Аммиак – при нормальных условиях бесцветный газ, с резким характерным запахом (запах «нашатырного спирта»).
Аммиак – токсичное горючее газообразное вещество, обладающее свойством образовывать при контакте с воздухом взрывоопасную смесь.
Водный раствор аммиака имеет сильную щелочную реакцию вследствие образования гидроокиси аммония NH4OH.
Аммиак в следовых количествах содержится в природе и планетах Солнечной системы. Почки человека выделяют аммиак для нейтрализации избыточной кислоты.
Ежегодное мировое промышленное производство аммиака составляет более 180 млн тонн. Он относится к числу важнейших продуктов химической промышленности. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH3.
Аммиак, жидкость, твердое тело, характеристики:
Жидкий аммиак – бесцветная жидкость, сильно преломляющая свет.
Сжиженный безводный аммиак относится к трудногорючим веществам.
Жидкий аммиак или струя газа, попадая на кожу человека, вызывает сильные ожоги.
Твёрдый аммиак внешне представляет собой снегообразную массу из кубических кристаллов правильной формы.
Физические свойства аммиака:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | с резким характерным запахом (запах «нашатырного спирта») |
| Вкус | едкий |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность жидкости (при температуре кипения и атмосферном давлении 1 атм.), кг/м 3 | 682,8 |
| Плотность газа (при температуре кипения и атмосферном давлении 1 атм.), кг/м 3 | 0,8886 |
| Плотность (при 15 °C и атмосферном давлении 1 атм.), кг/м 3 | 0,73 |
| Плотность (при 25 °C и атмосферном давлении 100 кПа ≈ 1 атм.), кг/м 3 | 0,7723 |
| Температура плавления, °C | -77,73 |
| Температура кипения, °C | -33,34 |
| Критическая температура*, °C | 132,4 |
| Критическое давление, МПа | 11,32 |
| Критический удельный объем, м 3 /кг | 0,00426 |
| Коэффициент теплопроводности газа (при 0 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,026 |
| Температура самовоспламенения, °C | 651 ± 1 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 14,5 (15,0) до 33,6 |
| Взрывоопасные концентрации смеси газа с кислородом, % объёмных | от 13,5 до 82 |
| Удельная теплота сгорания, МДж/кг | 20,5 |
| Температура пламени, °C | 700 |
| Константа диссоциации кислоты | 9,21 ± 0,01 |
| Молярная масса, г/моль | 17,0304 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства аммиака:
Основные свойства аммиака обусловлены наличием неподеленной пары электронов у атома азота. Степень окисления азота в аммиаке «-3» – минимальная. Поэтому в химическом отношении аммиак довольно активен: он вступает в реакции взаимодействия со многими веществами и проявляет только восстановительные свойства.
Для аммиака характерны следующие химические реакции:
1. реакция взаимодействия аммиака и воды:
В результате реакции образуется гидрат аммония (NH3•H2O или NH4OН). Раствор аммиака в воде имеет щелочную среду.
2. реакция взаимодействия аммиака и ортофосфорной кислоты:
В результате реакции образуется дигидрофосфат аммония.
Аналогичным образом протекают реакции аммиака с другими кислотами – с образованием солей аммония.
3. реакция взаимодействия аммиака и кислорода – горения аммиака:
4. реакция каталитического окисления аммиака:
4NH3 + 5O2 → 4NO + 6H2O (kat = Pt и пр., t = 800 о С);
В результате второй реакции образуются азотная кислота и вода. Это промышленный способ получения азотной кислоты. При этом смесь воздуха с 10% (по объему) аммиака пропускается над рядами металлических сеток ( платина с 5-15% родия ) при температуре около 850 о С и давлении 5 атм; время контактирования с катализатором ограничено до ≤ 1 мс чтобы минимизировать нежелательные побочные реакции. Степень превращения составляет около 96% (одна из наиболее эффективных из известных промышленных каталитических реакций); выходящие газы пропускают через абсорбционную колонну и получают 60%-й водный раствор азотной кислоты при 40°C. Реакция протекает в три стадии.
5. реакция взаимодействия аммиака и оксида меди:
2NH3 + 3CuO → N2 + 3Cu + 3H2O (t = 500-550 о С).
6. реакция термического разложения аммиака:
7. реакция взаимодействия аммиака и фтора:
Аналогичным образом протекают реакции аммиака с другими галогенами.
8. реакция взаимодействия оксида калия и аммиака:
Получение аммиака в промышленности и лаборатории. Химические реакции – уравнения получения аммиака:
Аммиак в лабораторных условиях получается в результате следующих химических реакций:
NH4Cl + NaOH → NH3 + NaCl + H2O.
В результате реакции образуются газообразный аммиак, хлорид натрия и вода.
В результате реакции образуются газообразный аммиак, сульфат кальция и вода.
В результате реакции образуются газообразный аммиак, хлорид кальция и вода.
Таким образом, для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония.
Аммиак в промышленности получают путем прямого взаимодействия водорода и азота:
N2 + 3H2 ↔ 2NH3 (kat = пористое железо с примесями Al2O3 и K2O, t = 500 о С, p = 350 атм.).
За счет высокого давления равновесие в указанной реакции смещается в сторону аммиака. Это так называемый процесс Габера. Немецкий физик Фриц Габер разработал физико-химические основы данного метода.
Применение и использование аммиака:
– в холодильной технике в качестве хладагента R717, где R – Refrigerant (хладагент), 7 – тип хладагента (неорганическое соединение), 17 – молекулярная масса,
– в медицине в виде примочек. 10 % водный раствор аммиака известен как нашатырный спирт,
– в химической промышленности для производства азотных удобрений (нитрат и сульфат аммония, мочевина),
– как сырье в химической промышленности для производства взрывчатых веществ, полимеров, азотной кислоты, соды (по аммиачному методу), нейлона, капрона и других продуктов химической промышленности,
– жидкий аммиак используют в качестве растворителя.
– в сельском хозяйстве в качестве удобрения в виде аммиачной воды.
Примечание: © Фото https://www.pexels.com, https://pixabay.com,
почему газообразный жидкий аммиак кислота формула связь можно водный химическая связь растворим растворили имеет является
вычислите уравнение моль окисление концентрация свойства производство плотность образование синтез взаимодействие водный раствор получение запах масса какой объем молекула краска без аммиака для волос
Физико-химические свойства аммиака и аммиачной воды
Аммиак не имеет цвета и обладает характерным запахом.
Температура воспламенения аммиака на воздухе составляет 651 °С. Он образует с воздухом взрывоопасные смеси в интервале при объемных концентрациях 15-28 %, с увеличением температуры пределы взрываемости расширяются, и при 100 °С они составляют 14,5-29,5 %. Максимальное давление при взрыве аммиачно-воздушной смеси в 7 раз превышает начальное.
Качественное и своевременное обслуживание кондиционеров LG.
В присутствии пара с концентрацией выше 11 % аммиачно-воздушные смеси взрывобезопасны.
Физические свойства аммиака