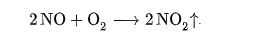Что образуется при сжигании водорода
Температура горения водорода: описание и условия реакции, применение в технике
Одной из актуальных проблем является загрязнение окружающей среды и ограниченность энергетических ресурсов органического происхождения. Многообещающим способом решения этих проблем является использование водорода в качестве источника энергии. В статье рассмотрим вопрос горения водорода, температуру и химию этого процесса.
Что такое водород?
Прежде чем рассматривать вопрос, какая температура сгорания водорода, необходимо вспомнить, что собой представляет это вещество.

Водород — это самый легкий химический элемент, состоящий всего из одного протона и одного электрона. При нормальных условиях (давление 1 атм., температура 0 oC) он присутствует в газообразном состоянии. Его молекула (H2) образована 2 атомами этого химического элемента. Водород является 3-м по распространенности элементом на нашей планете, и 1-м во Вселенной (около 90 % всей материи).

Водородный газ (H2) не имеет запаха, вкуса и цвета. Он не токсичен, однако, когда содержание его в атмосферном воздухе составляет несколько процентов, то человек может испытывать удушье, по причине недостатка кислорода.
Любопытно отметить, что хотя с химической точки зрения все молекула H2 идентичны, физические свойства их несколько отличаются. Дело все в ориентации спинов электронов (они ответственны за появление магнитного момента), которые могут быть параллельными и антипараллельными, такую молекулу называют орто- и параводородом, соответственно.
Химическая реакция горения
Рассматривая вопрос, температуры горения водорода с кислородом, приведем химическую реакцию, которая описывает этот процесс: 2H2 + O2 => 2H2O. То есть в реакции участвуют 3 молекулы (две водорода и одна кислорода), а продуктом являются две молекулы воды. Эта реакция описывает горение с химической точки зрения, и по ней можно судить, что после ее прохождения остается только чистая вода, которая не загрязняет окружающую среду, как это происходит при сгорании органического топлива (бензина, спирта).

С другой стороны, эта реакция является экзотермической, то есть помимо воды она выделяет некоторое количества тепла, которое можно использовать для приведения в движение машин и ракет, а также для его перевода в другие источники энергии, например, в электричество.
Механизм процесса горения водорода
Описанная в предыдущем пункте химическая реакция известна любому школьнику старших классов, однако она является очень грубым описанием того процесса, который происходит в действительности. Отметим, что до середины прошлого века человечество не знало, как происходит горение водорода в воздухе, а в 1956 году за ее изучение была присуждена Нобелевская премия по химии.
В действительности, если столкнуть молекулы O2 и H2, то никакой реакции не произойдет. Обе молекулы являются достаточно устойчивыми. Чтобы горение происходило, и образовывалась вода, необходимо существование свободных радикалов. В частности, атомов H, O и групп OH. Ниже приводится последовательность реакций, которые происходят в действительности при горении водорода:
Что видно из этих реакций? При горении водорода образуется вода, да, верно, но происходит это только, когда группа из двух атомов OH встречается с молекулой H2. Кроме того, все реакции происходят с образованием свободных радикалов, это означает, что запускается процесс самоподдержания горения.
Таким образом, ключевой момент в запуске этой реакции заключается в образовании радикалов. Они появляются, если поднести к кислород-водородной смеси горящую спичку, либо если нагреть эту смесь выше определенной температуры.
Инициация реакции
Как было отмечено, сделать это можно двумя способами:
Процентное содержание газов в горючей смеси

Говоря о температуре горения водорода в воздухе, следует отметить, что не всякая смесь этих газов будет вступать в рассматриваемый процесс. Экспериментально установлено, что если количество кислорода меньше 6% по объему, либо если количество водорода меньше 4% по объему, то никакой реакции не будет. Тем не менее, пределы существования горючей смеси являются достаточно широкими. Для воздуха процентное содержание водорода может составлять от 4,1 % до 74,8 %. Отметим, что верхнее значение как раз соответствует необходимому минимуму по кислороду.
Если же рассматривается чистая кислород-водородная смесь, то здесь пределы еще шире: 4,1-94 %.
Уменьшение давления газов приводит к сокращению указанных пределов (нижняя граница поднимается, верхняя — опускается).
Также важно понимать, что в процессе горения водорода в воздухе (кислороде), возникающие продукты реакции (вода) приводят к уменьшению концентрации реагентов, что может привести к прекращению химического процесса.
Безопасность горения
Это важная характеристика воспламеняющейся смеси, поскольку она позволяет судить о том, происходит реакция спокойно, и можно ее контролировать, либо процесс имеет взрывной характер. От чего зависит скорость горения? Конечно же, от концентрации реагентов, от давления, а также от количества энергии «затравки».
К большому сожалению, водород в широком интервале концентраций способен к взрывному горению. В литературе приводятся следующие цифры: 18,5-59 % водорода в воздушной смеси. Причем на краях этого предела в результате детонации выделяется наибольшее количество энергии на единицу объема.
Отмеченный характер горения представляет большую проблему для использования этой реакции в качестве контролируемого источника энергии.
Температура реакции горения
Теперь мы подошли непосредственно к ответу на вопрос, какая низшая температура сгорания водорода. Она составляет 2321 К или 2048 oC для смеси с 19,6 % H2. То есть температура горения водорода в воздухе выше 2000 oC (для других концентраций она может достигать 2500 oC), и в сравнении с бензиновой смесью — это огромная цифра (для бензина около 800 oC). Если сжигать водород в чистом кислороде, то температура пламени будет еще выше (до 2800 oC).
Столь высокая температура пламени представляет еще одну проблему в использовании этой реакции в качестве источника энергии, поскольку не существует в настоящее время сплавов, которые могли бы работать длительное время в таких экстремальных условиях.
Конечно, эта проблема решается, если использовать хорошо продуманную систему охлаждения камеры, где происходит горение водорода.
Количество выделяемой теплоты
В рамках вопроса температуры горения водорода любопытно также привести данные о количестве энергии, которая выделяется во время этой реакции. Для разных условий и составов горючей смеси получили значения от 119 МДж/кг до 141 МДж/кг. Чтобы понять, насколько это много, отметим, что аналогичное значение для бензиновой смеси составляет около 40 МДж/кг.
Энергетический выход водородной смеси намного выше, чем для бензина, что является огромным плюсом для ее применения в качестве топлива для двигателей внутреннего сгорания. Однако, и здесь не все так просто. Все дело в плотности водорода, она слишком низка при атмосферном давлении. Так, 1 м3 этого газа весит всего 90 грамм. Если сжечь этот 1 м3 H2, то выделится около 10-11 МДж теплоты, что уже в 4 раза меньше, чем при сжигании 1 кг бензина (чуть больше 1 литра).
Приведенные цифры говорят о том, что для использования реакции горения водорода необходимо научиться хранить этот газ в баллонах с высоким давлением, что создает уже дополнительные сложности, как в технологическом вопросе, так и с точки зрения безопасности.
Применение водородной горючей смеси в технике: проблемы
Сразу необходимо сказать, что в настоящее время водородная горючая смесь уже используется в некоторых сферах человеческой деятельности. Например, в качестве дополнительного топлива для космических ракет, в качестве источников для выработки электрической энергии, а также в экспериментальных моделях современных автомобилей. Однако масштабы этого применения являются мизерными, по сравнению с таковыми для органического топлива и, как правило, носят экспериментальных характер. Причиной этому являются не только трудности в контроле самой реакции горения, но также в хранении, транспортировке и добыче H2.
Водород на Земле практически не существует в чистом виде, поэтому его необходимо получать из различных соединений. Например, из воды. Это достаточно популярный способ в настоящее время, который осуществляется с помощью пропускания электрического тока через H2O. Вся проблема заключается в том, что при этом расходуется больше энергии, чем потом можно получить путем сжигания H2.
Еще одна важная проблема — транспортировка и хранение водорода. Дело в том, что этот газ, ввиду маленьких размеров его молекул, способен «вылетать» из любых контейнеров. Кроме того, попадая в металлическую решетку сплавов, он вызывает их охрупчивание. Поэтому наиболее эффективным способом хранения H2 является использование атомов углерода, способных прочно связывать «неуловимый» газ.
Таким образом, применение водорода в качестве топлива в более-менее широких масштабах возможно, только если его использовать в качестве «сохранения» электричества (например, переводить ветровую и солнечную энергию в водород с помощью электролиза воды), либо если научиться доставлять H2 из космоса (где его очень много) на Землю.
Экологические проблемы сжигания водорода
Все мы знаем формулу Н2О. Некоторые еще знают, что при сжигании водорода выделяется энергия (около 140 МДж/кг). Особо упоротые еще знают, что водород производят на водородных станциях, а кислород на кислородных станциях.
Еще кто-то слышал, что это самое экологичное топливо, так как выхлоп целиком состоит из водяного пара Н2О.
На этом «знания» заканчиваются.
Про то, что водяной пар — это главный парниковый газ я писал тут:
https://smart-lab.ru/blog/659641.php
Теперь перейдем непосредственно к самому процессу сжигания.
Приблизительно процесс описывается формулой 2H2 + O2 = 2H2O + E
Проблема в том, что при сжигании водорода используют не чистый водород, а атмосферный воздух.
атмосферный воздух состоит из азота на 78%, кислорода на 21 % — кислород. 1% приходится на другие газы, включая ныне нелюбимый всеми СО2.
Так что же происходит?
Всё дело в том, что при температуре горения более 600 оС, а особенно после 1500оС начинается реакция азота и кислорода: 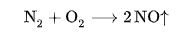
тепловой эффект реакции −180,9 кДж
NO не имеет запаха, но при вдыхании может связываться с гемоглобином, подобно угарному газу переводя его в форму, не способную переносить кислород.
При комнатной температуре и атмосферном давлении происходит окисление NO кислородом воздуха:
Оксид азота (IV) NO2 (диоксид азота; двуокись азота) в высоких концентрациях раздражает лёгкие и может привести к серьёзным последствиям для здоровья. NO2 соединяется с водой, хорошо растворяется в жире и может проникать в капилляры лёгких, где он вызывает воспаление и астматические процессы. Концентрация NO2 свыше 200 ppm считается летальной, но уже при концентрации свыше 60 ppm могут возникать неприятные ощущения и жжение в лёгких. Долговременное воздействие более низких концентраций может вызывать головную боль, проблемы с пищеварением, кашель и лёгочные заболевания.
В клинике острого отравления оксидами азота различают четыре периода: латентный, нарастания отёка лёгких, стабилизации и обратного развития[3]. В скрытом периоде мнимого благополучия, который может продолжаться 4—12 часов, больного может беспокоить конъюнктивит, ринит и фарингит за счёт раздражения слизистых оболочек, проявляющиеся кашлем, слезотечением, общим недомоганием, однако его общее состояние в целом удовлетворительное. Затем состояние больного ухудшается: по мере развития отёка лёгких появляется влажный кашель со слизистой или кровянистой мокрота, одышка, цианоз, тахикардия, субфебрильное или фебрильное повышение температуры. Возникает чувство страха, психомоторное возбуждение и судороги. В отсутствие квалифицированной медицинской помощи это может привести к летальному исходу.
Токсичность! Оксид азота (II) — ядовитый газ с удушающим действием.
Ответствен за смог!
Смог — это чрезмерное загрязнение воздуха вредными веществами, выделенными в результате работы промышленных производств, транспортом и теплопроизводящими установками при определённых погодных условиях. Выбросы NOx считаются одной из основных причин образования фотохимического смога:
ru.wikipedia.org/wiki/%D0%A1%D0%BC%D0%BE%D0%B3
Но это мелочи!
Соединяясь с парами воды в атмосфере, NOx образуют азотную кислоту, и, вместе с оксидами серы, являются причиной образования кислотных дождей.
Лес после кислотного дождя:
Именно по оксидам азота сильно ударили экологические нормы ЕВРО, начиная с ЕВРО-3: 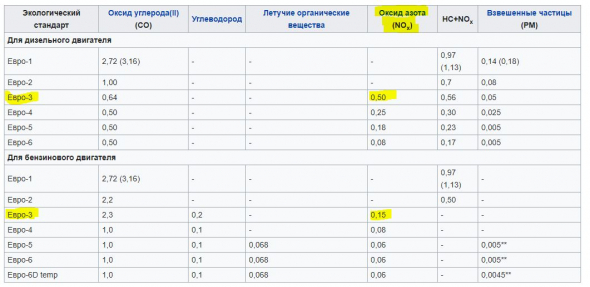
ru.wikipedia.org/wiki/%D0%95%D0%B2%D1%80%D0%BE-6
И так, а что же при сжигании водорода?
Температура более 1500 градусов, что приводит к недопустимо высоким выбросам NOx.
при горении водорода в воздухе достигается температура около 2000°С.
(Кстати, эти любимые всеми клапана EGR в автомобилях как раз и призваны снижать образование оксидов азота)
Особо забавно читать выводы по эксплуатации экспериментальных энергических установок на водороде:
Газовая турбина на водороде
Ключевая технология, необходимая для масштабного использования водорода в газовой электроэнергетике, – водородная турбина. По оценке компании Mitsubishi Hitachi Power Systems (MHPS), на существующих газотурбинных установках можно увеличить долю водорода до 20% в смеси его с природным газом без существенных изменений в конструкции. MHPS успешно испытала в Японии сверхмощную газовую турбину серии J в работе на топливной смеси из природного газа (70%) и водорода (30%). Испытания были проведены на заводе в Такасаго на парогазовой установке мощностью 700 МВт (КПД – 63% с температурой газов после камеры сгорания ГТУ – 1600°C). Для сжигания топлива использовались горелки с вихревым перемешиванием. Благодаря водороду выбросы CO2 сократились на 10%, а выбросы оксидов азота, по мнению компании, «остались на удовлетворительном уровне».
Т.е. если мы меняем смесь природного газа и водорода на (60%) и (40%), то очевидно что выбросы оксидов азота, даже по мнению компании оказываются уже на каком-то совершенно неприличном уровне!
Кстати, ранее именно из-за оксидов азота был похоронен проект автомобиля на газотурбинном двигателе:
Алгоритм взрыва гремучего газа
Алгоритм взрыва гремучего газа
Аннотация.
На базе частичного преодоления жестких рамок квантового формализма модели атома, а так же с возвратом к учету магнитных межатомных взаимодействий рассмотрен механизм образования химических связей в молекулах.
Предложена качественная модель формирования слабых неустойчивых связей, формирующих эффекты текучести нейтральных газов в нормальных условиях.
Представлена версия алгоритма горения чистого водорода (H + H = H2).
Предложен механизм высвобождения тепловой энергии в процессе симметричного процесса синтеза атомов водорода, происходящего при горении чистого водорода.
Предложен альтернативный алгоритм взрыва гремучего газа.
Достоинством работы является возможность простой и наглядной экспериментальной проверки её выводов.
Горение в бытовом и расширенном представлении
Горение водорода и метод черного ящика
Процесс горения атомарного водорода без посторонних реагентов представляет собой белое пятно в науке. Однако многие об этом даже не догадываются, так изящно это обстоятельство изложено в учебниках.
Для автора ситуация является поводом для исследования объекта методом черного ящика. Дело в том, что явление, бесспорно, происходит и наблюдается, а логическая цепь причин и промежуточных состояний его – автору, как и всем остальным, не известны, и экспериментальное исследование тоже недоступно.
Вот и приходится, применительно к горению атомарного водорода, использовать приемы исследования черного ящика.
Сознательно пропустим часть алгоритма процесса горения, и рассмотрим его в момент, когда молекула уже сформирована, и уже обладает порцией приобретенной и явно неравновесной энергии, которая ещё не превратилась в тепло, т.е. в хаотическое движение самой молекулы и её окружения.
Преобразование внутренней энергии молекулы в кинетическую энергию теплового движения среды возможно только посредством столкновения возбужденной молекулы с соседними молекулами окружающей среды, что следует из общих требований симметрии теплового процесса и закона сохранения движения. Из этого механизма превращения внутренней энергии в тепло, в свою очередь следует, что возбужденная и только что сформированная молекула должна обладать либо интенсивной механической вибрацией, либо вращением, либо электрическим возбуждением своей электронной оболочки. Наличие интенсивного поступательного движения исключается, опять же, из условий симметрии.
Находясь в газовой среде себе подобных молекул, такая возбужденная молекула должна иметь возможность расталкивать соседние молекулы, разогревая, таким образом, собственно среду.
Получается, что в процессе образования молекулы, формирующие её атомы, первыми приходят в интенсивное внутреннее движение молекулы.
Из простейших соображений несложно догадаться, что предпочтительнее всего энергия возбужденной молекулы будет представлена продольными колебаниями ядер атомов водорода в составе молекулы. Возбужденным состоянием электронов тоже нельзя пренебрегать, но оно не может влиять на температуру существенно, т.к. вызове только холодное свечение, подобное неоновому.
Получается, что атомы водорода, соединившись в одну молекулу, приобретают на заключительном этапе большие линейные ускорения (импульсы), которые естественным образом за счет симметрии конструкции молекулы проявляются в камертонной вибрации малоподвижной молекулы.
С этим можно бы согласиться, т.к. в этом нет ничего необычного, но почему вибрация так интенсивна, и за счет какого природного процесса это происходит? Какой объект или процесс теряет энергию, приобретаемую образовавшейся молекулой?
Таким образом, мы логически, из самых общих соображений, пришли к выводу, что образовавшаяся молекула водорода неизбежно должна быть сильно возбужденной, и вибрировать. Однако причина такого поведения всё еще осталась не выясненной.
Возбужденная «горячая» молекула интенсивно расталкивает непосредственных соседей, сообщая им хаотическую скорость, соответствующую температуре 3500 ;С. Это почти рекорд для всех известных реакций горения.
В рамках официальной модели объяснение выглядит тривиальным: протон одного атома притягивает орбитальный электрон второго атома, а тот притягивает (подтаскивает) уже свой протон, и тем самым атомы притягиваются и сближаются, причем, как известно из практики, с большой скоростью. Других возможностей из тривиального объяснения не просматривается.
Кажущаяся простота выводов убаюкивает и гипнотизирует.
Ситуация в науке сейчас такова, что достаточно сослаться на квантовую природу сил – и дальше можно не конкретизировать их происхождение, если результат конечного действия этих сил точно известен, и может быть рассчитан, то других обоснований не требуется. Попытаемся избежать этой заманчивой ловушки.
Краткий обобщенный анализ устройства атома
Обобщенный анализ физико-химических взаимодействий
В момент образования новых молекул, электронные структуры составляющих атомов соответственно перестраиваются. Причем изменяются траектории всех электронов на всех оболочках. Электрические поля электронов так велики в масштабе атома, а диаметры смежных электронных оболочек так мало отличаются друг от друга, что даже простая однократная ионизация атома вызывает вариацию всех электронных траекторий.
Все многочисленные вариации электронных оболочек атомов можно отнести к явлению дисперсии. От того, куда мы их отнесем, ничто в природе не может измениться, кроме точности наших прогнозов. Если в разнообразии множества проявлений дисперсии что-то упустить, то изменения в модели могут оказаться разительными. Это замечание непосредственно касается так называемых парных электронов ковалентной связи.
Стабильность электронов ковалентной связи, при наличии других электронов в оболочке атома, представляется очень сомнительной. Дело в том, что случайное изменение параметров одного из электронов ковалентной пары, должно быть точно отработано вторым электроном, а механизма реализации этой отработки нет. Таким образом, тандем электронов не может испытать стороннее воздействие, не нарушающее параметры равновесного, согласованного ковалентного тандема, как целого.
Создается впечатление, что в официальных моделях атомов все внутренние процессы искусственно и чрезмерно заквантованы, что приводит к обеднению моделей атомов в плане описания природного разнообразия.
Образ-идеализация спаренных электронов придуман химиками для удобства манипулирования валентностями. Однако физик, если он воспользуется образом спаренного электрона, испытает ненужные, искусственные трудности. Нельзя групповую корреляцию выдавать за квантовое взаимодействие конкретной пары электронов. Групповое взаимодействие принципиально не может имитировать природный квант, ибо групповое взаимодействие неустойчиво по своей природе.
Под групповым взаимодействием здесь понимается взаимодействие группировок условно свободных зарядов, возникающих по той или иной причине.
Объединившись в молекулу, атомы водорода уже не могут предоставить своим электронам возможности свободного обращения в трех плоскостях. Движение двух электронов, принадлежащих разным атомам одной молекулы неизбежно должно стать не сферическим и взаимно согласованным. Но в какой мере?
Химики избегают физически конкретной интерпретации, прикрываясь стилем функциональной терминологии. Они формулируют эту согласованность следующим образом: «пара электронов, осуществляющая ковалентную связь, одновременно принадлежит обоим связываемым атомам». Получается: солоно, потому что содержит соль. Кто бы спорил.
Принадлежать – это системная характеристика, требующая дополнительных пояснений, а пояснения каждый раз, если и приводятся, то только по мере надобности авторов, и именно в плане потребностей авторов.
Однако фундаментальная функция сбережения ядра от любых воздействий должна сохраняться, и именно как фундаментальное качество. При этом обобщенные, спаренные электроны ковалентной связи в молекуле водорода как исполнители этой функции являются не лучшим вариантом.
Для конкретизации и лучшего понимания способов реализации ковалентной связи обратимся к более наглядному примеру, тем более что он нам понадобится.
Вместо атомов водорода, с вырожденными электронными оболочками из одного электрона, рассмотрим два атома кислорода в составе аналогичной, двухатомной молекулы.
В процессе сближения атомов, перед самым образованием молекулы, в ожидаемой точке условного соприкосновения постепенно начнет формироваться зона разреженности электронов сближающихся оболочек. Для этого все электроны должны своевременно и соответствующим образом скорректировать свои траектории, и корректировать их непрерывно по мере сближения. В таком сценарии перескок двух конкретных электронов на траекторию, которая охватывает оба атома, выглядит не только маловероятной, но и неестественной.
Гораздо меньше сомнений вызывает наведенный электрический диполь, который представляется более естественным именно в групповом исполнении.
При образовании молекулярного кислорода всё происходит, как и при образовании молекулярного водорода, только в более обобщенном варианте, т.к. процесс реализован более обычными, а не вырожденными атомами с единственным электроном. По этой причине, эффекта скачкообразного формирования магнитного момента не будет, и не будет сопутствующего скачка ускорения атомов при сближении, а значит, не будет и большого выделения энергии в форме тепла. Данный вывод, как прогноз, подтверждается экспериментально. Горение чистого атомарного кислорода идет вяло, практически с нулевым тепловыделением.
Молекулы кислорода образуются неотвратимо, но медленно.
Вместе с эффектом наведенного группового диполя, признаваемого официальной теорией, в сближающихся атомах может реализоваться совсем другой эффект, эффект токовой природы, который тоже может обеспечивать химическую связь, но эту связь не хотят замечать официальные теоретики. Речь идет о магнитной связи, которая формируется за счет, и сообразно, случайным параметрам процесса сближения атомов. Магнитная связь не отменяет лондоновские дисперсионные силы, она их дополняет и разнообразит, т.к. сопряжена с множеством нюансов, зависящих от количества электронов в оболочках атомов [3].
Сближаясь, электроны постепенно перестраивают свои орбиты так, что в зоне геометрического (мнимого) касания оболочек образуется разреженность электронов, а по краям этой зоны образуется компенсирующий ободок вероятностного уплотнения электронов, который представляет собой групповой ток. Этот ток и формирует комплексную химическую связь, в которой можно усмотреть и элемент дипольного взаимодействия, и элемент взаимодействия магнитного.
Магнитное взаимодействие более конкретно опишем ниже, в связи с описанием алгоритма взрыва гремучего газа.
Для нас важно то, что ни столкновения электронов, ни их запредельного сближения в зоне мнимого касания атомов молекулы не будет ни при каких обстоятельствах.
В соответствии с классической электродинамикой, каждый электрон своевременно изменит свою траекторию, и продолжит движение вокруг ядра атома, но уже по другим, скорректированным траекториям. Этот эффект очевиден.
Анализ правомерности квантовых идеализаций
Корреляция дисперсионных эффектов групповых проявлений
Пучность заряда по краю кашпо формируется за счет согласованной деформации траекторий всех электронов, без наличия избранной ковалентной пары. Однако искусственное введение такой пары, в некоторых ситуациях облегчает формальное решение некоторых задач.
Если каждый электрон, совершив один виток своей траектории, возвращается точно в ту же точку молекулы, то образуемая пучность заряда будет хоть и групповой, т.е. статистической, но тем не менее стационарной, относительно своей огибающей. Такая, стационарная, пучность формирует групповой электрический диполь.
Но если при возвращении электрона происходит набег фазы, т.е. некоторое малое смещение, то электронная пучность может приобрести эффект движения, и в этом случае формируется еще один, дополнительный (нестационарный) магнитный и дипольный момент.
Направление обращения этого группового тока уже не зависит от направления движения электронов, а зависит от знака приращения сдвига фазы, и может изменять свое направление практически без инерции, как бы мгновенно, за время всего одного оборота электрона.
Групповой, замкнутый ток (магнитный момент) может сформироваться, а может и не сформироваться. Конкретные значения этого группового тока определяют нюансы химических свойств различных веществ и физических состояний атома в его среде, а предсказывать и рассчитывать их ученые пока не умеют.
Наличие группового магнитного момента не исключает наличия наведенного диполя, более того, эти два явления обуславливают друг друга.
Дисперсионные групповые эффекты применительно к атому водорода
Два атома водорода при столкновении в нормальных климатических условиях вероятнее всего оттолкнуться друг от друга, хотя молекула водорода для обоих атомов представляет глубокую потенциальную яму.
При нормальном давлении реакция горения водорода самовоспламеняется при температуре около 250;С.
Уточненный взгляд на принцип суперпозиции электрических полей
Энтузиасты планетарной модели атома, возможно, не были бы так бесшабашны при выборе моделей химических связей, если бы в свое время знали то, что знают современные астрофизики. А современные астрофизики знают, что в межпланетном пространстве преобладают магнитные поля, а не электрические потенциалы. Магнитные поля имеют свойство распространяться гораздо дальше по сравнению с эффективными кулоновскими полями.
Дело в том, что в учебниках напряженность электрического поля определена посредством силы, действующей на пробный единичный заряд. И это определение ни у кого не вызывает сомнений.
Однако практика использования этого определения продемонстрировала его несовершенство в плане полноты определения. Например, определяя напряженность электрического поля атомов, все справочники приводят нулевое значение, чем вводят обучающихся в заблуждение. В действительности же, поле атома является суперпозицией полей всех присутствующих в атоме зарядов, а нулю равно только суммарное воздействие всех полей на пробный заряд. Разница в интерпретации проясняется при оценке силового поля постоянного природного магнита. Кулоновское поле нейтрального магнита будет неуловимо мало, тогда как магнитное поле будет велико, по крайней мере, еще легко обнаруживаемым.
По существующему определению напряженности разноименных электрических полей вычитаются, а на самом деле компенсируются только воздействия полей, сами же поля не уничтожаются. Таким образом, в определении поля не хватает уточнения, что разноименные поля не уничтожают друг друга. Это очень важно.
На первый взгляд покажется, что это одно и то же. Однако процесс формирования магнитного поля вращающегося, несимметричного по массе диполя, т.е. атома водорода, демонстрирует, что это не так. Магнитное поле атома распространяется так далеко, как далеко распространяется поле электрона, который вращается, хотя пробным зарядом его электрическое поле не воспринимается, т.к. компенсируется полем протона атомного ядра.
Загадочное дальнодействие лондоновских сил, равное приблизительно одному нано метру, определяется дальнодействием магнитных полей, которые сознательно были исключены из состава дисперсионных взаимодействий.
Без учета магнитных сил, Фриц Лондон не смог объяснить дальнее действие введенных им дисперсионных сил, и они теперь «работают» на мистиков от квантовой теории.
Горение гремучего газа в официальной интерпретации
Взрывной характер процесса горения кислорода в водороде, в 1934 году объяснил Н.Н. Семенов, опираясь на принцип цепных химических реакций [4].
Вот, очень кратко, суть его объяснения. Цитата.
В представленной, остроумной схеме горения кислорода в водороде сделан упор на формальную (в семантическом смысле) возможность лавинообразного процесса. Семенов ни сколько не беспокоится, возможны ли в принципе каждая из реакций, которые он использует. Опыт, т.е. наблюдаемые взрывы гремучего газа, свидетельствует в его пользу.
Из нашего предшествующего анализа процесса горения водорода следует, что реакция (5.6) явно поглощает энергию (и значительно, М*), и реакция (5.9) вряд ли является эндотермической. А ведь эта, рекуррентного свойства реакция, является одновременно и стартовой, и результирующей. Получается, что её конечный результат, водяной пар, должен быть перегретым (2800 ;С). Всё это очень сомнительно. Но поскольку все промежуточные реакции являются виртуальными, а гремучий газ надежно взрывается, то всякая критика, которая не прекращается до настоящего времени, успешно отражается официальной наукой.
Химики, подобно математикам, доверились привлекательным манипуляциям символами, производимыми по установленным формальным правилам. Но эти правила не имеют отношения к энергетике описываемых процессов, требующих физической проверки.
В рамках взаимодействий, исключительно с электрическими полями, химические связи выглядят достаточно просто и привлекательно. К тому же Зоммерфельд в свое время разрешил электронам квантуемые эллиптические орбиты, и тем самым расширил ассортимент электрических связей. Но их возможностей все равно не хватает.
Дефицит сил, искусственно созданный пренебрежением магнитными силами, привел к функциональной перегрузке ковалентной связи, которая и так, сама по себе, вызывает недоверие своей несколько надуманной неестественностью.
Природное разнообразие заставляет придумывать разные химические связи с загадочным происхождением, например, силы Ван-дер-Ваальса, или уж совсем мистические – силы Казимира.
Чтобы иметь представление о трудностях теоретиков, пытающихся подменить магнитные силы тензорной природы, на векторные электрические силы, приведем наглядный пример.
Рассмотрим два идентичных подковообразных магнита с хорошо отшлифованными контактами полюсов. Смажем контактные площадки хорошим маслом и соединим магниты так, чтобы образовался замкнутый контур.
Оценим энергию связи этих магнитов двумя различными методами.
По первому методу будем растаскивать магниты, прилагая усилие строго по оси, которая ортогональна к плоскости контактов.
По второму методу повернем магниты вокруг этой же оси на 90 градусов.
Результаты обоих методов будут одинаковыми, но затраченная работа будет различаться в разы.
Спрашивается – какую из этих величин нужно указать при описании энергии связи этой конструкции?
Естественно, правильным будет указать обе величины со ссылкой на метод. Такая запись является оператором, что по отношению к тензорным взаимодействиям не является неожиданностью.
Сознательно исключив из своего инструментария магнитные связи, теоретики создали себе ворох проблем, которые постепенно завели химию в электрический тупик.
Основы кластерных взаимодействий
Отвлечемся временно от взаимодействия водорода и кислорода, и обратимся к поведению облаков различного происхождения и качества.
Все обращали внимание как в воздухе случайно образовавшиеся маленькие облачка и струйки дыма имеют тенденцию к сохранению своей текучей целостности, которая удерживается какими-то слабыми и податливыми силами.
Что это за силы? А всё те же: гравитационные, инерционные, электрические и магнитные. Почему же мы ничего не знаем о дисперсионном проявлении этих сил? Потому, что к этим силам не смогли применить математику, по причине кардинального несоответствия истинно природных молекул и их математической идеализации абсолютно круглыми упругими шариками.
Горение гремучего газа, применительно к кластерным образованиям
Феномен моментальной магнитной инверсии
Не будем прибегать к услугам произвольных допущений, а вспомним курс магнетизма, преподаваемого в средней школе. А еще вспомним свойства группового тока, создаваемого электронной оболочкой сомкнутых в молекулу атомов кислорода, из нашего примера выше.
Из школьного курса известно, что при намагничивании и перемагничивании ферромагнетиков четко фиксируются акустические щелчки. В свое время, некий авторитет описал процесс намагничивания как процесс скачкообразного поворота кристаллических доменов под действием стороннего поля намагничивания. Идея очень сомнительная, если не сказать вздорная. С тех пор, как идея была озвучена, микроскопы достигли разрешения, способного рассмотреть поворачивающиеся домены, но поворотов никто не обнаружил. Однако с тех пор ничего другого предложено не было.
Попытаемся исправить положение.
Если снять жестяную консервную крышку с бомбажной (вздувшейся) стеклянной банки, то эта крышка сохранит свою выпуклость. Нажав на выпуклость с некоторым, довольно энергичным усилием, можно продавить её в другую сторону, и она опять будет сохранять это новое состояние. Процесс изменения направления выпуклости происходит скачкообразно и сопровождается акустическим хлопком. Нечто отдаленно похожее происходит в напряженном кристалле ферромагнетика. Кристалл меняет свой прогиб, издавая акустический щелчок. При этом чуть-чуть изменяется геометрия кристалла и одновременно меняется набег фазы в пучности группового тока, формирующего магнитный момент кристаллического домена. Набег фазы вызывает мгновенную смену направления магнитного поля данного домена. Не надо забывать, что мы имеем дело не просто с токами, создающими магнитное поле, а с групповыми токами, законы поведения которых отличны от тех, к которым мы привыкли. Для смены направления тока не требуется смены направления напряжения питания, достаточно ничтожного изменения какого-нибудь параметра, которое (изменение) чуть-чуть изменит относительную фазу возвращения электронов на контур группового тока.
Таким образом, наше гипотетическое предположение о магнитной химической связи на основе группового эффекта приобрело реальное подтверждение, домены магнитов действительно щелкают, но при этом не кувыркаются в пространстве, а только меняют на 180; направление своего магнитного поля в соответствии с направлением механического напряжения (разновидность пьезо-эффекта).
У нас есть возможность экспериментального подтверждения данной концепции.
Если в официальной модели величина поворота домена не предсказуема, то в предлагаемой модели поворот строго определен и равен 180;. Кроме того, по мере увеличения поля намагничивания, количество доменов, сменивших знак, должно строго соответствовать увеличению проекции внешнего поля на магнитную ось домена. В случае официальной модели строгой зависимости быть не может, т.к. усилие поворота каждого домена будет различным.
Теперь нам нужно распространить этот принцип на молекулярный магнитный момент, а затем проверить полученные выводы.
Процесс горения кислорода в водороде
Что происходит в момент сгорания кислорода в водороде?
В исходной молекуле кислорода, результирующие силы магнитных моментов и моментов наведенных диполей двух атомов кислорода слабо притягивают атомы друг к другу, причем электрические силы, скорее всего, являются силами отталкивания.
Как только к молекуле кислорода с одного конца присоединятся два атома водорода (молекула водорода), характер движения электронов в оболочке кислорода существенно и резко изменится, в результате чего магнитный момент группового тока тоже изменится непредсказуемо. В общем случае это изменение трудно предсказуемо. Мы же должны предположить, что магнитный момент сменит знак, и к тому же еще и усилится. В результате атомы молекулы кислорода, ставшие основой для двух молекул воды, сразу оттолкнутся, реализуя тем самым процесс взрыва (или горения) кислорода в водороде.
Механизм взрыва гремучего газа