Что образуется при трансляции белка
Трансляция (биология)
Трансляция — процесс синтеза белков из аминокислот, катализируемой рибосомой на матрице матричной (информационной) РНК (мРНК или иРНК). Трансляция является одной из стадий процесса биосинтеза белков, в свою очередь части процесса экспрессии генов.
Трансляция происходит в цитоплазме, где находятся рибосомы клетки. Во время трансляции, информация, содержащаяся в мРНК, расшифровывается согласно правилам, известными как генетический код, и используется для синтеза закодированной полипептидной последовательности. Процесс трансляции можно разделить на четыре фазы: активацию, инициацию, элонгацию и терминацию.
При активации, соответствующая аминокислота (аа) присоединяется к соответствующей транспортной РНК (тРНК). Хотя эта стадия часто рассматривается отдельно от трансляции, она необходима для ее начала. Связана с аминокислотой тРНК называется аминоацил-тРНК или «заряженной» тРНК. При инициации имела субъединица рибосомы связывается с 5′-концом мРНК с помощью факторов инициации (IF), других белков, помогают процессу. Элонгация происходит, когда очередная аминоацил-тРНК используется для увеличения полипептидной цепочки. Терминация происходит, когда рибосома встречает стоп-кодон (UAA, UAG или UGA), для которого не существует соответствующей тРНК, при этом происходит освобождение полипептидной цепочки.
Механизм трансляции
Общие сведения
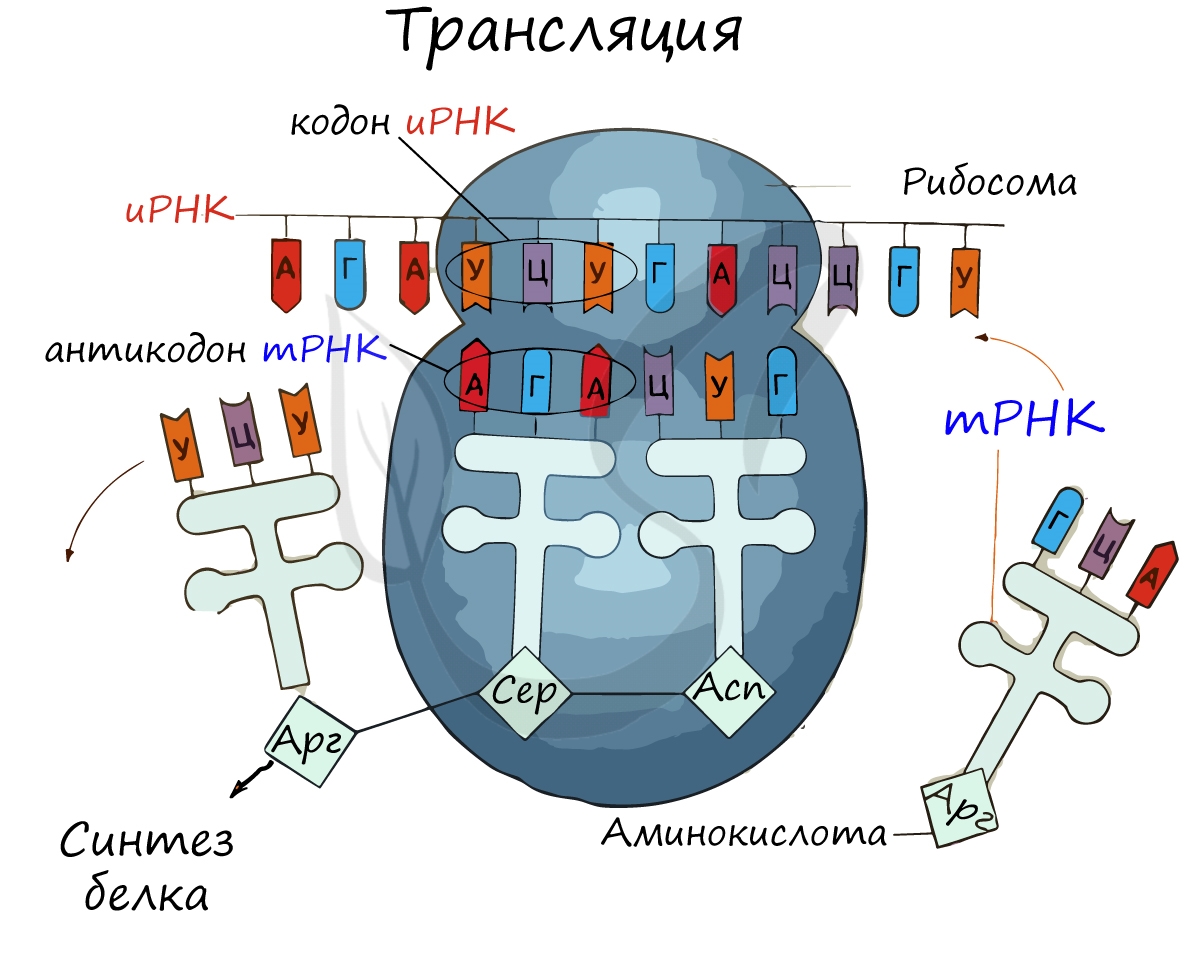
Для осуществления процесса трансляции в клетках всех без исключения организмов существуют специальные органеллы — рибосомы. Рибосомы являются рибонуклеопротеиднимы комплексами, построенными из 2 субъединиц: большой и малой. Функция рибосом заключается в распознавании тринуклеотидних кодонов мРНК, подбор соответствующих им аминокислот и присоединении этих аминокислот к белковой цепочки, что растет. Двигаясь вдоль молекулы мРНК, рибосома распознает кодон за кодоном и синтезирует белок в соответствии информации, заложенной в молекуле мРНК.
Для распознавания аминокислот в клетке существуют специальные «адаптеры», молекулы транспортной РНК (тРНК). Эти молекулы, имеющие форму клеверного листа, имеют участок (антикодон), комплементарную кодона мРНК, и другой участок, к которому присоединяется аминокислота, соответствующая этому кодона. Присоединение аминокислот к тРНК осуществляется в екзоенергетичний реакции ферментами аминоацил-тРНК-синтетазами, а молекула, получаемая в результате, называется аминоацил-тРНК. Таким образом, специфичность трансляции определяется взаимодействием между кодоном мРНК и антикодоном тРНК, а также специфичностью аминоацил-тРНК-синтеназ, что присоединяют аминокислоты строго к соответствующим им тРНК (например, кодона GGU отвечать тРНК, содержит антикодон CCA, а к этой тРНК будет присоединяться только аминокислота глицин).
Механизмы трансляции прокариот (бактерий и архей) и эукариот существенно отличаются, поэтому многие вещества, подавляющие прокариотических трансляцию, в значительно меньшей степени действуют на трансляцию эукариотических организмов, что позволяет использовать их в медицинской практике как антибактериальные средства, безопасные для организма млекопитающих.
Поскольку каждый кодон содержит три нуклеотида, один и тот же генетический «текст» можно прочитать тремя разными способами (начиная с первого, второго и третьего нуклеотидов), то есть в трех разных рамках считывания. По некоторым интересными исключениями, значимой является информация, закодированная только в одной рамке считывания. По этой причине крайне важным для синтеза белка рибосомой является ее правильное позиционирование на стартовом AUG-кодоне — при инициации трансляции.
Механизм трансляции прокариот
Инициация
Синтез белка всегда начинается с AUG-кодона, также кодирует метионин. Этот кодон обычно называют стартовым или инициаторним. Инициация трансляции предусматривает узнавание рибосомой этого кодона и привлечение инициаторной аминоацил-тРНК. Для инициации трансляции необходимо также наличие определенных нуклеотидных последовательностей в районе стартового кодона. Существование последовательности, отличающей стартовый AUG от внутренних, совершенно необходимо, поскольку иначе инициация синтеза белка происходила бы хаотично на всех AUG-кодонов.
Процесс инициации обеспечивается специальными белками — факторами инициации (англ. Initiation factors, сокращенно IF).
Малая рибосомная субъединица (30S) прокариот, если она не вовлечена в это время в трансляцию, существует в комплексе с факторами инициации IF1, IF3 и, в некоторых случаях, IF2:
Комплекс 30S субъединицы с инициаторным факторами способен распознавать специальные последовательности мРНК, так называемые участки связывания рибосомы (англ. Ribosomt-binding site или RBS). Эти участки содержат, во-первых, инициаторний кодон AUG и, во-вторых, специальную последовательность Шайн-Дальгарно, с которой комплементарно связывается рибосомная 16S РНК. Последовательность Шайн-Дальгарно служит для того, чтобы отличить инициаторным AUG от внутренних кодонов, кодирующих метионин. После того, как 30S-субъединица связалась с мРНК, к ней привлекается инициаторным аминоацил-тРНК и IF2, если они еще не были включены в комплекс. Затем присоединяется 50S-субъединица, происходит гидролиз ГТФ и диссоциация факторов инициации. Собранная рибосома начинает синтезировать полипептидную цепочку.
Элонгация
Элонгация полипептидной цепочки заключается в добавлении новых аминокислот к карбоксильного (C-) конца цепочки, растет. Этот полипептидную цепочку выходит из рибосомы через выходной туннель в большой субъединицы.
Элонгация начинается, когда метилированных аминоацил-тРНК связывается с участком P, приводит к конформационной изменения комплекса, открывает участок A для связывания новой аминоацил-тРНК. Это связывание облегчается фактором элонгации Tu (EF-TU), малой ГТФазою. В этот момент участок P содержит начало полипепдидного цепочки, синтезируется, а участок A содержит следующую аминокислоту, которая должна быть добавлена к цепочке. После этого полипептид отделяется от тРНК в области P и пептидный связь формируется между последней аминокислотой полипептида и аминокислотой, все еще присоединена к тРНК в области A. Этот процесс, известный как образование пептидной связи, катализируемой рибозимов, пептидилтрансферазою, такая активность присуща к 23S рРНК большой (50S) рибосомной субъединицы. После образования пептидной связи, участок A содержит полипептид, тогда как участок P содержит незаряженную тРНК (тРНК без аминокислоты).
На конечной стадии элонгации, рибосома перемещается на три нуклеотида в направлении 3 ‘конца мРНК. Так что тРНК связанные с мРНК за счет спаривания кодон-антикодон, тРНК движется относительно рибосомы, двигая полипептид с участка A в область P, а незаряженная тРНК перемещается в область выхода (участок E). Этот процесс катализируется фактором элонгации G (EF-G).
Рибосомы продолжает транслировать кодоны оставшиеся потому что новые аминоацил-тРНК звьязуютьться с участком A, пока рибосома не встретит кодон остановки на мРНК (UAA, UGA или UAG).
Терминация и переработка
Терминация происходит, когда один из трех стоп-кодонов перемещается в область A. Эти кодоны не имеют соответствующих тРНК. В свою очередь, их признают специальные белки — факторы терминации (англ. Release factors, RF), а именно RF1 (распознающий стоп-кодоны UAA и UAG) или RF2 (распознающий стоп-кодоны UAA и UGA). Третий фактор освобождения RF-3 катализирует освобождение RF-1 и RF-2 в конце процесса терминации. Эти факторы катализируют гидролиз эфирной связи, связывающей тРНК с пептидом, и высвобождение недавно синтезированного белка с рибосомы.
Пост-терминационного комплекс, сформированный после терминации, состоит из мРНК со стоп-кодоном в области A рибосомы и тРНК. Шаг переработки рибосомы отвечает за разборку пост-трансляционного рибосомного комплекса. Как только протеин, который синтезируется, освобождается после терминации, факторы переработки рибосомы и фактор элонгации EF-G освобождают мРНК и тРНК с рибосомы и разъединяют 70S рибосомы на 30S и 50S субъединицы. IF-3 также помогает процессу переработки, предотвращая повторное связывание субъединиц за счет связывания с 30S субъединицей. Этот процесс готовит рибосому для повторения цикла трансляции.
Полисомы
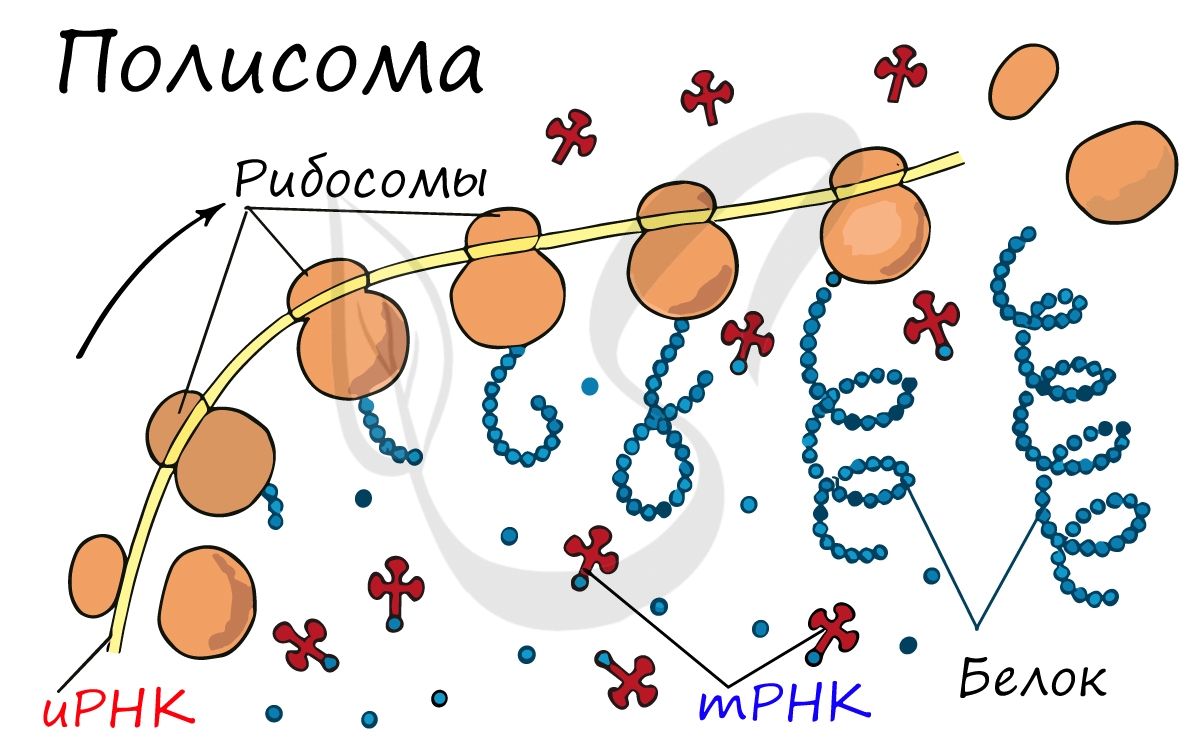
Трансляция обычно осуществляется более чем одной рибосомой одновременно. Из-за относительно большой размер рибосом, они могут связываться с участками мРНК на расстоянии не менее 35 нуклеотидов. Несколько рибосом и молекула мРНК, по которой они движутся, называются полисомы или полирибосомами.
Механизм трансляции эукариот
Кэп-зависимая инициация
С помощью этого механизма транслируется подавляющее число эукариотических мРНК. Белки, участвующие в процессах инициации трансляции у эукариот называют eIF (англ. Eukaryotic Initiation Factors — эукариотические факторы инициации). Кроме факторов инициации eIF1, eIF2 и eIF3, связывающиеся с малой рибосомной субъединицей (40S), и по своим функциям приблизительно аналогичными соответствующим белкам прокариот, эукариоты имеют еще две группы факторов инициации: семейство факторов, связывающих мРНК — eIF4 и семейство факторов, связываются с большой (60S) субъединицей рибосомы, eIF5. Ниже приведен список основных факторов:
На первом этапе инициации трансляции имела субъединица рибосомы в комплексе с факторами инициации eIF4G, eIF4B, eIF4E и инициаторным тРНК присоединяется к 5′-концу мРНК за счет способности eIF4E связывать кэп-структуру, а белка eIF3 — мРНК. Затем белок eIF4B привлекает геликазу eIF4A, и та начинает расплетать мРНК в направлении к 3′-концу, что сопровождается затратами энергии в форме молекул АТФ. За счет работы этого белка, 40S субъединица освобождается от белков eIF4G и eIF4E, и в комплексе с факторами инициации оставшиеся движется по мРНК к инициаторным кодона AUG, где происходит диссоциация факторов инициации, остались, и привлечение 60S-субъединицы рибосомы с помощью eIF5, после чего начинается синтез полипептидной цепочки.
Кэп-независимая инициация
Тогда как в большинстве случаев эукарио трансляция требует наличия кэпа на 5 ‘конце мРНК, некоторые вирусные и клеточные мРНК обходят кэп-зависимый механизм за счет инициации трансляции на определенных последовательностях внутри молекулы РНК.
Лучше исследованным (но далеко не единственным) примером кэп-независимой трансляции у эукариот является так называемая «внутренняя участок входа рибосомы» (англ. Internal Ribosome Entry Site или IRES). В отличие от кэп-зависимого механизма, кэп-независимый механизм также не требует сканирования рибосомой от 5′-конца рибосомы в стартовый кодона. Рибосомы могу быть доставлена в стартовой участки IRIS с помощью ITAFьив, (IRES trans-acting fantors), позволяющие обходить необходимость сканирования от 5′-конца РНК.
Этот метод трансляции был найден относительно недавно, и необходимо в условиях, которые требуют трансляции определенных мРНК в стрессовых условиях, когда общая эффективность трансляции уменьшена. Примеры включают факторы, вызывающие апоптоз, иммуноглобулины, некоторые факторы роста. Кроме того, этим механизмом иногда пользуются вирусы.
Элонгация
Элонгация трансляции эукариот очень похожа на элонгации трансляции прокариот. Основными факторами элонгации являются:
Терминация
У эукариот существует только один фактор высвобождения, eRF, вместо трех факторов прокариот. Однако, в целом процесс терминации подобен процессу терминации прокариот.
Трансляция вручную
Принцип
Для определения полипептидной последовательности возможно провести процесс переложения последовательности ДНК в последовательность аминокислот, так называемую «трансляцию вручную» (для коротких последовательностей) или трансляцию на компьютере. На первом этапе необходимо перевести последовательность ДНК в последовательность РНК, заменяя нуклеотиды A, T, C, G в ДНК на U, A, G, C в РНК, соответственно.
Затем РНК разбивается на тринуклеотидних последовательности (кодоны). Отметьте, что существует 3 «рамки считывания», или способы интерпретации кода в зависимости от того, на каком нуклеотиде начнется трансляция.
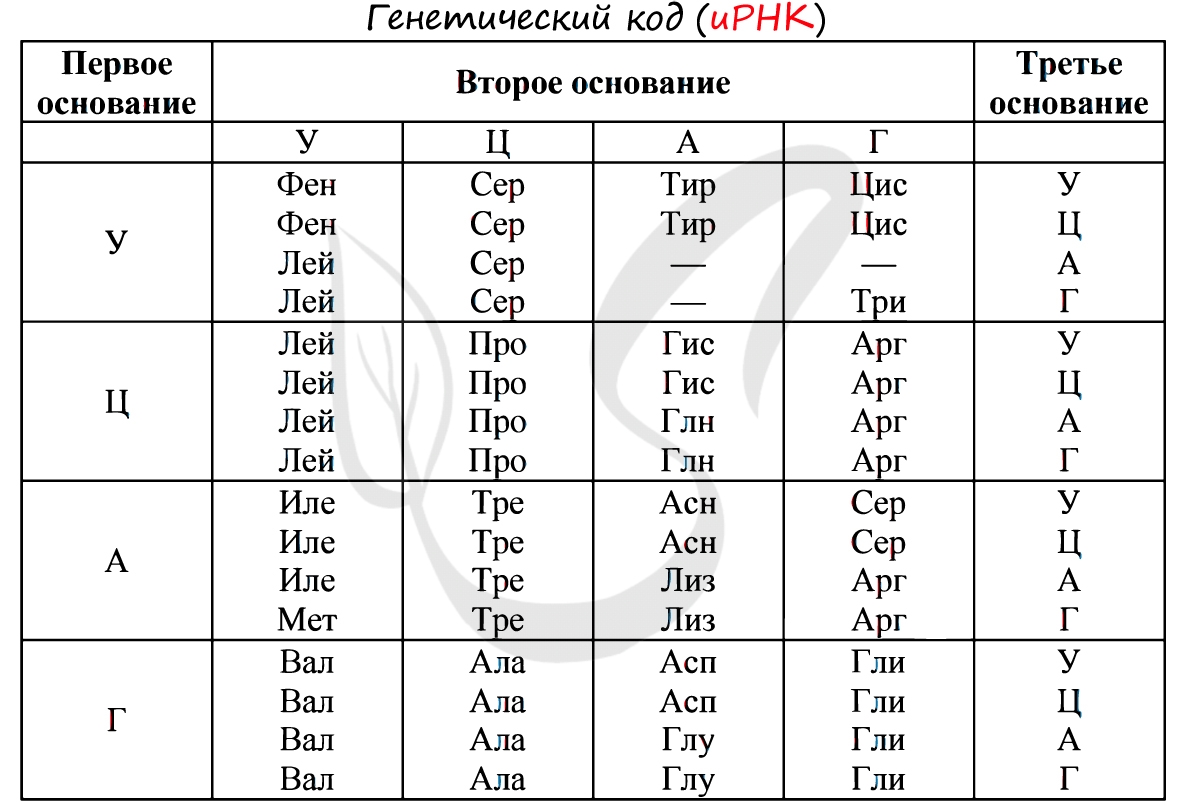
Наконец, используется так называемая «таблица трансляции» для перевода каждого кодона в соответствующую аминокислоту. В результате получается первичная структура белка.
Однако, белок также имеет структуру высшего порядка (вторичную, третичную и четвертную) или конформацию, которая определяется наличием гидрофобных и электростатических взаимодействий между частями полипептидной цепочки. Тогда как вторичная структура (структура «доменов» — коротких участков белка) еще может буди предусмотрена с помощью последовательности, надлежащая третичная структура обычно тяжелая для определения теоретически, и даже в природе выбор третичной структуры часто зависит от взаимодействия с другими белками.
Трансляция вручную в некоторых случаях также не дает правильной аминокислотной последовательности природного белка, в частности, если кодируется нестандартная аминокислота, например селенцистеин, который кодируется с помощью обычного стоп-кодона в сочетании с «шпилькой», расположенной дальше в последовательности (последовательность вставки селеноцистеина, Selenocysteine Insertion Sequence или SECIS).
Таблицы трансляции
Для большинства эукариот обычно используется стандартная таблица трансляции, в которой каждой аминокислоте соответствует одна или несколько последовательностей ДНК:.
Не все организмы используют одинаковый генетический код. Даже работая с генетическими последовательностями обычных эукариотических организмов, например дрожжей, часто желательно использовать альтернативные таблицы трансляции — а именно для транслиции митохондриальных генов. Сейчас группа таксономии NCBI определяет следующие таблицы для последовательностей, содержит GenBank:
Компьютерная трансляция
Существует много компьютерных программ, способных к трансляции последовательности ДНК / РНК в белковую последовательность. Однако, немного программ способны выдавать правильную последовательность во всех «особых» случаях, таких как использование альтернативных инициаторных кодонов. Например редкий код альтернативного кодона инициации TTG используется для метионина, когда используется как инициаторным кодон, и для лейцина в остальных случаях.
Транскрипция и трансляция
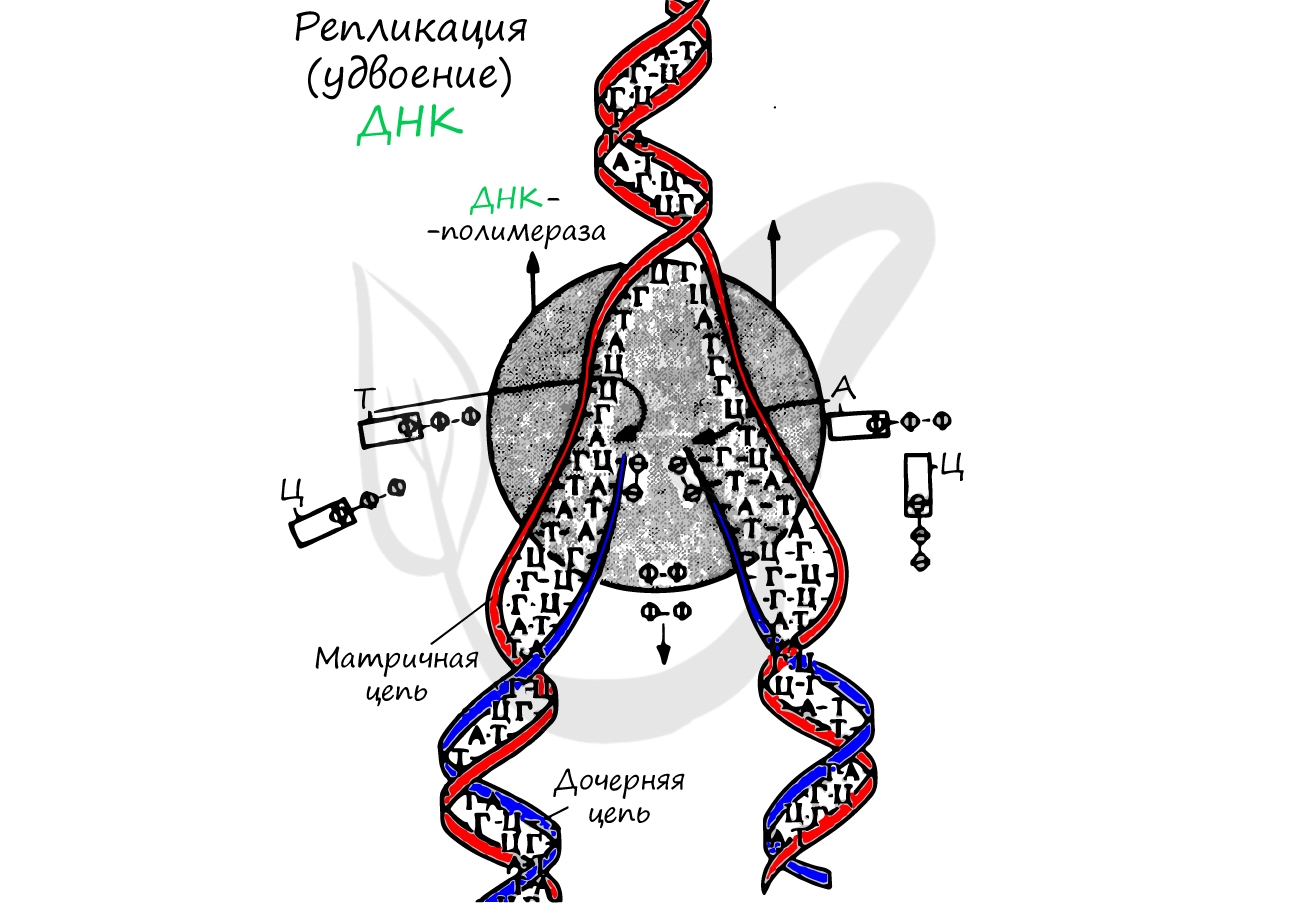
Удвоение ДНК происходит в синтетическом периоде интерфазы. При этом общее число хромосом не меняется, однако каждая из них содержит к началу деления две молекулы ДНК: это необходимо для равномерного распределения генетического материала между дочерними клетками.
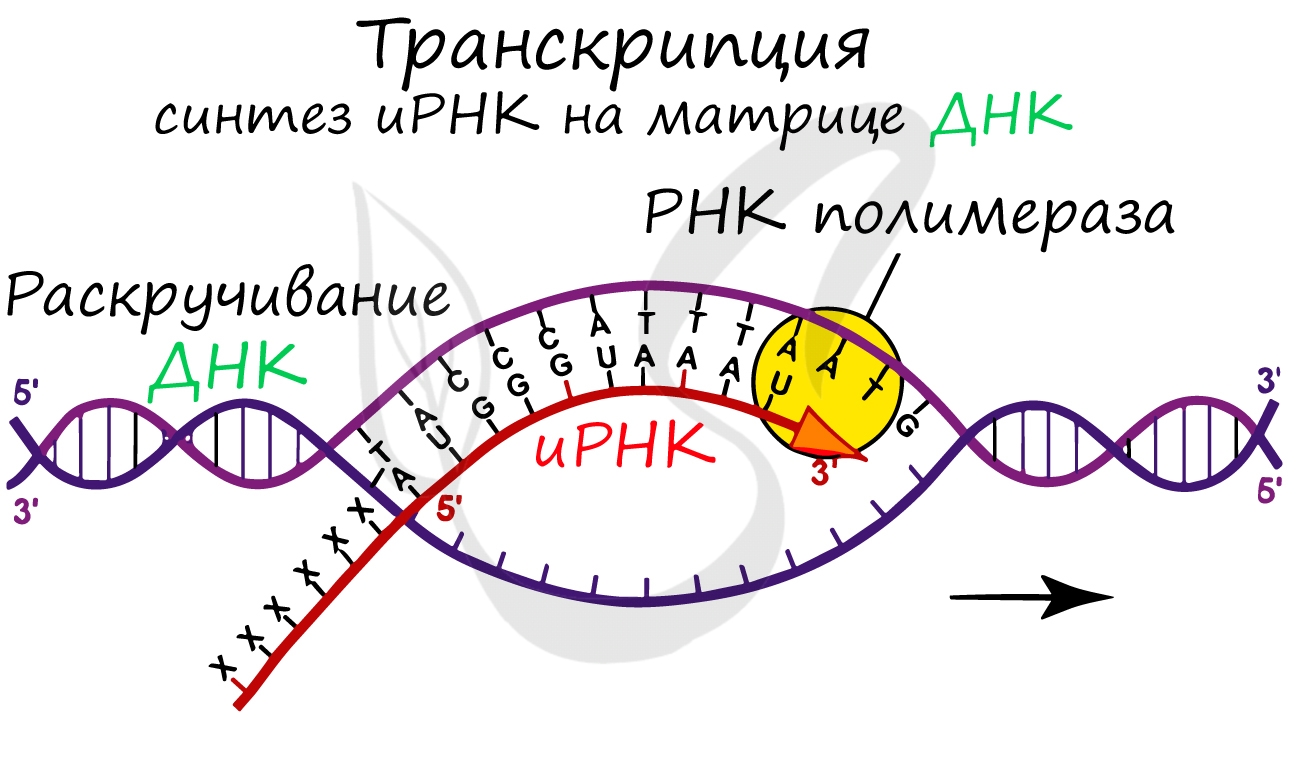
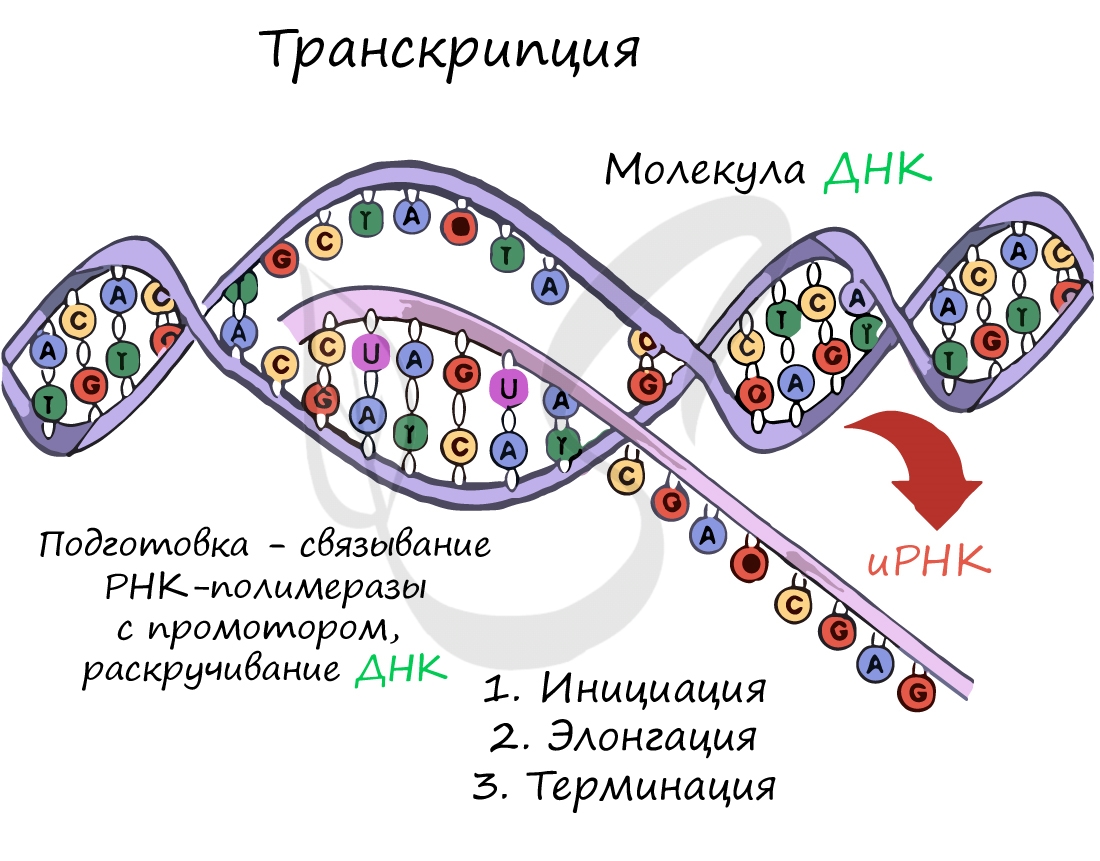
Транскрпиция (лат. transcriptio — переписывание)
Образуется несколько начальных кодонов иРНК.
Нити ДНК последовательно расплетаются, освобождая место для передвигающейся РНК-полимеразы. Молекула иРНК быстро растет.
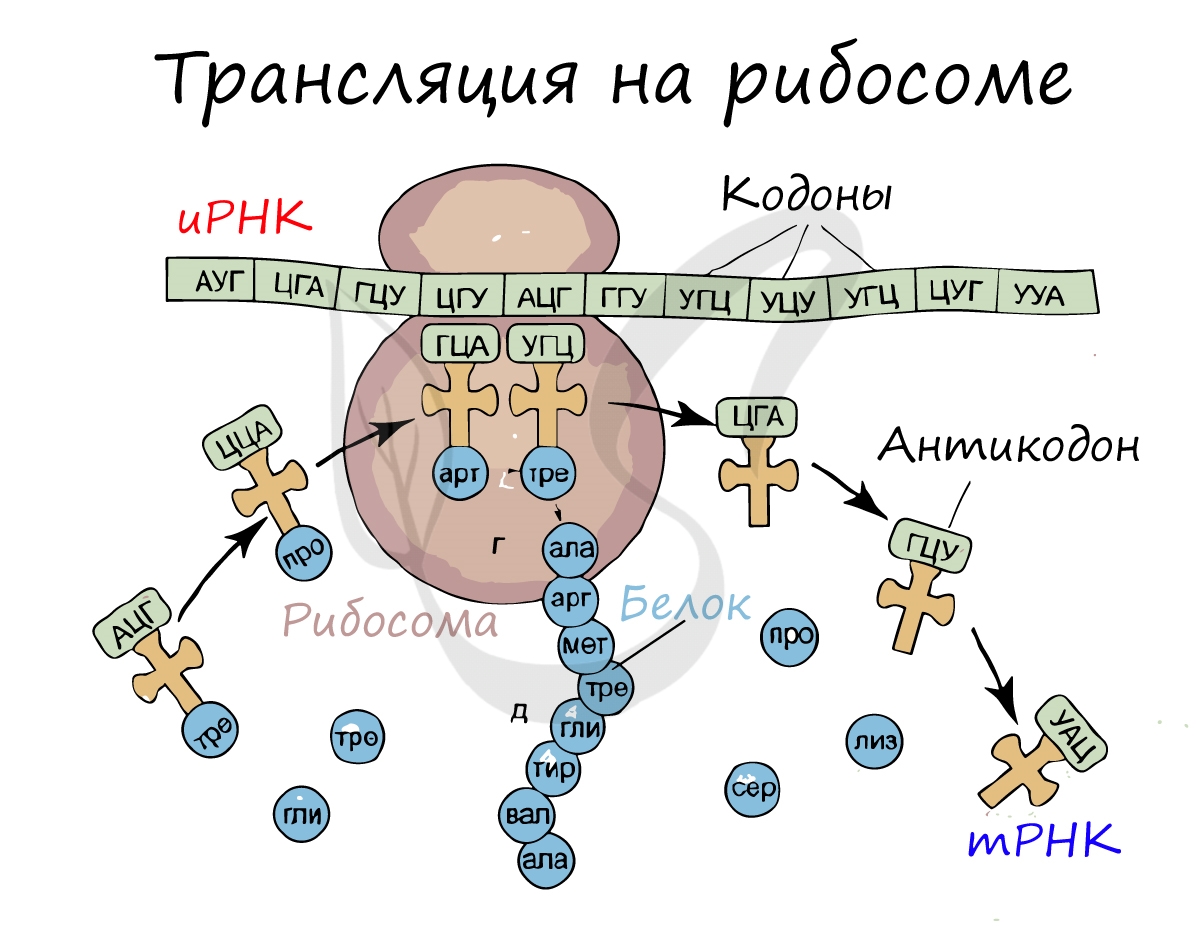
Трансляция (от лат. translatio — перенос, перемещение)
Рибосома делает шаг, и иРНК продвигается на один кодон: такое в фазу элонгации происходит десятки тысяч раз. Молекулы тРНК приносят новые аминокислоты, соответствующие кодонам иРНК. Аминокислоты соединяются друг с другом: между ними образуются пептидные связи, молекула белка растет.
Примеры решения задачи №1
Без практики теория мертва, так что скорее решим задачи! В первых двух задачах будем пользоваться таблицей генетического кода (по иРНК), приведенной вверху.
«Фрагмент цепи ДНК имеет следующую последовательность нуклеотидов: ЦГА-ТГГ-ТЦЦ-ГАЦ. Определите последовательность нуклеотидов во второй цепочке ДНК, последовательность нуклеотидов на иРНК, антикодоны соответствующих тРНК и аминокислотную последовательность соответствующего фрагмента молекулы белка, используя таблицу генетического кода»
По принципу комплементарности мы нашли вторую цепочку ДНК: ГЦТ-АЦЦ-АГГ-ЦТГ. Мы использовали следующие правила при нахождении второй нити ДНК: А-Т, Т-А, Г-Ц, Ц-Г.
Вернемся к первой цепочке, и именно от нее пойдем к иРНК: ГЦУ-АЦЦ-АГГ-ЦУГ. Мы использовали следующие правила при переводе ДНК в иРНК: А-У, Т-А, Г-Ц, Ц-Г.
Зная последовательность нуклеотидов иРНК, легко найдем тРНК: ЦГА, УГГ, УЦЦ, ГАЦ. Мы использовали следующие правила перевода иРНК в тРНК: А-У, У-А, Г-Ц, Ц-Г. Обратите внимание, что антикодоны тРНК мы разделяем запятыми, в отличие кодонов иРНК. Это связано с тем, что тРНК представляют собой отдельные молекулы (в виде клеверного листа), а не линейную структуру (как ДНК, иРНК).
Пример решения задачи №2
«Известно, что все виды РНК синтезируются на ДНК-матрице. Фрагмент цепи ДНК, на которой синтезируется участок центральной петли тРНК, имеет следующую последовательность нуклеотидов: ТАГ-ЦАА-АЦГ-ГЦТ-АЦЦ. Установите нуклеотидную последовательность участка тРНК, который синтезируется на данном фрагменте, и аминокислоту, которую будет переносить эта тРНК в процессе биосинтеза белка, если третий триплет соответствует антикодону тРНК»
Пример решения задачи №3
Длина фрагмента молекулы ДНК составляет 150 нуклеотидов. Найдите число триплетов ДНК, кодонов иРНК, антикодонов тРНК и аминокислот, соответствующих данному фрагменту. Известно, что аденин составляет 20% в данном фрагменте (двухцепочечной молекуле ДНК), найдите содержание в процентах остальных нуклеотидов.
Теперь мы украсили теорию практикой. Что может быть лучше при изучении новой темы? 🙂
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Трансляция
К сожалению, список литературы отсутствует.
Генетический код
К сожалению, список литературы отсутствует.
Трансляция у эукариот
К сожалению, список литературы отсутствует.
Трансляция у прокариот
Инициация
30S преинициаторный комплекс состояций из 30S рибосомной субъединицы, трех инициаторных факторов, mRNA в стартовой позиции, где fMet-tRNAf Met связана кодон независимо. Такой относительно нестабильный комплекс подвергается конформационному изменению, что обеспечивает кодон-антикодон взаимодействие и формирует более стабильный 30S инициаторный комплекс. Инициаторные факторы IF1 и IF3 отсоединяются, тогда как IF2 фактор стимулирует взаимодействие с 50S рибосомной субъединицей. После сборки рибосомы IF2 покидает комплекс. Во время этого процесса GTP связанный с IF2 гидролизуется до GDP и Pi. Вновь образованный 70S инициаторный комплекс, содержащий fMet-tRNAf Met как субстрат для пептидилтрансферазного центра 50S рибосомной субъединицы готов к вступлению в фазу элонгации трансляции.
Этапы инициации трансляции
1. Факторы инициации IF-1 и IF-3 связываются с 30S-субчастицей, что обеспечивает ее взаимодействие с IF-2, инициаторной формилметиониновой-тРНК (Fmet-тРНКF Met ) и GTP.
2. При связывании инициаторных белков IF-1 и IF-2 с 30S-субчастицей происходит диссоциация 70S-рибосомы на две субъединицы.
3. Комплекс 30S-субъединицы со всеми факторами инициации и Fmet-тРНКF Met связывается с 5′-концом мРНК вблизи кодона AUG и узнает. AUG-кодон мРНК.
Связывание 30S-субчастицы с мРНК находится под строгим контролем нуклеотидной последовательности, расположенной примерно
за 10 нуклеотидов до 5′-конца инициаторного кодона. Взаимодействию способствует комплементарное спаривание этой богатой пуринами по следовательности из 5-8н, называемой последовательностью Шайна-Дальгарно, с полипиримидиновым участком, находящимся вблизи 3′-конца 16S-pPHK.
4. Формирование полноценного функционального комплекса инициации завершается ассоциацией 50S-субчастицы с преинициаторным комплексом. При ассоциации 70S-рибосомы образуются два активных центра: Р- и А-участки. Fmet-TPHKF Met занимает Р-участок.
5. С образованием функциональной 70S-субчастицы отделяются все три белка инициации.
Элонгация
2. Когда оба участка, А и Р, заняты, пептидилтрансферазная активность 50S-субчастицы катализирует перенос группы Fmet с ее тРНК на аминогруппу аминоацил-тРНК, находящейся в А-участке. В результате в А-участке оказывается дипептидил-тРНК, а в Р – свободная тРНК.
3. тРНК освобождает Р-участок, образовавшаяся дипептидил-тРНК переместиться на него, а новый кодон должен быть готов к тому, чтобы занять освободившийся А-участок. Все эти процессы
осуществляются с помощью EF-G при GTP-зависимой транслокации рибосомы.
4. Теперь новый кодон, занявший А-сайт, готов к спариванию с родственной аминоацил-тРНК. Сразу после связывания аминоацил-тРНК с А-
участком высвобождается комплекс EF-Tu-GDP и происходит регенерация функционально активного EF-Tu-GTP. При этом EF-Tu-GDP взаи- модействует с белком EF-Ts, что приводит к отделению GDP и образованию комплекса EF-Tu•EF-Ts. Далее EF-Tu•EF-Ts взаимодействует с GTP, происходит регенерация EF-Tu-GTP и отделение EF-Ts, и оба соединения оказываются готовыми к следую- щему циклу.
Для прочтения следующего кодона и удлинения полипептидной цепи еще на одну аминокислоту вся серия реакций должна повториться.
При образовании каждой пептидной связи расходуется энергия, равная четырем энергетическим эквивалентам (если за один эквивалент принять энергию образования фосфатной связи): два эквивалента АТР потребляются при аминоацилировании тРНК и два эквивалента GTP-
в каждом цикле элонгации.
2. При инициации трансляции IF-2 узнает Fmet-тРНКFMet среди всех других аминоацил-тРНК, a EF-Tu отличает met-тРНКF Met от
Fmet-тРНКM Met при внедрении в А-участок.
3. Факторы элонгации EF-Tu и EF-G то присоединяются, то отделяются от рибосомы в зависимости от того, связаны ли они с GTP или с GDP соответственно.
4. Растущая полипептидная цепь всегда соединена своим карбоксильным концом с тРНК, которая соответствует С-концевой аминокислоте в растущей полипептидной цепи.
5. Пептидилтрансфераза катализирует формирование пептидных связей между карбоксильным концом растущей цепи и аминогруппой аминоацил-тРНК.
Терминация
Факторы терминации:
RF-1 вызывает отделение полипептидной цепи при считывании кодонов UAA и UAG;
RF-2 действует аналогичным образом при считывании UAA и UGA,
EF-3 может облегчить работу двух других факторов.
Этапы терминации трансляции:
1. В А-участке оказывается один из трех терминирующих кодонов – UAG, UAA или UGA. Из-за отсутствия тРНК, отвечающих этим кодонам,полипептидил-тРНК остается связанной с Р-участком.
2. RF-1 и RF-2 катализируют отсоединение полипептидной цепи от тРНК, отделение их обоих от рибосомы, а 70S-рибосомы – от мРНК.
RF-1 узнает в А-участке кодон UAA или UAG; RF-2 включается в том случае, когда в А-участке оказы-вается UAA или UGA;
RF-3 облегчает работу двух других факторов. Если терминирующим кодономявляется UAA, то эффективность процесса терминации оказывается наибольшей, поскольку этот кодон узнают оба фактора – RF-1 и RF-2. Однако, каким бы из стоп-кодонов ни обеспечивалась терминация,ее эффективность зависит от фланкирующих эти кодоны последовательностей в мРНК.
Биология. 11 класс
§ 24-1. Трансляция. Созревание белков
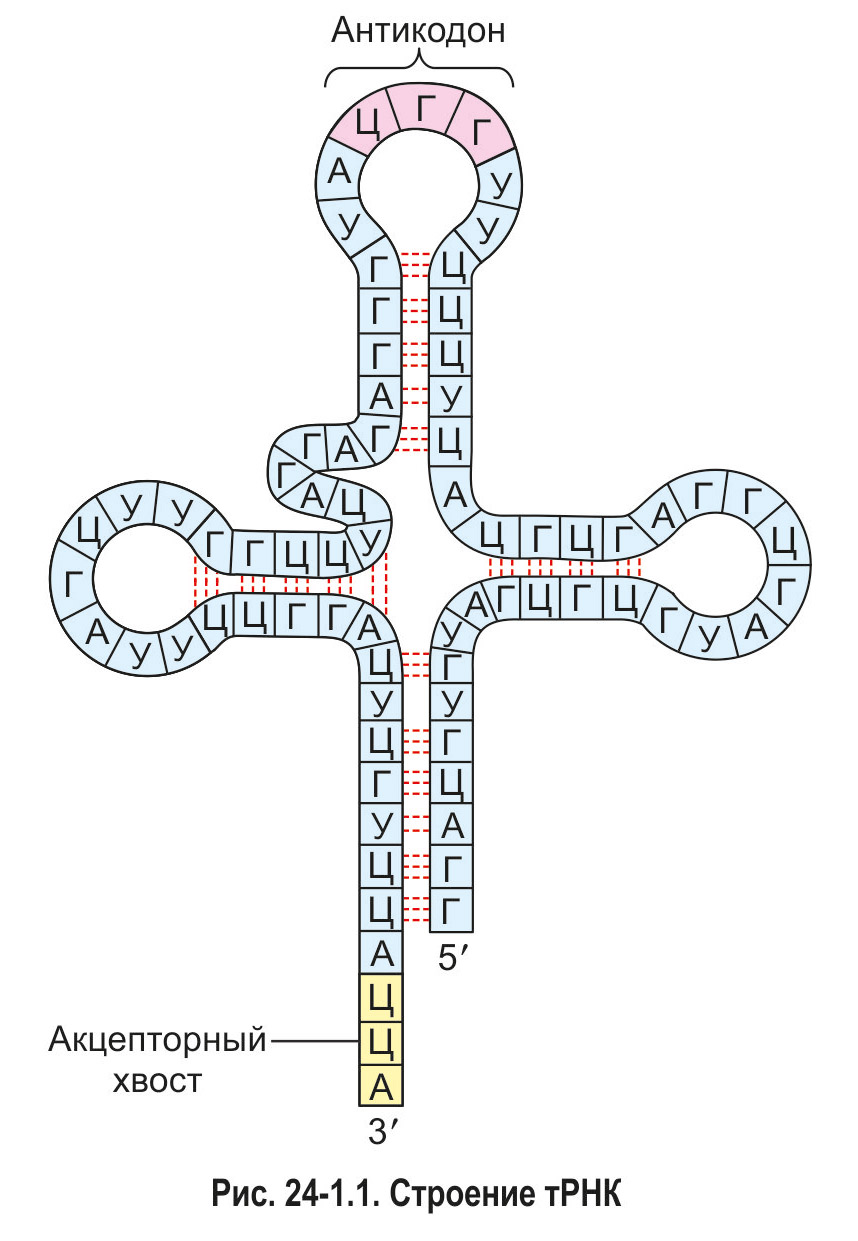
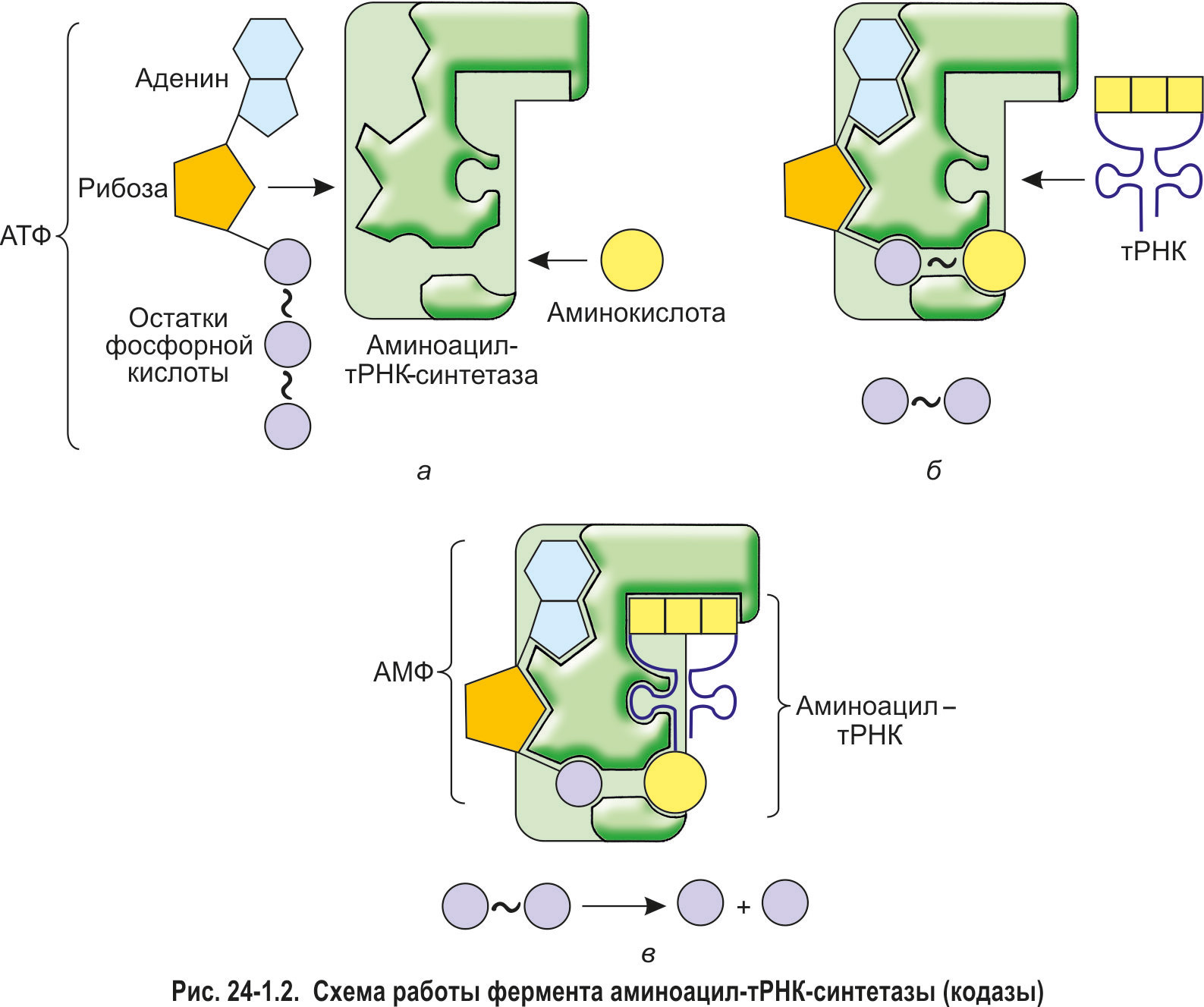
*Аминокислота способна присоединиться к акцепторному хвосту тРНК только в том случае, если она была предварительно активирована энергией, выделившейся при расщеплении одной молекулы АТФ. Активацию аминокислот и их последующее связывание с молекулами тРНК осуществляют ферменты аминоацил-тРНК-синтетазы (кодазы). При этом для каждой из 20 белокобразующих аминокислот существует особая кодаза. Она способна отличить данную аминокислоту от других аминокислот, связаться с ней, активировать и присоединить к тРНК, имеющей соответствующий антикодон.
Сначала в активный центр аминоацил-тРНК-синтетазы поступают аминокислота и молекула АТФ (рис. 24-1.2, а). Происходит расщепление АТФ до АМФ. При этом высвобождается энергия, которая идет на формирование макроэргической связи между аминокислотой и АМФ. Образуется богатый энергией комплекс «аминокислота
АМФ», аминокислота в его составе уже активирована. Это значит, что она обладает запасом энергии для того, чтобы присоединиться к тРНК, а затем, уже в рибосоме, образовать пептидную связь с другой аминокислотой.
Далее с активным центром кодазы связывается молекула тРНК (рис. 24-1.2, б). Активированная аминокислота отрывается от АМФ и присоединяется к акцепторному хвосту тРНК (рис. 24-1.2, в). АМФ и соединение «аминокислота—тРНК» (аминоацил-тРНК) покидают активный центр кодазы. Описанные процессы можно выразить суммарным уравнением (для упрощения не указаны молекулы воды, необходимые для гидролиза АТФ):
*Образовавшиеся аминоацил-тРНК транспортируются к рибосомам, где и происходит трансляция. Синтез белков у прокариот и эукариот осуществляется сходным образом, основными этапами трансляции являются инициация, элонгация и терминация. Рассмотрим эти этапы на примере синтеза белка в эукариотической клетке.
1. Инициация. К малой субъединице рибосомы присоединяется мРНК. Как вы знаете, 5′-конец этой молекулы содержит особую нуклеотидную последовательность, необходимую для правильного связывания с рибосомой. Поэтому прикрепление мРНК к малой субъединице происходит именно в области 5′-конца вблизи стартового кодона АУГ. Этот триплет кодирует аминокислоту метионин.
К стартовому кодону с помощью своего антикодона комплементарно присоединяется тРНК, несущая метионин, — так называемая инициаторная тРНК. Поскольку синтез белка начинается с триплета АУГ, практически все белки, образующиеся в ходе трансляции (за редким исключением), начинаются с остатка метионина. Позднее у большинства белков происходит отщепление этого остатка.
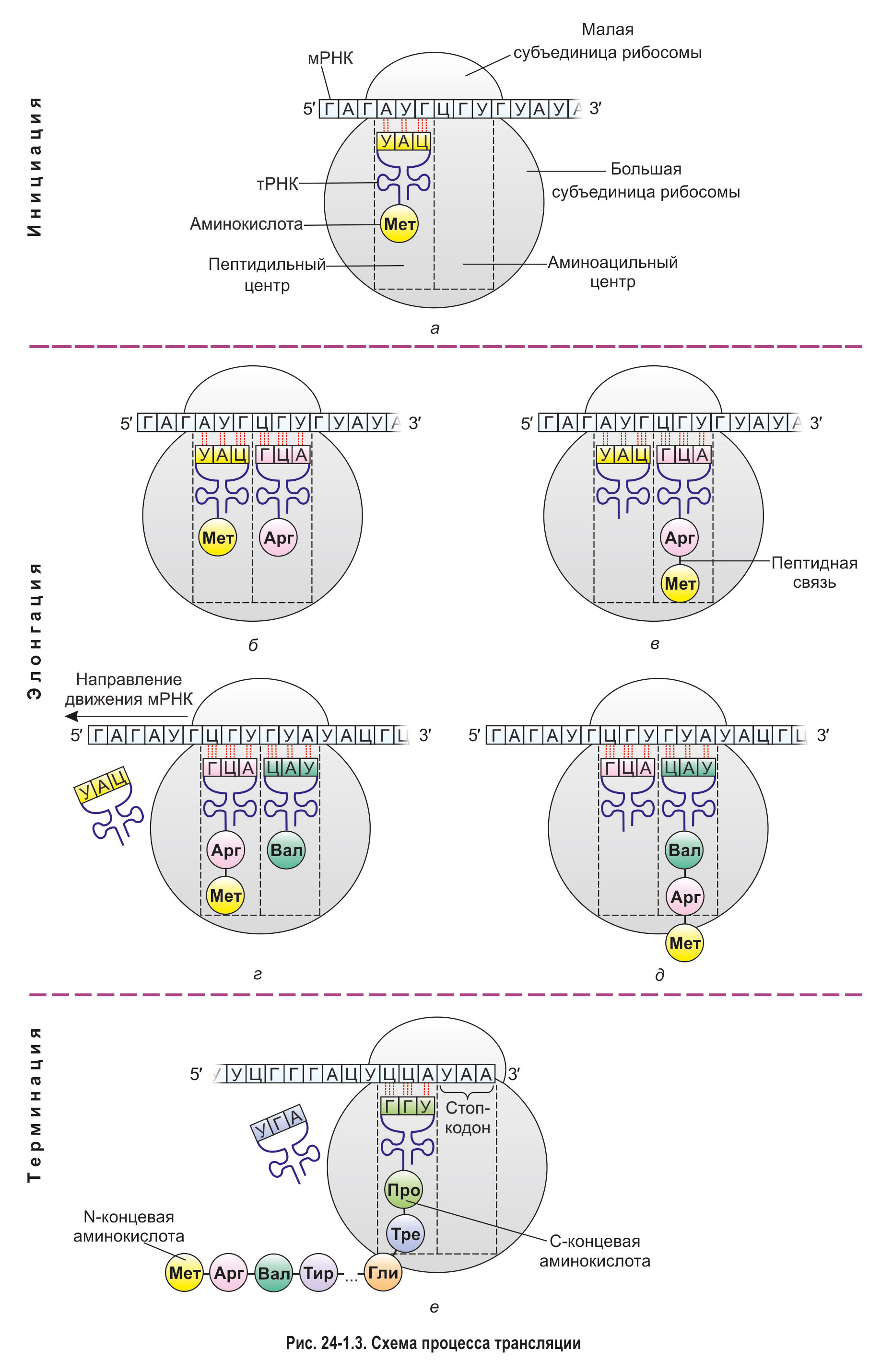
2. Элонгация. В аминоацильный центр поступает тРНК, принесшая вторую аминокислоту, и благодаря своему антикодону комплементарно связывается со вторым кодоном мРНК (рис. 24-1.3, б). Затем первая аминокислота (метионин) отщепляется от инициаторной тРНК и переносится из П-центра ко второй аминокислоте, находящейся в А-центре. Между двумя аминокислотами возникает пептидная связь (рис. 24-1.3, в). Подобный перенос и образование пептидной связи катализирует не один из рибосомальных белков, а молекула рРНК, т. е. рибозим.
Далее специальный белок сдвигает мРНК на один триплет (рис. 24-1.3, г). Вместе с мРНК смещаются и связанные с ней транспортные РНК. При этом первая тРНК выходит из П-центра, отделяется от молекулы мРНК и покидает рибосому. Вторая тРНК, соединенная с дипептидом, перемещается из А-центра в П-центр и занимает место первой.
В освободившийся А-центр поступает следующая аминоацил-тРНК и за счет антикодона комплементарно связывается с третьим кодоном мРНК. После этого происходит перенос образованного ранее дипептида из пептидильного центра в аминоацильный и его присоединение к третьей аминокислоте (рис. 24-1.3, д). Затем мРНК и связанные с ней тРНК сдвигаются еще на один триплет.
Описанная выше последовательность процессов (перенос пептида → образование новой пептидной связи → сдвиг мРНК) многократно повторяется. Так происходит наращивание полипептидной цепи. При этом считывание информации с мРНК происходит в направлении 5′ → 3′, а синтез белковой молекулы — от N-конца к С-концу. Это значит, что в составе полипептида остаток первой аминокислоты имеет свободную аминогруппу, а последний аминокислотный остаток — карбоксильную.*
*Доказательством того, что включение аминокислоты в состав белка зависит не от самой аминокислоты, а от взаимодействия принесшей ее тРНК с молекулой мРНК, может служить следующий эксперимент. С триплетом УГУ, кодирующим аминокислоту цистеин, может комплементарно связаться только тРНК, имеющая антикодон АЦА. В норме эта тРНК транспортирует цистеин. В опыте комплекс «цистеин—тРНК» подвергали воздействию особого катализатора, превращающего цистеин в другую аминокислоту — аланин. Полученный комплекс транспортировал аланин, однако антикодон тРНК соответствовал цистеину. Участие таких модифицированных аминоацил-тРНК в трансляции приводило к тому, что в составе белка позиции, которые кодировались триплетом УГУ, занимал не цистеин, а аланин. Таким образом, ключевую роль в механизме синтеза белка играет не природа аминокислот как таковая, а комплементарное связывание антикодонов тРНК с соответствующими кодонами мРНК.*
*3. Терминация. Биосинтез белка продолжается до тех пор, пока в аминоацильный центр рибосомы не попадет один из стоп-кодонов мРНК — УАА, УАГ или УГА (рис. 24-1.3, е). В клетках не существуют тРНК, антикодоны которых соответствовали бы этим кодонам. Следовательно, в А-центре не может закрепиться ни одна молекула тРНК, из-за чего процесс трансляции прекращается. Происходит отделение от рибосомы молекулы мРНК и синтезированной полипептидной цепи. Рибосома при этом, как правило, распадается на две отдельные субъединицы.
Следует отметить, что для протекания трансляции нужны не только рибосома, мРНК и различные аминоацил-тРНК. В этом процессе также участвуют особые белки — так называемые факторы инициации, элонгации и терминации. Поставщиками энергии для синтеза белка служат макроэргические соединения АТФ и ГТФ. Для образования каждой пептидной связи необходимо разорвать четыре макроэргические. Две из них разрываются при расщеплении молекулы АТФ до АМФ в ходе активации аминокислоты. Еще две макроэргические связи разрушаются при гидролизе двух молекул ГТФ до ГДФ в каждом цикле элонгации.*
Синтез белков в клетках осуществляется быстро. Установлено, что за 1 мин в рибосоме образуются приблизительно 5—6 тыс пептидных связей. Таким образом, время синтеза небольших белковых молекул исчисляется секундами, а на образование крупных, содержащих по нескольку тысяч аминокислотных остатков уходит около минуты.
В организме человека массой 70 кг содержится примерно 10 кг белков. При этом ежедневно около 300—400 г белков, входящих в состав клеток и тканей, расщепляется до аминокислот и приблизительно такое же количество аминокислот включается во вновь синтезированные белковые молекулы. Это значит, что все белки организма обновляются в среднем за 30 дней.
*Однако на самом деле скорость ресинтеза белков в различных органах и тканях неодинакова. Например, почти все белки плазмы крови человека, а также около половины белков, входящих в состав печени и слизистой оболочки кишечника, обновляются за 10 сут. Сравнительно медленно происходит ресинтез белков дермы кожи, мышц, костной, хрящевой и нервной тканей. Так, 50 % мышечного белка миозина обновляется примерно за 180 дней.*
По мере продвижения мРНК через рибосому с ее освободившимся 5′-концом может связываться следующая рибосома. Благодаря этому на одной молекуле мРНК могут одновременно находиться несколько рибосом, синтезирующих с небольшой разбежкой во времени идентичные молекулы белка. Такие комплексы рибосом, связанные одной молекулой мРНК, называются полисомами.
Таким образом, генетическая информация, которая содержится в ДНК, в результате процессов транскрипции и трансляции реализуется в виде молекул белков. Синтез белка обеспечивается взаимодействием различных видов РНК. Рибосомные РНК являются главным структурным компонентом рибосом, *некоторые из них катализируют реакции синтеза белка*. Матричная РНК — носитель информации о первичной структуре белка. Транспортные РНК доставляют в рибосому аминокислоты.
Биосинтез РНК (транскрипция) и биосинтез белка (трансляция) осуществляются с использованием матриц — ДНК и мРНК соответственно. Поэтому, так же как и репликация, процессы транскрипции и трансляции являются реакциями матричного синтеза.