Что общего между нативным и денатурированным белком молекулярная масса
Свойства белков: молекулярная масса, растворимость, гидратация. Осаждение
Белков: высаливание, денатурация. Механизм, факторы, обратимость, применение в
Медицине.
Особая роль в жизнедеятельности живых организмов принадлежит белкам. От родителей детям передается генетическая информация о специфической структуре и функциях всех белков данного организма. Синтезированные белки выполняют многообразные функции: ускоряют химические реакции, выполняют транспортную, структурную, защитную функции, участвуют в передаче сигналов от одних клеток другим и таким образом реализуют наследственную информацию.
Наиболее характерными физико- химическими свойствами белков являются: высокая вязкость растворов, незначительная диффузия, способность к набуханию в больших пределах, оптическая активность, подвижность в электрическом поле, низкое осмотическое давление и высокое онкотическое давление.
Аминокислотный состав и пространственная организация каждого белка в отдельности различны. Они обладают амфотерными, буферными, коллоидными и осмотическими свойствами.
Молекулярная масса белков колеблется от 6000(нижний предел) до 1000000 и выше в зависимости от количества полипептидных цепей в составе единой молекулярной структуры белка.
Изоэлектрическая точка большинства белков животных тканей лежит в пределах от 5,5 до 7,0. В изоэлектрической точке суммарный заряд белков равен нулю и белки не перемещаются в электрическом поле, наименее устойчивы в растворе и легко выпадают в осадок.
Стабильность растворам белков придают заряд белковой молекулы и гидратная оболочка. Между зарядом белка и гидратацией существует тесная связь: чем больше полярных аминокислот в белке, тем больше связывается воды. Некоторые белки гидратируются сильнее, а растворяются хуже. Например, коллаген связывает воды больше, чем многие хорошо растворимые глобулярные белки, но не растворим в воде.
Процесс осаждения белков нейтральными солями (высокие концентрации солей щелочных и щелочноземельных металлов) называется высаливанием. Механизм состоит в том, что добавляемые анионы и катионы солевого раствора снимают гидратную оболочку белков и заряд, являющие факторами устойчивости.
Характерной особенностью белков, полученных высаливанием, является сохранение ими нативных биологических свойств после удаления соли. Высаливание белков является обратимой реакцией, так как осадок белка может вновь раствориться после уменьшения концентрации солей путем диализа или разведением водой.
В медицинской практике для высаливания чаще всего применяют сульфат аммония или натрия (высокие концентрации). Альбумины осаждаются при 100% насыщении (NH4)2SO4. Глобулины – в полунасыщенном растворе (NH4)2SO4.
Высаливание широко используется для разделения и очистки белков в научно-исследовательской работе и медицинской практике.
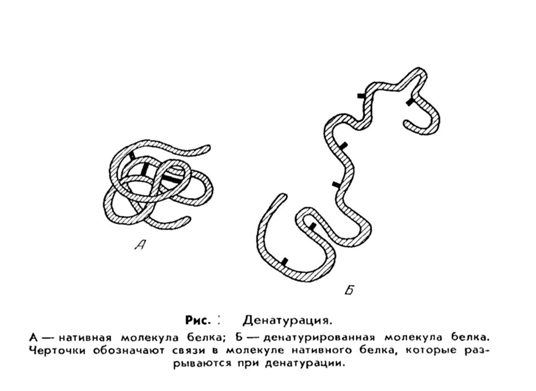
Разрушение структуры белка и потеря им своих нативных свойств (биологических, физико-химических) называется денатурацией. Осажденный денатурированный белок, в отличие от белка, осажденного путём высаливания, утрачивает свои нативные свойства. Денатурирующие факторы делятся на:
1) физические (температура, радиация, ультрафиолетовое излучение)
2) механические (вибрация и т.д.)
3) химические (концентрированные кислоты, щелочи, соли тяжелых металлов и т.д.)
При непродолжительном действии и быстром удалении денатурирующих агентов возможна ренатурация белка с полным восстановлением исходной трехмерной структуры и нативных свойств его молекулы.
Денатурация используется для определения белка в моче при заболеваниях почек (пиелонефрите), мочевого пузыря (цистите), предстательной железы (простатите), а также при отравлении солями тяжелых металлов.
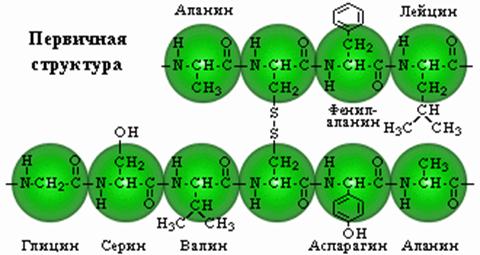
2.2 вопрос. Пептидная теория строения белков, характеристика пептидной связи. Первичная структура белков. Специфичность первичной структуры белков. Конформация пептидных цепей белков (вторичная и третичные структуры). Дисульфидные, водородные, гидрофобные, ионные и другие связи в стабилизации конформации белковой молекулы.
Установлено, что при гидролизе чистого белка, не содержащего примесей, освобождается 20 различных
α- аминокислот. α- Аминокислоты представляют собой производные карбоновых кислот, у которых один водородный атом, у α- углерода, замещен на аминогруппу (-NH2), например:
α
NH2
Все встречающиеся в природе аминокислоты обладают общим свойством – амфотерностью, т.е. каждая
аминокислота содержит как минимум одну кислотную и одну основную группы. Аминокислоты будут отличаться друг от друга химической природой радикала R, не участвующего в образовании пептидной связи при синтезе белка. Все разнообразие особенностей структуры и функции белковых молекул связано с химической природой и физико-химическими свойствами радикалов аминокислот. Именно благодаря им белки наделены рядом уникальных функций, не свойственных другим биополимерам, и обладают химической индивидуальностью.
Стабильность первичной структуры обеспечивается в основном главновалентными пептидными связями; возможно участие и небольшого числа дисульфидных связей.
В полипептидной цепи могут быть обнаружены разнообразные комбинации аминокислот; в полипептидах относительно редки повторяющиеся последовательности.
Каждый индивидуальный гомогенный белок характеризуется уникальной первичной структурой; частота замены аминокислот приводит не только к структурным перестройкам, но и к изменениям физико- химических свойств и биологических функций.
В некоторых ферментах, обладающих близкими свойствами, встречаются идентичные пептидные структуры (последовательность аминокислот), в особенности в областях их активных центров. Этот принцип структурного подобия наиболее типичен для ряда протеолитических ферментов- трипсина, химотрипсина и т.д.
Белки имеют 4 уровня структурной организации.
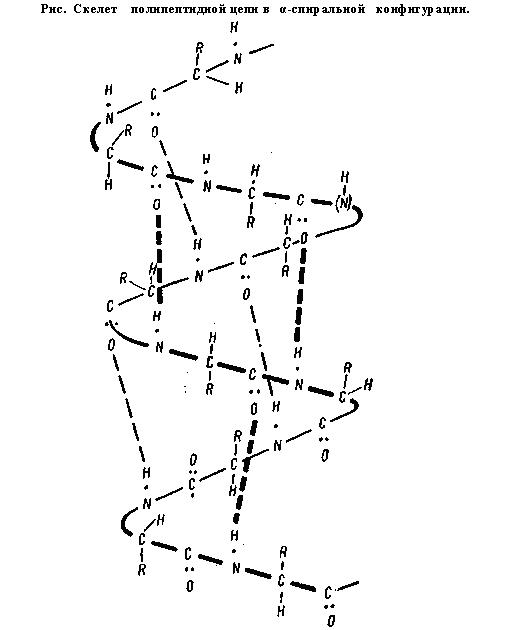
α-спираль имеет винтовую симметрию:
а) ход спирали стабилизируется водородными связями между пептидными группами каждого 1-го и 4-го остатка аминокислот.
б) регулярность витков спирали.
в) равнозначность всех аминокислотных остатков независимо от строения их боковых радикалов.
г) боковые радикалы не участвуют в образовании α-спирали.
Очень много в α-спирали цистеина. Благодаря своей SH-группе он может образовать дисульфидные связи между витками спирали.
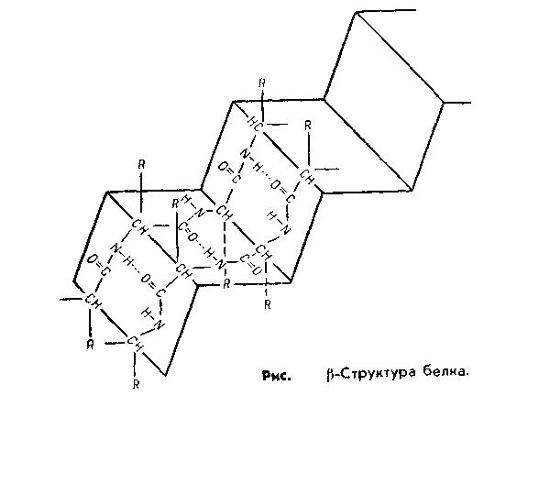
Другой тип вторичной структуры называется β-структурой. Этот вид обнаружен в белках волос, мышц, ногтей и других фибриллярных белках. Состав таких полипептидных цепей имеет складчатую структуру. Её стабилизируют водородные связи между пептидными группировками отдельных участков цепи, чаще двух или нескольких полипептидных цепей, расположенных параллельно. В β-складчатых слоях отсутствуют S-S-связи (в этих участках нет цистеина). Боковые радикалы выступают наружу по обе стороны складчатого слоя.
β-структура образуется только при наличии в составе цепей определенных аминокислот, в частности, аланина и глицина. В молекулах многих нативных белков одновременно присутствует α-спиральные участки и β-складчатые слои.
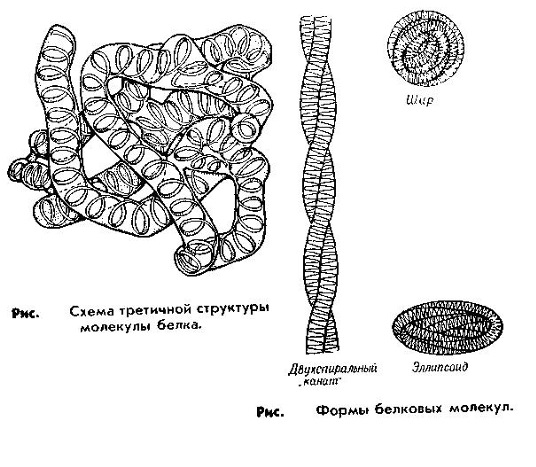
По форме молекулы и особенностям пространственной структуры белки делятся на две группы- фибриллярные и глобулярные. Форма глобулярных белков близка к сферической или эллипсоидной. Молекулы фибриллярных белков имеют удлиненную форму и могут образовывать многомолекулярные нитевидные агрегаты- фибриллы.
Фибриллярные белки выполняют главным образом опорные функции, обеспечивая прочность тканей; глобулярные белки различны по функциям. Третичная структура глобулярных белков образуется путем дополнительного складывания пептидной цепи, содержащей α- спирали, β- структуры и участки периодической структуры. Основную роль в образовании третичной структуры играют слабые связи (водородные, ионные, гидрофобные) и дисульфидные связи.
Дисульфидная связь возникает за счет сульфгидрильных (тиоловых) групп цистеина. Образование дисульфидных связей приводит к тому, что удаленные друг от друга области пептида сближаются и фиксируются.
В результате возникновения множества слабых связей между аминокислотными остатками все части пептидной связи оказываются фиксированными относительно друг друга, образуя компактную структуру- глобулу. При этом значительная часть неполярных(гидрофобных) аминокислот оказываются погруженной во внутренние области глобулы, в то время как полярные(гидрофильные) аминокислоты располагаются преимущественно на поверхности глобулы, контактируя с водной фазой. Характер пространственной укладки определяются аминокислотным составом и чередованием аминокислот в пептидной цепи.
Стабилизируют эту структуру 4 типа внутримолекулярных связей:
4- гидрофобные ван-дер-ваальсовые взаимодействия между неполярными боковыми радикалами аминокислот.
По форме третичной структуры белки делят на глобулярные (ферменты, транспортные белки, антитела, гормоны) и фибриллярные (структурные) (кератин волос, ногтей; коллаген соединительной ткани, эластин связок; миозин и актин мышечной ткани).
Третичная структура определяет нативные свойства белка.
3.2 вопрос. Четвертичная структура. Особенности строения и функционирования олигомерных белков на примере гемсодержащих белков- гемоглобина и миоглобина.
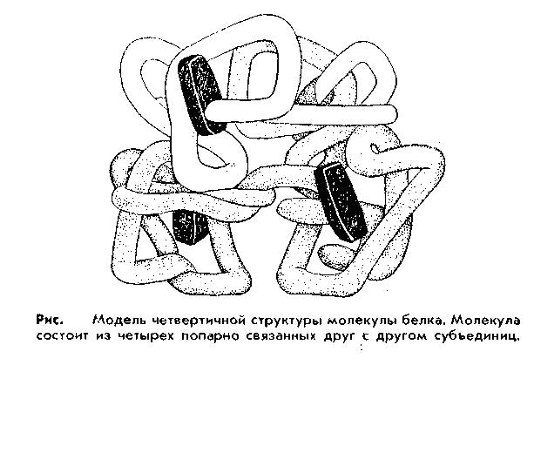
Примеры белков, обладающих четвертичной структурой: гемоглобин – состоит из 4 пептидных цепей- 2 цепи α и 2 цепи β. Строение тетрамерного гемоглобина представляют формулой 2α2β. При действии денатурирующих агентов тетрамерный гемоглобин диссоциирует на димеры и протомеры. Протомеры- наименьшие субъединицы. При удалении денатурирующих агентов, структура восстанавливается.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Что общего между нативным и денатурированным белком молекулярная масса
§ 9. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ
Белки – это очень крупные молекулы, по своим размерам они могут уступать только отдельным представителям нуклеиновых кислот и полисахаридам. В таблице 4 представлены молекулярные характеристики некоторые белков.
Молекулярные характеристики некоторых белков
Относитель-ная молекулярная масса
Число аминокислотных остатков
Зная относительную молекулярную массу белка, можно приблизительно оценить, какое число аминокислотных остатков входит в его состав. Средняя относительная молекулярная масса аминокислот, образующих полипептидную цепь, равна 128. При образовании пептидной связи происходит отщепление молекулы воды, следовательно, средняя относительная масса аминокислотного остатка составит 128 – 18 = 110. Используя эти данные, можно подсчитать, что белок с относительной молекулярной массой 100000 будет состоять приблизительно из 909 аминокислотных остатков.
Электрические свойства белковых молекул
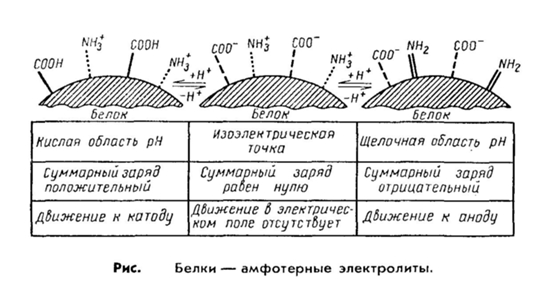
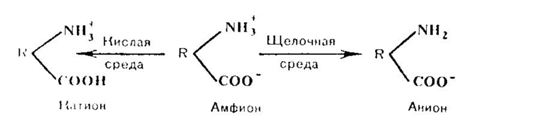
Электрические свойства белков определяются присутствием на их поверхности положительно и отрицательно заряженных аминокислотных остатков. Наличие заряженных группировок белка определяет суммарный заряд белковой молекулы. Если в белках преобладают отрицательно заряженные аминокислоты, то его молекула в нейтральном растворе будет иметь отрицательный заряд, если преобладают положительно заряженные – молекула будет иметь положительный заряд. Суммарный заряд белковой молекулы зависит и от кислотности (рН) среды. При увеличении концентрации ионов водорода (увеличении кислотности) происходит подавление диссоциации карбоксильных групп:
и в то же время увеличивается число протонированных амино-групп;
Таким образом, при увеличении кислотности среды происходит уменьшение на поверхности молекулы белка числа отрицательно заряженных и увеличение числа положительно заряженных групп. Совсем другая картина наблюдается при снижении концентрации ионов водорода и увеличении концентрации гидроксид-ионов. Число диссоциированных карбоксильных групп возрастает
и снижается число протонированных аминогрупп
Итак, изменяя кислотность среды, можно изменить и заряд молекулы белка. При увеличении кислотности среды в молекуле белка снижается число отрицательно заряженных группировок и увеличивается число положительно заряженных, молекула постепенно теряет отрицательный и приобретает положительный заряд. При снижении кислотности раствора наблюдается противоположная картина. Очевидно, что при определенных значениях рН молекула будет электронейтральной, т.е. число положительно заряженных групп будет равно числу отрицательно заряженных групп, и суммарный заряд молекулы будет равен нулю (рис. 14).
Значение рН, при котором суммарный заряд белка равен нулю, называется изоэлектрической точкой и обозначается pI.
Рис. 14. В состоянии изоэлектрической точки суммарный заряд молекулы белка равен нулю
Изоэлектрическая точка для большинства белков находится в области рН от 4,5 до 6,5. Однако есть и исключения. Ниже приведены изоэлектрические точки некоторых белков:
При значениях рН ниже изоэлектрической точки белок несет суммарный положительный заряд, выше – суммарный отрицательный.
Растворимость белков
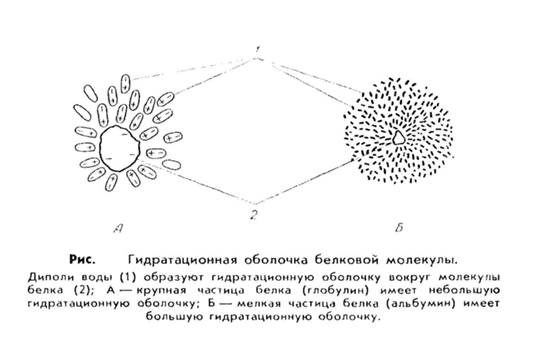
Рис. 15. Образование гидратной оболочки вокруг молекулы белка.
На растворимость белка влияет наличие нейтральных солей (Na2SO4, (NH4)2SO4 и др.) в растворе. При малых концентрациях солей растворимость белка увеличивается (рис. 16), так как в таких условиях увеличивается степень диссоциации полярных групп и экранируются заряженные группы белковых молекул, тем самым снижается белок-белковое взаимодействие, способствующее образованию агрегатов и выпадению белка в осадок. При высоких концентрациях солей растворимость белка снижается (рис. 16) вследствие разрушения гидратной оболочки, приводящего к агрегации молекул белка.
Рис. 16. Зависимость растворимости белка от концентрации соли
Существуют белки, которые растворяются только в растворах солей и не растворяются в чистой воде, такие белки называют глобулины. Существуют и другие белки – альбумины, они в отличие от глобулинов хорошо растворимы в чистой воде.
Растворимость белков зависит и от рН растворов. Как мы уже отмечали, минимальной растворимостью обладают белки в изоэлектрической точке, что объясняется отсутствием электростатического отталкивания между молекулами белка.
При определенных условиях белки могут образовывать гели. При образовании геля молекулы белка формируют густую сеть, внутреннее пространство которой заполнено растворителем. Гели образуют, например, желатина (этот белок используют для приготовления желе) и белки молока при приготовлении простокваши.
На растворимость белка оказывает влияние и температура. При действии высокой температуры многие белки выпадают в осадок вследствие нарушения их структуры, но об этом более подробно поговорим в следующем разделе.
Денатурация белка
Рис. 17. Денатурация белка
При денатурации гидрофобные радикалы аминокислот, находящиеся в нативных белках в глубине молекулы, оказываются на поверхности, в результате создаются условия для агрегации. Агрегаты белковых молекул выпадают в осадок. Денатурация сопровождается потерей биологической функции белка.
Денатурация белка может быть вызвана не только повышенной температурой, но и другими факторами. Кислоты и щелочи способны вызвать денатурацию белка: в результате их действия происходит перезарядка ионогенных групп, что приводит к разрыву ионных и водородных связей. Мочевина разрушает водородные связи, следствием этого является потеря белками своей нативной структуры. Денатурирующими агентами являются органические растворители и ионы тяжелых металлов: органические растворители разрушают гидрофобные связи, а ионы тяжелых металлов образуют нерастворимые комплексы с белками.
Наряду с денатурацией существует и обратный процесс – ренатурация. При снятии денатурирующего фактора возможно восстановление исходной нативной структуры. Например, при медленном охлаждении до комнатной температуры раствора восстанавливается нативная структура и биологическая функция трипсина.
Белки могут денатурировать и в клетке при протекании нормальных процессов жизнедеятельности. Совершенно очевидно, что утрата нативной структуры и функции белков – крайне нежелательное событие. В связи с этим следует упомянуть об особых белках – шаперонах. Эти белки способны узнавать частично денатурированные белки и, связываясь с ними, восстанавливать их нативную конформацию. Шапероны также узнают белки, процесс денатурации которых зашел далеко, и транспортируют их в лизосомы, где происходит их расщепление (деградация). Шапероны играют важную роль и в процессе формирования третичной и четвертичной структур во время синтеза белка.
Интересно знать! В настоящее время часто упоминается такое заболевание, как коровье бешенство. Эту болезнь вызывают прионы. Они могут вызывать у животных и человека и другие заболевания, носящие нейродегенеративный характер. Прионы – это инфекционные агенты белковой природы. Прион, попадая в клетку, вызывает изменение конформации своего клеточного аналога, который сам становится прионом. Так возникает заболевание. Прионный белок отличается от клеточного по вторичной структуре. Прионная форма белка имеет в основном b-складчатую структуру, а клеточная – a-спиральную.
BioximiaForYou
Строение, свойства, классификация аминокислот
При изучении состава белков было установлено, что все они построены по единому принципу и имеют четыре уровня организации: первичную, вторичную, третичную, а отдельные из них и четвертичную струк туры.
Аминокислоты могут объединяться в длинные цепи, обра зуя между собой пептидные связи. Две аминокислоты при этом образуют дипептид ; если к нему добавить еще одну, то возникнет трипептид и т.д. Пептиды, содержащие до 10 аминокис лот, называют олигопептидами, а до 50 — полипептидами. По липептиды, содержащие более 50 аминокислот, уже называют белками, хотя это название чаще используют для соединений, содержащих более 100 аминокислот.
Вторичная структура. Представляет собой упорядоченную и компактную упаковку полипептидной цепи. По конфигурации она бывает в виде спирали и складчатой структуры.
Основу α-спирали составляет пептидная цепь, а радикалы аминокислот направлены кнаружи, располагаясь по спирали. Внешне α-спираль похожа на слегка растянутую спираль электроплитки. Такая форма характерна для белков, имеющих одну полипептидную цепь (альбуминов, глобулинов и др.).
Складчатая β-структура представляет собой плоскую форму и похожа на меха гармошки. Она характерна для белков, имеющих несколько полипептидных цепей, расположенных параллельно, β-структура встречается в таких белках, как трипсин, рибонуклеаза, кератин волос, коллаген сухожилий.
Водородная связь является слабой, она легко образуется и так же легко разрывается. В молекуле белка этот вид связи образуется между водородом α-аминной группы одной пептидной связи и кислородом β-карбоксильной группы другой.
Третичная структура. Имеющая третичную структуру белковая молекула представляет собой более компактное пространственное расположение полипептидной цепи, точнее ее вторичной структуры. Форма третичной структуры может быть самая различная и определяется тем, что различные функциональные группы полипептидной цепи могут образовывать различные типы связей (электростатические, ионные, силы Ван-дер-Ваальса и др.).
Именно третичная структура обеспечивает выполнение белком его основных функций и в зависимости от этого третичная структура может быть представлена или в виде шарика (глобулы) у глобулярных белков, или и виде нитей (фибрилл) у фибриллярных белков. Глобулярные белки обнаружены в крови и многих органах. Их представителями являются альбумины и глобулины. Фибриллярные белки составляют основу мышечной ткани.
Четвертичная структура. В организме имеются более сложные по структуре белки, состоящие из нескольких так называемых субъединиц, каждая из которых представляет собой молекулу белка со своей специфической структурой, вплоть до третичной. Такое объединение субъединиц называют четвертичной структурой. Особенностью белков с четвертичной структурой является их способность проявлять свои функции и свойства только при наличии всех субъединиц. Удаление хотя бы одной из них приводит к потере функций. К таким белкам относятся гемоглобин, ряд ферментов и др.
Т.о., под четвертичной структурой понимают структуру белков, состоящих из нескольких полипептидных цепей. Каждая из этих цепей имеет свою завершенную пространственную структуру и называется субъединицей белка с четвертичной структурой.
Белки имеют высокую молекулярную массу, растворимы в воде, способны к набуханию, характеризуются химической активностью, подвижностью в электри ческом поле и некоторыми другими свойствами. Белки активно вступают в химические реакции. Это свойство связано с тем, что аминокислоты, входящие в состав белков, содержат разные функциональные группы, способные реагировать с другими веществами. Важно, что такие взаимодействия происходят и внутри белковой молекулы, в результате чего образуются пептидная, водородная, дисульфидная и другие виды связей. К радикалам аминокислот, а, следовательно, и белков, могут присоединяться различные соединения и ионы, что обеспечивает транспорт их по крови.
Определение молекулярной массы проводится различными методами: осмометрическим, гельфильтрационным, оптическим и др. Однако наиболее точным является метод седиментации, предложенный Т. Сведбергом. Он основан на том, что при ультрацентрифугировании с ускорением до 900000 g скорость осаждения белков зависит от их молекулярной массы.
Например, кислотные свойства белку придают карбоксильные группы аспарагиновой и глутаминовой аминокислот, а щелочные — радикалы аргинина, лизина и гистидина. Чем больше дикарбоновых аминокислот содержится в белке, тем сильнее проявляются его кислотные свойства и наоборот.
Свойство амфотерности лежит в основе буферных свойств белков и их участии в регуляции рН крови. Амфотерность белков используют для разделения их на фракции, например методом электрофореза, с целью диагностики ряда заболеваний и контроля за состоянием больного, так как при различных патологических состояниях фракционный состав белков существенно меняется.
3. Важное значение для организма имеет с пособность белков адсорбировать на своей поверхности некоторые вещества и ионы (гормоны, витамины, железо, медь и др.), которые либо плохо растворимы в воде, либо являются токсичными (билирубин, свободные жирные кислоты). Белки транспортируют их по крови к местам дальнейших превращений или обезвреживания.
4. Водные растворы белков имеют свои особенности. Во-первых, белки обладают большим сродством к воде, т. е. они гидрофильны. Это значит, что молекулы белка, как заряженные частицы, притягивают к себе диполи воды, которые располагаются вокруг белковой молекулы и образуют водную или гидратную оболочку . Эта оболочка предохраняет молекулы белка от склеивания и выпадения в осадок.
Величина гидратной оболочки зависит от структуры белка. Например, альбумины более легко связываются с молекулами воды и имеют относительно большую водную оболочку, тогда как глобулины, фибриноген присоединяют воду хуже и гидратная оболочка у них меньше.
Таким образом, устойчивость водного раствора белка определяется двумя факторами : наличием электрического заряда белковой молекулы и находящейся вокруг нее гидратной оболочки. При удалении этих факторов белок выпадает в осадок. Данный процесс может быть обратимым и необратимым.
Обратимое осаждение белков (высали вшие) предполагает выпадение белка в осадок под действием определенных веществ, после удаления, которы х он вновь возвращается в свое исходное (нативное) состояние. Для высаливания белков используют соли щелочных и щелочноземельных металлов (наиболее часто в практике используют сульфат натрия и аммония). Эти соли удаляют водную оболочку (вызывают обезвоживание) и снимают заряд. Между величиной гидратной оболочки белковых молекул и концентр ацией солей существует прямая зависимость: чем меньше гидратная оболочка, тем меньше требуется солей. Так, глобулины, имеющие крупные и тяжелые молекулы и небольшую гидратную оболочку, выпадают в осадок при неполном насыщении раствора солями, а альбумины как более мелкие молекулы, окруженные большой водной оболочкой,- при полном насыщении.
Денатурация белков (от лат. de- — приставка, означающая отделение, удаление и лат. nature — природа; не путать с лат. denaturatus — лишенный природных свойств) — термин биологической химии, означающий потерю белками их естественных свойств (растворимости, гидрофильности и др.) вследствие нарушения пространственной структуры их молекул.
Процесс денатурации отдельной белковой молекулы, приводящий к распаду её «жёсткой» трёхмерной структуры, иногда называют плавлением молекулы.
Практически любое заметное изменение внешних условий, например, нагревание или обработка белка кислотой приводит к последовательному нарушению четвертичной, третичной и вторичной структур белка. Обычно денатурация вызывается повышением температуры, действием сильных кислот и щелочей, солей тяжелых металлов, некоторых растворителей (спирт), радиации и др.
Денатурация часто приводит к тому, что в коллоидном растворе белковых молекул происходит процесс агрегации частиц белка в более крупные. Визуально это выглядит, например, как образование «белка» при жарке яиц.
Денатурация белков положена в основу лечения отравлений тяжелыми металлами, когда больному вводят per os молоко или сырые яйца с тем, чтобы металлы, денатурируя белки молока и яиц, адсорбировались на их поверхности и не действовали на белки слизистой оболочки желудка и кишечника, а также не всасывались в кровь.
Ренатурация (высаливание) — процесс, обратный денатурации, при котором белки возвращают свою природную структуру. Нужно отметить, что не все белки способны ренатурировать; у большинства белков денатурация необратима.
5. Размер белковых молекул лежит в пределах 1 мкм до 1 нм и, следовательно, они являются коллоидными частиц… Продолжение »