Что общего у изотопов одного и того же элемента
Тестовые задания к параграфу 52
1. Изотопы одного и того же химического элемента различаются
| 1) числом электронов | 3) числом нейтронов |
| 2) числом протонов | 4) зарядом ядра |
Думаю, нужно прокомментировать.
Если разница в числе электронов – то это ионы. Если электронов меньше, чем должно быть, то атом имеет общий положительный заряд и называется катионом. Если общее число электронов больше, чем должно быть, то общий заряд атома имеет отрицательную величину, а сам такой атом называется анионом.
Заряд ядра = числу протонов в ядре = порядковому номеру элемента. То есть, атом с иным зарядом ядра будет представлять из себя уже другой элемент.
Определение: химический элемент – это вид атомов с одинаковым зарядом ядра.
Определение: изотопами называют разновидности одного и того же элемента с разным числом нейтронов в ядре атома.
Ответ: 3) Изотопы одного и того же химического элемента различаются числом нейтронов в ядре атома.
2. Ядро атома 27 13 Al содержит
| 1) 27 протонов и 13 нейтронов | 3) 14 протонов и 13 нейтронов |
| 2) 13 протонов и 14 нейтронов | 4) 13 протонов и 27 нейтронов |
Порядковый номер алюминия 13, значит заряд ядра = +13 = число протонов. Число нейтронов = массовое число (27) – порядковый номер (число протонов) = 27 – 13 = 14.
Ответ: 2) 13 протонов и 14 нейтронов
Г). Что общего у различных изотопов одного и того же химического элемента? Чем они различаются?
Изотопы – это разновидности данного химического элемента, различающиеся массовым числом своих ядер.
Различаются количеством нейтронов в ядре, массовым числом своих ядер, различается стабильность атомов, у нестабильных ядер различается время полураспада, физические свойства изотопов могут различаться весьма резко
2. Муфельная печь потребляет мощность Р=1кВт. Температура Т ее внутренней поверхности при открытом отверстии площадью S=25 см 2 равна 1200К. Считая, что отверстие печи излучает как черное тело, определить, какая часть мощности рассеивается стенками
а). Запишите формулу Рэлея-Джинса для теплового излучения. Что известный физик Эренфест имел – в виду, когда говорил об «ультрафиолетовой катастрофе»?
Формула Рэлея-Джинса для теплового излучения:

Формула Рэлея-Джинса для испускательной способности
абсолютно черного тела:
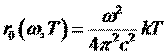
Интегрирование выражения (2) по всему частотному диапазону дает бесконечно большое значение, т.е. энергетическая светимость абсолютно черного тела должна равняться бесконечности при любой температуре.Практически вся энергия нагретого тела должна быть немедленно испущена в виде излучения с очень большой частотой и малой длиной волны. Этот результат назвали «ультрафиолетовой катастрофой Рэлея-Джинса»
б). Почему в спектре водорода так много линий, если у атома водорода всего лишь один электрон?
в). Каков физический смысл коэффициентов Эйнштейна для спонтанного излучения, резонансного поглощения, вынужденного излучения?
Коэффициенты Эйнштейна определяют вероятности переходов атомов с уровня 

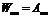
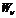
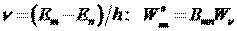

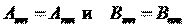
г). Как изменится положение химического элемента в таблице Менделеева после испускания его ядром гамма-кванта?
2. Короткий импульс света с энергией Е=7,5 Дж в виде узкого почти параллельного пучка падает на зеркальную пластинку с коэффициентом отражения р=0,60. Угол падения пучка равен 30°. Определить с помощью корпускулярных представлений импульс, переданный
пластинке.
2. Определить, какая часть (в процентах) начального количества ядер радиоактивного изотопа останется нераспавшейся по истечении времени t, равного трем средним временам жизни радиоактивного ядра.
Что общего у изотопов одного и того же элемента
а). Что можно сказать об относительной температуре звезд, имею щих желтый, голубой и красный оттенки?
Температура красных звезд меньше температуры желтых. Температура голубых звезд больше температуры желтых.
б). Предложите методику определения значения постоянной Планка из опытов по изучению фотоэффекта.
в). Какова зависимость от времени волновой функции для частицы, находящейся в бесконечно глубокой одномерной прямоугольной по тенциальной яме?
Частица в потенциальной яме
Пусть частица движется вдоль оси x. В точках x=0 и x=l установлены непроницаемые бесконечно высокие стенки.
Потенциальная энергия в этом случае имеет вид.
Такая зависимость потенциальной энергии от x получила название потенциальной ямы.
Стац. уравнение Шредингера имеет вид:

Вероятность нахождения частицы вне потенциальной ямы равна 0.
Найдём условия, при которых ψ-функция удовлетворяет граничным условиям.


Важный результат: 

Энергия электрона внутри потенциальной ямы принимает дискретные значения, т.е. является квантованной. Величина En зависит от числа n, которое носит название главного квантового числа. Квантованные значения энергии называются энергетическими уровнями. Главное квантовое число n определяет номер энергетического уровня, следовательно, электрон в потенциальной яме может находиться только на определённом энергетическом уровне, причём минимальное значение En<>0. Дискретный характер энергетических уровней проявляется при малых значениях массы частицы, размера потенциальной ямы и главного квантового числа n. При больших значениях этих параметров движение становится классическим. Положение частицы в яме не равновероятно, а определяется собственными функциями.
Заметим еще, что на ширине “ямы” l должно укладываться целое
На рис. представлена зависимость плотности вероятности
обнаружения частицы в окрестности определенной точки “ямы”
от координаты точки x (т.е. ½ y n ( x ) ½ 2 ), а также спектр значений
энергии частицы. Из рисунка видно, что, например, при n =2
частица не может находиться в центре ямы, но одинаково часто
бывает как в левой, так и в правой её половинах.
г). Что общего у различных изотопов одного и того же химического элемента? Чем они различаются?
Изотопы – это разновидности данного химического элемента, различающиеся массовым числом своих ядер.
Различаются количеством нейтронов в ядре, массовым числом своих ядер, различается стабильность атомов, у нестабильных ядер различается время полураспада, физические свойства изотопов могут различаться весьма резко
2. Муфельная печь потребляет мощность Р=1кВт. Температура Т ее внутренней поверхности при открытом отверстии площадью S =25 см 2 равна 1200К. Считая, что отверстие печи излучает как черное те ло, определить, какая часть мощности рассеивается стенками
Химические элементы
Химический элемент
Надо заметить, что на экзамене часто из карточки элемента скрывают распределение электронов и конфигурацию внешнего уровня. Тем не менее, если вы успешно освоили предыдущую тему, то для вас не составит труда написать электронную конфигурацию атома зная его порядковый номер в таблице Д.И. Менделеева (номер уж точно не тронут!))
Протоны, нейтроны и электроны
Вы уже знаете, что порядковый номер элемента в периодической таблице Д.И. Менделеева равен числу протонов, а число протонов равно числу электронов.
Для того чтобы найти число нейтронов в атоме алюминия, необходимо вычесть из атомной массы число протонов:
Получается, что в атоме алюминия 14 нейтронов. Посчитайте число нейтронов, электронов и протонов самостоятельно для атомов бериллия, кислорода, меди. Решение вы найдете ниже.
Если вы поняли суть и научились считать протоны, нейтроны и электроны, самое время приступать к следующей теме.
Изотопы
Лучше всего объяснить, что такое изотопы наглядным примером. Широко известны три изотопа водорода: протий, дейтерий и тритий.
Рассмотрим пример с изотопами лития. Самостоятельно посчитайте количество нейтронов у каждого изотопа. Найдите тот, который включен в таблицу Д.И. Менделеева.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Чем отличаются изотопы одного элемента друг от друга
Что такое изотоп?
Хотя все атомы одного элемента имеют одинаковое число протонов, эти атомы могут отличаться числом имеющихся у них нейтронов. Такие различные атомы одного и того же элемента называются изотопами. Количество протонов, а также количество электронов у изотопа и исходного элемента совпадает. По этой причине в природе существует гораздо больше химических элементов, чем указано в таблице Менделеева, которая систематизирует элементы по числу протонов (порядковый номер).
Например, все атомы Li имеют 3 протона, но в природе существуют изотопы, содержащие от 3 до 5 нейтронов. Для обозначения изотопа, слева от символа элемента подписывают нижним индексом его порядковый номер, а верхним — массовое число. Массовое число — это суммарное число нуклонов (протонов и нейтронов) в атомном ядре, численно близкое к атомной массе элемента. Нижний индекс, обозначающий порядковый номер элемента, указывать не обязательно, так как все атомы лития имеют в своем ядре по 3 протона. Также, обсуждая эти изотопы, можно пользоваться записью «литий-6» и «литий-8».
Пример 1. Сколько протонов, нейтронов и электронов содержится в атоме урана-238? Запишите символ этого изотопа.
Решение: Порядковый номер урана (см. таблицу Менделеева) равен 92, а массовое число изотопа равно 238 (по условию). Следовательно, он содержит 92 протона, 92 электрона и 238 — 92 = 146 нейтронов. Его символ 238 U.
Методы разделения изотопов
Для изучения свойств изотопов и особенно для их применения в научных и прикладных целях требуется их получение в более или менее заметных количествах. В обычных масс-спектрометрах достигается практически полное разделение изотопов, однако количество их ничтожно мало. Поэтому усилия ученых и инженеров были направлены на поиски других возможных методов разделения изотопов. В первую очередь были освоены физико-химические методы разделения, основанные на различиях в таких свойствах изотопов одного итого же элемента, как скорости испарения, константы равновесия, скорости химических реакций и т.п. Наиболее эффективными среди них оказались методы ректификации и изотопного обмена, которые нашли широкое применение в промышленном производстве изотопов легких элементов: водорода, лития, бора, углерода, кислорода и азота.
Определение
Изотопы – это разновидность атомов какого-либо химического элемента. Электронов и протонов в любом атоме всегда равное количество. Поскольку они обладают противоположными зарядами (электроны – отрицательным, а протоны – положительным), атом всегда нейтрален (эта элементарная частица не несет заряда, он равен у нее нулю). При потере или захвате электрона атом теряет нейтральность, становясь либо отрицательным, либо положительным ионом.
Нейтроны не имеют заряда, зато их количество в атомном ядре одного и того же элемента может быть разным. Это никак не сказывается на нейтральности атома, однако влияет на его массу и свойства. Например, в любом изотопе атома водорода есть по одному электрону и протону. А количество нейтронов разное. В протии имеется всего лишь 1 нейтрон, в дейтерии – 2 нейтрона и в тритии – 3 нейтрона. Эти три изотопа заметно отличаются друг от друга по свойствам.
Особенности изотопов
Различные изотопы элементов отличаются количеством нейтронов в ядре.
Сейчас известно, что некоторые элементы (водород, бор, кадмий и т.д.) имеют свойство захватывать нейтроны и образовывать изотопы. Например, легкий водород (11Н), захватывая один нейтрон, образует тяжелый водород – дейтерий (21D), а когда захватывает еще один нейтрон – тритий (31Т).
Изотопы водорода и гелия имеют важное значение в физических исследованиях ядра. В оболочке атома водорода только один электрон, атома гелия – два электрона. Поэтому их можно сравнительно легко «сорвать», получив ядра этих элементов. Тяжелые изотопы водорода играют существенную роль в осуществлении ядерных реакций синтеза и деления. Следует отметить, что хотя молекулярные свойства вещества определяются вообще не ядром, а строением электронной оболочки, все же физические свойства тяжелых изотопов и обычного водорода заметно различаются. Например:
Важные свойства имеет тяжелая вода, то есть вода, в молекулах которой вместо атомов легкого водорода содержится дейтерий.
Однако заметные изменения свойств изотопов наблюдаются только у легких элементов. Объясняется это тем, что у тяжелых элементов отношение массы ядра к массе нейтрона гораздо больше.