Что означает 2o2 химия
Кислород
Газ без цвета, без запаха, составляет 21% воздуха.
Общая характеристика элементов VIa группы
От O к Po (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.
Основное состояние атома кислорода
У атома кислорода (как и атомы азота, фтора, неона) нет возбужденного состояния, так как отсутствует свободная орбиталь с более высоким энергетическим уровнем, куда могли бы перемещаться валентные электроны.
Атом кислорода имеется два неспаренных электрона, максимальная валентность II.
Природные соединения
Получение
В промышленности кислород получают из сжиженного воздуха. Также активно применяются кислородные установки, мембрана которых устроена как фильтр, отсеивающие кислород (мембранная технология).
В лаборатории кислород получают разложением перманганата калия (марганцовки) или бертолетовой соли при нагревании. Применяется реакция каталитического разложения пероксида водорода.
На подводных лодках для получения кислорода применяют следующую реакцию:
Химические свойства
Является самым активным неметаллом после фтора, образует бинарные соединения со всеми элементами кроме гелия, неона, аргона. Чаще всего реакции с кислородом экзотермичны (горение), ускоряются при повышении температуры.
Во всех реакциях, кроме взаимодействия со фтором, кислород проявляет себя в качестве окислителя.
F + O2 → OF2 (фторид кислорода, O +2 )
В реакциях кислорода с металлами образуются оксиды, пероксиды и супероксиды. Реакции с активными металлами идут без нагревания.
Известна реакция горения воды во фторе.
Все органические вещества сгорают с образованием углекислого газа и воды.
Процесс можно остановить на любой стадии в зависимости от желаемого результата.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Кислород: химия кислорода
Кислород
Положение в периодической системе химических элементов
Кислород расположен в главной подгруппе VI группы (или в 16 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кислорода
Электронная конфигурация кислорода в основном состоянии :
+8O 1s 2 2s 2 2p 4 1s 

Атом кислорода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 2 неподеленные электронные пары в основном энергетическом состоянии.
Физические свойства и нахождение в природе
Озон О3 — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода.
Кислород — это самый распространённый в земной коре элемент. Кислород входит в состав многих минералов — силикатов, карбонатов и др. Массовая доля элемента кислорода в земной коре — около 47 %. Массовая доля элемента кислорода в морской и пресной воде составляет 85,82 %.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе.
Способы получения кислорода
В промышленности кислород получают перегонкой жидкого воздуха.
Лабораторные способы получения кислорода:
Разложение перманганата калия:
Разложение бертолетовой соли в присутствии катализатора MnO2 :
2KClO3 → 2KCl + 3O2
Разложение пероксида водорода:
2HgO → 2Hg + O2
Соединения кислорода
| Степень окисления | Типичные соединения |
| +2 | Фторид кислорода OF2 |
| +1 | Пероксофторид кислорода O2F2 |
| -1 | Пероксид водорода H2O2 Пероксид натрия Na2O2 и др. |
| -2 | Вода H2O Оксиды металлов и неметаллов Na2O, SO2 и др. Соли кислородсодержащих кислот Кислородсодержащие органические вещества Основания и амфотерные гидроксиды |
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
Но чаще фосфор сгорает до оксида фосфора (V):
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000 о С), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
CS2 + 3O2→ CO2 + 2SO2
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Кислород окисляет азотистую кислоту :
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
Разница между 2O и O2
Основное различие между 2O и O2 является то, что 2O относится к двум свободным атомам кислорода, в то время как O2 относится к молекуле, имеющей два атома кислорода.
2O и O2 — два термина, которые часто путают нас. Оба термина означают, что есть два атома кислорода. Но разница между 2O и O2 заключается в состоянии этих атомов кислорода — независимо от того, свободны они или связаны друг с другом.
Содержание
Что такое 2O?
20 означает, что есть два атома кислорода. При этом эти атомы кислорода не связаны друг с другом, и они находятся в свободном состоянии. Здесь кислород находится в элементарном состоянии. Кроме того, эти атомы кислорода доступны для образования химических связей.

O2 представляет собой молекулу кислорода, имеющую два атома кислорода, связанных друг с другом посредством ковалентной химической связи. Здесь кислород находится в молекулярном состоянии. Кроме того, атомы кислорода в этой структуре уже находятся в химических связях. Таким образом, никакие дальнейшие связи не сформируются между ними. Важно отметить, что необходимо писать 2 как нижний индекс O: «O2».
Это соединение естественным образом встречается в газообразном состоянии, и оно необходимо для жизни на Земле, поскольку мы вдыхаем воздух состоящий из кислорода.

В чем разница между 2O и O2?
Хотя оба термина 2O и O2 означают, что имеется два атома кислорода, состояние кислорода у них является различным. Основное различие между 2O и O2 состоит в том, что 2O означает, что имеется два свободных атома кислорода, тогда как O2 означает, что это молекула, имеющая два атома кислорода. Кроме того, 2O находится в элементарном состоянии, в то время как O2 находится в молекулярном состоянии. Важно отметить, что при их написании мы обычно пишем 2 в 2O с тем же размером шрифта, что и O, но в O2 мы должны писать 2 как нижний индекс O.
Заключение — 2O против O2
Хотя оба термина 2O и O2 означают, что имеется два атома кислорода, состояние кислорода у них различное. Таким образом, ключевое отличие между 2O и O2 состоит в том, что 2O означает, что имеется два свободных атома кислорода, тогда как O2 означает, что это молекула, имеющая два атома кислорода.
Перекись водорода
Перекись водорода
| Пероксид водорода | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Пероксид водорода |
| Химическая формула | H2O2 |
| Отн. молек. масса | 34,01 а. е. м. |
| Молярная масса | 34,01 г/моль |
| Физические свойства | |
| Плотность вещества | 1.4 г/см³ |
| Состояние (ст. усл.) | жидкость |
| Термические свойства | |
| Температура плавления | −0,432 °C |
| Температура кипения | 150,2 °C |
| Энтальпия (ст. усл.) | -136.11 кДж/моль |
| Химические свойства | |
| pKa | 11.65 |
| Растворимость в воде | неограниченная г/100 мл |
| Классификация | |
| номер CAS | [7722-84-1] |
Перокси́д водоро́да (перекись водорода), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2•2H2O.
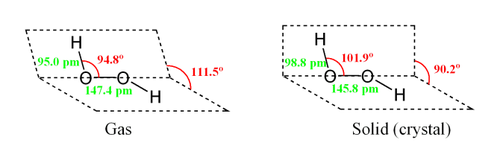
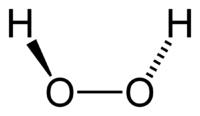
Молекула пероксида водорода имеет следующее строение:
Содержание
Физические свойства
Чистый пероксид водорода очень сильно отличается от знакомого всем 3%-ного раствора Н2О2, который стоит в домашней аптечке. Прежде всего, он почти в полтора раза тяжелее воды (плотность при 20° С равна 1,45 г/см3). Замерзает Н2О2 при температуре, немного меньшей, чем температура замерзания воды – при минус 0,41° С, но если быстро охладить чистую жидкость, она обычно не замерзает, а переохлаждается, превращаясь в прозрачную стеклообразную массу. Растворы Н2О2 замерзают при значительно более низкой температуре: 30%-ный раствор – при минус 30° С, а 60%-ный – при минус 53° С. Кипит Н2О2 при температуре более высокой, чем обычная вода, – при 150,2° С. Смачивает стекло Н2О2 хуже, чем вода, и это приводит к интересному явлению при медленной перегонке водных растворов: пока из раствора отгоняется вода, она, как обычно, поступает из холодильника в приемник в виде капель; когда же начинает перегоняться Н2О2, жидкость выходит из холодильника в виде непрерывной тоненькой струйки. На коже чистый пероксид водорода и его концентрированные растворы оставляют белые пятна и вызывают ощущение жгучей боли из-за сильного химического ожога.
Чистый Н2О2, как и сахарный сироп, сильно преломляет свет. Действительно, коэффициент преломления безводного Н2О2 (1,41) намного больше, чем у воды (1,33). Однако то ли в результате неверного толкования, то ли из-за плохого перевода с французского, практически во всех учебниках до сих пор пишут, что чистый пероксид водорода – «густая сиропообразная жидкость», и даже объясняют это теоретически – образованием водородных связей. Но ведь вода тоже образует водородные связи. На самом деле вязкость у Н2О2 такая же, как и у чуть охлажденной (примерно до 13° С) воды, но нельзя сказать, что прохладная вода густая, как сироп.
Химические свойства
Разлагается на кислород и воду при нагревании, под действием ультрафиолетового излучения, а также в присутствии ионов переходных металлов и серебра:
Однако очень чистый пероксид водорода устойчив.
Пероксид водорода проявляет очень слабые кислотные свойства (К = 1,4·10 –12 ). При действии концентрированного раствора Н2O2 на гидроксиды в ряде случаев можно выделить пероксиды металлов (Li2O2, MgO2 и др.):
Окислительно-восстановительные свойства
Пероксид водорода обладает сильными окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также кислород при реакции с водным раствором перманганата калия в кислой среде.
При действии сильных окислителей H2O2 проявляет восстановительные свойства, выделяя свободный кислород:
Реакцию KMnO4 с Н2O2 используют в химическом анализе для определения содержания Н2O2:
Окисление органических соединений пероксидом водорода (например, сульфидов и тиолов) целесообразно проводить в среде уксусной кислоты.
Биологические свойства
Перекись водорода относится к реактивным формам кислорода и при повышенном образовании в клетке вызывает оксидативный стресс. Некоторые ферменты, например глюкозоксидаза, образуют в ходе окислительно-восстановительной реакции пероксид водорода, который может играть защитную роль в качестве бактерицидного агента. В клетках млекопитающих нет ферментов, которые бы восстанавливали кислород до перекиси водорода. Однако несколько ферментных систем (ксантиноксидаза, НАД(Ф)H-оксидаза, циклоксигеназа и др.) продуцируют супероксид, который спонтанно или под действием супероксиддисмутазы превращается в перекись водорода.
Получение
Пероксид водорода получаются в промышленности по реакции с участием органических веществ, в частности, каталитическим окислением изопропилового спирта:
Ценным побочным продуктом этой реакции является ацетон.
В лабораторных условиях для получения пероксида водорода используют реакцию
Концентрирование и очистку пероксида водорода проводят осторожной перегонкой.
Применение
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо — в качестве окислителя или как однокомпонентное (с разложением на катализаторе). Используется в аналитической химии, в медицине, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит свое применение в качестве катализатора, гидрирующего агента, как эпоксидирующий агент при эпоксидировании олефинов. В медицине растворы пероксида водорода применяются как антисептическое средство. При контакте с поврежденной кожей и слизистыми пероксид водорода под влиянием фермента каталазы распадается с выделением кислорода, что способствует сворачиванию крови и создает неблагоприятные условия для развития микроорганизмов. Однако такое действие непродолжительно и обладает слабым эффектом. Тем не менее, пероксид водорода (аптечное название — перекись водорода, 3 %) применяется при первичной обработке ран (в том числе открытых). Перекись водорода очень эффективна для лечения небольших царапин, особенно у детей — она не «щиплет», не имеет запаха, бесцветна. Однако она может вызывать небольшое жжение в районе открытой раны. Стоимость пузырька такого раствора (на 2009 год) — около 6 руб. В пищевой промышленности растворы пероксида водорода применяются для дезинфекции технологических поверхностей оборудования, непосредственно соприкасающихся с продукцией. Кроме того, на предприятиях по производству молочной продукции, соков, растворы перекиси водорода используются для дезинфекции упаковки (технология «Тетра Пак»). Для технических целей пероксид водорода применяют в производстве электронной техники.
Формы выпуска
Выпускается в виде водных растворов, стандартная концентрация 3, 30, 38, 50, 60, 85, 90 и 98%. 30% водный раствор пероксида водорода, стабилизированный добавлением фосфатов натрия, называется пергидролем.
Опасность применения
Несмотря на то, что пероксид водорода не токсичен, его концентрированные растворы при попадании на кожу, слизистые оболочки и в дыхательные пути вызывают ожоги. В больших концентрациях недостаточно чистый пероксид водорода может быть взрывоопасен.
Что означает 2o2 химия
Молекула кислорода состоит из двух атомов. Химическая связь ковалентная неполярная.
Кислород отличает высокая реакционная способность, он окисляет многие вещества уже при комнатной температуре. Если реакции инициировать нагреванием, освещением, катализатором, они протекают очень бурно и сопровождаются выделением большого количества тепла. Особенно сильным окислителем является жидкий кислород: пропитанная им вата при поджигании мгновенно сгорает. Некоторые летучие органические вещества самопроизвольно воспламеняются на расстоянии нескольких метров от открытого сосуда с жидким кислородом.
Кислород образует соединения со всеми химическими элементами, кроме гелия, неона и аргона. С большинством элементов он взаимодействует непосредственно, кроме галогенов, за исключением фтора, золота и платины.
В результате реакции образуется оксид этого металла.
При этом образуется оксид этого неметалла.
Сера взаимодействует с кислородом при 250°С:
Горение фосфора с образованием оксида фосфора (V) начинается при 60 °С:
Графит реагирует с кислородом при 700-800 °С:
С водородом кислород взаимодействует при 300 °С:
В этом случае образуются оксиды элементов, из которых состоит молекула сложного вещества.
Кислород – второй по электроотрицательности элемент, поэтому в окислительно-восстановительных процессах он выступает в качестве окислителя. Горение, гниение, ржавление и дыхание протекают при участии кислорода.
Только при взаимодействии с фтором он проявляет восстановительные свойства:
Дифторид кислорода может быть получен при быстром пропускании фтора через 2 % раствор щелочи: