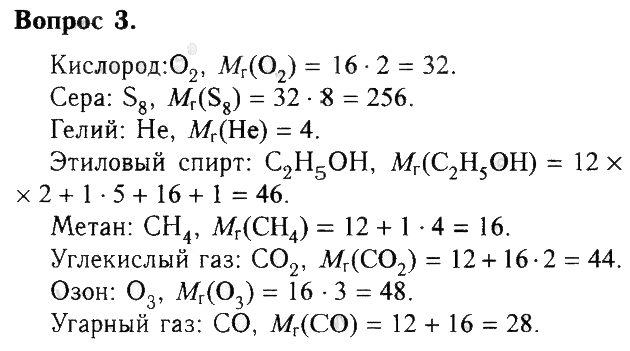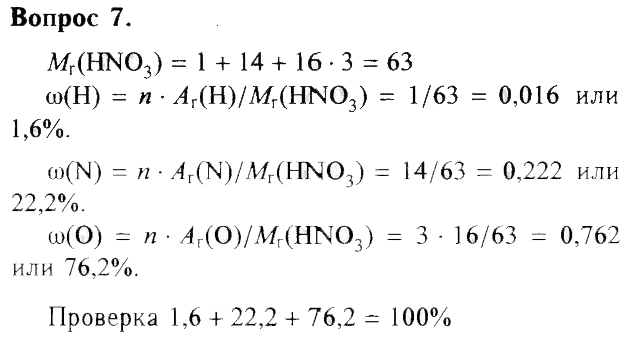Что означает 3o2 по химии
Кислород: химия кислорода
Кислород
Положение в периодической системе химических элементов
Кислород расположен в главной подгруппе VI группы (или в 16 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кислорода
Электронная конфигурация кислорода в основном состоянии :
+8O 1s 2 2s 2 2p 4 1s 

Атом кислорода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 2 неподеленные электронные пары в основном энергетическом состоянии.
Физические свойства и нахождение в природе
Озон О3 — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода.
Кислород — это самый распространённый в земной коре элемент. Кислород входит в состав многих минералов — силикатов, карбонатов и др. Массовая доля элемента кислорода в земной коре — около 47 %. Массовая доля элемента кислорода в морской и пресной воде составляет 85,82 %.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе.
Способы получения кислорода
В промышленности кислород получают перегонкой жидкого воздуха.
Лабораторные способы получения кислорода:
Разложение перманганата калия:
Разложение бертолетовой соли в присутствии катализатора MnO2 :
2KClO3 → 2KCl + 3O2
Разложение пероксида водорода:
2HgO → 2Hg + O2
Соединения кислорода
| Степень окисления | Типичные соединения |
| +2 | Фторид кислорода OF2 |
| +1 | Пероксофторид кислорода O2F2 |
| -1 | Пероксид водорода H2O2 Пероксид натрия Na2O2 и др. |
| -2 | Вода H2O Оксиды металлов и неметаллов Na2O, SO2 и др. Соли кислородсодержащих кислот Кислородсодержащие органические вещества Основания и амфотерные гидроксиды |
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
Но чаще фосфор сгорает до оксида фосфора (V):
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000 о С), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
CS2 + 3O2→ CO2 + 2SO2
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Кислород окисляет азотистую кислоту :
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
Кислород
Газ без цвета, без запаха, составляет 21% воздуха.
Общая характеристика элементов VIa группы
От O к Po (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.
Основное состояние атома кислорода
У атома кислорода (как и атомы азота, фтора, неона) нет возбужденного состояния, так как отсутствует свободная орбиталь с более высоким энергетическим уровнем, куда могли бы перемещаться валентные электроны.
Атом кислорода имеется два неспаренных электрона, максимальная валентность II.
Природные соединения
Получение
В промышленности кислород получают из сжиженного воздуха. Также активно применяются кислородные установки, мембрана которых устроена как фильтр, отсеивающие кислород (мембранная технология).
В лаборатории кислород получают разложением перманганата калия (марганцовки) или бертолетовой соли при нагревании. Применяется реакция каталитического разложения пероксида водорода.
На подводных лодках для получения кислорода применяют следующую реакцию:
Химические свойства
Является самым активным неметаллом после фтора, образует бинарные соединения со всеми элементами кроме гелия, неона, аргона. Чаще всего реакции с кислородом экзотермичны (горение), ускоряются при повышении температуры.
Во всех реакциях, кроме взаимодействия со фтором, кислород проявляет себя в качестве окислителя.
F + O2 → OF2 (фторид кислорода, O +2 )
В реакциях кислорода с металлами образуются оксиды, пероксиды и супероксиды. Реакции с активными металлами идут без нагревания.
Известна реакция горения воды во фторе.
Все органические вещества сгорают с образованием углекислого газа и воды.
Процесс можно остановить на любой стадии в зависимости от желаемого результата.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Разница между 2O и O2
Основное различие между 2O и O2 является то, что 2O относится к двум свободным атомам кислорода, в то время как O2 относится к молекуле, имеющей два атома кислорода.
2O и O2 — два термина, которые часто путают нас. Оба термина означают, что есть два атома кислорода. Но разница между 2O и O2 заключается в состоянии этих атомов кислорода — независимо от того, свободны они или связаны друг с другом.
Содержание
Что такое 2O?
20 означает, что есть два атома кислорода. При этом эти атомы кислорода не связаны друг с другом, и они находятся в свободном состоянии. Здесь кислород находится в элементарном состоянии. Кроме того, эти атомы кислорода доступны для образования химических связей.

O2 представляет собой молекулу кислорода, имеющую два атома кислорода, связанных друг с другом посредством ковалентной химической связи. Здесь кислород находится в молекулярном состоянии. Кроме того, атомы кислорода в этой структуре уже находятся в химических связях. Таким образом, никакие дальнейшие связи не сформируются между ними. Важно отметить, что необходимо писать 2 как нижний индекс O: «O2».
Это соединение естественным образом встречается в газообразном состоянии, и оно необходимо для жизни на Земле, поскольку мы вдыхаем воздух состоящий из кислорода.

В чем разница между 2O и O2?
Хотя оба термина 2O и O2 означают, что имеется два атома кислорода, состояние кислорода у них является различным. Основное различие между 2O и O2 состоит в том, что 2O означает, что имеется два свободных атома кислорода, тогда как O2 означает, что это молекула, имеющая два атома кислорода. Кроме того, 2O находится в элементарном состоянии, в то время как O2 находится в молекулярном состоянии. Важно отметить, что при их написании мы обычно пишем 2 в 2O с тем же размером шрифта, что и O, но в O2 мы должны писать 2 как нижний индекс O.
Заключение — 2O против O2
Хотя оба термина 2O и O2 означают, что имеется два атома кислорода, состояние кислорода у них различное. Таким образом, ключевое отличие между 2O и O2 состоит в том, что 2O означает, что имеется два свободных атома кислорода, тогда как O2 означает, что это молекула, имеющая два атома кислорода.
Кубок главы по химии 2014. Очный этап. 6 и 7 класс. Решения
КУБОК ГЛАВЫ ПО ХИМИИ 2014. ОЧНЫЙ ЭТАП. 6 И 7 КЛАСС. РЕШЕНИЯ.
2 БАЛЛА ЗА КАЖДЫЙ ПРАВИЛЬНЫЙ ОТВЕТ. МАХ = 20 БАЛЛОВ
1) три молекулы воды 2) шесть молекул воды
3) три молекулы кислорода 4) три молекулы водорода
ПРАВИЛЬНЫЙ ОТВЕТ : 1. ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА.
1) 2; 2) 14; 3) 7; 4) 9; 5) столько же сколько и кислорода
ПРАВИЛЬНЫЙ ОТВЕТ : 2. ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА.
3. Абсолютная масса атома кислорода:
1) 16 г/моль 3) 16 2) 16 г 4) 2,667 ∙ 10-26 кг 5) 6,023 * 1023
ПРАВИЛЬНЫЙ ОТВЕТ : 4. ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА.
4. Формула молекулы вещества, которая состоит из двух атомов натрия,
одного атома кремни я и трех атомов кислорода: ____________________
ПРАВИЛЬНЫЙ ОТВЕТ : Na2SiO3 . ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА.
5. Выберите формулу пероксида натрия, состоящего из двух атомов натрия и двух атомов кислорода.
1) NaO2 2) Na2O 3) Na2O2 4) Na2O4
ПРАВИЛЬНЫЙ ОТВЕТ : 3 . ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА.
6. Распределите вещества на простые (А) и сложные (Б).
ПРАВИЛЬНЫЙ ОТВЕТ : В ТАБЛИЦЕ. ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА.
ЕСЛИ ОТВЕТ ВЕРНЫЙ ЧАСТИЧНО, ТО ЗА КАЖДЫЕ ДВЕ ВЕРНЫЕ ЦИФРЫ 0,5 БАЛЛОВ. ВСЕГО НЕ БОЛЕЕ 1,5 БАЛЛОВ.
Формула вещества: А) H2SO4 Б) Cu(OH)2 В) AgNO3 Г) BaCl2
Относительная молекулярная масса:
ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА. ЕЛИ ОТВЕТ НЕ ПОЛНЫЙ, ТО ЗА КАЖДОЕ ВЕРНОЕ ЗНАЧЕНИЕ – 0,5 БАЛЛОВ.
8. В составе воздуха больше всего по массе:
1) кислорода 2) углекислого газа 3) воды 4) азота 5) озона 6) глюкозы
9. В воде практически не растворяется одно из следующих веществ:
1) сахар 2) поваренная соль 3) пищевая сода 4) уксусная кислота 5) мел 6) спирт
ПРАВИЛЬНЫЙ ОТВЕТ : 5. ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА.
10. Причиной парникового эффекта может быть избыток в атмосфере одного из газов:
1) водород 2) кислород 3) азот 4) озон 5) углекислый газ 6) гелий
ПРАВИЛЬНЫЙ ОТВЕТ : 5. ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА.
Задание № 2. В качестве топлива космических ракет часто используют 1,1-диметилгидразин, который получил техническое название – гептил. Эмпирическая формула этого вещества: N2C2H8 Вопрос 1. Какова массовая доля (в %) азота в гептиле?
РЕШЕНИЕ: ОТНОСИТЕЛЬНАЯ МОЛЕКУЛЯРНАЯ МАС СА ГЕПТИЛА = 60
НА АЗОТ ПРИХОДИТСЯ 28.
МАССОВАЯ ДОЛЯ АЗОТА В ГЕПТИЛЕ: 28/ 60 = 0, 466 ИЛИ 46,6 %
ЗА ПРАВИЛЬНОЕ РЕШЕНИЕ 2 БАЛЛА. ЗА КАЖДОЕ ПРАВИЛЬНОЕ ДЕЙСТВИЕ 0,5 БАЛЛОВ. ЗВ ИНОЕ, НО ВЕРНОЕ РЕШЕНИЕ 2 БАЛЛА.
Вопрос 2. Какое число химических элементов-неметаллов входит в состав гептила?
ПРАВИЛЬНЫЙ ОТВЕТ : 3. ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА.
Вопрос 3. При горении гептила в ракетном двигателе протекает химическая реакция:
N2C2H8 + О2 = N2 + CO2 + H2O
В приведённом уравнении нет коэффициентов. Напишите уравнение с коэффициентами.
N2C2H8 + 4 О2 = N2 + 2 CO2 + 4 H2O
ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА.
РЕШЕНИЕ. НАЙДЁМ ОБЪЁМ КОМНАТЫ: 12 * 5 * 3 = 180 м3
НАЙДЁМ СОДЕРЖАНИЕ ГЕПТИЛА В КОМНАТЕ: 180 * 0,03 = 5, 4 грамм
НАЙДЁМ МАССУ АКТИВИРОВАННОГО УГЛЯ: 5,4 / 0,3 = 18 грамм
ЗА ПРАВИЛЬНОЕ РЕШЕНИЕ 2 БАЛЛА. ЕСЛИ РШЕНИЕ ВЫПОЛНЕНО ЧАСТИЧНО, ТО ЗА КАЖДОЕ ВЕРНОЕ ДЕЙСТВИЕ 0,5 БАЛЛОВ. ЗА ЛЮБОЕ ИНОЕ, НО ВЕРНЕ РЕШЕНИЕ 2 БАЛЛА.
Вопрос 5. В качестве окислителя гептила в ракетных двигателях применялась концентрированная азотная кислота. Уравнение горения гептила в НNO3 описывается схемой:
5 N2C2H8 + 16 НNO3 = 13 N2 + 28 H2O + 10 CO2
Какое число формул сложных веществ в этом уравнении реакции?
ПРАВИЛЬНЫЙ ОТВЕТ : 4. ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА.
Задание № 3. Формула нитрата аммония: NH4NO3. Это вещество находит широкое применение в качестве азотного удобрения. Впервые получена Глаубером в 1659 году.
Вопрос 2. Смесь нитрата аммония с алюминиевой пудрой (и небольшое количество мазута), под названием аммонал, находила применение в боеголовках ракет, применяемых в годы второй мировой войны. Расставьте коэффициенты в уравнении взрывного разложения аммонала:
NH4NO3 + Al = N2 + H2O + Al2O3 + Q
3 NH4NO3 + 2 Al = 3 N2 + 6 H2O + Al2O3 + Q
ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА.
Вопрос 3. Смесь нитрата аммония, цинковой пудры и поваренной соли при определённом соотношении используется в качестве химической зажигалки в походных условиях. Смесь может самовоспламеняться при действии небольшого количества воды, которую в походе всегда можно раздобыть. Хлорид натрия используется в этой смеси в качестве катализатора. Что Вы понимаете под словом катализатор?
ПРАВИЛЬНЫЙ ОТВЕТ: КАТАЛИЗАТОР – ЭТО ВЕЩЕСТВО, КОТОРОЕ В МАЛЫХ КОЛИЧЕСТВАХ СИЛЬНО УСКОРЯЕТ ХИМИЧЕСКУЮ РЕАКЦИЮ, НО САМО ПРИ ЭТОМ НЕ РАСХОДУЕТСЯ.
ЗА ПРАВИЛЬНЫЙ ОТВЕТ 2 БАЛЛА. ЗА ИНОЙ, НО ПО-СУТИ, ВЕРНЫЙ ОТВЕТ 2 БАЛЛА. ЗА НЕПОЛНЫЙ ОТВЕТ НЕ БОЛЕЕ 1 БАЛЛА
Вопрос 4. Нитрат аммония при температуре ниже 270 °C: может разлагаться по схеме:
NH4NO3 = N2O + 2 H2O
«Образующийся оксид азота (II) иногда называют веселящим газом из-за его опьяняющего действия».
Найдите ошибку в предложении взятом в кавычки и исправьте её.
ЗА ВЕРНО НАЙДЕННУЮ ОШИБКУ В ПРЕДЛОЖЕНИИ 2 БАЛЛА.
Вопрос 5. Известно, что при температуре 200 С в 100 грамм воды растворяется 193 грамма нитрата аммония. Сколько грамм нитрата аммония выпадет в осадок из горячего раствора, содержащего 2500 грамм воды и 5800 грамм нитрата аммония, при охлаждении раствора от 800 С до 200С.
РЕШЕНИЕ: в 100 грамм воды растворяется 193 грамма нитрата аммония
в 2500 грамм воды растворяется Х грамм нитрата аммония
ЗА ВЕРНОЕ РЕШЕНИЕ: 2 БАЛЛА.
ЕСЛИ РЕШЕНИЕ ЧАСТИЧНОЕ, ТО ЗА КАЖДОЕ ДЕЙСТВИЕ О,5 БАЛЛОВ, НО ВСЕГО НЕ БОЛЕЕ 1,5 БАЛЛОВ.
ЗА ЮБОЕ ИНОЕ РЕШЕНИЕ, ПРИВОДЯЩЕЕ К ВЕРНОМУ ОТВЕТУ, 2 БАЛЛА
Что означают записи: 3H; 2H2O; 5O2.
Вопросы:
1. Что означают записи: 3H; 2H2O; 5O2?
2. Запишите формулу сахарозы, если известно, что в состав её молекулы входят двенадцать атомов углерода, двадцать два атома водорода и одиннадцать атомов кислорода.
3. Используя рисунок 2 (см. с. 5), запишите формулы веществ и рассчитайте их относительные молекулярные массы.
4. Какой форме существования химического элемента кислорода соответствует каждая из следующих записей: 3O; 5O2; 4CO2?
5. Почему относительная атомная масса элемента и относительная молекулярная масса вещества не имеют единиц измерения?
6. B каком из веществ, формулы которых SO2 и SO3, массовая доля серы больше? Ответ подтвердите расчетами.
7. Вычислите массовые доли элементов в азотной кислоте HNO3.
8. Дайте полную характеристику глюкозы (C6H12O6, используя пример описания углекислого газа CO2 (см. с. 42).
Ответы: