Что означает бром в химии
Определение и физическая характеристика
Бром, обозначаемый символом Вг, является галогеном и входит в VII группу периодической таблицы химических элементов. Вещество имеет атомный номер 35, а его атомная масса составляет 79,904 дальтонов. Молярная масса составляет 79,904 г/моль. Относительная молекулярная масса молекулы равна 159,808, а её молярная масса — 160 г/моль. Бром, встречающийся в природе, состоит из двух нуклидов с массовыми числами 79 и 81.
Существует множество искусственных радиоактивных изотопов. Среди них самым интересным считается 80Вr, поскольку на его примере советский физик И. В. Курчатов открыл изомерию атомных ядер.
Бром плохо растворяется в воде. Так, если её температура не превышает 5,84 °С, то вещество образует тёмно-красные кристаллы. Лучше всего для его растворения подходят органические составы. Извлекать элемент из различных водных соединений позволяет именно это физическое свойство.
Бром в любом физическом виде состоит из двухатомных молекул. Распад на атомы становится хорошо заметен при температуре 800 °C. Но также его можно наблюдать при действии света.
Химическое строение и свойства
Внешние электроны атома имеют конфигурацию 4s24p5. Необходимо отметить, что такое химическое свойство брома, как степень окисления, разнится в зависимости от соединения, к примеру, у гипобромитов этот показатель равен +1, а у броматов он составляет +5.
В соединениях валентность брома переменна. Атом вещества имеет заряд только тогда, когда является ионом, заряд ядра атома составляет 35. Представить электронную формулу брома можно следующим образом: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5. Структурная же формула имеет вид: Br-Br.
Неметалл является химически активным, а потому по способности к реакции располагается между хлором и йодом. Сильное разогревание, иногда сопровождающееся горением, возникает, когда вещество взаимодействует со следующими реагентами:
Так же протекает реакция вещества с некоторыми металлами, к примеру, калием и алюминием. Но большинство металлических элементов плохо реагирует с безводным бромом, потому что на их поверхности образуется защитная плёнка бромида, который не растворяется в этом реагенте.
Самыми устойчивыми к такой реакции, даже при высокой температуре и наличии воды, считаются следующие металлы:
У золота с бромом взаимодействие проходит довольно активно. Кислород, азот и углерод не создают с элементом прямых соединений даже при повышенной температуре. Чтобы эти вещества соединились, химики применяют различные косвенные методы. К примеру, очень непрочный оксид Вr3О8 получают посредством воздействия озона на бром при 80 °C. Реагировать непосредственно с элементом способны галогены, в результате их взаимодействия образуются BrF3, BrCl и другие соединения.
Бром относится к сильным окислителям. Элемент способен вытеснить из химических соединений йод. Само же вещество подвергается вытеснению хлором и фтором.
Выделить чистый неметалл из бромидов на основе воды можно посредством использования сильных окислителей, поместив все реагенты в кислую среду. Растворяясь в воде, вещество вступает с нею в слабую реакцию, результатом которой становится образование бромистоводородной и бромноватистой кислот. Водный раствор элемента называется бромной водой.
Неметалл растворяется в щелочах:
Взаимодействие брома и органических соединений чаще всего проходит с характерным присоединением углерода по двойной связи и замещением водорода. Обычно это происходит при воздействии различных катализаторов или света. Ещё одной распространённой химической реакций является бромирование, суть которого заключается во введении атома реагента в соединение посредством химической реакции вещества с ненасыщенной молекулой или замещения водорода.
Нахождение в природе
Основная часть природного брома рассеяна в земной коре. Больше всего вещества содержится в породах, сформированных магмой. Этот элемент можно обнаружить рядом с хлором. Так, соли элемента встречаются в солевых хлорных отложениях, в морской воде, насыщенном растворе соляных озёр и рассолах, находящихся под землёй, которые зачастую связаны с месторождениями соли и нефти. Так как вещество хорошо растворяется в воде, его соли скапливаются в рассолах, оставшихся на месте озёр и заливов.
Неметалл перемещается в форме хорошо растворимых соединений, а потому его довольно сложно встретить в твёрдой минеральной форме. Минералами становятся бромирит AgBr, эмболит Ag (Cl, Вг) и йодэмболит Ag (Cl, Вr, I), которые образуются в зонах окисления сульфидных месторождений серебра, сформировавшихся в областях пустынь и полупустынь.
Промышленное получение
В промышленности для получения брома используют морскую воду, озёрные и подземные рассолы, а также калийные щёлоки. Для выделения вещества применяют хлор. Процедура состоит из следующих этапов:
Метод с применением воздуха позволяет получать бром из рассолов даже с небольшим количеством вещества. Применять к таким смесям паровой способ экономически невыгодно, поскольку на выделение малого количества реагента тратится значительное количество пара.
Применение вещества
Прежде всего, вещество является основой для создания бромистых солей и различных производных на основе органики. Но и сам реактив, и его соединения довольно широко используются во многих областях жизнедеятельности человека:
Бром в организме
Вещество содержится в тканях всех животных и растений. Его обнаружили практически во всех жидкостях тела. Если человек здоров, то в его организме уровень брома составляет от 0,11 до 2,00 мг/%. Для поддержания этого показателя в сутки необходимо получать не больше 0,8−1 г реактива.
Радиоактивный бром позволил выявить, что вещество поглощается щитовидной железой, почками и мозгом. Бромиды, которые были введены в животные организмы, увеличили концентрацию процессов торможения, проходящих в головном мозге. Они способствовали приведению в норму нервной системы, которая пострадала от чрезмерного напряжения, возникшего в результате подобного процесса.
Но следует учитывать, что химический элемент задерживается в щитовидной железе, вступая в конкуренцию с йодом. Это влияет на работу органа, что отражается на обмене веществ.
Бром плохо усваивается, если в реакции будут участвовать хлор, алюминий, йод и фтор. Чтобы избежать такой ситуации, перед началом лечения препаратами, содержащими бромные соли, необходимо проконсультироваться с врачом.
Опасность и вред
Очень опасны пары вещества:
Во избежание отравления все работы с реагентом необходимо осуществлять в специальных шкафах, оборудованных хорошей вытяжной системой. Если же защититься от паров не удалось, то следует подышать сильно разбавленным водным раствором аммиака, возможно применение раствора на этиловом спирте. Для устранения боли в горле, возникшей из-за воздействия отравляющего газа, нужно выпить хорошо нагретое молоко.
В жидком виде попавшее на кожу вещество вызывает ожоги, которые плохо заживают. В случае поражения кожи реагент необходимо тщательно смыть большим количеством воды или сдуть мощной воздушной струёй. Место ожога следует смазать ланолином.
Представителям профессий, требующих постоянной концентрации внимания, к примеру, водителям и альпинистам, применять лекарства на основе брома не рекомендуется. Это обусловлено свойством вещества снимать возбуждённое состояние нервной системы, расслаблять её.
Признаки избытка и нехватки
Чаще всего переизбыток вещества в организме возникает при неправильном употреблении бромосодержащих препаратов. Это состояние может привести к серьёзным проблемам со здоровьем. Признаки избытка микроэлемента:
Нехватка брома не менее серьёзная проблема. Из-за отсутствия в организме необходимого количества вещества у беременных женщин повышается вероятность выкидыша на разных сроках.
Проявляться недостаток микроэлемента может в виде таких симптомов:
Эти проблемы редко ассоциируются именно с нехваткой брома, но всё же лучше обратиться к врачу и сдать необходимые анализы. Такая мера позволит установить причину недомогания и исключить возможность развития более серьёзных заболеваний.
Бром является важным химическим элементом. Он необходим для нормальной жизнедеятельности растений и животных. Недостаток этого неметалла, как и его избыток, может привести к развитию заболеваний. Кроме того, вещество активно применяется в различных сферах деятельности человека. На его основе создаются лекарственные препараты, химические реагенты и инсектициды.
Что означает бром в химии
Бром / Bromum (Br), 35
[Ar] 3d 10 4s 2 4p 5
Содержание
История
Бром был открыт в 1826 году молодым преподавателем колледжа города Монпелье А. Ж. Баларом. Открытие Балара сделало его имя известным всему миру. Из одной популярной книги в другую кочует утверждение, что огорчённый тем, что в открытии брома никому неизвестный Антуан Балар опередил самого Юстуса Либиха, Либих воскликнул, что, дескать, не Балар открыл бром, а бром открыл Балара. Однако это неправда, или, точнее, не совсем правда: фраза принадлежала не Ю. Либиху, а Шарлю Жерару, который очень хотел, чтобы кафедру химии в Парижском университете занял Огюст Лоран, а не избранный на должность профессора А. Балар.
Происхождение названия
Нахождение в природе
Кларк брома — 1,6 г/т. Бром широко распространён в природе и в рассеянном состоянии встречается почти повсеместно. Почти все соединения брома растворимы в воде и поэтому легко выщелачиваются из горных пород. Как примесь, он есть в сотнях минералов. Но имеется лишь небольшое количество нерастворимых в воде минералов — галогенидов серебра и меди. Самый известный из них — бромаргирит AgBr. Другие минералы — йодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br). Собственных минералов брома мало еще и потому, что его ионный радиус очень большой и ион брома не может надежно закрепиться в кристаллической решетке других элементов, вместе с катионами средних размеров. В накоплении брома основную роль играют процессы испарения океанической воды, в результате чего он накапливается как в жидкой, так и в твёрдой фазах. Наибольшие концентрации отмечаются в конечных маточных рассолах. В горных породах бром присутствует главным образом в виде ионов, которые мигрируют вместе с грунтовыми водами. Часть земного брома связана в организмах растений в сложные и большей частью нерастворимые органические соединения. Некоторые растения активно накапливают бром. Это в первую очередь бобовые — горох, фасоль, чечевица, а также морские водоросли. В море сосредоточена большая часть брома. Есть он и в воде соленых озер, и в подземных водоносных пластах, сопутствующих месторождениям горючих ископаемых, а также калийных солей и каменной соли. Есть бром и в атмосфере, причем содержание этого элемента в воздухе приморских районов всегда больше, чем в районах с резко континентальным климатом.
В качестве исходного сырья для производства брома служат:
Получение
Бром получают химическим путём из рассола Br − :
Физические свойства
При обычных условиях бром — красно-бурая жидкость с резким неприятным запахом, ядовит, при соприкосновении с кожей образуются ожоги. Бром — одно из двух простых веществ (и единственное из неметаллов), наряду со ртутью, которое при комнатной температуре является жидким. Плотность при 0 °C — 3,19 г/см³. Температура плавления (затвердевания) брома −7,2 °C, кипения 58,8 °C, при кипении бром превращается из жидкости в буро-коричневые пары, при вдыхании раздражающие дыхательные пути. Стандартный электродный потенциал Br2/Br − в водном растворе равен +1,065 В.
Природный бром состоит из двух стабильных изотопов 79 Br (50,56 %) и 81 Br (49,44 %). Искусственно получены многочисленные радиоактивные изотопы брома.
Химические свойства
В свободном виде существует в виде двухатомных молекул Br2. Заметная диссоциация молекул на атомы наблюдается при температуре 800 °C и быстро возрастает при дальнейшем росте температуры. Диаметр молекулы Br2 равен 0,323 нм, межъядерное расстояние в этой молекуле — 0,228 нм.
Бром немного, но лучше других галогенов растворим в воде (3,58 г в 100 г воды при 20 °C), раствор называют бромной водой. В бромной воде протекает реакция с образованием бромоводородной и неустойчивой бромноватистой кислот:
С большинством органических растворителей бром смешивается во всех отношениях, при этом часто происходит бромирование молекул органических растворителей.
По химической активности бром занимает промежуточное положение между хлором и иодом. При реакции брома с растворами иодидов выделяется свободный иод:
Напротив, при действии хлора на бромиды, находящиеся в водных растворах, выделяется свободный бром:
При реакции брома с серой образуется S2Br2, при реакции брома с фосфором — PBr3 и PBr5. Бром реагирует также с неметаллами селеном и теллуром.
Реакция брома с водородом протекает при нагревании и приводит к образованию бромоводорода HBr. Раствор HBr в воде — это бромоводородная кислота, по силе близкая к соляной кислоте HCl. Соли бромоводородной кислоты — бромиды (NaBr, MgBr2, AlBr3 и др.). Качественная реакция на присутствие бромид-ионов в растворе — образование с ионами Ag + светло-желтого осадка бромида серебра AgBr, практически нерастворимого в воде.
С кислородом и азотом бром непосредственно не реагирует. Бром образует большое число различных соединений с остальными галогенами. Например, со фтором бром образует неустойчивые BrF3 и BrF5, с иодом — IBr. При взаимодействии со многими металлами бром образует бромиды, например, AlBr3, CuBr2, MgBr2 и др. Устойчивы к действию брома тантал и платина, в меньшей степени — серебро, титан и свинец.
Бром — сильный окислитель, он окисляет сульфит-ион до сульфата, нитрит-ион — до нитрата и т. д.
При взаимодействии с органическими соединениями, содержащими двойную связь, бром присоединяется, давая соответствующие дибромпроизводные:
Присоединяется бром и к органическим молекулам, в составе которых есть тройная связь. Обесцвечивание бромной воды при пропускании через нее газа или добавлении к ней жидкости свидетельствует о том, что в газе или в жидкости присутствует непредельное соединение.
При нагревании в присутствии катализатора бром реагирует с бензолом с образованием бромбензола C6H5Br (реакция замещения).
При взаимодействии брома с растворами щелочей и с растворами карбонатов натрия или калия образуются соответствующие бромиды и броматы, например:
Бромсодержащие кислоты
Помимо бескислородной бромоводородной кислоты HBr, бром образует ряд кислородных кислот: бромную HBrO4, бромноватую HBrO3, бромистую HBrO.
Применение
В химии
В технике
В медицине
В производстве оружия
Со времен Первой мировой войны бром используется для производства боевых отравляющих веществ.
Физиологическое действие
Утечкой брома из железнодорожного вагона было вызвано чрезвычайное происшествие в городе Челябинске, вызвавшее отравление сотен жителей. Более 50 человек на следующий день лежали в больницах города с острым отравлением. Большинство — жители Ленинского района.
Особенности работы
При работе с бромом следует пользоваться защитной спецодеждой, противогазом, специальными перчатками. Из-за высокой химической активности и токсичности, как паров брома, так и жидкого брома его следует хранить в стеклянной, плотно укупоренной толстостенной посуде. Сосуды с бромом располагают в ёмкостях с песком, который предохраняет сосуды от разрушения при встряхивании. Из-за высокой плотности брома сосуды с ним ни в коем случае нельзя брать только за горло (горло может оторваться, и тогда бром окажется на полу).
По реакции, указанной ниже, целесообразно посыпать проливы карбонатом натрия:
Однако реакция элементарного брома с содой носит сильно экзотермический характер, что ведёт к увеличению испарения брома, к тому же, выделяющаяся углекислота также способствует испарению, поэтому пользоваться вышеописанными методами не рекомендуется. Лучше всего для дегазации брома подходит водный раствор тиосульфата натрия Na2S2O3. Для локализации больших проливов брома можно использовать раствор тиосульфата натрия с добавками пенообразующих веществ и аэросила. Этот же раствор (3-5 % тиосульфат натрия) используется для смачивания ватно-марлевых повязок, которые помогают защитить органы дыхания от паров брома.
Мифы и легенды
Существует широко распространенная легенда о том, что в армии будто бы добавляют бром в еду для снижения полового влечения. Происхождение этого мифа неизвестно.
Что означает бром в химии
БРОМ (Bromum, Br) – элемент 17 (VIIa) группы периодической системы, атомный номер 35, относительная атомная масса 79,904. Природный бром состоит из двух стабильных изотопов: 79 Br (50,69 ат.%) и 81 Br (49,31 ат.%), а всего известно 28 изотопов с массовыми числами от 67 до 94. В химических соединениях бром проявляет степени окисления от –1 до +7, в природе встречается исключительно в степени окисления –1.
История открытия.
Вплотную к открытию брома практически одновременно подошли сразу трое ученых, но официально признанным первооткрывателем суждено было стать только одному из них.
В 1825 молодой французский химик Антуан Жером Балар (Antoine-Jérôme Balard), работавший препаратором в Фармакологической школе при университете небольшого южного городка Монпелье, приступил к своим первым самостоятельным научным исследованиям. С древнейших времен Монпелье был знаменит своими соляными промыслами. Для добычи соли на берегу моря вырывали бассейны и заполняли их морской водой. После того, как под действием солнечных лучей вода испарялась, выпавшие кристаллы соли вычерпывали, а оставшийся маточный раствор (рапу) возвращали обратно в море.
Руководитель Балара, профессор Жозеф Англада (Joseph Anglada), поручил ему изучить химический состав сливаемого рассола и прибрежных морских водорослей. Действуя на рапу различными реактивами, Болар заметил, что при пропускании через нее хлора раствор приобретает интенсивный желтый цвет. Аналогично окрашивал хлор и щелочной экстракт золы водорослей. Вначале Балар предположил, что наблюдаемая окраска вызвана присутствием в исследуемых образцах иода, который, реагируя с хлором, и образует неизвестное вещество. Для начала он экстрагировал его последовательно эфиром и водным гидроксидом калия. Обработав полученный щелочной раствор пиролюзитом (MnO2) в сернокислой среде, Балар выделил неприятно пахнущую красно-бурую жидкость и попробовал разделить ее на составные части. Когда все попытки не принесли результата, стало ясно, что это новый элемент. Определив плотность и температуру кипения жидкости, а также изучив ее важнейшие химические свойства, 30 ноября 1825 Балар отправил доклад о своих опытах в Парижскую академию наук. В нем, в частности, для нового элемента было предложено название «мурид» (от латинского слова «muria» – рассол).
Для проверки сообщения была назначена комиссия из трех химиков: Луи Вокелена (Louis Nicolas Vauquelin), Луи Тенара (Louis Jacques Thénard) и Жозефа Гей-Люссака. Повторив описанные эксперименты, они подтвердили выводы Балара, но название «мурид» признали неудачным, т.к. что соляная кислота называлась тогда acidum muriaticum – муриевой (от гипотетического элемента мурия), а ее соли – муриатами и употребление столь похожих названий «мурид» и «мурий» могло вызвать недоразумения. Согласно рекомендации номенклатурного комитета при академии наук новый элемент было предложено назвать бромом от греческого brwmoV – зловонный. В России название «бром» утвердилось не сразу, в течение долгого времени для элемента № 35 использовались названия «вром», «мурид», и «вромид».
Позднее выяснилось, что впервые элементарный бром получил не Балар а студент известного немецкого химика Леопольда Гмелина Карл Левиг (Carl Jacob Löwig, Leopold Gmelin), который в 1825 в Гейдельбергском университете выделил его из воды источника в Крейцнахе. Пока он приготовлял большее количество препарата для исследования, появилось сообщение Балара.
Вплотную к открытию брома подошел и знаменитый немецкий химик Юстус Любих, точно так же, как и Балар, принявший его за соединение хлора и иода.
Можно сказать, что открытие брома лежало на поверхности, и французский химик Шарль Жерар (Charles Frédéric Gerhardt) сказал даже, что «Не Балар открыл бром, а бром открыл Балара».
В природе бром почти всегда встречается вместе с хлором в виде изоморфной примеси в природных хлоридах (до 3% в сильвине KCl и карналлите KCl·MgCl2·6H2O). Собственные минералы брома: бромаргирит AgBr, бромсильвинит KMgBr3·6H2O и эмболит Ag(Br, Cl) – встречаются редко и промышленного значения не имеют. Они были открыты гораздо позже элементарного брома (бромаргирит – в Мексике, в 1841). Кларк (среднее содержание в земной коре) брома в земной коре составляет 2,1·10 –4 %.
Большое количество брома содержится в гидросфере Земли (около 3/4 от имеющегося в земной коре): в океанах (6,6·10 –3 %), соляных озерах, подземных рассолах и грунтовых водах. Наибольшая концентрация растворенных бромидов – около 6 мг/л – отмечена в воде Мертвого моря, а общее количество брома в нем оценивается в 1 млрд. тонн. Вместе с брызгами соленой воды соединения брома попадают в атмосферу.
Получение брома.
Промышленное производство брома началось в 1865 на базе Страссфуртского соляного месторождения в Германии, двумя годами позже бром стали добывать в США, в штате Вирджиния. В 1924 на борту судна «Этила» была продемонстрирована возможность добычи брома из морской воды, а в 1934 организовано промышленное производство, основанное на этом методе. В России первый бромный завод был построен в 1917 на соляном озере Сакское.
Все промышленные способы получения брома из соляных растворов основаны на его вытеснении хлором из бромидов:
При получении брома методом выдувания исходное сырье (рапу соляных озер, попутные воды нефтяных скважин, морскую воду) подкисляют серной кислотой до pH » 3,5 и обрабатывают избыточным количеством хлора. Затем рассол, содержащий растворенный бром, подают в верхнюю часть колонны, заполненной небольшими керамическими кольцами. Раствор стекает по кольцам, а навстречу ему продувают мощную струю воздуха, при этом бром переходит в газовую фазу. Бромовоздушную смесь пропускают через раствор карбоната натрия:
3Na2CO3 + 3Br2 = 5NaBr + NaBrO3 + 3CO2
Для выделения брома из полученной смеси бромида и бромата натрия, ее подкисляют серной кислотой:
Если содержание бромидов в исходном сырье достаточно велико, то вместо воздуха экономически выгоднее использовать водяной пар.
Другие предложенные способы извлечения брома из хлорированного рассола: экстракция углеводородами или адсорбция ионообменными смолами – не получили широкого распространения.
Часть используемых в промышленности растворов бромидов (в США до 35%) отправляют на повторную переработку с целью получения дополнительных количеств брома.
Мировое производство брома (по данным на 2003) составило около 550 тыс. тонн в год, большая часть его производится в США (39,4%), Израиле (37,6%), и Китае (7,7%). Динамика производства брома в различных странах мира приведена в таблице 1.
| Табл. 1. ДИНАМИКА МИРОВОГО ПРОИЗВОДСТВА БРОМА (в тыс. тонн). | |||||
| Страна | 1999 | 2000 | 2001 | 2002 | 2003 |
| США | 239 | 228 | 212 | 222 | 216 |
| Израиль | 181 | 210 | 206 | 206 | 206 |
| Китай | 42 | 42 | 40 | 42 | 42 |
| Великобритания | 55 | 32 | 35 | 35 | 35 |
| Иордания | – | – | – | 5 | 20 |
| Япония | 20 | 20 | 20 | 20 | 20 |
| Украина | 3 | 3 | 3 | 3 | 3 |
| Азербайджан | 2 | 2 | 2 | 2 | 2 |
| Франция | 1,95 | 2 | 2 | 2 | 2 |
| Индия | 1,5 | 1,5 | 1,5 | 1,5 | 1,5 |
| Германия | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 |
| Италия | 0,3 | 0,3 | 0,3 | 0,3 | 0,3 |
| Туркменистан | 0,15 | 0,15 | 0,15 | 0,15 | 0,15 |
| Испания | 0,1 | 0,1 | 0,1 | 0,1 | 0,1 |
| Всего в мире | 547 | 542 | 523 | 540 | 548 |
Цена элементного брома колеблется от 700 до 1000 долл. за тонну. Годовая потребность России в броме оценивается в 20–25 тыс. тонн, она удовлетворяется, в основном, за счет импорта из США и Израиля.
В лаборатории бром можно получить взаимодействием бромидов с подходящим окислителем, например перманганатом калия или диоксидом марганца, в кислой среде.
Выделившийся бром отделяют экстракцией неполярными растворителями или перегонкой с водяным паром.
Простое вещество.
В твердом, жидком и газообразном состоянии бром существует в виде двухатомных молекул Br2, заметная диссоциация на атомы начинается только при 800° C, диссоциация происходит и под действием света. Элементный бром является сильным окислителем, он непосредственно реагирует почти со всеми неметаллами (за исключением инертных газов, кислорода, азота и углерода) и многими металлами, эти реакции зачастую сопровождаются воспламенением (например, с фосфором, сурьмой, оловом):
Многие металлы медленно реагируют с безводным бромом из-за образования на их поверхности пленки бромида, нерастворимого в броме. Из металлов наиболее устойчивы к действию брома (даже при повышенных температурах и в присутствии влаги) серебро, свинец, платина и тантал. Золото, в отличие от платины, легко реагирует с ним, образуя AuBr3.
В водной среде бром окисляет нитриты до нитратов, аммиак до азота, иодиды до свободного иода, серу и сульфиты до серной кислоты:
2NH3 + 6Br2 = N2
Бром умеренно растворим в воде (3,58 г в 100 г при 20° C), при охлаждении этого раствора до 6° C из него выпадают гранатово-красные кристаллы клатратного гидрата брома состава 6Br2·46H2O. Растворимость брома существенно возрастает при добавлении бромидов за счет образования прочных комплексных соединений:
В водном растворе брома («бромной воде») существует равновесие между молекулярным бромом, бромид-ионом и оксокислотами брома:
В насыщенном растворе бром диссоциирован на 0,85%, в 0,001-молярном – на 17%.
При хранении бромной воды на свету она постепенно разлагается с выделением кислорода из-за фотолиза бромноватистой кислоты:
2HOBr + hv = 2HBr + O2
При взаимодействии брома с растворами щелочей образуются соответствующие бромиды и гипобромиты (на холоду) или броматы:
Br2 + 2NaOH = NaBr + NaBrO + H2O (при t 3 ) бесцветный газ с резким запахом, дымящий на воздухе из-за взаимодействия с парами воды. При охлаждении до –67° C бромоводород переходит в жидкое состояние. HBr хорошо растворим в воде: при 0° C в одном объеме воды растворяется 612 объемов бромоводорода, в растворе HBr диссоциирует на ионы:
Водный раствор HBr называется бромоводородной кислотой, она относится к числу сильных кислот (pKa = –9,5). В HBr бром имеет степень окисления –1 и поэтому бромоводородная кислота проявляет восстановительные свойства, она окисляется концентрированной серной кислотой и кислородом воздуха (на свету):
H2SO4 + 2HBr = Br2 + SO2
При взаимодействии с металлами, а также с оксидами и гидроксидами металлов бромоводородная кислота образует соли – бромиды:
HBr + KOH = KBr + H2O
В промышленности бромоводород получают прямым синтезом из элементов в присутствии катализатора (платины или активированного угля) H2 + Br2 = 2HBr и, в качестве побочного продукта, при бромировании органических соединений:
В лаборатории HBr может быть получен при действии концентрированной фосфорной кислоты на бромиды щелочных металлов при нагревании:
Удобным лабораторным методом синтеза HBr является также взаимодействие брома с бензолом или декалином в присутствии железа:
Бромоводород применяется для получения бромидов и некоторых органических соединений брома.
Бромид калия KBr – бесцветное кристаллическое вещество, хорошо растворимое в воде (65 г в 100 г воды при 20° C), tпл = 730° C. Бромид калия применяется при изготовлении фотоэмульсий и в качестве противовуалирующего вещества в фотографии. KBr хорошо пропускает инфракрасные лучи и поэтому служит материалом для изготовления линз для ИК-спектроскопии.
Бромид лития LiBr, представляет собой бесцветное гигроскопичное вещество (tпл = 552° C), хорошо растворимое в воде (63,9% при 20° C). Известен кристаллогидрат LiBr·2H2O. Бромид лития получают при взаимодействии водных растворов карбоната лития и бромоводородной кислоты:
Li2CO3 + 2HBr = 2LiBr + H2O + CO2
Бромид лития применяют при лечении психических заболеваний и хронического алкоголизма. Из-за высокой гигроскопичности LiBr используется как осушающее вещество в системах кондиционирования воздуха и для обезвоживания минеральных масел.
Бромноватистая кислота HOBr относится к слабым кислотам, она существует лишь в разбавленных водных растворах, которые получают взаимодействием брома с суспензией оксида ртути:
Соли бромноватистой кислоты называются гипобромитами, они могут быть получены взаимодействием брома с холодным раствором щелочи (см. выше), при нагревании щелочных растворов гипобромиты диспропорционируют:
3NaBrO = 2NaBr + NaBrO3
Степени окисления брома +3 соответствует бромистая кислота HBrO2, которая в настоящее время не получена. Известны только ее соли – бромиты, которые можно получить окислением гипобромитов бромом в щелочной среде:
Бромноватая кислота HBrO3 получена в растворах при действии разбавленной серной кислоты на растворы ее солей – броматов:
При попытке получения растворов с концентрацией выше 30% бромноватая кислота разлагается со взрывом.
Бромноватая кислота и броматы являются сильными окислителями:
Бромат калия KBrO3 – бесцветное кристаллическое вещество, растворимое в воде (в 100 г воды при 20° C растворяется 6,9 г KBrO3, при 100° C – 49,7 г). При нагревании до 434° C разлагается без плавления:
Бромат калия получают электролизом растворов KBr или взаимодействием гидроксида калия с бромом и хлором:
KBrO3 применяется в аналитической химии в качестве окислителя при броматометрическом титровании, он входит в состав нейтрализаторов для химической завивки.
Наиболее устойчивой из оксокислот брома является бромная кислота HBrO4, которая существует в водных растворах с концентрацией, не превышающей 6 моль/л. Несмотря на то, что HBrO4 – самый сильный окислитель среди кислородных кислот брома, окислительно-восстановительные реакции с ее участием протекают очень медленно. Так, например, бромная кислота не выделяет хлор из одномолярного раствора соляной кислоты, хотя эта реакция термодинамически выгодна. Особая устойчивость иона BrO4 – связана с тем, что атомы кислорода, окружая атом брома по тетраэдру, эффективно защищают его от атаки восстановителя. Растворы бромной кислоты можно получить подкислением растворов ее солей – перброматов, которые, в свою очередь, синтезируют электролизом растворов броматов, а также окислением щелочных растворов броматов фтором или фторидами ксенона:
NaBrO3 + XeF2 + 2NaOH = NaBrO4 + 2NaF + Xe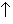
Из-за сильных окислительных свойств перброматов они были синтезированы только во второй половине 20 в. американским ученым Эваном Эпплманом (Evan H.Appelman) в 1968.
Кислородные кислоты брома и их соли могут быть использованы в качестве окислителей.
Биологическая роль и токсичность соединений брома.
Многие аспекты биологической роли брома в настоящее время еще не выяснены. В организме человека бром участвует в регуляции деятельности щитовидной железы, так как является конкурентным ингибитором иода. Некоторые исследователи полагают, что соединения брома участвуют в деятельности эозинофилов – клеток иммунной системы. Пероксидаза эозинофилов окисляет бромид-ионы до бромноватистой кислоты, которая помогает разрушать чужеродные клетки, в том числе и раковые. Недостаток брома в пище приводит к бессоннице, замедлению роста и уменьшению числа эритроцитов в крови. Ежедневное поступление брома в организм человека с пищей составляет 2–6 мг. Особенно богаты бромом рыба, злаки и орехи.
Применение брома и его соединений.
Первым известным применением соединений брома было производство пурпурного красителя. Его добывали еще во втором тысячелетии до нашей эры из моллюсков вида «мурекс», накапливающих бром из морской воды. Процесс извлечения красителя был очень трудоемок (из 8000 моллюсков можно получить всего 1 грамм пурпура) и позволить себе носить окрашенную им одежду могли только очень богатые люди. В древнем Риме носить ее могли только представители высшей власти, поэтому он получил название «королевский пурпур». Структуру действующего начала этого красителя установили только во второй половине 19 в., им оказалось соединение брома – 6,6’– диброминдиго. Бромпроизводные индиго, синтезируемые искусственно, используются для окрашивания тканей (в основном, хлопковых) и сейчас.
В 19 в. главными областями использования соединений брома были фотография и медицина.
Бромид серебра AgBr стал применяться как светочувствительный материал около 1840. Современные фотоматериалы на основе AgBr позволяют делать снимки с выдержкой 10 –7 секунды. Для изготовления фотопленки на основе бромида серебра, эта соль синтезируется в водном растворе желатина, при этом выпавшие кристаллики AgBr равномерно распределяются по всему объему раствора. После застывания желатина образуется тонкодисперсная суспензия, которую тонким слоем (толщиной от 2 до 20 мкм) равномерно наносят на поверхность носителя – прозрачной пленки, изготовленной из ацетата целлюлозы. В каждом квадратном сантиметре полученного слоя содержится несколько сот миллионов зерен бромида серебра, окруженных желатиновой пленкой. При попадании света на такую фотопленку происходит фотолитическое разложение AgBr:
Протеканию в фотоэмульсии обратного процесса – окисления серебра бромом, препятствует желатина. Фотолиз приводит к образованию в микрокристаллах AgBr групп атомов серебра с размерами 10 –7 –10 –8 см, так называемых центров скрытого изображения. Для получения видимого изображения бромид серебра на засвеченных участках восстанавливают до металлического серебра. Центры скрытого изображения катализируют (ускоряют) реакцию восстановления и позволяют провести ее, практически не затронув неосвещенных кристалликов AgBr. После растворения оставшегося бромида серебра на фотопленке получается черно-белое изображение (негатив), устойчивое к действию света. Для создания позитивного изображения нужно повторить процесс, освещая (обычно) фотобумагу через пленку, на которой с негативным изображением.
Соли брома оказались очень эффективными лекарственными средствами для лечения многих нервных болезней. Знаменитый русский физиолог И.П.Павлов сказал: «Человечество должно быть счастливо тем, что располагает таким драгоценным для нервной системы препаратом, как бром». Использование KBr в медицине в качестве седативного (успокоительного) и противосудорожного средства при лечении эпилепсии началось в 1857. В то время водные растворы бромида калия и натрия были известны под общим названием «бром». В течение долгого времени механизм действия препаратов брома оставался неизвестным, считалось, что бромиды уменьшают возбудимость, действуя аналогично снотворным. Лишь в 1910 один из учеников Павлова П.М.Никифоровский экспериментально показал, что бромиды усиливают процессы торможения в центральной нервной системе. Сейчас бромиды натрия и калия практически вышли из употребления при лечении нервных заболеваний. Они были вытеснены более эффективными броморганическими препаратами.
Теперь основной областью использования брома является производство антипиренов (от 40% мирового потребления брома). Антипирены – вещества, защищающие материалы органического происхождения от воспламенения. Их используют для пропитки тканей, изделий из древесины и пластмасс, производства негорючих красок. В качестве антипиренов применяются, в основном, ароматические бромпроизводные: дибромстирол, тетрабромфталевый ангидрид, декабромдифенилоксид, 2,4,6-трибромфенол и другие. Бромхлорметан используется в качестве наполнителя огнетушителей, предназначенных для тушения электропроводки.
Значительная часть брома (в США – 24%) в форме бромидов кальция, натрия и цинка расходуется для изготовления буровых растворов, которые закачивают в скважины для увеличения объема добытой нефти.
До 12% брома идет на синтез пестицидов и инсектицидов, используемых в сельском хозяйстве и для защиты деревянных изделий (метилбромид).
Элементный бром и его соединения применяются в процессах водоочистки и водоподготовки. Бром иногда используют для мягкой дезинфекции воды в бассейнах при повышенной чувствительности к хлору. На эти цели расходуется 7% производимого брома.
Около 17% брома расходуется на производство фотографических материалов, фармацевтических препаратов и высококачественной резины (бромбутилкаучука).
Органические соединения брома применяют для ингаляционного наркоза (галотан – 1,1,1-трифтор-2-хлор-2-бромэтан, CF3CHBrCl), в качестве обезболивающих, успокоительных, антигистаминных и антибактериальных препаратов, при лечении язвенных болезней, эпилепсии, сердечно-сосудистых заболеваний. Изотоп брома с атомной массой 82 находит применение в медицине при лечении опухолей и при изучении поведения бромсодержащих препаратов в организме.
Бромбутилкаучук получают в промышленности при неполном бромировании бутилкаучука – сополимера 97–98% изобутилена CH2=C(CH3)2 и ne 2–3% изопрена CH2=C(CH3)CH=CH2. В этом процессе происходит бромирование только изопреновых звеньев макромолекулы каучука:
Введение брома в бутилкаучук существенно повышает скорость его вулканизации. Бромбутилкаучук не имеет запаха, не выделяет вредных веществ при хранении и переработке, он отличается высокой степенью совулканизации с ненасыщенными каучуками и лучшей, чем у бутилкаучука, адгезией к другим полимерам. Галогенированные бутилкаучуки используются для герметизации резиновых изделий из других полимеров (например, в производстве автомобильных шин), для изготовления теплостойких транспортных лент с высоким сопротивлением истиранию, резиновых пробок, химически стойких обкладок емкостей.