Что означает h2o в химии
ВОДА, H2O
Смотреть что такое «ВОДА, H2O» в других словарях:
H2O: Просто добавь воды — H2O: Just Add Water … Википедия
Вода — ВОДА, H2O, жидкость без запаха, вкуса и цвета; плотность 1,000 г/см3 (3,98°C), tпл 0°C, tкип 100°C; при замерзании образует лед. Одно из наиболее распространенных соединений в природе (количество воды на поверхности Земли 1,39´1018 т, в атмосфере … Иллюстрированный энциклопедический словарь
вода — вода, H2O, жидкость без запаха, вкуса, цвета (в толстых слоях голубоватая). Простейшее устойчивое соединение водорода с кислородом (11,19% Н и 88,81% О по массе). Плотность 1000 г/см3 (3,98ºC), tпл 0ºС, tкип 100ºC. Самое распространённое вещество … Сельское хозяйство. Большой энциклопедический словарь
H2O: Просто добавь воды. Список серий телесериала — Содержание 1 Эпизоды 2 Обзор сезонов 3 Список серий 3.1 … Википедия
Вода — хим. соединение водорода и кислорода. Весовой состав ее: 11,19% Н и 88,81% О. Молекулярная масса 18,0153. В молекуле В. имеется 10 электронов (5 пар): одна пара внутренних электронов расположена вблизи ядра кислорода, две пары внешних электронов… … Геологическая энциклопедия
ВОДА — вода, окись водорода, H2O, простейшее устойчивое в обычных условиях химическое соединение водорода с кислородом (11,19% Н и 88,81% О по массе). Молекулярная масса 18,0160, t замерзания 0°C (при 1 ат), t кипения 100ºC (при 1 ат), плотность при… … Ветеринарный энциклопедический словарь
вода (вещество) — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN water (substance) Common liquid (H2O) which forms rain, rivers, the sea, etc., and which makes up a large part of the bodies of organisms. (Source: PHC)… … Справочник технического переводчика
вода адсорбційна — вода адсорбционная adsorbtion water Adsorptionswasser молекули H2O, які притягаються мінералами під впливом поверхневої енергії … Гірничий енциклопедичний словник
ВОДА — H2O, жидкость без запаха, вкуса, цвета (в толстых слоях голубоватая). Простейшее устойчивое соединение водорода с кислородом (11,19% Н и 88,81% О по массе). Плота. 1000 г/см3 (3,98 °С), tпл 0 °С, tкип 100 °С. Самое распространённое в во в природе … Сельско-хозяйственный энциклопедический словарь
Вода — окись водорода, H20, простейшее устойчивое в обычных условиях химическое соединение водорода с кислородом (11,19% водорода и 88,81% кислорода по массе), молекулярная масса 18,0160; бесцветная жидкость без запаха и вкуса (в толстых слоях… … Большая советская энциклопедия
Что означает h2o в химии
ВОДА – оксид водорода H2O.
В течение многих столетий вода считалась простым веществом. Лишь в 1783 французский химик Антуан Лоран Лавуазье (1743–1794) сумел разложить ее. Он показал, что вода состоит из водорода и кислорода, а в 1789 дал первую оценку ее количественного состава: 15% водорода и 85% кислорода. В дальнейшем количественный анализ воды проводили многие ученые. Долгое время образцовыми считались результаты французского химика и физика Жозефа Луи Гей-Люссака (1778–1850), полученные около 1808: 13,27% водорода и 86,73% кислорода. Только в 1821 шведский химик Йенс Якоб Берцелиус (1779–1848) и французский физик и химик Пьер Луи Дюлонг (1785–1838) сделали более правильный анализ воды и нашли, что она содержит 11,1% водорода и 88,9% кислорода, что очень близко к современным значениям (11,19% водорода и 88,81% кислорода).
Изучая объемные отношения реагирующих газов, Гей-Люссак показал, что один объем кислорода и два объема водорода при взаимодействии дают два объема водяного пара (при температуре выше 100° С). На основании этих результатов с учетом закона Авогадро был сделан вывод, что две частицы водяного пара образуются из одной частицы кислорода и двух частиц водорода. Таким образом была выведена формула воды H2O.
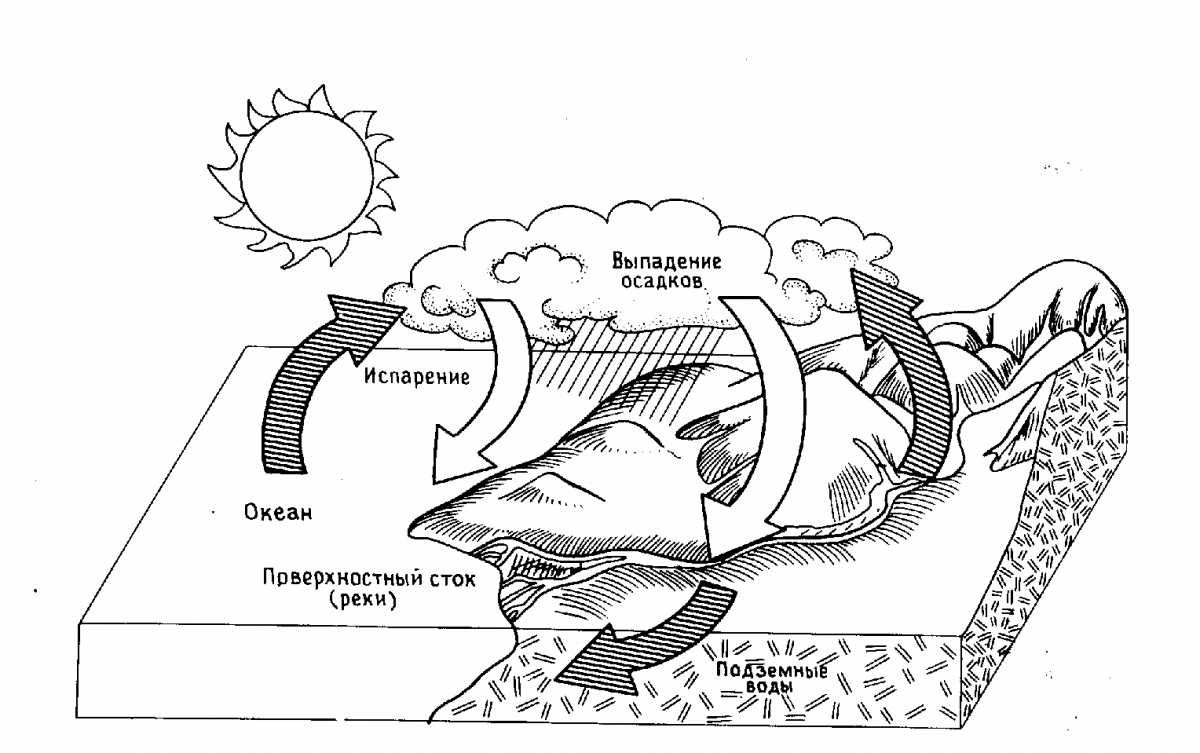
На нашей планете вода играет очень важную роль. В природе она совершает непрерывный круговорот. Под влиянием солнечной энергии жидкая вода (главным образом, в теплых морях и океанах) превращается в пар, который поднимается в верхние слои атмосферы. Это происходит благодаря тому, что водяной пар легче воздуха. Так происходит образование облаков, которые ветрами переносятся в другие части планеты, где в виде дождя и других осадков вода попадает на поверхность земли. Здесь она образует ручьи и реки, которые возвращают испаренную воду в океаны (рис. 1).
Чистой воды в природе нет. Даже наиболее чистая дождевая вода при падении через атмосферу растворяет газы и захватывает пыль. При ее испарении всегда остается небольшой остаток – около 0,03 г на литр. На поверхности земли вода дополнительно растворяет многие твердые вещества. Часть ее впитывается в почву. В глубине земли продолжается растворение различных веществ, так что при выходе на поверхность вода иногда образует минеральные источники. Ключевая и колодезная вода от растворенных в ней солей часто бывает жесткой.
Речная (пресная) вода содержит до 0,5 г растворенных солей в одном литре. В конце концов, все это попадает в море. Таким образом, море, испаряя чистую воду, получает взамен воду с растворенными в ней веществами. Количество солей, поставляемое реками в моря и океаны, огромно. Так, река Дон ежегодно вносит в Азовское море около 16 млн. т солей, Дунай в Черное море – 9 млн. т.
В океанской воде содержится около 35 г солей в литре. Столько же имеется в водах большинства морей. Однако для закрытых морей встречаются отклонения от средней солености, связанные с числом впадающих рек, средней температурой и другими факторами. Балтийское море содержит лишь 3–8 г солей на литр, а Красное – до 45 г. В соленых озерах содержание солей может быть намного больше: в Мертвом море – 228 г в одном литре, в оз. Эльтон – 270 г. В морской воде растворен, в основном, хлорид натрия; кроме того, имеются и другие соли натрия, магния, кальция.
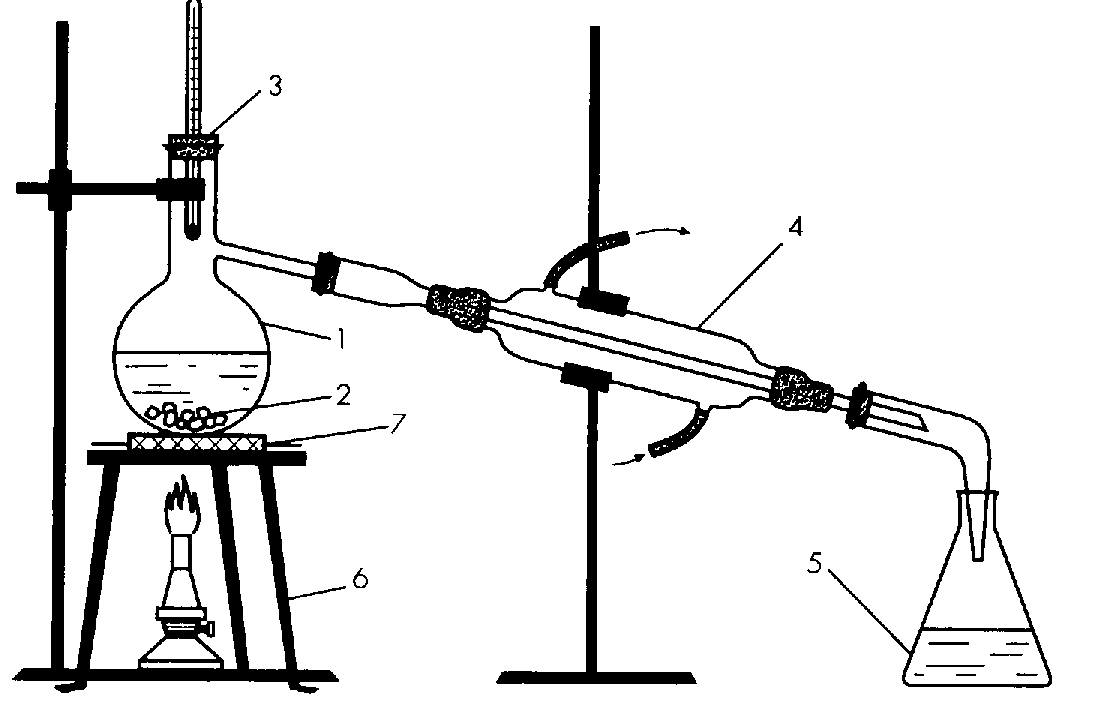
Для научной работы, а также для фармацевтических и других целей, воду перегоняют (рис. 2). Для этого ее превращают в пар, который затем охлаждают, получая чистую дистиллированную воду. Примеси остаются в перегонном сосуде.
Природная вода содержит следы «тяжелой» воды (оксида дейтерия) D2O. Физические свойства H2O и D2O заметно различаются.
| H2O | D2O | |
| t плав.,°С | 0,0 | 3,8 |
| t кип., °С | 100,0 | 101,4 |
Свойства воды служат точкой отсчета для многих физических величин. Так, температуры замерзания и кипения воды лежат в основе шкалы Цельсия. Один литр – это объем 1 кг чистой воды, взвешенной при +4 °С (при этой температуре вода имеет максимальную плотность).
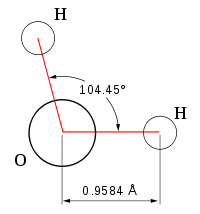
Многие физические свойства воды аномальны по сравнению с другими жидкостями. Одной из причин этого служат малые размеры молекул воды – минимальные среди всех жидких веществ при обычных условиях. Однако наиболее важным свойством воды является ее способность образовывать прочные водородные связи.
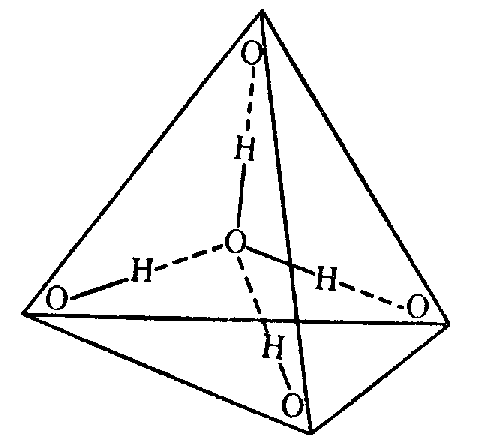
В водяном паре при температуре кипения и атмосферном давлении присутствует около 1% димеров, в которых молекулы воды объединены в пары водородными связями. В жидком и твердом состоянии каждая молекула воды образует четыре водородные связи: две как донор протонов и две – как акцептор протонов. Водородные связи молекулы воды направлены приблизительно к вершинам правильного тетраэдра (рис. 3.).
Если бы водородных связей не было, то температуры плавления и кипения воды были бы существенно ниже, как это наблюдается у других водородных соединений неметаллов. Водородные связи являются причиной и другого уникального свойства воды – при плавлении ее плотность возрастает. При 0°С плотность льда (0,9168 г/см 3 ) меньше, чем плотности жидкой воды (0,9998 г/см 3 ), поэтому лед плавает на поверхности воды. Если бы у льда была более высокая плотность, по мере замерзания он опускался бы на дно, что сделало бы жизнь в водоемах зимой невозможной.
Чтобы превратить воду в пар, надо затратить много энергии – около 44 кДж/моль. При обратном переходе пара в жидкую воду выделяется то же количество теплоты.
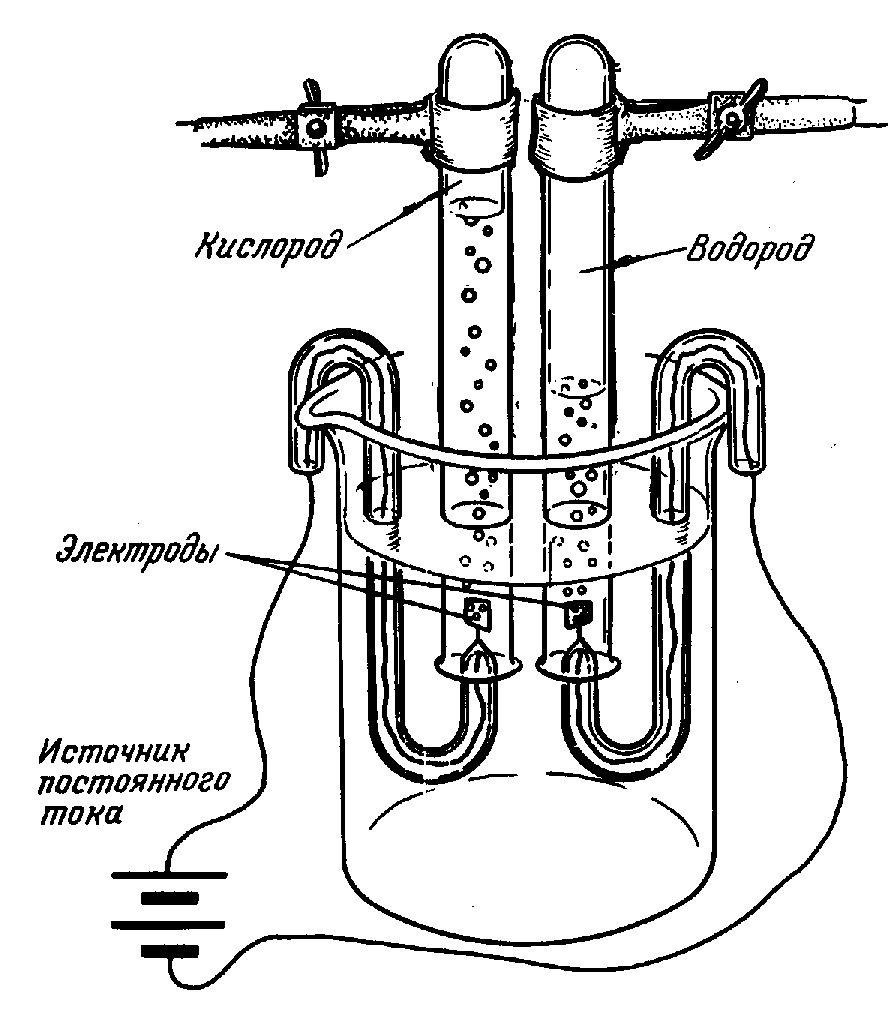
Вода устойчива при нагревании вплоть до 1000°С. При более высоких температурах она частично разлагается на водород и кислород. Эти же продукты образуются при электролизе воды.
Разложение воды искрами электрической машины заметили еще в 1789, а годом позже воду разложили с помощью гальванического электричества. В России это впервые было сделано профессором С.-Петербургской Медико-Хирургической Академии В.В. Петровым летом 1802 посредством огромной «гальвани-вольтовой батареи», состоявшей из 4200 медных и цинковых кружков. Электролиз чистой воды идет очень медленно. Для более быстрого разложения воды электрическим током в нее добавляют какую-либо кислоту, щелочь или соль. Этот процесс иногда используют для получения чистого водорода и кислорода (рис. 4).
Вода вступает в химическое взаимодействие со многими простыми веществами. Большинство таких реакций протекает при высокой температуре. Только наиболее активные металлы (щелочные и щелочноземельные) и неметаллы (галогены) реагируют с водой при комнатной температуре. Однако при одновременном воздействии воды и окислителей даже при обычной температуре происходит разрушение металлов средней активности (таких как железо) в результате коррозии.
Очень сильными восстановителями вода восстанавливается до водорода, очень сильными окислителями – окисляется до кислорода.
Вода взаимодействует со многими основными оксидами с образованием гидроксидов. В реакциях воды с большинством кислотных оксидов образуются кислоты.
РЕАКЦИИ ВОДЫ
| С простыми веществами: | |
| металлами | неметаллами |
| 2Na + 2H2O = 2NaOH + H2 | Cl2 + H2O⇋ HCl + HClO |
| 2Fe + 3H2O = Fe2O3 + 3H2 (600 °C) | H2O + C ⇋ CO + H2 (800–1000 °C) |
| С оксидами: | |
| основными | кислотными |
| CaO + H2O = Ca(OH)2 | SO3 + H2O = H2SO4 |
| Na2O + H2O = 2NaOH | N2O5 +H2O = 2HNO3 |
| Термическое разложение: 2Н2О⇋ 2Н2 + О2 | |
Некоторые сложные вещества полностью разлагаются водой – подвергаются необратимому гидролизу:
Вода может служить катализатором. Например, щелочные металлы и водород реагируют с хлором только в присутствии следов воды. Иногда вода является каталитическим ядом, например, для железного катализатора при синтезе аммиака.
В результате образования водородных связей твердая вода (лед) имеет рыхлую структуру с обширными замкнутыми полостями двух типов: больших и малых. В этих полостях могут размещаться молекулы других веществ, имеющие соответствующие размеры. Они удерживаются в них ван-дер-ваальсовыми силами. Так образуются газовые гидраты – клатраты, соединения типа «гость-хозяин», в которых «гостями» являются молекулы газов или легкокипящих жидкостей (благородные газы, галогены, углеводороды и др.), а «хозяевами» – молекулы воды, образующие кристаллический каркас. По внешнему виду газовые гидраты напоминают снег или рыхлый лед, но могут существовать только при повышенном давлении и отрицательной (по Цельсию) температуре. Наиболее важным на сегодняшний день газовым гидратом является гидрат природного газа метана, колоссальные скопления которого обнаружены в недрах земли, в особенности на шельфе морей и океанов.
Вода хорошо растворяет многие вещества, имеющие ионное строение (соли, щелочи), а также вещества, молекулы которых полярны. Наличие в жидкой воде ассоциатов (элементов кристаллической структуры) наряду с большим дипольным моментом молекул приводит к высокой диэлектрической проницаемости воды (ε = 78,3 при 25 °С). Это вызывает заметное ослабление кулоновского притяжения в водной среде, а, следовательно, способствует электролитической диссоциации ионных и полярных ковалентных соединений. При этом полярные молекулы воды участвуют в процессе гидратации за счет притяжения соответствующих полюсов полярных молекул воды к образующимся катионам и анионам. В ряде случаев образующиеся связи являются настолько прочными, что можно говорить о возникновении аквакомплексов. Аквакомплексы обнаружены не только в водных растворах, но и во многих кристаллических структурах.
Твердые вещества, как правило, лучше растворяются при нагревании. При этом вещества с очень прочной кристаллической решеткой мало растворимы в воде. К ним относятся хлориды, бромиды и иодиды серебра и свинца, сульфаты щелочноземельных металлов и свинца, большинство гидроксидов, сульфидов, ортофосфатов и карбонатов металлов.
Газы обычно плохо растворяются в воде. Исключение составляют газообразные вещества, взаимодействующие с водой, например аммиак, хлороводород или диоксид серы. Растворимость всех газов возрастает при увеличении давления и, как правило, понижается при нагревании.
В жидкой воде одна из каждых 10 миллионов молекул диссоциирует, образуя ионы: катионы водорода Н + и гидроксид-ионы ОН – :
Н2О ⇋ Н + + ОН –
| Индикатор | Кислотная среда | Нейтральная среда | Щелочная среда |
| Лакмус | Красный | Фиолетовый | Синий |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
| Метиловый оранжевый | Розовый | Оранжевый | Желтый |
| Вещества | Сильные | Слабые |
| Основания | NaOH, KOH, Ca(OH)2, Ba(OH)2 | NH3 |
| Кислоты | HCl, HBr, HI, H2SO4, HNO3 | H3PO4, H2CO3, H2S |
Соли при растворении в воде диссоциируют на катионы металла и анионы кислоты. Растворы многих солей имеют кислотную или щелочную среду за счет обратимого гидролиза по катиону или по аниону (см. ГИДРАТАЦИЯ, ГИДРАТЫ, ГИДРОЛИЗ).