Что означает hv в химической реакции
Уравнения химических реакций
Схема химической реакции
Для характеристики определенной химической реакции необходимо уметь составить запись, которая будет отображать условия протекания химической реакции, показывать какие вещества вступили в реакцию, а какие образовались. Для этого используют схемы химических реакций.
Схема химической реакции – условная запись, показывающая, какие вещества вступают в реакцию, какие продукты реакции образуются, а также условия протекания реакции Рассмотрим в качестве примера реакцию взаимодействия угля и кислорода. Схема данной реакции записывается следующим образом:
уголь взаимодействует с кислородом с образованием углекислого газа
Углерод и кислород – в данной реакции реагенты, а полученный углекислый газ – продукт реакции. Знак «→» обозначает протекание реакции. Часто над стрелкой пишут условия, при которых происходит реакция
Так, природный газ, в основном состоит из метана CH4, при его нагревании до 1500°С он превращается в два других газа: водород Н2 и ацетилен С2Н2. Схема реакции записывается так:
Важно не только уметь составлять схемы химических реакций, но и понимать, что они обозначают. Рассмотрим, еще одну схему реакции:
Данная схема означает, что под действием электрического тока, вода разлагается на два простых газообразных вещества: водород и кислород. Схема химической реакции является подтверждением закона сохранения массы и показывает, что химические элементы во время химической реакции не исчезают, а только перегруппировываются в новые химические соединения.
Уравнения химических реакций
Согласно закону сохранения массы исходная масса продуктов всегда равна массе полученных реагентов. Количество атомов элементов до и после реакции всегда одинаковое, атомы только перегруппировываются и образуют новые вещества. Вернемся к схемам реакций, записанным ранее:
С + О2 ↑ СО2.
В данных схемах реакций знак «→» можно заменить на знак «=», так как видно, что количество атомов до и после реакций одинаковое. Записи будут иметь следующий вид:
С + О2 = СО2.
Именно такие записи называют уравнениями химических реакций, то есть, это – записи схем реакций, в которых количество атомов до и после реакции одинаковое.
Уравнение химической реакции – условная запись химической реакции посредством химических формул, которая соответствует закону сохранения массы вещества
Если мы рассмотрим другие, приведенные ранее схемы уравнений, можно заметить, что на первый взгляд, закон сохранения массы в них не выполняется:
Видно, что в левой части схемы, атом углерода один, а в правой – их два. Атомов водорода поровну и в левой и правой частях их по четыре. Превратим данную схему в уравнение. Для этого необходимо уравнять количество атомов углерода. Уравнивают химические реакции при помощи коэффициентов, которые записывают перед формулами веществ. Очевидно, чтобы количество атомов углерода стало одинаковым слева и справа, в левой части схемы, перед формулой метана, необходимо поставить коэффициент 2:
Видно, что атомов углерода слева и справа теперь поровну, по два. Но теперь неодинаково количество атомов водорода. В левой части уравнения их 2∙4 = 8. В правой части уравнения атомов водорода 4 (два из них в молекуле ацетилена, и еще два – в молекуле водорода). Если поставить коэффициент перед ацетиленом, нарушится равенство атомов углерода. Поставим перед молекулой водорода коэффициент 3:
Теперь количество атомов углерода и водорода в обеих частях уравнения одинаковое. Закон сохранения массы выполняется! Рассмотрим другой пример. Схему реакции Na + H2O → NaOH + H2 необходимо превратить в уравнение. В данной схеме различным является количество атомов водорода. В левой части два, а в правой – три атома. Поставим коэффициент 2 перед NaOH.
Na + H2O → 2NaOH + H2
Тогда атомов водорода в правой части станет четыре, следовательно, коэффициент 2 необходимо добавить и перед формулой воды:
Na + 2H2O → 2NaOH + H2
Уравняем и количество атомов натрия:
2Na + 2H2O = 2NaOH + H2
Теперь количество всех атомов до и после реакции одинаковое. Таким образом, можно сделать вывод: чтобы превратить схему химической реакции в уравнение химической реакции, необходимо уравнять количество всех атомов, входящих в состав реагентов и продуктов реакции при помощи коэффициентов. Коэффициенты ставятся перед формулами веществ. Подведем итоги об Уравнения химических реакций
Дистанционный материал по химии на тему «Первоначальные химические понятия» (часть 10)
Описание разработки
Нам с тобой уже известно, что вещества могут реагировать друг с другом с образованием новых веществ за счет перегруппировки атомов, входящих в состав исходных веществ, и образуются новые вещества при химических реакциях.
Например, серавзаимодействует с кислородом с образованием сернистого газа.
Этот процесс можно записать словесно так:
сера + кислород ⇒ сернистый газ.
Можно использовать формулы веществ и тогда этот процесс можно будет записать так:
Это уже будет химическая схема реакции, поскольку в ней вместо названий веществ содержатся химические формулы.
Посмотрим еще раз на схему S+О2 ⇒ SО. Мы видим, что до и после реакции были использованы атомы Сульфура и Оксигена. Причем их количество до реакции и после реакции одинаково. Получается, что все химические элементы во время реакции сохраняются. Атомы в ходе реакции никуда не исчезают и ниоткуда не появляются. Происходит лишь их перегруппировка в соответствии с законом сохранения массы веществ.
Закон сохранения массы веществбыл открыт в середине XVIII в. русским ученым М.В. Ломоносовым и независимо от него чуть позже французским ученымА.Л.Лавуазье.
Закон формулируется так: масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
Другими словами, если мы будем знать массу серы и массу кислорода, которые прореагировали между собой, то масса сернистого газа будет равна сумме их масс.
Задолго до открытия закона сохранения массы веществ в химии господствовала ошибочная теория о флогистоне. Многие ученые заметили, что при прокаливании (т.е. длительном нагревании) металлов масса их увеличивалась. Ученые считали, что “нечто” из огня присоединяется к металлам и приводит к увеличению их массы. Но если металл прокаливать в плотно закрытом сосуде, например, реторте, то масса при этом не меняется.
Ученые проводили опыты по прокаливанию металлов, чаще всего ртути. Помещали ртуть в сосуд. Взвешивали сосуд с ртутью до начала прокаливания и после. Масса сосуда с металлом увеличивалась. Считалось, что к металлу присоединяется флогистон.
Вот этот факт и объяснил М.В. Ломоносов. Масса металла в запаянной реторте не изменяется после длительного нагревания. А если этот металл прокаливать в открытом сосуде, то его масса увеличится. Теперь каждый школьник может объяснить, почему так происходит. Оказывается, что к металлу присоединяется определенная порция кислорода из воздуха, если у него есть доступ к металлу, а не флогистон, который в природе не существует. В закрытом сосуде масса прокаливаемого металла не меняется.
Рассмотрим пример. Известно, что между собой прореагировали железо и сера массой соответственно 56 г и 32 г. Определить массу продукта реакции FeS.
Ответ: Масса FeS равна 88г.
В соответствии с законом сохранения массы веществ химики составляют уравнения химических реакций, но о них мы поговорим в следующий раз.
Домашнее задание на следующий раз: определить массу цинка, вступившего в реакцию с 64 граммами серы,если масса полученного сульфида цинка равна 194 грамма.
Содержимое разработки
Закон сохранения массы веществ
Нам с тобой уже известно, что вещества могут реагировать друг с другом с образованием новых веществ за счет перегруппировки атомов, входящих в состав исходных веществ, и образуются новые вещества при химических реакциях.
Например, сера взаимодействует с кислородом с образованием сернистого газа.
Этот процесс можно записать словесно так:
сера + кислород сернистый газ.
Можно использовать формулы веществ и тогда этот процесс можно будет записать так:
S + 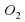
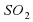
Это уже будет химическая схема реакции, поскольку в ней вместо названий веществ содержатся химические формулы.
Над стрелкой иногда можно увидеть 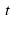
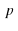
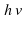
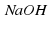
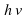
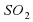
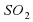
Посмотрим еще раз на схему S + 
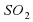
Закон сохранения массы веществ был открыт в середине XVIII в. русским ученым М.В. Ломоносовым и независимо от него чуть позже французским ученым А.Л. Лавуазье.
Закон формулируется так: масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
Другими словами, если мы будем знать массу серы и массу кислорода, которые прореагировали между собой, то масса сернистого газа будет равна сумме их масс.
Задолго до открытия закона сохранения массы веществ в химии господствовала ошибочная теория о флогистоне. Многие ученые заметили, что при прокаливании (т.е. длительном нагревании) металлов масса их увеличивалась. Ученые считали, что “нечто” из огня присоединяется к металлам и приводит к увеличению их массы. Но если металл прокаливать в плотно закрытом сосуде, например, реторте, то масса при этом не меняется.
Ученые проводили опыты по прокаливанию металлов, чаще всего ртути. Помещали ртуть в сосуд. Взвешивали сосуд с ртутью до начала прокаливания и после. Масса сосуда с металлом увеличивалась. Считалось, что к металлу присоединяется флогистон. Вот этот факт и объяснил М.В. Ломоносов. Масса металла в запаянной реторте не изменяется после длительного нагревания. А если этот металл прокаливать в открытом сосуде, то его масса увеличится. Теперь каждый школьник может объяснить, почему так происходит. Оказывается, что к металлу присоединяется определенная порция кислорода из воздуха, если у него есть доступ к металлу, а не флогистон, который в природе не существует. В закрытом сосуде масса прокаливаемого металла не меняется.
Рассмотрим пример. Известно, что между собой прореагировали железо и сера массой соответственно 56 г и 32 г. Определить массу продукта реакции FeS.
Ответ: Масса FeS равна 88 г.
В соответствии с законом сохранения массы веществ химики составляют уравнения химических реакций, но о них мы поговорим в следующий раз.
Домашнее задание на следующий раз: определить массу цинка, вступившего в реакцию с 64 граммами серы, если масса полученного сульфида цинка равна 194 грамма.
Урок 8 Бесплатно Химическая реакция- уравнение и типы
Начало
Продолжим изучение химической реакции как одной из основ химической науки.
Ведь полноценное понимание этой темы нужно для дальнейшего изучения химии, и в то же время это сделает вас образованнее не только в научном плане, но и в бытовом!
Уравнение химической реакции
Вся информация о протекающей химической реакции (исходные вещества, продукты реакции, условия протекания, тепловой эффект) на письме фиксируется в виде уравнения реакции.
Уравнение можно записать для любой реакции. Для этого нужно знать состав молекул исходных веществ и продуктов.
Всё это записывается в виде химических формул.
Всё происходит как в математике: в левой части записываются формулы исходных веществ, а в правой – формулы продуктов.
Только вместо знака «равно» чаще всего ставят стрелку: она показывает, что реакция идёт именно в этом направлении.
У меня есть дополнительная информация к этой части урока!
В некоторых случаях возможно протекание реакции при одних и тех же условиях в обоих направлениях. В таком случае обычно ставят две стрелки в обе стороны, но также и допустимо ставить знак «равно».
В некоторых случаях (когда это требуется) указывают условия протекания реакции и тепловой эффект реакции.
Условия протекания записывают над стрелкой, а тепловой эффект – в виде количества теплоты в левой части, если реакция эндотермическая, и в правой части, если экзотермическая.
Для примера запишем уравнение реакции водорода с кислородом:
Зигзаг обозначает искру – условие для начала реакции, а «+ Q» – то, что в результате реакции выделяется энергия.
В зависимости от конкретных задач условия протекания и тепловой эффект могут вообще не отмечать или отмечать конкретное числовое значение теплового эффекта.
Если среди продуктов реакции есть газ, около его формулы пишут стрелку вверх.
Например, когда мы капаем на рану перекись водорода, под действием ферментов крови она разлагается с выделением кислорода:
У меня есть дополнительная информация к этой части урока!
Кислород обладает обеззараживающим действием и способствует более быстрой свёртываемости крови!
Перекись водорода может разлагаться не только под воздействием ферментов крови, но и многих других веществ.
Разложение перекиси водорода в присутствии оксида марганца (IV) (Оксид марганца (IV) в химической реакции не участвует).
Если реакция идет в растворе и в результате выпадает осадок, то пишут стрелку вниз.
Садовые деревья весной обрабатывают от паразитов «бордосской жидкостью». Чтобы её приготовить, смешивают растворы извести и медного купороса.
При этом наблюдается выпадение хлопьев, которые состоят сразу из двух нерастворимых веществ: гидроксида меди и сульфата кальция.
Получившийся сульфат кальция, гипс, образует корку, которая будет дольше держаться на стволе дерева, и поэтому такая смесь дольше защищает его от вредителей.
Запишем уравнение этой реакции
Как правильно читать уравнение химической реакции?
В химии принято делать это примерно так: «один моль сульфата меди реагирует с одним молем гидроксида кальция с образованием одного моля гидроксида меди и одного моля сульфата кальция».
То есть коэффициент перед формулой вещества считают количеством вещества в молях, а не количеством молекул.
Ведь в реальной жизни мы наблюдаем реакцию не единичных молекул, а большого объема веществ.
При составлении уравнений химики опираются на два основных закона природы: закона сохранения массы и закона постоянства состава веществ.
Пройти тест и получить оценку можно после входа или регистрации
1.4.4. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов.
Обратимые и необратимые химические реакции
Химические реакции бывают обратимые и необратимые.
Необратимыми реакциями называют такие реакции, которые идут только в одном (прямом →) направлении:
т.е. если некоторая реакция A + B = C + D необратима, это значит, что обратная реакция C + D = A + B не протекает.
Обратимые реакции – это такие реакции, которые идут как в прямом, так и в обратном направлении (⇄):
т.е., например, если некая реакция A + B = C + D обратима, это значит, что одновременно протекает как реакция A + B → C + D (прямая), так и реакция С + D → A + B (обратная).
По сути, т.к. протекают как прямая, так и обратная реакции, реагентами (исходными веществами) в случае обратимых реакций могут быть названы как вещества левой части уравнения, так и вещества правой части уравнения. То же самое касается и продуктов.
Однако, условно принято считать, что реагентами в каждом конкретном уравнении обратимой реакции являются те вещества, которые записаны в его левой части, а продуктами – те, что записаны в правой, т.е.:
Для любой обратимой реакции возможна ситуация, когда скорость прямой и обратной реакций равны. Такое состояние называют состоянием равновесия.
В состоянии равновесия концентрации как всех реагентов, так и всех продуктов неизменны. Концентрации продуктов и реагентов в состоянии равновесия называют равновесными концентрациями.
Смещение химического равновесия под действием различных факторов
Вследствие таких внешних воздействий на систему, как изменение температуры, давления или концентрации исходных веществ или продуктов, равновесие системы может быть нарушено. Однако после прекращения этого внешнего воздействия система через некоторое время перейдет в новое состояние равновесия. Такой переход системы из одного равновесного состояния в другое равновесное состояние называют смещением (сдвигом) химического равновесия.
Для того чтобы уметь определять, каким образом сдвигается химическое равновесие при том или ином типе воздействия, удобно пользоваться принципом Ле Шателье:
Если на систему в состоянии равновесия оказать какое-либо внешнее воздействие, то направление смещения химического равновесия будет совпадать с направлением той реакции, которая ослабляет эффект от оказанного воздействия.
Влияние температуры на состояние равновесия
При изменении температуры равновесие любой химической реакции смещается. Связано это с тем, что любая реакция имеет тепловой эффект. При этом тепловые эффекты прямой и обратной реакции всегда прямо противоположны. Т.е. если прямая реакция является экзотермической и протекает с тепловым эффектом, равным +Q, то обратная реакция всегда эндотермична и имеет тепловой эффект, равный –Q.
Таким образом, в соответствии с принципом Ле Шателье, если мы повысим температуру некоторой системы, находящейся в состоянии равновесия, то равновесие сместится в сторону той реакции, при протекании которой температура понижается, т.е. в сторону эндотермической реакции. И аналогично, в случае, если мы понизим температуру системы в состоянии равновесия, равновесие сместится в сторону той реакции, в результате протекания которой температура будет повышаться, т.е. в сторону экзотермической реакции.
Например, рассмотрим следующую обратимую реакцию и укажем, куда сместится ее равновесие при понижении температуры:
Как видно из уравнения выше, прямая реакция является экзотермической, т.е. в результате ее протекания выделяется тепло. Следовательно, обратная реакция будет эндотермической, то есть протекает с поглощением тепла. По условию температуру понижают, следовательно, смещение равновесия будет происходить вправо, т.е. в сторону прямой реакции.
Влияние концентрации на химическое равновесие
Повышение концентрации реагентов в соответствии с принципом Ле Шателье должно приводить к смещению равновесия в сторону той реакции, в результате которой реагенты расходуются, т.е. в сторону прямой реакции.
И наоборот, если концентрацию реагентов понижают, то равновесие будет смещаться в сторону той реакции, в результате которой реагенты образуются, т.е. сторону обратной реакции (←).
Аналогичным образом влияет и изменение концентрации продуктов реакции. Если повысить концентрацию продуктов, равновесие будет смещаться в сторону той реакции, в результате которой продукты расходуются, т.е. в сторону обратной реакции (←). Если же концентрацию продуктов, наоборот, понизить, то равновесие сместится в сторону прямой реакции (→), для того чтобы концентрация продуктов возросла.
Влияние давления на химическое равновесие
В отличие от температуры и концентрации, изменение давления оказывает влияние на состояние равновесия не каждой реакции. Для того чтобы изменение давления приводило к смещению химического равновесия, суммы коэффициентов перед газообразными веществами в левой и в правой частях уравнения должны быть разными.
Т.е. из двух реакций:
изменение давления способно повлиять на состояние равновесия только в случае второй реакции. Поскольку сумма коэффициентов перед формулами газообразных веществ в случае первого уравнения слева и справа одинаковая (равна 2), а в случае второго уравнения – различна (4 слева и 2 справа).
Отсюда, в частности, следует, что если среди и реагентов, и продуктов отсутствуют газообразные вещества, то изменение давления никак не повлияет на текущее состояние равновесия. Например, давление никак не повлияет на состояние равновесия реакции:
Если же слева и справа количество газообразных веществ различается, то повышение давления будет приводить к смещению равновесия в сторону той реакции, при протекании которой объем газов уменьшается, а понижение давления – в сторону той реакции, в результате которой объем газов увеличивается.
Влияние катализатора на химическое равновесие
Поскольку катализатор в равной мере ускоряет как прямую, так и обратную реакции, то его наличие или отсутствие никак не влияет на состояние равновесия.
Единственное, на что может повлиять катализатор, — это на скорость перехода системы из неравновесного состояния в равновесное.
Воздействие всех указанных выше факторов на химическое равновесие сведено ниже в таблицу-шпаргалку, в которую поначалу можно подглядывать при выполнении заданий на равновесия. Однако же пользоваться на экзамене ей не будет возможности, поэтому после разбора нескольких примеров с ее помощью, ее следует выучить и тренироваться решать задания на равновесия, уже не подглядывая в нее:
Обозначения: T – температура, p – давление, с – концентрация, ↑ — повышение, ↓ — понижение








