Что означает пептидная связь
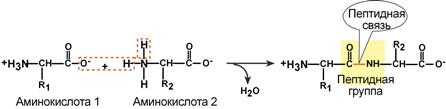
Аминокислоты соединяются пептидной связью
Пептидная связь – это связь между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой аминокислоты.
Образование пептидной связи
При необходимости назвать пептид ко всем названиям аминокислот добавляют суффикс «-ил», только последняя аминокислота сохраняет свое название неизменным. Например,
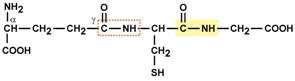
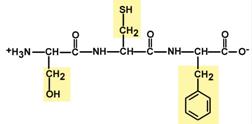
Строение трипептида глутатиона
Особенностью глутатиона является связывание глутамата и цистеина не истинной пептидной связью, а через γ-карбоксильную группу радикала глутаминовой кислоты.
К свойствам пептидной связи относятся:
1. Копланарность
Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы «Н» и «О» расположены по разные стороны от пептидной связи.
2.Транс-положение заместителей
Радикалы аминокислот по отношению к оси пептидной C—N-связи находятся по «разные» стороны, в транс-положении.
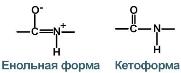
3. Две равнозначные формы
Пептидная связь находится в кетоформе и енольной форме.
4. Способность к образованию водородных связей.
Атомы кислорода и водорода, входящие в пептидную группу, обладают способностью образовывать водородные связи с атомами кислорода и водорода других пептидных групп.
5. Пептидная связь имеет частично характер двойной связи.
Длина пептидной связи меньше, чем одинарной связи, она является жесткой структурой, и вращение вокруг нее затруднено. Но так как, кроме пептидной, в белке есть и другие связи, цепочка аминокислот способна вращаться вокруг основной оси, что придает белкам различную конформацию (пространственное расположение атомов).
Что означает пептидная связь
Пептидная связь образуется при реакции аминогруппы одной аминокислоты и карбоксильной группы другой с выделением молекулы воды:
Пептидная связь – ковалентная связь между карбонильной группой (С=О) одного остатка аминокислоты и аминогруппой (N-H) другого остатка.
Связанные пептидной связью аминокислоты образуют полипептидную цепь.
Характерной особенностью пептидной связи является то, что 6 атомов при ней находятся в одной плоскости. Это связано с тем, что связь С=О не является полностью кратной, а связь С-N не является полностью простой. В реальности наличествует некая, близкая к полуторной, связь, чем и объясняется планарное расположение 6 атомов:
Вызвано это различной электроотрицательностью атомов С, N и O.
Подобное строение пептидной связи накладывает отпечаток на формирование вторичной и третичной структуры белка.
Среди полимеров из аминокислотных остатков, в зависимости от длины полимерной цепи, различают:
Олигопептиды или просто пептиды, содержат до 20 остатков аминокислот
Полипептиды содержат от 20 до 50 остатков аминокислот
Белки содержат более 50 АК-остатков. Самый маленький белок с 51 аминокислотным остатком в двух полипептидных нитях, соединенных двумя дисульфидными мостиками –S–S–, называется инсулином. Образуется в организме из белка с одной полипептидной нитью проинсулина, вырезанием отрезка нити – пептида С. Белки состоят в среднем из 500 аминокислотных остатков. Длинные белки – коллаген и тропоколлаген – содержат около 1 000 аминокислотных остатков.
Белки, в зависимости от состава, бывают простые (содержащие только незамещенные остатки аминокислот в полипептидной цепи) и сложные, когда посредством боковых радикалов аминокислотных остатков к полипептидной цепи присоединены молекулы жирных кислот, сахаров, ацилглицеринов, другие органические группы (в том числе порфириновые), остатки фосфорной кислоты и т.д.
К сложным белкам, в частности, относятся:
• липопротеины (содержат остатки липидов);
• гликопротеины (содержат остатки сахаров, масса белковой части превышает массу углеводной части);
• протеогликаны (полисахариды, содержащие полипептидные участки);
• фосфопротеины (остатки фосфорной кислоты);
• металлопротеины (ионы металлов, связанные донорно-акцпторным взаимодействием с простетическими группами, типа порфиринов).
Что означает пептидная связь
Цель исследования – изучение преимуществ и недостатков пептидных препаратов, их применения, путей введения, традиционных и новых возможностей в разработке пептидных препаратов.
Материалы и методы: Повествовательный обзор, основанный на поисках литературы в текстовой базе данных медицинских и биологических публикаций PubMed, а также в российской научной электронной библиотеке eLIBRARY до июня 2019 года без ограничений по срокам. Поиск включал такие термины, как «пептиды», «пептидная терапия», «пептидные технологии».
Введение
На сегодняшний день известно более 7000 встречающихся в природе пептидов, многие из которых выполняют важные функции в организме, включая действия в качестве гормонов, нейротрансмиттеров, факторов роста, лигандов ионных каналов или противоинфекционных средств [1]. Пептиды являются селективными сигнальными молекулами, которые связываются со специфическими поверхностными рецепторами клеток, такими как G-белок-связанные рецепторы (GPCR) или ионными каналами, запуская тем самым внутриклеточные реакции. Учитывая их привлекательный фармакологический профиль и другие свойства, такие как безопасность, хорошая переносимость и эффективность, пептиды представляют собой оптимальную основу для разработки новых терапевтических средств. Кроме того, получение пептидов связано с более низкой сложностью производства по сравнению с биофармацевтическими препаратами на основе белков и, следовательно, связанно с более низкими расходами. Однако встречающиеся в природе пептиды часто не подходят для использования в качестве терапевтических средств, так как они имеют ряд недостатков, включая химическую и физическую нестабильность, а также короткий период полураспада в циркулирующей плазме крови. Некоторые из этих недостатков могут быть успешно устранены с помощью методов традиционной конструкции и ряда других разрабатываемых в настоящее время технологий. К таким технологиям относятся многофункциональные и проникающие в клетку пептиды, а также конъюгаты пептидных лекарственных [2,3].
Основная часть
Рынок пептидных препаратов
Применение пептидов
Помимо применения пептидов в качестве лекарственных средств, возможно их использование в качестве биомаркеров с диагностической целью. Наконец, пептиды также нашли применение в качестве вакцин [7].
Пути введения пептидов в организм
В настоящее время большинство пептидных лекарств вводят парентеральным путем, тем не менее, разрабатываются альтернативные формы введения, включая пероральный, интраназальный, и трансдермальный пути, в соответствии с развитием технологий. Одним из примеров альтернативных путей введения пептидов является препарат мидазол, с трансбукальным способом введения. В настоящее время разрабатываются системы трансбуккальной доставки, в которых используются гликонаночастицы золота [8]. Другие разрабатываемые системы могут обеспечить пероральную доставку пептидов, непосредственно экспрессируемых в желудочно-кишечном тракте.
Использование альтернативных форм введения может также обеспечить более широкое использование пептидной терапии при других состояниях, таких как воспаление, где местное введение пептидов может стать эффективным методом лечения [9].
Традиционные технологии конструирования пептидов
С целью избавления от таких недостатков применения природных пептидов как короткий период полувыведения и плохие физико-химические свойства, с которыми связана агрегация и плоха растворимость пептидов, используют ряд технологий
Вначале проводится определение аминокислотной структуры пептида и выявление в ней константных участков и участков возможной замены без изменения свойств. Данный анализ возможно осуществить, например, с помощью аланиновых замен отдельных аминокислот с последующим изучением полученного пептида. Важным в этом процессе, особенно когда необходимо получение жидких лекарственных форм, является определения химически лабильных аминокислот, подверженных таким процессам как изомеризация, гликозилирование или окисление, что является нежелательным [10].
В дальнейшем возможно ограничение ферментативного расщепления пептида путем идентификации возможных сайтов молекулярного расщепления с последующей заменой соответствующих аминокислот. Защита от ферментативного расщепления также может быть достигнута путем усиления вторичной структуры пептидов. Этот подход включает в себя вставку зонда, определяющего новую структуру, вставку лактамных мостиков, сшивание или клипирование пептидных последовательностей, а также циклизацию пептидов. Полиэтиленгликольилирование было использовано для ограничения глобулярной фильтрации и тем самым увеличения периода полувыведения пептидов из плазмы крови. К другим способам стабилизации пептидов относится связывание их с циркулирующим белком альбумином, в качестве носителя, для продления периода полураспада, что приводит к появлению пептидных препаратов пролонгированного действия, которые можно вводить до одного раза в неделю [11].
С целью улучшения физико-химических свойств пептидов, в частности уменьшения агрегации, производят разрушение гидрофобных участков в структуре пептида, что может быть достигнуто с помощью замены или N-метилирования определенных аминокислот. Для улучшения растворимости определенного пептидного препарата, изменяется распределение его зарядов, с помощью вставок или замены аминокислот что приводит к изменению изоэлектрической точки пептида и его стабилизации при рН желаемой рецептуры конечного продукта. Физико-химические свойства пептидов также могут быть улучшены путем введения стабилизирующих структур, таких как α-спираль или лактамные мостики [12].
Считается что пептидные препараты второго поколения, оптимизированные для терапевтического использования с помощью перечисленных технологий, оказались более удобными для применения. Дальнейшее развитие пептидной терапии связывают с быстрым появлением и дальнейшей миниатюризацией специальных устройств, насосов и систем обратной связи с сенсорами, и автоматизированным управлением, что позволило бы осуществить умную доставку пептидов [13].
Новые пептидные технологии
Существует огромное количество природных пептидов, некоторые из которых могут являться хорошей основой для создания новых пептидных препаратов. Большой интерес на сегодняшний день представляют исследования обмена веществ в кишечнике, так как он богат разнообразными микроорганизмами, изучение которых может привести к идентификации новых пептидов из фрагментов микробных белков, продуктов распада или сигнальных молекул. Продолжающиеся исследования микроорганизмов помогут значительно обогатить спектр имеющихся пептидных препаратов и тем самым повысить возможности для пептидной терапии в будущем [14].
Многофункциональные пептиды
Способы получения многофункциональных пептидов могут включать гибридизацию двух пептидов, связываемых вместе как модули либо напрямую, либо через линкер, либо с помощью образования химер, где вторая фармакологическая активность «спроектирована» для уже существующего пептидного остова [15].
Одной из проблем разработки многофункциональных пептидов является возможное несоответствие эффектов нового препарата, полученных in vitro и его воздействия in vivo, при этом в организме могут включится новые пути действия препарата, не связанные с запланированным эффектом. Кроме того, перевод результатов исследований препаратов, полученных от животных моделей на человека, также является проблемой. В целом сложность предсказывания эффектов многофункциональных пептидов в организме резко возрастает, что требует дальнейшего развития аналитического и экспериментального процесса в фармакологии.
Проникающие в клетку пептиды
Способы введения в организм лекарственных средств непрерывно совершенствуются. Возникают новые, более тонкие иглы и приборы, осуществляющие парентеральное введение лекарственных средств, разрабатываются пероральные системы со сложным механизмом высвобождения лекарственных средств, все это направленно на повышение эффективности терапии в результате повышения биодоступности лекарств в области нахождения их мишени.
Одной из важных проблем применения лекарственных средств на основе пептидов является плохая способность нативных пептидов переходить через клеточную мембрану, для воздействия на внутриклеточную мишень, что ранее ограничивало их терапевтическое применение.
В последние годы были изобретены «проникающие в клетку пептиды», использование которых повышает вероятность связывания пептидов с их внутриклеточными мишенями, так как при применении обычных лекарственных средств только часть пептидного препарата достигает цели [16].
Конъюгирование пептидов
К новым пептидным технологиям также можно отнести конъюгирование пептидов, например, с небольшими молекулами, олигорибонуклеотидами или антителами предоставляющее возможность для разработки новых пептидных терапевтических средств с улучшенной эффективностью и безопасностью. Например, в онкологии этот подход вызвал большой интерес, в результате чего более 20 пептидных конъюгатов проходят клинические испытания. Уже был продемонстрирован довольно удачный способ сопряжения пептидного агониста рецептора нейротензина 1 с радиоактивным лигандом для лечения рака поджелудочной железы, при этом первый компонент осуществляет прицельную доставку второго к органу мишени, создавая высокую местную концентрацию химиопрепарата в опухолевом очаге. Данный метод может помочь устранить главную проблему применения химиотерапии, уменьшая системные побочные эффекты и повышая эффективность применения препарата. В конъюгатах пептид-антитело часть антитела может играть роль целевого объекта, тогда как пептид является эффекторной частью [17].
Заключение
Дальнейшая разработка пептидных препаратов будет основываться на встречающихся в природе пептидах с применением традиционных пептидных технологий для улучшения их слабых мест, таких как как их химические и физические свойства, а также короткий период полураспада.
Также ожидается, что новые пептидные технологии, в том числе многофункциональные пептиды, пептиды, проникающие в клетки, и конъюгаты пептидных лекарственных средств, помогут расширить сферу применения пептидов в качестве терапевтических средств.
Пептиды обладают огромным потенциалом в качестве будущих препаратов для успешного решения многих медицинских проблем.
Клиническая фармакология Тимогена®. Глава 1
Долгов Г.В., Куликов С.В., Легеза В.И., Малинин В.В., Морозов В.Г., Смирнов В.С., Сосюкин А.Е.
Под редакцией проф. В.С. Смирнова.
Авторский коллектив:
Опубликовано в СПб, 2003. — 103 с.
Скачать PDF
Введение
Глава 1. Механизмы пептидной регуляции гомеостаза (В.В. Малинин, В.Г. Морозов)
Глава 2. Регуляторные пептиды тимуса (В.С. Смирнов)
Глава 3. Тимоген®: структура, химический синтез, свойства (С.В. Куликов, В.С. Смирнов)
Глава 4. Тимоген® в профилактике и комплексной терапии инфекционных заболеваний (В.С. Смирнов)
Глава 5. Тимоген® в терапии бронхолегочных заболеваний (В.С. Смирнов)
Глава 6. Применение тимогена в комплексной терапии внутренних болезней (В.С. Смирнов, А.Е. Сосюкин)
Глава 7. Тимоген® в дерматологии (В.С. Смирнов)
Глава 8. Применение Тимогена® для профилактики и лечения радиационных поражений (В.И.Легеза, В.С. Смирнов)
Глава 9. Применение Тимоген® в комплексном лечении механических и термических травм (В.С. Смирнов)
Глава 10. Тимоген® в акушерско-гинекологической практике (Г.В. Долгов, В.С. Смирнов)
Глава 11. Особенности применения Тимогена® в педиатрии (В.С. Смирнов)
Заключение
Глава 1. МЕХАНИЗМЫ ПЕПТИДНОЙ РЕГУЛЯЦИИ ГОМЕОСТАЗА
В.В. Малинин, В.Г. Морозов
Механизмы, регулирующие постоянство внутренней среды (гомеостаз), представляют собой сложный комплекс нейрогуморальных процессов, позволяющих организму сохранять жизнеспособность и устойчивость в окружающей среде. При этом стабильность внутренней среды тесно связана с уровнем биологической защиты организма.
По современным представлениям регуляция гомеостаза многоклеточных систем осуществляется с помощью нейроэндокринных, иммунологических, клеточных и молекулярных механизмов. Наиболее изучена роль нервных и гормональных воздействий на процессы, позволяющие организму контролировать постоянство внутренней среды (Горизонтов, 1981). Функция иммунной системы рассматривается как висцеральная, обеспечивающая сохранение генетического постоянства клеточного состава, т.е. она является одним из гомеостатических механизмов целостного организма (Корнева, 1993).
Известно, что нервная и эндокринная системы модулируют функции иммунной системы с помощью нейротрансмиттеров, нейропептидов и гормонов, а иммунная система взаимодействует с нейроэндокринной системой с помощью цитокинов, иммунопептидов и других иммунотрансмиттеров. В настоящее время установлена роль эндогенных пептидов в формировании компенсаторно-приспособительных реакций организма в ответ на стресс и нарушения гомеостаза. Система пептидов рассматривается в качестве универсальной при нейроиммуноэндокринных взаимодействиях (Коpнева, Шхинек, 1988; Fabry et al., 1994).
При изучении механизма действия цитомединов было установлено, что эти факторы принимают непосредственное участие в процессах тканеспецифической регуляции экспрессии генов и биосинтеза. В результате этого в клетках понижается скорость накопления патологических изменений (повреждения ДНК, мутации, злокачественная трансформация и т.п.) и повышается активность репаративных процессов, направленных на восстановление клеточного гомеостаза.
Нарушение цитомединовой регуляции снижает резистентность клеток и тканей организма к дестабилизирующим факторам как внешней, так и внутренней среды. Это может служить одной из причин развития заболеваний, инволюции органов и тканей, а также ускоренного старения. Последующие работы подтвердили, что система пептидергической регуляции включает широкий спектр тканеспецифических пептидов, поддерживающих гомеостаз (Ivanov et al., 1997; Karelin et al., 1998).
В настоящее время цитомедины выделены практически из всех клеток, тканей и биологических жидкостей организма. По данным физико-химических исследований эти комплексы пептидов различаются между собой по составу, молекулярной массе и электрохимическим свойствам компонентов. На основе цитомединов разработан целый ряд новых лекарственных препаратов. Применение этих препаратов в условиях нарушенного клеточного гомеостаза позволяет восстанавливать функциональную активность различных физиологических систем организма (Морозов, Хавинсон, 1996).
Интенсивное исследование регуляторных пептидов за последние 2-3 десятилетия привело к кардинальному пересмотру представлений о механизмах регуляции физиологических функций, принципов координации процессов гомеостаза и адаптации функциональных систем организма к окружающей среде.
Оказалось, что для воздействия на физиологические процессы необязательно наличие целой молекулы. Более того, в некоторых случаях фрагменты, состоящие всего из 3-4 аминокислотных остатков, были эффективнее, чем нативные соединения. Эти данные послужили предпосылкой к формированию представлений о том, что регуляция и координирование функций организма могут осуществляться за счет процессинга полипептидов, когда в зависимости от потребностей организма от достаточно длинных полипептидных цепей отщепляются фрагменты, обладающие той или иной степенью активности, специфичности и направленности действия на определенные физиологические системы. Процессинговая регуляция обладает значительно большей степенью гибкости, позволяя в короткие сроки путем активации соответствующих пептидаз образовывать в нужном месте требуемые регуляторы из уже готового предшественника. Кроме того, в механизм процессинга заложена определенная программа последовательности включения регуляторов. Процессинговый тип регуляции в наибольшей степени присущ именно пептидным соединениям с линейной структурой, открывающей широкие возможности для изменения конформации молекулы при отщеплении хотя бы одного аминокислотного остатка с любого конца. Кроме того, при таком отщеплении могут значительно меняться другие свойства молекулы, например, степень ее гидрофобности, определяющая способность прохождения через клеточные мембраны и гистогематические барьеры и т.д. (Ерошенко и др., 1991).
Как известно, подавляющее большинство регуляторных пептидов обладает поли- функциональностью. Другими словами, одно соединение обеспечивает регуляцию различных, часто физиологически несхожих функций. В связи с этим, многие физиологические функции оказываются под контролем целого ряда регуляторных пептидов.
Все больше и больше данных свидетельствует о том, что регуляторные олигопептиды являются участниками процессов роста, развития и регенерации. Многие из них представляют собой хорошо изученные структуры, регулирующие различные физиологические функции организма (Замятнин, 1988). Предполагают, что на уровне олигопептидов существует единая система регуляции как эмбрионального развития, роста и регенерации, так и функционирования сформированного организма. По-видимому, в процессе морфогенеза большинство (если не все) функционально активные олигопептиды принимают участие в появлении новых форм и структур в ходе индивидуального развития. При этом становится очевидной условность подразделения олигопептидов на нейро-, эндокрино- или иммуноактивные и одновременно на морфогенетически активные факторы (Замятнин, 1992).
Известно, что взаимодействие лиганда с рецептором реализуется на основе их структурного соответствия (Говырин, Жоров, 1994). Для олигопептида это означает наличие определенной совокупности свойств молекулы, которую на основе применения принципов системного анализа и элементов теории информации было предложено называть сигнатурой (Чипенс, 1980). Очевидно, что это понятие включает сведения и об аминокислотной последовательности. Как отмечает Г.И. Чипенс, каждая пептидная молекула имеет бесконечное число свойств, которые проявляются и определяются только в процессе взаимодействия с другими молекулами как результат внутри- и межмолекулярных взаимодействий в условиях данной среды.
В основу анализа первичных структур белков и пептидов были положены три принципа теории информации — сигнатур, двузначности и эквивокации (Чипенс, 1980; Quastler, 1965). Согласно принципу сигнатур, взаимодействие и комплексообразование молекул определяется наборами свойств (сигнатурами) активных участков их электронных структур (носителей сигнатур). Поскольку молекула может иметь множество сигнатур, то это приводит к неопределенности биологических эффектов, которые она может индуцировать (принцип двузначности теории информации). В определенных ситуациях различные по своей химической структуре молекулы могут иметь одинаковые сигнатуры и выполнять одинаковые функции (принцип эквивокации, или неопределенности причины эффекта). На основе принципов сигнатур и эквивокации развиты представления об эквифункциональных, т.е. однонаправленно действующих, аминокислотных остатках. В зависимости от сигнатуры однонаправленно действующими могут быть самые разные по химической структуре аминокислотные остатки (Чипенс и др., 1990).
Таким образом, основываясь на представлениях о сигнатурах, а также принципах эквивокации (несколько структур ® одна сигнатура ® одна функция) и двузначности (одна структура ® несколько сигнатур ® несколько функций), можно попытаться дать общую характеристику функциональных особенностей эндогенных регуляторных олиго- пептидов, помогающую уяснить, почему структурно разные молекулы способны вызвать близкие, практически одинаковые реакции или почему одна молекулярная структура участвует в различных физиологических процессах? Очевидно, что на основании принципа двузначности несостоятельность существующих понятий и терминов может быть объяснена наличием нескольких сигнатур у одной молекулы олигопептида, что позволяет ей взаимодействовать с рецепторами нескольких типов.
Выявление двух типов функционально значимых групп – положительно заряженных и циклических (R+ и cyc), позволяет рассматривать одно из свойств сигнатуры как взаимное расположение этих групп в первичной структуре олигопептида. Исходя из этого, можно представить значительное число структур, содержащих одинаковое расположение радикалов R+ и сyc, в то время как сами эти радикалы в разных молекулах будут принадлежать аминокислотным остаткам разного типа. Хорошо известными примерами такого рода среди радикалов R+ являются взаимные замены остатков Arg и Lys у членов одного олигопептидного семейства. Более того, многочисленные возможные замены других аминокислотных остатков при сохранении расположения R+ и cyc также могут приводить к одинаковой сигнатуре при разной первичной структуре. Примерами могут служить данные по сравнению первичных структур разных олигопептидов или по семействам, полученные в результате классификации, в том числе замены близких по радикалам аминокислотных остатков в квазиконсервативной области. По-видимому, в этом и проявляется принцип эквивокации (Zamyatnin, 1991).
Основу принципа двузначности составляет высокая конформационная подвижность олигопептидов, в результате которой одна молекула принимает различные конформации (имеет несколько сигнатур), и этим обеспечивается пространственное соответствие с рецепторами различного типа.
На основании исследований физико-химических особенностей эндогенных олигопептидов сделано предположение о том, что спектр функциональной активности этих веществ в основном определяется двумя типами радикалов, формирующих сигнатуру, а состав радикалов определяет полифункциональность олигопептидов. В то же время их уникальное распределение вдоль цепи молекулы (последовательность) определяет специфичность действия. Эти два типа радикалов в принципе могут составлять основу молекулярного физиологического кода. Данные выводы могут быть использованы при прогнозировании функциональных свойств олигопептидов, основанном на рассмотрении структуры. Кроме того, обнаружение ограниченного числа функционально значимых групп, по-видимому, позволит сузить поиск новых высокоактивных соединений пептидной природы (Замятнин, 1990).
Характерным признаком регуляторных олигопептидов оказалось небольшое содержание в них аминокислотных остатков с отрицательно заряженными боковыми радикалами (Аsp и Glu). В то же время содержание остатков с положительным зарядом достоверно больше только для Arg. Достаточно часто встречаются аминокислотные остатки Pro, Phe, Tyr, Trp и Cys. Большинство этих молекул содержат циклическую химическую группу (а Cys, как правило, участвует в образовании молекулярных макроциклов). Из сказанного следует, что регуляторные олигопептиды с заданным спектром функциональной активности содержат преимущественно положительно заряженные и циклические радикалы.
Сравнение аминокислотных последовательностей пептидных препаратов, выделенных из различных органов и тканей млекопитающих, не позволяет выявить в них гомологические участки. Если же сравнивать суммарный аминокислотный состав, то можно отметить высокое содержание аминокислот с боковыми амино- и карбоксильными группами, т. е. высокую диполярность этих макромолекул. Можно предположить, что именно высокоосновные боковые группы, как, например, у тафцина, обеспечивают селективное взаимодействие этих пептидов с поверхностными рецепторами клеток, которые содержат, как правило, карбоксильные группы глутаминовой, аспарагиновой и сиаловой кислот. Иначе говоря, в основе селективного аффинного взаимодействия пептидов-регуляторов с клеточной мембраной лежат ион-ионные и ион-дипольные взаимодействия пептида с карбоксильными группами мембраны (Демин и др., 1994).
Внутриклеточной мишенью для эндогенных биологически активных пептидов, вероятно, является биохимический комплекс, осуществляющий в клетке синтез белка. Получены первые экспериментальные данные, доказывающие целесообразность введения понятия об эссенциальных аминокислотах в качестве метаболической особенности каждого органа (ткани). Это дает основание предполагать, что изменение внутриклеточной концентрации данных аминокислот (их особого сочетания в виде ди- и трипептидов) играет важную роль в регуляции рибосомального синтеза белка. Говоря об уникальных особенностях метаболизма некоторых органов, имеется в виду тот факт, что некоторые клетки, например, кардиомиоциты, синтезируют новые белковые соединения в основном из аминокислот, высвобождающихся только при катаболизме собственных белков. Из притекающей крови кардиомиоциты утилизируют лишь две аминокислоты – Asp и Glu. Данное положение подсказывает решение вопроса об эссенциальных аминокислотах в составе пептидов, высокотропных для миокарда (Кожемяки, 1992).
Проблема биогенеза регуляторных олигопептидов из белковых предшественников вблизи клеточных рецепторов является кардинальной для изучения механизма действия ростовых трансформирующих факторов, нейроактивных пептидов и белков, белковых гормонов и др.
Как и для большинства физиологически активных веществ, эффект регуляторных пептидов определяется взаимодействием со специфическими рецепторами. Расчеты показывают, что в ряде случаев эффекты, связанные с пептидами, не удается объяснить с позиций лиганд-рецепторных взаимодействий. Отсюда возникло предположение об их модулирующем влиянии, которое сводится к изменению характеристик возбудимых мембран клетки (рецептора), облегчающих реализацию эффекта основного медиатора (Гомазков, 1992).
Регуляторные пептиды и сопряженные с их функцией ферменты следует рассматривать как сложную адаптивную систему организма, организующую реализацию приспособительных реакций на всех уровнях его интеграции. Возможно, разнообразные эффекты одного пептида объясняются не его непосредственным действием, а модуляцией эффектов нервной и гуморальной регуляции.
Особый интерес вызывает исследование процессов эндоцитоза (и не только лиганд- рецепторных комплексов). Отдельные участки поверхностных мембран клеток непрерывно втягиваются внутрь и отрываются, образуя внутриклеточные пузырьки, содержащие вещества, которые находились во внешней среде или были адсорбированы на поверхности клетки. Поэтому можно допустить возможность попадания пептидов и белков внутрь клеток и без наличия специфических для них рецепторов на клеточной поверхности.
В последнее время наблюдается возрастающий интерес исследователей к парадоксальным эффектам действия сверхмалых доз (10-18-10-14 М) биологически активных веществ. Данные эффекты наблюдаются для самых разных групп веществ – гормонов и регуляторных пептидов, а также некоторых веществ непептидной природы.
Результаты экспериментов с концентрациями веществ 10-19 М и ниже довольно противоречивы, а объяснение эффектов при концентрациях ниже 10-19 М требует привлечения таких понятий, как “активированная” вода, “память молекул” (Замятнин, 1992).
Одной из особенностей действия сверхмалых доз пептидов является наличие отчетливого эффекта, несмотря на то, что во многих случаях в объекте эксперимента присутствует значительно бoльшая эндогенная концентрация того же вещества. Предполагают, что эффекты сверхмалых доз связаны с адаптационными явлениями, поскольку клетка может реагировать не на величину действующей концентрации, а на изменения концентрации вещества в малых и сверхмалых дозах (Сазанов, Зайцев, 1992). Усиление сигнала возможно не только путем изменения концентраций вторичных мессенджеров, но также и за счет активации синтеза белков, участвующих в передаче сигнала (Reibman et al., 1991). Предполагают, что для достижения эффекта достаточно того, чтобы до клеток достигли самые “быстрые” молекулы действующего вещества из общего распределения, а не все молекулы (Бурлакова и др., 1990).
Выделяют несколько основных систем, необходимых для реализации эффектов сверхмалых концентраций (доз) эндогенных и экзогенных веществ: а) системы каскадные, амплифицирующие сигнал; б) собирательные, “отлавливающие” системы; в) накопители и транспортеры сигнальных молекул; г) супераффинные рецепторы (Ашмарин и др., 1996).
Физико-химическую основу феномена высокой чувствительности организма к так называемым факторам малой интенсивности, в том числе, и сверхмалым дозам биологически активных веществ, составляют процессы колебания биомолекул, перехода одного типа энергии в другой, резонансные эффекты взаимодействия и некоторые иные механизмы. При этом с кибернетических позиций возможен перевод сложной системы на иной уровень реагирования (например, выход из патологического состояния) путем информационных воздействий на нее, которые в своей основе имеют характер слабых по силе сигналов (Подколзин и др., 1994).
Как было отмечено, пептидная регуляция осуществляет связь между нервной, эндокринной, иммунной и, по-видимому, другими системами, участвующими в поддержании гомеостаза. Полифункциональность пептидов и каскадный механизм реализации биологических эффектов определяют те процессы, которые происходят в организме как после экзогенного введения пептида, так и после его эндогенного образования.
Таким образом, пептидная биорегуляция – новое научное направление, связанное с изучением молекулярных и клеточных механизмов, управляющих гомеостазом, разработкой способов и средств восстановления физиологических функций организма с целью предупреждения и лечения заболеваний. Дальнейшее развитие этого направления позволит по-новому подойти к изучению функций организма в норме и патологии, а также объяснить механизмы регуляции гомеостаза на уровне клеток и макромолекул.