Что означает понятие культивирование микробов
Современный подход к культивированию микроорганизмов и культур клеток
Большинство научных исследований в области биологии и медицины проводятся не на живых организмах, а «в пробирке». Клеточные культуры и культуры микроорганизмов являются наиболее простым и удобным модельным объектом, позволяющим как тестировать на них воздействие извне, так и исправлять ошибки внутри клетки. Благодаря исследованиям в области клеточного редактирования постепенно становится возможным лечение многих генетических заболеваний. Но каким образом мы можем добиться культуры, максимально соответствующей требованиям к модели для сложных экспериментов? Рассмотрим наиболее популярные современные способы выращивания микроорганизмов и культур клеток.
Общее понимание культивирования
Культивирование как микроорганизмов, так и отдельных клеток – это выращивание изъятого из определенной среды материала в лабораторных условиях. Выращенная таким образом подборка единообразных микробов или клеток уже может называться культурой.
Для того, чтобы выращивание прошло успешно, требуется наличие определенного оборудования, а также соблюдение условий, необходимых для роста и созревания культуры. Стандартно для культивирования используются:
Также в процессе культивирования от лаборатории требуется соблюдение условий роста для каждой конкретной культуры. Ввиду того, что как клетки, так и микробы, требуют для себя условий, приближенных к естественным, в лаборатории должны поддерживаться различные условия роста при наличии разных культур. Основные условия: приемлемая для культур температура, влажность, давление, постоянная подача кислорода (для аэробных бактерий) или исключение доступа к кислороду (для анаэробных). (Рекомендуем статью: «Флуоресцентная микроскопия»)
Факторы роста
Факторами роста называют все питательные вещества, которые требуются бактериям и клеткам для оптимального роста и развития. В случае если сама среда не обладает достаточным количеством нужных элементов, их добавляют извне. При этом количество строго регулируется в зависимости от требований к конечной культуре.
К наиболее часто использующимся в современном лабораторном культивировании факторам роста относятся:
В зависимости от типа культивируемых клеток или бактерий, фактор роста может как входить в состав питательной среды, так и вноситься извне.
Питательные среды и требования к ним
Питательная среда – это пространство, в котором находится необходимая группа клеток или бактерий. Среды бывают очень разными, в том числе и узкоспециализированными, для роста наиболее привередливых микроорганизмов. Однако существуют и общие требования, предъявляемые ко всем средам без исключения:
При этом питательные среды могут значительно различаться по всем остальным характеристикам. Они могут быть как натуральными, так и синтезированными искусственно, а также жидкими, полужидкими или плотными.
Условия роста
Рост микроорганизмов и клеток невозможен без соблюдения определенных условий, таких как температура, влажность, давление, свет и аэрация (насыщение кислородом). Существуют микроорганизмы, которые имеют диаметрально противоположные требования по условиям роста. Для решения проблемы условий при культивировании различных клеток или микроорганизмов используется специальная аппаратура с камерами, внутри которых поддерживается нужный уровень температуры, света или давления. В одном таком устройстве, но в разных камерах, может быть одновременно несколько чашек Петри с материалом, имеющим различные требования по условиям роста. (Рекомендуем статью: «Инновационные технологии для поиска и разработки новых лекарств»)
Стерилизация посуды, сред и окружения
Одним из наиболее важных требований к процессу культивирования, является отсутствие загрязнений на оборудовании, при помощи которого происходит выращивание. Этого добиваются, проводя мероприятия по стерилизации. Стерилизация может проводиться несколькими способами, наиболее известные и используемые в современных лабораториях:
Основным моментом в современном культивировании клеток и микроорганизмов, всегда будет являться неуниверсальность методик. Из-за большого разнообразия объектов культивирования, всегда будет необходимость подбирать наилучшие условия для конкретного объекта.
Культивирование микроорганизмов
Типы питания, дыхания (аэробы и анаэробы), индукцию и активность ферментов, токсинов, пигментов, рост и размножение являются основными физиологическими параметрами, которые учитывают при разработке составов питательных сред и условий культивирования микробов in vitro.
2. Культивирование микроорганизмов.
Культивировать микроорганизмы – это значит искусственно создавать условия для их роста и размножения in vitro, взаимосвязанных, но не обязательно сопряжённых процесса. Рост и размножение –циклический 4-х фазный процесс (латентная, логарифмического роста, стационарная, гибель). Период между образованием новых клеток и их делением называется периодом генерации, на длительность которого, кроме особенностей микроба, влияет состав питательной среды. Формы колоний разных микробов на питательной среде одного и того же состава отличаются, что учитывают при их дифференциации.
Для культивирования in vitro необходимы субстраты, которые микроорганизмы могут использовать в качестве питательных веществ для своего роста и размножения. Такие питательные субстраты – плотные или жидкие – называют культуральными или питательным средами. В большинстве случаев в микробиологических лабораториях микроорганизмы культивируют in vitro, т. е. в стеклянных колбах, пробирках и других сосудах.
К любой питательной среде предъявляют ряд основных требований:
1). Стерильность и по возможности прозрачность.
2). При составлении питательных сред учитывают потребность микроорганизмов в элементах питания (необходимые для жизнедеятельности клеток биохимические факторы – источники энергии, С, N, S, а также неорганические ионы – доступные для усвоения микроорганизмами).
3). Оптимальные значения ряда биофизических показателей: концентрации водородных ионов (pH), окислительно-восстановительного потенциала (Eh), активности воды (aw), осмотического давления.
3. Классификация питательных сред и способы их получения.
Питательные среды классифицируют в зависимости от:
v химического состава и исходных компонентов;
В зависимости от химического состава и исходных компонентов различают следующие типы питательных сред:
— среды неопределенного химического состава (естественные или натуральные среды) – это среды, которые состоят из продуктов животного или растительного происхождения, имеющие сложный неопределенный химических состав:
1) среды животного происхождения (исходные продукты – мясо, рыба, яйца, молоко и т. д.)
2) среды растительного происхождения (исходные продукты – соя, горох, картофель, морковь и т. д.)
На естественных средах хорошо развиваются микроорганизмы, однако эти среды малопригодны для контролируемого изучения физиологии обмена веществ микроорганизмов и диагностических исследований, поскольку они не позволяют учитывать потребности ряда компонентов среды, а с другой стороны определять вещества, образующие микроорганизмами. Естественные среды используют главным образом для поддержания культур микроорганизмов, накопления их биомассы и диагностических целей.
«Полусинтетические» среды (гидролизатные), относящиеся к средам с неопределенным составом. В них, наряду с соединениями известной химической природы, входят вещества неопределенного состава. Их используют в микробиологической практике для получения витаминов, антибиотиков, аминокислот и других продуктов жизнедеятельности микроорганизмов (продукты гидролиза мяса, молока, дрожжей, крови и др. белковых веществ).
Среды известного химического состава (синтетические) – в их состав включают известные химические соединения (соли, углеводы, аминокислоты, витамины и т. д.) в оптимальном количественном соотношении. Синтетические среды по составу бывают простыми или имеют относительно большой набор компонентов. Их используют, когда выращиваемую клеточную массу необходимо максимально освободить от балластных органических соединений, входящих в состав обычных сред, например при получении диагностических аллергенов или при изучении метаболических потребностей микроорганизма в том или ином конкретном химическом соединение. Кроме того, исследователи стремятся определить для каждого микроорганизма минимальные потребности в питательных веществах и, исходя из этого, создать минимальную среду, содержащую лишь необходимы для его размножения химические соединения.
По консистенции питательные среды дифференцируют на плотные, полужидкие и жидкие.
Жидкие питательные среды. Готовят, используя экстракты, гидролизаты, растворы исходных продуктов.
Агар-агар (малайское желе)- растительный коллоид, получаемый из некоторых морских водорослей. В его состав входят главным образом полисахариды с ничтожным количеством азотистых веществ. Для получения плотных сред его добавляют в количестве 1,5-2%,полужидких –0,3-0,7%.
Желатина – кислый азотистосодержащий продукт, добываемый при выварке костей и хрящей. Обычно в питательные среды вносят 10-20% желатины. Но ряд бактерий выделяют протеолитические ферменты, разлагающие желатину, что делает его неудобным для применения.
По целевому назначению различают:
А).Общеупотребительные (основные) среды.
Их применяют для культивирования относительно неприхотливых микроорганизмов.
Мясная вода: Получение – мясной фарш заливают водопроводной водой 1:2, кипятят 1ч., затем фильтруют, доливают водой до первоначального объема, разливают по емкостям, плотно закрывают и стерилизуют автоклавированием при 120ОС 20 мин.
Перевар Хоттингера готовят из мясных отходов путем их триптического гидролиза. Жир, фасции, сухожилия нарезают, заливают кипящей водой 1:2, кипятят, охлаждают до 45ОС, добавляют панкреатин, подщелачивают раствором карбоната натрия, встряхивают, добавляют хлороформ, закрывают и выдерживают в теплом месте 10 дней.
Мясо-пептонный бульон (МПБ). Для приготовления используют мясной бульон. К 1 л мясного бульона добавляют 5-10 г пептона (первый продукт гидролиза белка с высокой молекулярной массой) для повышения калорийности среды и 5 г NaCI для создания осмотической активности. Затем устанавливают нейтральную или слабощелочную реакцию среды. Кипятят. Фильтруют через бумажный фильтр, разливают по колбам, пробиркам и стерилизуют автоклавированием при 1200С 20 мин.
Мясо–пептонный агар (МПА): к 1 л МПБ добавляют 15-20 г мелко нарезанного агар-агара. Среду нагревают до растворения агара, устанавливают слабощелочную реакцию среды 20%-ным раствором Na2CO3, фильтруют и через воронки разливают в пробирки, стерилизуют автоклавированием при1200 20 мин.
Мясо-пептонная желатина (МПЖ). К 1 литру МПБ добавляют желатин до конечной концентрации 10-20%, нагревают, устанавливают слабо-щелочную pH, кипятят, фильтруют, разливают по пробиркам и стерилизуют в кипятильнике Коха текучим паром 3 дня или однократно автоклавированием при 1200С при 1 атм. течение 20 мин.
Полужидкий мясо-пептонный агар (ПЖА) готовят, как МПА, но добавляют 0,25% агара, кипятят до его расплавления, устанавливают требуемую pH, фильтруют в горячем виде и стерилизуют автоклавированием.
Бульон Хоттингера: основной перевар Хоттингера разводят водой 1:5 (1:8), добавляют 0,5% NaСI, 0,1 г гидрофосфата калия, устанавливают pH, кипятят 150-20 мин, фильтруют, разливают по емкостям и стерилизуют автоклавированием при 1200 20 мин.
Агар Хоттингера готовят, добавляя к бульону Хоттингера 2% агар-агара.
Многие виды болезнетворных бактерий плохо растут на обще-употребительных средах, поэтому в основные среды добавляют кровь, сыворотку крови, углеводы и т. д. Такие среды получили название обогащенных.
Сывороточный и кровяной агары: к расплавленному и охлажденному стерильному питательному агару добавляют дефибринированной крови или сыворотки крови (лошади, КРС, кролика). Компоненты перемешивают, разливают в чашки Петри, пробирки и оставляют до застывания.
Сывороточный и кровяной бульоны готовят аналогично.
Растворы углеводов стерилизуют текучим паром или фильтрованием и добавляют в количестве 0,5- 1% к пит. среде.
Среды, разработанные с учетом специфических ростовых потребностей ряда бактерий.
Среда Терских состоит из фосфатной смеси Зеренсена и кроличьей сыворотки.
Смесь Зеренсена: раствор А: гидрофосфат натрия, вода дист.; раствор Б: дигидрофосфат калия, вода дист. К 90 мл раствора А добавляют 10 мл раствора Б и доводят объем до 1000 мл, разливают по пробиркам, стерилизуют, а затем добавляют 6-8 капель стерильной инактивированной сыворотки кролика.
Г). Элективные (избирательные) среды
Предназначены для культивирования определенных групп микроорганизмов, обеспечивающие преимущественное развитие одного вида или группы родственных микроорганизмов и менее пригодные или совсем не пригодные для развития других. Их применяют главным образом для выделения микроорганизмов из мест их естественного обитания и получения накопительных культур. Элективные среды чрезвычайно разнообразны по своему составу. По консистенции среды данного типа могут быть плотными и жидкими. Жидкие среды называются средами обогащения или накопления, их применяют, когда ставят цель увеличить количество искомого микроорганизма смешанной популяции. Среды стерилизуют автоклавированием текучим паром или в автоклаве под давлением при 1 атм 12-30 мин.
Молочно-солевой агар предназначен для избирательного культивирования стафилококков.
Среда Шустовой предназначена для выделения сальмонелл
Среды Раппопорта и Мюллера предназначены для культивирования сальмонелл.
Среда Кауфмана – это среда обогащения для сальмонелл
Предназначены для выявления ферментов у микроорганизмов. В состав этих сред входит основная питательная среда, обеспечивающая рост изучаемого микроорганизма, субстрат для обнаружения фермента и индикатор, по изменению цвета которого судят о сдвиге pH среды в результате расщепления субстрата.
Среды Гисса используют для изучения ферментативных свойств выделенных культур микроорганизмов. К 100мл дист. Воды добавляют 1% пептона, 0,5 г NaCI. Компоненты растворяют, фильтруют, устанавливают pH, добавляют один из углеводов субстратов, агар-агар, а затем индикатора Андрэдэ. Готовую среду разливают по 3мл в пробирки, стерилизуют текучим паром 3 дня по 30 мин.
Среда Энда содержит лактозу в качестве субстрата и предназначена для дифференцировки бактерий, различающихся по способности расщеплять глюкозу.
Среда Левина, по целевому назначению аналогична среде Эндо, но содержит другой индикатор.
Агар Плоскирева предназначен для выделения сальмонелл, содержит лактозу в качестве субстрата и компоненты, подавляющие рост сопутствующей микрофлоры.
4. Культивирование грибов.
Лучший рост грибов отмечен на средах с содержанием углеводов 1…4%. При первичной изоляции для подавления роста различных сопутствующих бактерий в питательные среды часто добавляют различные антибиотики.
Агар Сабуро применяют для культивирования возбудителей дерматомикозов и кандидамикоза.
Агар Чапека используют для культивирования грибов многих видов.
Сусло-агар предназначен для культивирования возбудителей дерматомикозов и кандидомикоза.
Агар Литмана пригоден для культивирования дерматофитов.
Среда Ван-Итерсона предназначена для авыделения из кормов токсичных грибов, вызывающих стахиботриотоксикоз, дендродохитоксикоз и др.
Среда Билай предназначена для получения макроконидий грибов.
Культивирование на волосах по Ванбрейзегему применяют при выделении дерматофитов. Здоровые стерильные волосы прикрепляют коллодием к стеклянной трубочке. На середину волос наносят культуру гриба. Трубочку помещают в цилиндр, на дно которого для влажности наливают небольшое количество воды. Культивируют при 250С 5-10 дней и более.
Для выделения возбудителей гистоплазмоза, эпизоотического лимфангита применяют кровяной агар.
5. Вывод.
Микроорганизмы культивируют на питательных средах. К универсальным средствам относят мясо-пептонный агар и мясо-пептонный бульон. Первая характеристика изучаемого микроорганизма определяется способностью его роста на универсальных средах. На плотных питательных средах многие микроорганизмы образуют колонии. Для микроорганизмов, не растущих на обычных средах, используют специальные среды. Для выделения каких-либо определенных видов, отличающихся особенностями роста, применяют элективные среды.
Правильный подбор и использование питательных сред обеспечивает успешное культивирование микробов для накопления биомассы и её биотехнологическое использование для производства диагностических и вакцинных препаратов, определения и идентификации микробов в диагностической лаборатории и научных исследованиях.
http://ru. wikipedia. org/wiki/%CF%E8%F2%E0%F2%E5%EB%FC%ED%E0%FF_%F1%F0%E5%E4%E0
Требования, предъявляемые к средам
Чтобы во время роста микроорганизмов кислые или щелочные продукты их жизнедеятельности не изменили pH, средым должны обладать буферностью, т. е. содержать вещества, нейтрализующие продукты обмена.
Классификация
Приготовление сред
Посуда для приготовления сред
Посуда для приготовления сред не должна содержать посторонних веществ, например щелочей, выделяемых некоторыми сортами стекла, или окислов железа, которые могут попасть в среду при варке её в ржавых кастрюлях. Лучше пользоваться стеклянной, эмалированной или алюминиевой посудой. Перед употреблением посуду необходимо тщательно вымыть, прополоскать и высушить. Новую стеклянную посуду предварительно кипятат 30 минут 1-2% растворе хлороводородной кислоты, после чего в течение часа прополаскивают в проточной воде.
Сырьё
Исходным сырьём для приготовления большинства сред служат продукты животного и растительного происхождения, а также готовые полуфабрикаты.
Культивирование микроорганизмов
Категории Микробиология | Под редакцией сообщества: Биология
Содержание
↑Требования микроорганизмов к питательным веществам
Культивирование микроорганизмов – это один из основных приемов в микробиологии. Для роста и развития микроорганизмов в природе и в лабораторных условиях необходимо наличие питательных веществ для энергетических и конструктивных реакций. Требования разных групп микроорганизмов к источникам энергии и химическим элементам определяются их метаболическими возможностями. Выращивание и поддержание микробных культур в лаборатории основано на моделировании естественных условий обитания данного организма в лаборатории, а также на знании особенностей обмена веществ.
Основными биогенными элементами являются углерод, азот, фосфор, кислород, водород, сера. Это компоненты белков, углеводов и жиров, а также нуклеиновых кислот. Эти элементы требуются в значительных количествах (г/л) и поэтому их называют макроэлементами. К макроэлементам также относятся ионы калия, магния, натрия, кальция и железа. Они выполняют в клетке разнообразные функции. Например, К + необходим для активности большого числа ферментов и в частности ферментов белкового синтеза. Са 2+ определяет устойчивость бактериальных эндоспор к нагреванию. Mg 2+ стабилизирует рибосомы, многие ферменты и клеточные мембраны. Fe 2+ и Fe 3+ являются частью цитохромов и кофакторами электронпереносящих белков.
Биогенные элементы должны присутствовать в питательной среде в доступной для микроорганизмов форме. Как правило, ионы металлов, сера, фосфор и микроэлементы добавляют в среду в виде минеральных солей. Минеральная основа среды (минеральный фон) практически одинакова для большинства микроорганизмов.
Источники углерода и азота в среде могут быть как неорганическими соединениями (СО2, N2, карбонаты, нитриты, нитраты, аммонийные соли), так и органическими веществами разной степени сложности и окисленности (сахара, спирты, органические кислоты и аминокислоты, олигосахариды, пептиды и т.д.). Если микроорганизму требуется набор источников углерода или азота, и тогда применяют различные экстракты и гидролизаты смеси белков и полисахаридов неопределенного состава (сусло, гидролизат молочного белка, пептон и др.).
У некоторых микроорганизмов спектр потребляемых органических веществ очень широк (например, у Pseudomonas, Actinomyces), у других – достаточно узок (например, у облигатных метилотрофов). В то же время, можно найти микроорганизмы, способные использовать сложные неприродные соединения типа пластиков, красителей, пестицидов. У некоторых микроорганизмов потребности в питании так сложны, что они растут только внутри живого организма (например, внутриклеточные паразиты риккетсии и хламидии).
Как правило, лабораторные среды содержат питательные вещества в более высоких концентрациях, чем это присуще природным местообитаниям. Для разных микроорганизмов границы значений физико-химических факторов, в которых может происходить рост, существенно отличаются. Поэтому важным условием успешного культивирования является поддержание оптимальных значений таких параметров, как рН, температура, освещенность, аэрация и т.д.
↑Типы сред и способы культивирования микроорганизмов
Разнообразные питательные среды, используемые в микробиологической практике для культивирования микроорганизмов, подразделяются по составу, физическому состоянию и назначению.
По составу среды делятся на натуральные и синтетические. Синтетические среды применяют для изучения обмена веществ у микроорганизмов. Они имеют определенный химический состав с точным указанием концентрации каждого соединения. Натуральные среды применяют для накопления биомассы микроорганизмов и широко используют для первичного выделения из естественных субстратов, поскольку их состав позволяет удовлетворить питательные потребности многих групп микроорганизмов. В них содержатся богатые различными органическими веществами продукты животного или растительного происхождения, имеющие сложный и непостоянный состав. Часто натуральные среды готовят на основе мясо-пептонного бульона (МПБ) и солодового сусла. МПБ – это прокипяченный экстракт мясного фарша с добавлением пептона и поваренной соли. Он богат азотсодержащими органическими соединениями, но обеднен углеводами. Солодовое сусло, напротив, содержит преимущественно углеводы. Его получают путем настаивания размолотого солода в водопроводной воде при постепенном нагревании. Солодом называют пророщенные и высушенные зерна ячменя. В процессе приготовления сусла происходит гидролиз крахмала ячменя и экстракция сахаров в воду. В зависимости от партии зерна концентрация сахаров в сусле может быть разной. Ее выражают в градусах Баллинга ( о Б), что примерно соответствуют процентному содержанию сахаров в растворе. Сусло с разной концентрацией сахаров применяют для выращивания разных групп микроорганизмов.
Жидкие среды представляют собой растворы или суспензии ингредиентов в воде. В качестве сыпучих сред применяют наборы длительно хранящихся сухих компонентов, которые перед работой растворяют или смачивают водой. Это могут быть зерно, отруби, твердые отходы сельского хозяйства и пищевой промышленности. В настоящее время получили широкое распространение порошкообразные синтетические и натуральные среды. Для получения твердых сред в жидкую основу добавляют уплотняющие агенты. Наиболее известными отвердителями являются желатин, агар и силикагель. Желатин – это белок из соединительной ткани животных, образующий гель при 25 о С. Неудобство его применения заключается в том, что температура роста многих микроорганизмов выше, чем температура плавления желатина. Наличие протеолитических ферментов у многих микроорганизмов приводит к расщеплению и разжижению желатина. Более удобен как уплотнитель сложный полисахарид агар, получаемый из морских бурых водорослей, так как большинство микроорганизмов не использует его для питания. Агар может многократно плавиться при 100 о С и застывать при 45 о С. Добавлением 2% агара в жидкую основу получают широко применяемые мясо-пептонный агар (МПА), сусло-агар (СА) и бульон-сусло-агар (БСА). В качестве твердой основы для синтетических сред часто используют неорганическое соединение кремния силикагель.
По назначению среды подразделяются на универсальные, элективные и индикаторные. Универсальные среды используют для накопления микробных клеток и первоначального выявления видового разнообразия микроорганизмов в смешанных популяциях. Они позволяют поддерживать рост значительного числа микроорганизмов. В то же время следует помнить, что не существует одной среды, универсальной для всех микробных культур. Элективные среды используют для получения накопительных культур как первого этапа при выделении чистой культуры из природных местообитаний. Создание условий, благоприятных для определенной группы микроорганизмов (элективных условий), приводит к преобладанию в смешанной популяции желаемых микроорганизмов. Рост и размножение других микроорганизмов в этих условиях не значительны. Для быстрого выявления определенных групп микроорганизмов или особенностей их метаболизма применяют индикаторные среды, содержащие вещество-индикатор, реагирующий изменением цвета на проявление какого-либо свойства организма. Индикаторные среды наиболее часто используют в санитарной и медицинской микробиологии.
↑Способы культивирования микроорганизмов
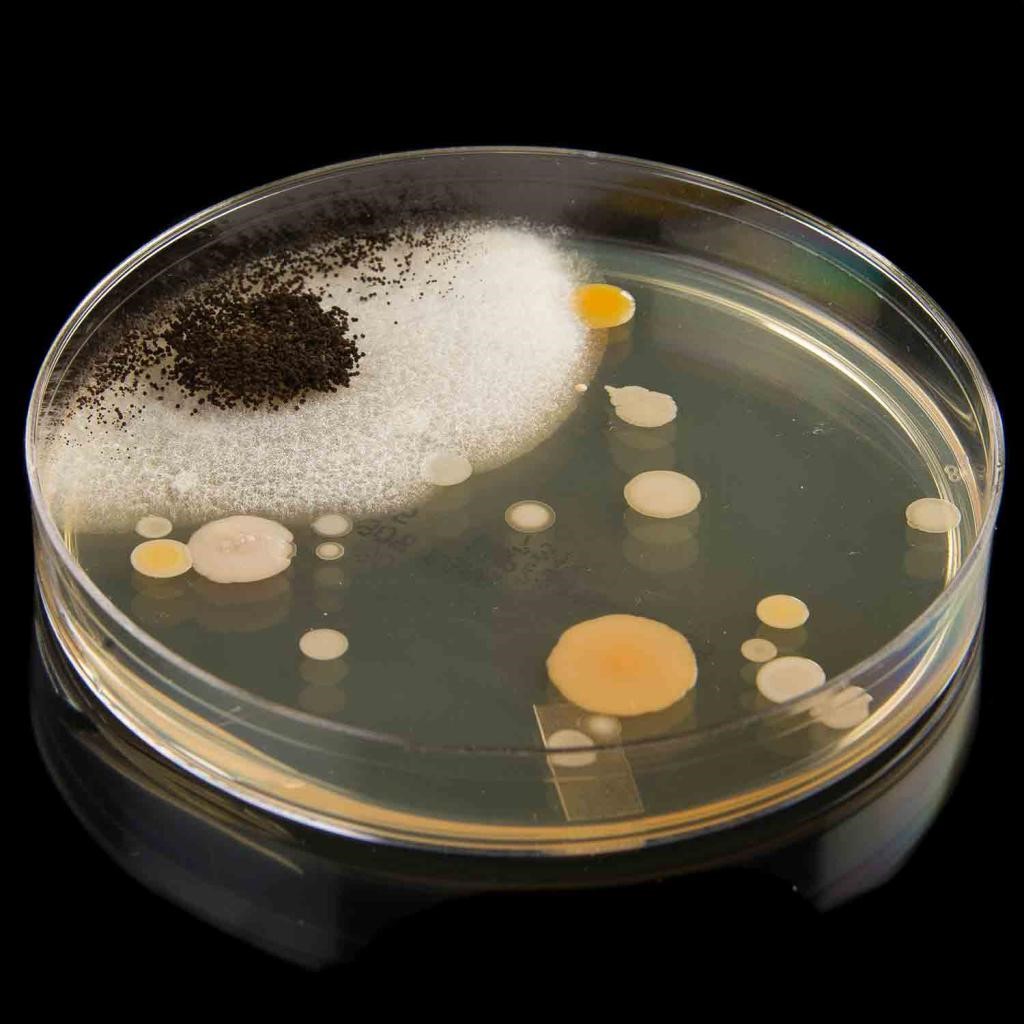
Особенности роста микроорганизма (культуральные свойства) иногда служат одним из критериев при определении его систематического положения. Микробные клетки в зависимости от условий могут расти в виде суспензии, микроколоний или обрастаний в жидких средах и образовывать колонии, штрихи или газон на твердых средах. Глубинные колонии формируются в толще агаризованных сред в виде чечевичек, тонких пленок или пучков ваты. Из-за выделения газов микроорганизмами при глубинном росте могут наблюдаться разрывы агаризованной среды. Поверхностные колонии отличаются большим разнообразием формы, размера, цвета, профиля. Колония может быть прозрачной, плотной, мягкой, хрупкой, врастать в агар, сниматься целиком в виде пленки, тянуться за петлей и т.д. Ее поверхность может быть блестящей или матовой, гладкой или шероховатой, иметь различные выпуклости, исчерченность и т.д. Различия в форме края и структуре колоний можно увидеть при малом увеличении микроскопа. Морфология колоний может значительно изменяться в зависимости от состава среды, возраста культуры и температуры культивирования. При посеве штрихом (прямой линией по агару) рост бывает обильный или скудный, сплошной или в виде цепочек очень мелких колоний, перистый, древовидный с различной формой края. При развитии культуры в жидких средах развитие микроорганизма может приводить к окрашиванию среды и появлению запаха, образованию пены и пузырьков, появлению помутнения, пленки на поверхности среды или осадка на дне сосуда.
Различают два основных способа культивирования микроорганизмов – периодическое и непрерывное. При периодическом культивировании клетки помещают в закрытый сосуд определенного объема, содержащий питательную среду, и задают начальные условия. Постепенно увеличивается плотность популяции, снижается концентрация питательных веществ и накапливаются продукты обмена, т.е. условия существования микроорганизмов изменяются. Периодическую культуру обычно рассматривают как замкнутую систему, переживающую разные фазы развития. Каждая фаза характеризуется определенными физиологическими параметрами. Лаг-фаза – это фаза «привыкания» клеток к среде, при этом происходит увеличение количества ДНК и РНК и индукция синтеза соответствующих ферментов. Лаг-фаза удлиняется, если брать старый посевной материал и переносить клетки в совершенно новую по составу среду. Лаг-фаза сокращается (или может совсем отсутствовать), если активные молодые клетки перенести в свежую среду того же состава и той же температуры. На средах, содержащих смесь субстратов, наблюдается диауксия, при которой после исчерпания одного субстрата культура переходит во вторую лаг-фазу для подготовки к потреблению другого субстрата. В экспоненциальной (логарифмической) фазе клетки растут и делятся с максимальной скоростью, их рост не ограничен. Обычно такие клетки используют в биохимических и физиологических исследованиях. По мере исчерпания субстратов и накопления продуктов обмена скорость роста снижается (фаза замедления роста) и культура переходит в стационарную фазу, в течение которой процессы деления и отмирания клеток в популяции находятся в динамическом равновесии. Для бактерий эта фаза достигается при концентрации в среднем 10 9 клеток/мл, для водорослей и простейших – 10 6 клеток/мл. Когда исчерпание питательных веществ и накопление продуктов метаболизма преодолеют некие пороговые концентрации, начинается фаза отмирания и число клеток в популяции постепенно снижается.
Непрерывное (проточное) культивирование позволяет зафиксировать культуру в какой-то определенной фазе (обычно экспоненциальной). При этом состав среды и условия роста остаются постоянными. Этого добиваются постоянным прибавлением новой питательной среды в сосуд для выращивания и одновременным удалением такого же количества среды с клетками. Простейшая схема организации протока представлена на рис. 45. Подача свежей среды и удаление части суспензии (проток) происходит с той же скоростью, с какой растет культура. В этом случае устанавливается динамическое равновесие.
Некоторые микроорганизмы способны к пребыванию в особом физиологическом состоянии, при котором живые клетки не дают колоний на пригодных для них лабораторных средах, но под микроскопом наблюдаются как живые. Такое некультивируемое состояние (некультивируемая форма) присуще ряду микроорганизмов в природных местообитаниях, например, возбудителям сальмонеллеза и холеры, находящимся вне организма человека. Механизм перехода в некультивируемую форму и обратно не изучен, но есть данные о том, что этот процесс запрограммирован в геноме микроорганизмов и запускается недостатком питательных веществ в природных эконишах. В природных образцах такие микроорганизмы изучают путем прямого наблюдения и с помощью методов молекулярного анализа состава нуклеиновых кислот образца.
↑Смешанные и чистые культуры микроорганизмов. Накопительные культуры. Способы получения чистых культур
Эта статья еще не написана, но вы можете сделать это.