Что означает в химии sio2
Двуокись кремния
Диокси́д кре́мния (оксид кремния (IV), кремнезём, SiO2) — бесцветные кристаллы, tпл 1713—1728 °C, обладают высокой твёрдостью и прочностью.
Содержание
Свойства
Полиморфизм
Диоксид кремния имеет несколько полиморфных модификаций.
Самая распространенная из них на поверхности земли — α-кварц — кристаллизуется в тригональной сингонии
При нормальных условиях диоксид кремния чаще всего находится в полиморфной модификации α-кварца, которая при температуре выше 573 °C обратимо переходит в β-кварц. При дальнейшем повышении температуры кварц переходит в тридимит и кристобалит. Эти полиморфные модификации устойчивы при высоких температурах и низких давлениях. При высоких температуре и давлении диоксид кремния сначала превращается в коэсит, а затем в стишовит (который впервые был обнаружен на месте эпицентра ядерного взрыва). Согласно некоторым исследованиям стишовит слагает значительную часть мантии, так что вопрос о том какая разновидность SiO2 наиболее распространена на Земле, пока не имеет однозначного ответа.
Также имеет аморфную модификацию — кварцевое стекло.
Химические свойства
Диоксид кремния SiO2 — кислотный оксид, не реагирующий с водой.
Химически стоек к действию кислот, но реагирует с плавиковой кислотой:
Эти две реакции широко используют для травления стекла.
При сплавлении SiO2 с щелочами и основными оксидами, а также с карбонатами активных металлов образуются силикаты — соли не имеющих постоянного состава очень слабых, нерастворимых в воде кремниевых кислот общей формулы xH2O·ySiO2 (довольно часто в литературе упоминаются не кремниевые кислоты, а кремниевая кислота, хотя фактически речь при этом идет об одном и том же).
Например, может быть получен ортосиликат натрия:
или смешанный силикат кальция и натрия:
Из силиката Na2O·CaO·6SiO2 изготовляют оконное стекло.
Следует отметить, что большинство силикатов не имеет постоянного состава. Из всех силикатов растворимы в воде только силикаты натрия и калия. Растворы этих силикатов в воде называют растворимым стеклом. Из-за гидролиза эти растворы характеризуются сильно щелочной средой. Для гидролизованных силикатов характерно образование не истинных, а коллоидных растворов. При подкислении растворов силикатов натрия или калия выпадает студенистый белый осадок гидратированных кремниевых кислот.
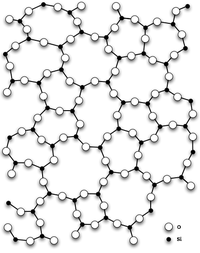
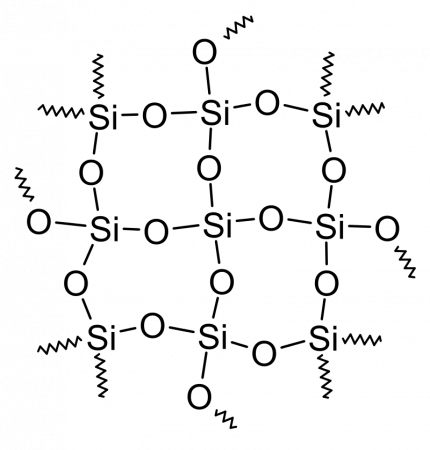
Главным структурным элементом как твердого диоксида кремния, так и всех силикатов выступает группа [SiO4/2], в которой атом кремния Si окружен тетраэдром из четырех атомов кислорода О. При этом каждый атом кислорода соединен с двумя атомами кремния. Фрагменты [SiO4/2] могут быть связаны между собой по-разному. Среди силикатов по характеру связи в них фрагментов [SiO4/2] выделяют островные, цепочечные, ленточные, слоистые, каркасные и другие.
Получение
Синтетический диоксид кремния получают нагреванием кремния до температуры 400—500°C в атмосфере кислорода, при этом кремний окисляется до диоксида SiO2.
В лабораторный условиях синтетический диоксид кремния может быть получен действием кислот на силикатные соли. Например:
кремниевая кислота сразу разлагается на воду и SiO2, выпадающий в осадок.
Натуральный диоксид кремния в виде песка используется там, где не требуется высокая чистота материала.
Применение
Диоксид кремния применяют в производстве стекла, керамики, абразивов, бетонных изделий, для получения кремния, как наполнитель в производстве резин, при производстве кремнезёмистых огнеупоров, в хроматографии и др. Кристаллы кварца обладают пьезоэлектрическими свойствами и поэтому используются в радиотехнике, ультразвуковых установках, в зажигалках.
Диоксид кремния — главный компонент почти всех земных горных пород, в частности, кизельгура. Из кремнезёма и силикатов состоит 87% массы литосферы.
Аморфный непористый диоксид кремния применяется в пищевой промышленности в качестве вспомогательного вещества E551, препятствующего слёживанию и комкованию, парафармацевтике (зубные пасты), в фармацевтической промышленности в качестве вспомогательного вещества (внесён в большинство Фармакопей), а также пищевой добавки или лекарственного препарата в качестве энтеросорбента.
Искусственно полученные плёнки диоксида кремния используются в качестве изолятора при производстве микросхем и других электронных компонентов.
Также используется для производства волоконно-оптических кабелей. Используется чистый плавленый диоксид кремния с добавкой в него некоторых специальных ингредиентов.
Пористые кремнезёмы
Пористые кремнезёмы получают различными методами.
Силохром получают путём агрегирования аэросила, который, в свою очередь, получают сжиганием силана (SiH4). Силохром характеризуется высокой чистотой, низкой механической прочностью. Характерный размер удельной поверхности 60—120 м²/г. Применяется в качестве сорбента в хроматографии, наполнителя резин, катализе.
Силикагель получают путём высушивания геля кремневой кислоты. В сравнении с силохромом обладает меньшей чистотой, однако может обладать чрезвычайно развитой поверхностью: до 320 м²/г.
Кремниевый аэрогель приблизительно на 99,8 % состоит из воздуха может иметь плотность до 1,9 кг/м³ (всего в 1,5 раза больше плотности воздуха).
Полезное
Смотреть что такое «Двуокись кремния» в других словарях:
ДВУОКИСЬ КРЕМНИЯ — SiO2, см. Кремнезем. Геологический словарь: в 2 х томах. М.: Недра. Под редакцией К. Н. Паффенгольца и др.. 1978 … Геологическая энциклопедия
двуокись кремния — кремнезём, кремнёвый ангидрид … Cловарь химических синонимов I
легированная синтетическая двуокись кремния — СЛДК Синтетическая двуокись кремния, полученная путем химического соединения двуокиси кремния с легирующими компонентами. [ГОСТ 16548 80] Тематики оптика, оптические приборы и измерения Синонимы СЛДК EN synthetic doped silica DE synthetisches… … Справочник технического переводчика
синтетическая двуокись кремния — СДК Полидисперсная аморфная двуокись кремния, являющаяся продуктом технологического процесса. [ГОСТ 16548 80] Тематики оптика, оптические приборы и измерения Синонимы СДК EN synthetic silica DE synthetisches Siliziumdioxyd FR silice synthétique … Справочник технического переводчика
материалы, не содержащие двуокись кремния — rus материалы (мн), не содержащие двуокись кремния eng non siliceous materials (pl) fra matériaux (m pl) non silicieux deu nicht kieselhaltiges Material (n) spa materiales (m pl) no silíceos … Безопасность и гигиена труда. Перевод на английский, французский, немецкий, испанский языки
кристаллическая свободная двуокись кремния — rus кристаллическая свободная двуокись (ж) кремния, кристаллический свободный кремнезем (м) eng free crystalline silica fra silice (f) libre cristalline deu freie kristalline Kieselsäure (f) spa sílice (f) cristalina libre, sílice (f) libre… … Безопасность и гигиена труда. Перевод на английский, французский, немецкий, испанский языки
Кремния двуокись — Кварц Кварцевое стекло Диоксид кремния (оксид кремния (IV), кремнезём, SiO2) бесцветные кристаллы, tпл 1713 1728 °C, обладают высокой твёрдостью и прочностью … Википедия
Кремния двуокись — кремнезём, SiO2, соединение кремния с кислородом. Кремнезём в форме минерала кварца и др. разновидностей составляет около 12% массы земной коры (см. Кремнезёма минералы). К. д. широко применяется в силикатной промышленности в производстве … Большая советская энциклопедия
Двуокись — Оксид (окисел, окись) соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам… … Википедия
кремнезём — двуокись кремния, кремнёвый ангидрид … Cловарь химических синонимов I
Оксид кремния (IV)
Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) SiO2 – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:
Химические свойства
Еще пример : диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
4. Из кислот диоксид кремния реагирует только с плавиковой или с газообразным фтороводородом:
5. При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Еще пример : оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
Диоксид кремния
| Диоксид кремния | |
|---|---|
 | |
| Систематическое наименование | оксид кремния (IV) |
| Традиционные названия | кремнезём |
| Хим. формула | SiO2 |
| Рац. формула | SiO2 |
| Температура | |
| • плавления | 1600 °C |
| • кипения | 2950 °C |
| Давление пара | 0 ± 1 мм рт.ст. |
| ГОСТ | ГОСТ 9428-73 |
| Рег. номер CAS | 7631-86-9 |
| PubChem | 24261 |
| Рег. номер EINECS | 231-545-4 |
| SMILES | |
| Кодекс Алиментариус | E551 |
| RTECS | VV7565000 |
| ChEBI | 30563 |
| ChemSpider | 22683 |
| Токсичность | Пыль SiO2 чрезвычайно токсична и канцерогенна при вдыхании, поражает лёгкие, приводит к силикозу |
| Пиктограммы ECB |   |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Диоксид кремния (кремнезём, SiO2; лат. silica ) — оксид кремния (IV). Бесцветные кристаллы с температурой плавления +1713…+1728 °C, обладающие высокой твёрдостью и прочностью.
Диоксид кремния — главный компонент почти всех земных горных пород, в частности, кизельгура. Из кремнезёма и силикатов состоит 87 % массы литосферы. В крови и плазме человека концентрация кремнезёма составляет 0,001 % по массе.
Содержание
Свойства
Полиморфизм
Диоксид кремния имеет несколько полиморфных модификаций.
Самая распространённая из них на поверхности земли — α-кварц — кристаллизуется в тригональной сингонии. При нормальных условиях диоксид кремния чаще всего находится в полиморфной модификации α-кварца, которая при температуре выше +573 °C обратимо переходит в β-кварц. При дальнейшем повышении температуры кварц переходит в тридимит и кристобалит. Эти полиморфные модификации устойчивы при высоких температурах и низких давлениях.
В природе также встречаются формы — опал, халцедон, кварцин, лютецит, аутигенный кварц, которые относятся к группе кремнезёма. Опал (SiO2·nH2O) в шлифе бесцветен, изотропен, имеет отрицательный рельеф, отлагается в морских водоёмах, входит в состав многих кремнистых пород. Халцедон, кварцин, лютецит — SiO2 — представляют собой скрытокристаллические разновидности кварца. Образуют волокнистые агрегаты, розетки, сферолиты, бесцветные, голубоватые, желтоватые. Отличаются между собой некоторыми свойствами — у халцедона и кварцина — прямое погасание, у лютецита — косое, у халцедона — отрицательное удлинение.
При высоких температуре и давлении диоксид кремния сначала превращается в коэсит (который в 1953 году был синтезирован американским химиком Лорингом Коэсом), а затем — в стишовит (который в 1961 году был синтезирован С. М. Стишовым, а в 1962 году был обнаружен в кратере Бэрринджера (кратере Аризонского метеорита). Согласно некоторым исследованиям, стишовит слагает значительную часть мантии, так что вопрос о том, какая разновидность SiO2 наиболее распространена на Земле, пока не имеет однозначного ответа.
Также имеет аморфную модификацию — кварцевое стекло.
Химические свойства
Диоксид кремния SiO2 — кислотный оксид, не реагирующий с водой.
Химически стоек к действию кислот, но реагирует с газообразным фтороводородом:
и плавиковой кислотой:
Эти две реакции широко используют для плавления стекла.
При сплавлении SiO2 с щелочами и основными оксидами, а также с карбонатами активных металлов образуются силикаты — соли не имеющих постоянного состава очень слабых, нерастворимых в воде кремниевых кислот общей формулы xH2O·ySiO2 (довольно часто в литературе упоминаются не кремниевые кислоты, а кремниевая кислота, хотя фактически речь при этом идёт об одном и том же веществе).
Например, может быть получен ортосиликат натрия:
или смешанный силикат кальция и натрия:
Из силиката Na2CaSi6O14 (Na2O·CaO·6SiO2) изготовляют оконное стекло.
Большинство силикатов не имеет постоянного состава. Из всех силикатов растворимы в воде только силикаты натрия и калия. Растворы этих силикатов в воде называют жидким стеклом. Из-за гидролиза эти растворы характеризуются сильно щелочной средой. Для гидролизованных силикатов характерно образование не истинных, а коллоидных растворов. При подкислении растворов силикатов натрия или калия выпадает студенистый белый осадок гидратированных кремниевых кислот.
Главным структурным элементом как твёрдого диоксида кремния, так и всех силикатов, выступает группа [SiO4/2], в которой атом кремния Si окружен тетраэдром из четырёх атомов кислорода О. При этом каждый атом кислорода соединён с двумя атомами кремния. Фрагменты [SiO4/2] могут быть связаны между собой по-разному. Среди силикатов по характеру связи в них фрагментов [SiO4/2] выделяют островные, цепочечные, ленточные, слоистые, каркасные и другие.
Получение
Синтетический диоксид кремния получают нагреванием кремния до температуры +400…+500 °C в атмосфере кислорода, при этом кремний окисляется до диоксида SiO2. А также термическим оксидированием при больших температурах.
В лабораторных условиях синтетический диоксид кремния может быть получен действием кислот, даже слабой уксусной, на растворимые силикаты. Например:
кремниевая кислота сразу распадается на воду и SiO2, выпадающий в осадок.
Натуральный диоксид кремния в виде песка используется там, где не требуется высокая чистота материала.
Применение
Аморфный непористый диоксид кремния применяется в пищевой промышленности в качестве вспомогательного вещества E551, препятствующего слёживанию и комкованию, в парафармацевтике (зубные пасты), в фармацевтической промышленности в качестве вспомогательного вещества (внесён в большинство фармакопей), для стабилизации суспензий и линиментов, в качестве загустителя мазевых основ, наполнителя таблеток и суппозиториев. Он входит в состав композиции пломбировочных материалов, снижает гигроскопичность сухих экстрактов, замедляет выход БАВ из различных лекарственных форм; в качестве пищевых добавок и сорбента, а также матриц для создания лекарственных форм с заданными свойствами – так как нет кристаллической структуры (аморфен) – безопасен, а также в качестве пищевой добавки или лекарственного препарата в качестве энтеросорбента Полисорб МП с широким спектром применения с учётом высокой удельной поверхности сорбции (в интервале 300-400 м² ) на 1 г основного вещества.
Диоксид кремния применяют в производстве стекла, керамики, абразивов, бетонных изделий, для получения кремния, как наполнитель в производстве резин, при производстве кремнезёмистых огнеупоров, в хроматографии и другом.
Кристаллы кварца обладают пьезоэлектрическими свойствами и поэтому используются в радиотехнике, ультразвуковых установках, в зажигалках.
Искусственно полученные плёнки диоксида кремния используются в качестве изолятора при производстве микросхем и других электронных компонентов.
Также используется для производства волоконно-оптических кабелей. Используется чистый плавленый диоксид кремния с добавкой в него некоторых специальных ингредиентов.
Кремнезёмная нить также используется в нагревательных элементах электронных сигарет, так как хорошо впитывает жидкость и не разрушается под нагревом спирали.
Также диоксид кремния нашёл наиболее широкое применение в шинной промышленности, производстве РТИ и пластмасс, химической промышленности, машиностроении, а в ряде конкретных операций:
Крупные прозрачные кристаллы кварца используются в качестве полудрагоценных камней; бесцветные кристаллы называют горным хрусталём, фиолетовые — аметистами, жёлтые — цитрином.
В микроэлектронике диоксид кремния является одним из основных материалов. Его применяют в качестве изолирующего слоя, а также в качестве защитного покрытия. Получают в виде тонких плёнок термическим окислением кремния, химическим осаждением из газовой фазы, магнетронным распылением.
Пористые кремнезёмы
Пористые кремнезёмы получают различными методами.
Силохром получают путём агрегирования аэросила, который, в свою очередь, получают сжиганием силана (SiH4). Силохром характеризуется высокой чистотой, низкой механической прочностью. Характерный размер удельной поверхности 60—120 м²/г. Применяется в качестве сорбента в хроматографии, наполнителя резин, катализе.
Кремниевый аэрогель приблизительно на 99,8 % состоит из воздуха и может иметь плотность до 1,9 кг/м³ (всего в 1,5 раза больше плотности воздуха).
Токсичность
Что означает в химии sio2
Диокси́д кре́мния (оксид кремния (IV), кремнезём, SiO2) — бесцветные кристаллы, tпл 1713—1728 °C, обладают высокой твёрдостью и прочностью.
Содержание
Свойства
Полиморфизм
Диоксид кремния имеет несколько полиморфных модификаций.
Самая распространенная из них на поверхности земли — α-кварц — кристаллизуется в тригональной сингонии
При нормальных условиях диоксид кремния чаще всего находится в полиморфной модификации α-кварца, которая при температуре выше 573 °C обратимо переходит в β-кварц. При дальнейшем повышении температуры кварц переходит в тридимит и кристобалит. Эти полиморфные модификации устойчивы при высоких температурах и низких давлениях. При высоких температуре и давлении диоксид кремния сначала превращается в коэсит, а затем в стишовит (который впервые был обнаружен на месте эпицентра ядерного взрыва). Согласно некоторым исследованиям стишовит слагает значительную часть мантии, так что вопрос о том какая разновидность SiO2 наиболее распространена на Земле, пока не имеет однозначного ответа.
Также имеет аморфную модификацию — кварцевое стекло.
Химические свойства
Диоксид кремния SiO2 — кислотный оксид, не реагирующий с водой.
Химически стоек к действию кислот, но реагирует с плавиковой кислотой:
Эти две реакции широко используют для травления стекла.
При сплавлении SiO2 с щелочами и основными оксидами, а также с карбонатами активных металлов образуются силикаты — соли не имеющих постоянного состава очень слабых, нерастворимых в воде кремниевых кислот общей формулы xH2O·ySiO2 (довольно часто в литературе упоминаются не кремниевые кислоты, а кремниевая кислота, хотя фактически речь при этом идет об одном и том же).
Например, может быть получен ортосиликат натрия:
или смешанный силикат кальция и натрия:
Из силиката Na2O·CaO·6SiO2 изготовляют оконное стекло.
Следует отметить, что большинство силикатов не имеет постоянного состава. Из всех силикатов растворимы в воде только силикаты натрия и калия. Растворы этих силикатов в воде называют растворимым стеклом. Из-за гидролиза эти растворы характеризуются сильно щелочной средой. Для гидролизованных силикатов характерно образование не истинных, а коллоидных растворов. При подкислении растворов силикатов натрия или калия выпадает студенистый белый осадок гидратированных кремниевых кислот.
Главным структурным элементом как твердого диоксида кремния, так и всех силикатов выступает группа [SiO4/2], в которой атом кремния Si окружен тетраэдром из четырех атомов кислорода О. При этом каждый атом кислорода соединен с двумя атомами кремния. Фрагменты [SiO4/2] могут быть связаны между собой по-разному. Среди силикатов по характеру связи в них фрагментов [SiO4/2] выделяют островные, цепочечные, ленточные, слоистые, каркасные и другие.
Получение
Синтетический диоксид кремния получают нагреванием кремния до температуры 400—500°C в атмосфере кислорода, при этом кремний окисляется до диоксида SiO2.
В лабораторный условиях синтетический диоксид кремния может быть получен действием кислот на силикатные соли. Например:
кремниевая кислота сразу разлагается на воду и SiO2, выпадающий в осадок.
Натуральный диоксид кремния в виде песка используется там, где не требуется высокая чистота материала.
Применение
Диоксид кремния применяют в производстве стекла, керамики, абразивов, бетонных изделий, для получения кремния, как наполнитель в производстве резин, при производстве кремнезёмистых огнеупоров, в хроматографии и др. Кристаллы кварца обладают пьезоэлектрическими свойствами и поэтому используются в радиотехнике, ультразвуковых установках, в зажигалках.
Диоксид кремния — главный компонент почти всех земных горных пород, в частности, кизельгура. Из кремнезёма и силикатов состоит 87% массы литосферы.
Аморфный непористый диоксид кремния применяется в пищевой промышленности в качестве вспомогательного вещества E551, препятствующего слёживанию и комкованию, парафармацевтике (зубные пасты), в фармацевтической промышленности в качестве вспомогательного вещества (внесён в большинство Фармакопей), а также пищевой добавки или лекарственного препарата в качестве энтеросорбента.
Искусственно полученные плёнки диоксида кремния используются в качестве изолятора при производстве микросхем и других электронных компонентов.
Также используется для производства волоконно-оптических кабелей. Используется чистый плавленый диоксид кремния с добавкой в него некоторых специальных ингредиентов.
Пористые кремнезёмы
Пористые кремнезёмы получают различными методами.
Силохром получают путём агрегирования аэросила, который, в свою очередь, получают сжиганием силана (SiH4). Силохром характеризуется высокой чистотой, низкой механической прочностью. Характерный размер удельной поверхности 60—120 м²/г. Применяется в качестве сорбента в хроматографии, наполнителя резин, катализе.
Силикагель получают путём высушивания геля кремневой кислоты. В сравнении с силохромом обладает меньшей чистотой, однако может обладать чрезвычайно развитой поверхностью: до 320 м²/г.
Кремниевый аэрогель приблизительно на 99,8 % состоит из воздуха может иметь плотность до 1,9 кг/м³ (всего в 1,5 раза больше плотности воздуха).