Что означает запись h3po4
Фосфорная кислота: получение и свойства
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.
При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.
Способы получения
Наибольшее практическое значение из фосфорных кислот имеет ортофосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Химические свойства
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
HPO4 2– ⇄ H + + PO4 3–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Еще пример : при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:
Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
Структура фосфорной кислоты (H3PO4), номенклатура, свойства, применение
фосфорная кислота оксокислота фосфора, которая имеет химическую формулу H3ПО4. Он состоит из минеральной кислоты, в которой три кислых протона связаны с фосфат-анионом (PO4 3- ). Хотя она не считается сильной кислотой, ее неправильное использование может представлять опасность для здоровья.
Три группы ОН ответственны за донорство кислых водородов. Из-за наличия их в своей структуре, он может реагировать с различными гидроксидами, вызывая несколько солей.
В случае гидроксида натрия он может образовывать три: одноосновный фосфат натрия (NaH)2ПО4), двухосновный фосфат натрия (Na2HPO4) и трехосновный фосфат натрия (Na3ПО4).
Однако в зависимости от того, какое основание используется для его нейтрализации или какие катионы очень близки к нему, оно может образовывать другие соли фосфатов. Среди них: фосфат кальция (Са3(РО4)2), фосфат лития (Li3ПО4), фосфат железа (FePO4) и другие. Каждый с его различными степенями протонирования фосфат-аниона.
Реакция этого типа делает это соединение способным создавать большое количество структур с фосфорными и кислородными скелетами, из которых также может быть получен широкий спектр известных солей, таких как полифосфаты..
Химическая структура
Фосфорная кислота состоит из связи P = O и трех P-OH, где последние являются носителями кислотных водородов, выделяющихся в среде растворения. С атомом фосфора в центре, кислороды притягивают своего рода молекулярный тетраэдр.
Таким образом, фосфорная кислота может быть визуализирована как тетраэдр. С этой точки зрения упомянутые тетраэдры (на единицы Н3ПО4взаимодействуют между собой водородными связями; то есть их вершины близко приближены.
Эти межмолекулярные взаимодействия позволяют фосфорной кислоте кристаллизоваться в два твердых вещества: безводный и полугидрат (H3ПО4· 1 / 2Н2О) как с моноклинными кристаллическими системами. Его безводная форма также может быть описана формулой: 3Н2O · P2О5, что равно тригидратированному пятиокиси фосфора.
Тетраэдры могут даже ковалентно связываться, но для этого одно из их звеньев должно удалить молекулу воды путем дегидратации. Это происходит, когда H3ПО4 он подвергается нагреванию и, как следствие, вызывает образование полифосфорных кислот (ПА).
Дифосфорная кислота (H4P2О7)
Простейшим из всех ПА является дифосфорная кислота (Н4P2О7), также известный как пирофосфорная кислота. Химическое уравнение его образования заключается в следующем:
Баланс зависит от количества воды и температуры. Какова его структура? На изображении сечения структуры ортофосфорной кислоты и пирофосфорной кислоты показаны в верхнем левом углу..
Полифосфорные кислоты
Примерами этих кислот являются триполифосфорная и тетраполифосфорная кислоты (обе показаны на рисунке). Можно видеть, как скелет P-O-P растягивается в виде цепочки, образованной тетраэдрами.
Когда эти соединения полностью нейтрализуются основанием, возникают так называемые полифосфаты. В зависимости от того, какие катионы окружают их, они образуют широкий спектр полифосфатных солей.
С другой стороны, если они реагируют со спиртами ROH, водороды их скелета замещаются алкильными заместителями R-. Таким образом, возникают фосфатные (или полифосфатные) эфиры: RO (PO)2OR)хA. Достаточно заменить H на R во всех структурах изображения сечения, чтобы получить их.
Циклические полифосфорные кислоты
Цепи P-O-P могут быть даже замкнуты в кольцевом или фосфорном цикле. Простейшим соединением этого типа является триметафосфорная кислота (верхний правый угол изображения). Таким образом, PA могут быть линейными, циклическими; или если их структуры проявляют оба типа, разветвленные.
номенклатура
Номенклатура фосфорной кислоты определяется IUPAC и как называются тройные соли оксокислот.
Орто
Однако фосфорную кислоту также обычно называют ортофосфорной кислотой. Почему? Потому что слово «орто» по-гречески означает «правда»; что привело бы к его «истинной» или «более гидратированной» форме.
Когда фосфорный ангидрид гидратируется избытком воды (P4О10, люминофорная «шапка» на изображении выше) H производится3ПО4 (3H2O · P2О5). Таким образом, орто-префикс присваивается тем кислотам, которые образуются в избытке воды..
Пиро
Префикс «пиро» относится ко всем соединениям, образовавшимся после применения тепла, поскольку дифосфорная кислота возникает в результате термического обезвоживания фосфорной кислоты. Поэтому она называется пирофосфорной кислотой (2Н)2O · P2О5).
цель
Мета-префикс, который также является греческим словом, означает «после». Он добавляется к тем веществам, чья формула уничтожила молекулу, в данном случае воду:
Обратите внимание, что на этот раз не происходит добавления двух фосфорных звеньев с образованием дифосфорной кислоты, но вместо этого получается метафосфорная кислота (о которой нет никаких доказательств ее существования)..
Также важно отметить, что эта кислота может быть описана как H2O · P2О5 (аналог Хемидрато, умножение HPO3 за 2). Префикс мета идет идеально в соответствии с циклическим РА, потому что, если трифосфорная кислота дегидратируется, но не добавляет другую единицу Н3ПО4 чтобы стать тетрафосфорной кислотой, тогда она должна образовать кольцо.
И это в случае с другими полиметафосфорными кислотами, хотя IUPAC рекомендует называть их циклическими соединениями соответствующего PA..
свойства
Молекулярная формула
Молекулярный вес
Внешний вид
В твердой форме он представляет собой ромбические, гигроскопичные и прозрачные кристаллы. Под жидкой формой это кристаллическое появление вязкого сиропа.
Коммерчески это достигается в водном растворе с концентрацией 85% мас. / Мас. Во всех этих презентациях отсутствует запах.
Точки кипения и плавления
158º C (316ºF до 760 мм рт. Ст.).
Растворимость в воде
548 г / 100 г Н2Или при 20º С; 369,4 г / 100 мл при 0,5 ° С; 446 г / 100 м до 14,95º С.
плотность
1,892 г / см 3 (Твердая); 1,841 г / см 3 (100% раствор); 1,685 г / см 3 (85% раствор); 1,334 г / см 3 50% раствор) при 25ºC.
Плотность пара
Относительно воздуха 3,4 (воздух = 1).
Автоматическое зажигание
вязкость
3,86 мПуаз (40% раствор при 20ºС).
кислотность
рН: 1,5 (0,1 н раствор в воде)
рКа: рКа1 = 2,148; рКа2 = 7,198 и рКа3 = 12,319. Следовательно, его водород плюс кислота является первым.
разложение
При нагревании выделяет оксиды фосфора. Если температура поднимается до 213 ° C или выше, она превращается в пирофосфорную кислоту (H4P2О7).
коррозионная активность
Коррозийный для черных металлов и алюминия. При реакции с этими металлами образуется водородный топливный газ.
полимеризация
Бурно полимеризуется с азосоединениями, эпоксидами и полимеризуемыми соединениями.
приложений
Фосфатные соли и общее использование
-Фосфорная кислота служит основой для выработки фосфатов, которые используются в качестве удобрений, потому что фосфор является основным питательным веществом растений.
-Он использовался для лечения отравления свинцом и других состояний, при которых требуются значительные количества фосфатов, и для производства легкого ацидоза.
-Используется для контроля pH мочевых путей норки и расходов во избежание образования камней в почках.
-Фосфорная кислота образует соли Na2HPO4 и NaH2ПО4 которые составляют буферную систему для рН с рКа 6,8. Эта регуляторная система рН присутствует у человека, что имеет значение для регуляции внутриклеточного рН, а также для управления концентрацией водорода в дистальных канальцах и коллекторе нефронов..
-Он используется для удаления заплесневелого слоя оксида железа, который накапливается на этом металле. Фосфорная кислота образует фосфат железа, который легко удаляется с поверхности металла. Он также используется при электрической полировке алюминия и является связующим веществом для огнеупорных изделий, таких как глинозем и магнезия..
промышленные
-Фосфорная кислота предназначена в качестве каталитического агента при производстве нейлона и бензина. Он используется в качестве дегидратирующего агента в литографической гравировке, в производстве красителей для использования в текстильной промышленности, в процессе коагуляции латекса в резиновой промышленности и в очистке перекиси водорода..
-Кислота используется в качестве добавки в безалкогольных напитках, тем самым способствуя ее вкусу. Разбавленный применяется в процессе рафинирования сахара. Он также действует как буферная система при приготовлении ветчины, желатина и антибиотиков..
-Участвует в разработке моющих средств, в кислотном катализе производства ацетилена.
-Он используется в качестве подкислителя в сбалансированном корме для животноводства и домашних животных. Фармацевтическая промышленность использует его в производстве противорвотных лекарств. Это также используется в смеси, чтобы сделать асфальт, чтобы проложить землю и восстановить трещины.
-Фосфорная кислота действует как катализатор в реакции гидратации алкенов с образованием спирта, главным образом этанола. Кроме того, он используется при определении органического углерода в почвах..
стоматологический
Он используется стоматологами для очистки и кондиционирования поверхности зуба перед установкой зубных опор. Он также находит применение при отбеливании зубов и при удалении зубных бляшек. Кроме того, он используется при изготовлении адгезивов для зубных протезов..
косметика
Фосфорная кислота используется для корректировки рН при приготовлении косметических средств и для ухода за кожей. Используется в качестве химического окислителя для производства активированного угля..
Образование фосфорной кислоты
-Фосфорную кислоту получают из фосфатных пород апатитового типа путем расщепления концентрированной серной кислотой:
Фосфорная кислота, полученная в этой реакции, имеет низкую чистоту, поэтому она подвергается процессу очистки, который включает методы осаждения, экстракции растворителем, кристаллизации и ионного обмена..
-Фосфорная кислота может быть получена путем растворения пятиокиси фосфора в кипящей воде.
-Его также можно получить, нагревая фосфор смесью воздуха и водяного пара:
риски
-Поскольку давление его паров при комнатной температуре низкое, маловероятно, что его пары могут вдыхаться, если только не распыляется кислота. Если это так, симптомы ингаляции включают в себя: кашель, боль в горле, одышка и затрудненное дыхание.
-В литературе приводится пример моряка, который долгое время подвергался воздействию паров фосфорной кислоты. Он страдал от общей слабости, сухого кашля, болей в груди и проблем с дыханием. После одного года воздействия наблюдалась реактивная дисфункция дыхательных путей..
-Контакт кожи с фосфорной кислотой может вызвать покраснение, боль, волдыри и ожоги кожи.
-Контакт кислоты с глазами, в зависимости от ее концентрации и продолжительности контакта, может привести к коррозийным поражениям тканей или серьезным ожогам с постоянным повреждением глаз..
-Прием пищи вызывает ожоги во рту и горле, ощущение жжения за грудиной, боли в животе, рвоту, шок и коллапс.
Ортофосфорная кислота
| Ортофосфорная кислота | |
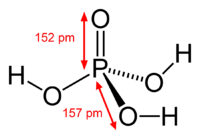 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Ортофосфорная кислота |
| Химическая формула | H3PO4 |
| Физические свойства | |
| Состояние (ст. усл.) | твердое |
| Отн. молек. масса | 98,0 а. е. м. |
| Молярная масса | 98,0 г/моль г/моль |
| Плотность | 1,685 (жидк) г/см³ |
| Динамическая вязкость (ст. усл.) | 2,4-9,4 сПуаз Па·с (при 20 °C) |
| Термические свойства | |
| Температура плавления | 42,35 °C |
| Температура кипения | 158 °C |
| Химические свойства | |
| pKa | 2,12, 7,21, 12,67 |
| Растворимость в воде | 548 г/100 мл |
| Классификация | |
| Рег. номер CAS | [7664-38-2] |
При температуре выше 213 °C она превращается в пирофосфорную кислоту H4P2O7. Очень хорошо растворима в воде. Обычно ортофосфорной (или просто фосфорной) кислотой называют 85 % водный раствор (бесцветная сиропообразная жидкость без запаха). Растворима также в этаноле и других растворителях.
Содержание
Получение
Фосфорную кислоту получают из фосфата:
Или взаимодействием с водой оксида фосфора(V), полученного сжиганием фосфора в кислороде:
С водой реакция идет очень бурно, поэтому оксид фосфора(V) обрабатывают нагретым до 200 °C концентрированным раствором ортофосфорной кислоты.
Расплавленная ортофосфорная кислота и ее концентрированные растворы обладают большой вязкостью, что обусловлено образованием межмолекулярных водородных связей.
Свойства
H3PO4 — трехосновная кислота средней силы. При взаимодействии с очень сильной кислотой, например, с хлорной HClO4, фосфорная кислота проявляет признаки амфотерности — образуются соли фосфорила, например [Р(ОН)4]·(ClO4).
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок:
Качественной реакцией на ион РО4 3− является образование ярко-жёлтого осадка молибденофосфата аммония:
Фосфаты
Соли фосфорной кислоты называются фосфатами. Фосфорная кислота образует одно-, двух- и трехзамещенные соли.



Дигидрофосфаты (однозамещенные фосфаты) имеют кислую реакцию, гидрофосфаты (двузамещенные фосфаты) — слабощелочную, средние (трехзамещенные фосфаты, или просто фосфаты) — щелочную.
Дигидрофосфаты обычно хорошо растворимы в воде, почти все гидрофосфаты и фосфаты растворимы мало. Прокаливание солей приводит к следующим превращениям:

Фосфаты при прокаливании не разлагаются, исключение составляет фосфат аммония (NH4)3PO4.
Органические фосфаты играют очень важную роль в биологических процессах. Фосфаты сахаров участвуют в фотосинтезе. Нуклеиновые кислоты также содержат остаток фосфорной кислоты.
Применение
Используется при пайке в качестве флюса (по окисленой меди, по чёрному металлу, по нержавеющей стали), для исследований в области молекулярной биологии. Применяется также для очищения от ржавчины металлических поверхностей. Образует на обработанной поверхности защитную плёнку, предотвращая дальнейшую коррозию. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество.
Пищевая промышленность
Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках.
Применение ортофосфорной кислоты в сельском хозяйстве. В звероводстве (в частности, при выращивании норок) используют выпойку раствора ортофосфорной кислоты для профилактики повышенного рН желудка и мочекаменной болезни.
Применение ортофосфорной кислоты в стоматологии. Ортофосфорная кислота применяется для снятия зубной эмали перед пломбированием зубов. При применении адгезивных материалов 2 и 3 поколения требуется тотальное протравливание зуба кислотой, с последующим промыванием и просушиванием. Кроме дополнительных временных затрат на проведение данные этапы несут в себе опасность возникновения различных ошибок и осложнений.
При нанесении ортофосфорной кислоты сложно проконтролировать степень и глубину деминерализации дентина и эмали. Это приводит к тому, что нанесенный адгезив не полностью (по всей глубине) заполняет открытые дентинные канальцы, а это в свою очередь не обеспечивает образование полноценного гибридного слоя.
Кроме того, не всегда удается полностью удалить ортофосфорную кислоту после ее нанесения на дентин. Это зависит от того, каким способом сгущена фосфорная кислота. Остатки ортофосфорной кислоты ухудшают прочность бондинга, а также приводят к образованию так называемой «кислотной мины».
Поэтому с появлением адгезивных материалов 5 и 6 поколения ортофосфорная кислота использоваться перестала.
См. также
Примечания
Литература
Ссылки
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Ортофосфорная кислота» в других словарях:
ОРТОФОСФОРНАЯ КИСЛОТА — ОРТОФОСФОРНАЯ КИСЛОТА, то же, что фосфорная кислота … Современная энциклопедия
ортофосфорная кислота — ortofosfato rūgštis statusas T sritis chemija formulė H₃PO₄ atitikmenys: angl. orthophosphoric acid; phosphoric acid rus. ортофосфорная кислота; фосфорная кислота ryšiai: sinonimas – vandenilio tetraoksofosfatas (3–) sinonimas – fosforo rūgštis … Chemijos terminų aiškinamasis žodynas
ортофосфорная кислота — Е338 – ортофосфорная кислота. В зависимости от концентрации применяют для производства фосфорных удобрений, в пищевой, текстильной, стекольной промышленности. Пропитка древесины ортофосфорной кислотой и ее солями делают дерево негорючим. На этой… … Универсальный дополнительный практический толковый словарь И. Мостицкого
ортофосфорная кислота — то же, что фосфорная кислота … Энциклопедический словарь
ОРТОФОСФОРНАЯ КИСЛОТА — то же, что фосфорная кислота … Естествознание. Энциклопедический словарь
ортофосфорная кислота — фосфорная кислота … Cловарь химических синонимов I
Ортофосфорная кислота — см. Фосфор … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Кислота — У этого термина существуют и другие значения, см. Кислота (значения) … Википедия
фосфорная кислота — ортофосфорная кислота … Cловарь химических синонимов I












