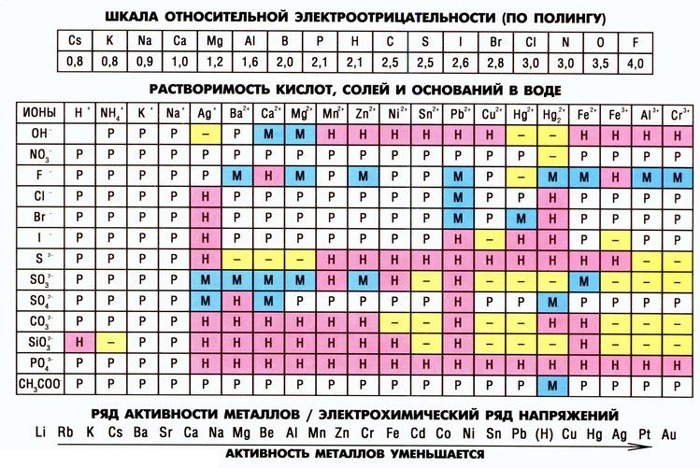
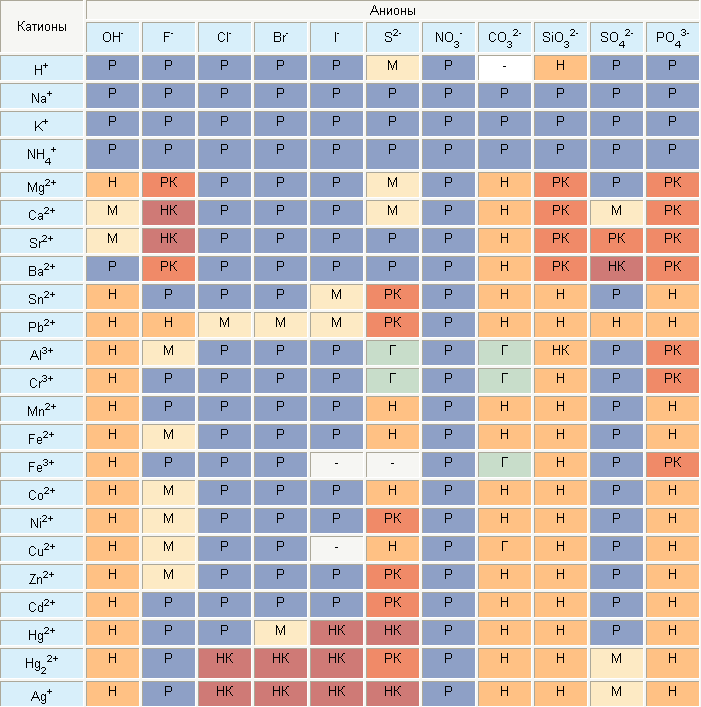
Что означает знак вопроса в таблице растворимости
Как пользоваться таблицей растворимости в химии
Функции таблицы растворимости
Таблица Менделеева — не единственный помощник в работе химика. Не менее важным инструментом для решения химических уравнений является таблица растворимости веществ. Прежде всего она помогает определить, растворяется ли вещество в воде. Если оно не растворяется, можно узнать каким будет осадок и решить ионное уравнение.
Растворимость веществ
Если вещество может образовать с другим однородное соединение, значит оно растворимо. Степень растворимости у всех веществ разная. В зависимости от этого все вещества делят на группы:
Каждое вещество имеет коэффициент растворимости, показывающий величину массы, которую оно может растворить. На растворение зачастую влияет температура и давление, при которых происходит реакция.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Полная таблица растворимости
В школьном курсе химии используется упрощенная таблица растворимости. Для более высокого уровня изучения или работы необходима полная, где приводятся данные о большем количестве реакций и включено больше химических элементов и соединений.
Школьная таблица растворимости
Полная таблица растворимости
Условные обозначения
В таблице указаны названия химических элементов и соединений, а также условные обозначения, говорящие о степени растворимости. Часть обозначений действительна и для школьной. В полной таблице учтена способность веществ растворяться в кислотах.
Как применять таблицу
Растворимость
Растворимость (Р, χ или ks) – это характеристика насыщенного раствора, которая показывает, какая масса растворенного вещества может максимально раствориться в 100 г растворителя. Размерность растворимости — г/ 100 г воды. Поскольку мы определяем массу соли, которая приходится на 100 г воды, в формулу растворимости добавляем множитель 100:
здесь mр.в. – масса растворенного вещества, г
mр-ля – масса растворителя, г
Иногда используют обозначение коэффициент растворимости kS.
Задачи на растворимость, как правило, вызывают сложности, так как эта физическая величина для школьников не очень привычна.
Растворимость веществ в различных растворителях меняется в широких пределах.
В таблице приведена растворимость некоторых веществ в воде при 20 o С:
Растворимость, г на 100 г H2O
Растворимость, г на 100 г H2O
От чего же зависит растворимость веществ? От ряда факторов: от природы растворенного вещества и растворителя, от температуры и давления. В справочных таблицах предлагается вещества делят на хорошо растворимые, малорастворимые и нерастворимые. Такое деление очень условное, поскольку абсолютно нерастворимых веществ нет. Даже серебро и золото растворимы в воде, однако их растворимость настолько мала, что можно пренебречь ей.
Зависимость растворимости от природы растворенного вещества и растворителя*
Большинство солей щелочных металлов и аммония хорошо растворимы в воде. Хорошо растворимы почти все нитраты, нитриты и многие галогениды (кроме галогенидов серебра, ртути, свинца и таллия) и сульфаты (кроме сульфатов щелочноземельных металлов, серебра и свинца). Для переходных металлов характерна небольшая растворимость их сульфидов, фосфатов, карбонатов и некоторых других солей.
Растворимость газов в жидкостях также зависит от их природы. Например, в 100 объемах воды при 20 o С растворяется 2 объема водорода, 3 объема кислорода. В тех же условиях в 1 объеме Н2О растворяется 700 объемов аммиака.
Влияние температуры на растворимость газов, твердых веществ и жидкостей*
Растворение газов в воде вследствие гидратации молекул растворяемого газа сопровождается выделением теплоты. Поэтому при повышении температуры растворимость газов понижается.
Влияние давления на растворимость газов, твердых веществ и жидкостей*
На растворимость твердых и жидких веществ в жидкостях давление практически не оказывает влияния, так как изменение объема при растворении невелико. При растворении газообразных веществ в жидкости происходит уменьшение объема системы, поэтому повышение давления приводит к увеличению растворимости газов. В общем виде зависимость растворимости газов от давления подчиняется закону У. Генри (Англия, 1803 г.): растворимость газа при постоянной температуре прямо пропорциональна его давлению над жидкостью.
Закон Генри справедлив лишь при небольших давлениях для газов, растворимость которых сравнительно невелика и при условии отсутствия химического взаимодействия между молекулами растворяемого газа и растворителем.
Влияние посторонних веществ на растворимость*
В присутствии в воде других веществ (солей, кислот и щелочей) растворимость газов уменьшается. Растворимость газообразного хлора в насыщенном водном растворе поваренной соли в 10 раз меньше. Чем в чистой воде.
Эффект понижения растворимости в присутствии солей называется высаливанием. Понижение растворимости обусловлено гидратацией солей, что вызывает уменьшение числа свободных молекул воды. Молекулы воды, связанные с ионами электролита, уже не являются растворителем для других веществ.
Примеры задач на растворимость
Задача 1. Массовая доля вещества в насыщенном растворе равна 24% при некоторой температуре. Определите коэффициент растворимости этого вещества при данной температуре.
Решение:
Для определения растворимости вещества примем массу раствора равной 100 г. Тогда масса соли равна:
mводы = mр-ра – mр.в. = 100 — 24 = 76 г
χ = mр.в./mр-ля⋅100 = 24/76⋅100 = 31,6 г вещества на 100 г воды.
Еще несколько аналогичных задач:
2. Массовая доля соли в насыщенном растворе при некоторой температуре равна 28,5%. Определите коэффициент растворимости вещества при этой температуре.
3. Определите коэффициент растворимости нитрата калия при некоторой температуре, если массовая доля соли при этой температуре равна 0,48.
4. Какая масса воды и соли потребуется для приготовления 500г насыщенного при некоторой температуре раствора нитрата калия, если его коэффициент растворимости при этой температуре равен 63,9г соли в 100г воды?
Ответ: 194,95 г
5. Коэффициент растворимости хлорида натрия при некоторой температуре составляет 36г соли в 100г воды. Определите молярную концентрацию насыщенного раствора этой соли, если плотность раствора 1,2 г/мл.
6. Какая масса соли и 5% раствора её потребуется для приготовления 450г насыщенного при некоторой температуре раствора сульфата калия, если его коэффициент растворимости при этой температуре равен 439г/1000г воды?
7. Какая масса нитрата бария выделится из раствора, насыщенного при 100ºС и охлаждённого до 0ºС, если во взятом растворе было 150мл воды? Коэффициент растворимости нитрата бария при температурах 0ºС и 100ºС равен соответственно 50г и 342г в 100г воды.
8. Коэффициент растворимости хлорида калия при 90ºС равен 500г/л воды. Сколько граммов этого вещества можно растворить в 500г воды при 90ºС и какова его массовая доля в насыщенном растворе при этой температуре?
9. В 500г воды растворено при нагревании 300г хлорида аммония. Какая масса хлорида аммония выделится из раствора при его охлаждении до 50ºС, если коэффициент растворимости соли при этой температуре равен 50г/л воды?
Произведение растворимости
Материалы портала onx.distant.ru
Теоретическое введение
Примеры решения задач
Задачи для самостоятельного решения
Теоретическое введение
В насыщенных водных растворах малорастворимых соединений устанавливается равновесие:
PbCl2(кристалл.) ↔Pb 2+ (насыщ.р-р) + 2 Cl – (насыщ.р-р)
ПР = [Pb 2+ ] [Cl – ] 2
Понятие ПР используется только при описании гетерогенных равновесий в насыщенных растворах малорастворимых сильных электролитов и их твердых фаз. Растворимость вещества равна его концентрации в насыщенном растворе. Насыщенный раствор находится в равновесии с кристаллической фазой.
ПР связано с изменением энергии Гиббса процесса уравнением:
ΔG о T = – RT lnПР (1)
которое используется для расчетов ПР по термодинамическим данным.
Из определенной опытным путем растворимости соединения можно рассчитать ПР и, наоборот, зная ПР соединения, можно рассчитать его растворимость в воде.
Рассмотрим растворение малорастворимого электролита КnАm. В насыщенном растворе этого электролита имеет место равновесие:
КnАm (к) + aq ↔ n К m+ (насыщ.р-р) + m A n- (насыщ.р-р)
Произведение растворимости КnАm запишется в виде:
ПР = [К m+ ] n [A n- ] m (2)
Если обозначить растворимость электролита буквой Р, то концентрации катионов и анионов в насыщенном растворе составят:
[К m+ ] = nP; [A n- ] = mP
В результате для величины ПР получаем
ПР = [nP] n [mP] m = n n m m P n+m (3)
Растворимость симметричных электролитов (содержащих равнозарядные ионы, например, AgCl, BaSO4, AlPO4) рассчитывается как корень квадратный из ПР.
Добавление в раствор малорастворимого электролита, например, AgCl, веществ, содержащих одноименные ионы, в частности, BaCl2 или AgNO3, приводит к уменьшению растворимости этого электролита.
Примеры решения задач
Решение. М(BaCO3) = 197 г/моль. Растворимость Р карбоната бария равна:
В насыщенном растворе карбоната бария:
концентрации ионов бария и карбонат-ионов равны. Следовательно,
[Ba 2+ ] = [СO3 2- ] = 7× 10 –5 моль/л
Таким образом, растворимость Р карбоната бария равна 7·10 –5 моль/л. Величина ПР составит:
PbCl2(к) + aq ↔ Pb 2+ (насыщ.р-р) + 2 Cl — (насыщ.р-р)
Пусть Р (моль/л) — растворимость PbCl2. Тогда концентрации ионов соли в растворе составят:
[Pb 2+ ] = Р; [Cl – ] = 2[Pb 2+ ] = 2P.
Р(PbCl2) = 278× 1,6× 10 –5 = 4,4× 10 –3 г/л, где 278 — М(PbCl2) (г/моль)
Задача 3. Вычислите растворимость (моль/л) PbCl2 в 0,1 М растворе KCl, если ПР (PbCl2) = 1,6× 10 –5 при 298 К.
Решение. Суммарная концентрация хлорид-ионов составляет
[Cl – ] = (2Р + 0,1) моль/л
Хлорид-ионы образуются при диссоциации PbCl2. В его насыщенном растворе:
PbCl2(к) + aq ↔ Pb 2+ (насыщ.р-р) + 2 Cl — (насыщ.р-р)
а также за счет диссоциации неассоциированного электролита KCl в его 0,1М растворе:
KCl → K + + Cl —
В воде растворимость PbCl2 равна 1,6× 10 –2 моль/л (см. предыдущую задачу), в растворе KCl растворимость PbCl2 уменьшилась и составила 1,6× 10 –3 моль/л.
Решение. Осадок выпадет, если [Сu 2+ ][S 2– ] > ПР(СuS), т.е. если произведение концентраций ионов Сu 2+ и S 2– в растворе будет больше ПР, то раствор окажется пересыщенным и из него будет выпадать осадок.
Молярные концентрации растворов равны:
См (СuCl2) = 1/2× 0,01 = 0,005M
См (Na2S) = 1/2× 0,1 = 0,05M
До смешения растворов: [Сu 2+ ] = 0,005 M, [S 2– ] = 0,05М.
После смешения растворов концентрации ионов изменятся и станут равными:
[Сu 2+ ] = 0,005× 0,1:0,4 = 0,00125M
[S 2– ] = 0,05× 0,3:0,4 = 0,0375М
Следовательно, произведение концентраций ионов равно:
[Сu 2+ ][S 2– ] = 0,00125× 0,0375 = 4,7× 10 –5 (моль/л) 2
Решение.
Примем растворимость BaSO4 за Р моль/л.
Растворимость BaSO4 равна концентрации ионов Ba 2+ и SO4 2– в растворе: [Ba 2+ ] = [SO4 2– ].
где 233 — М(BaSO4) (г/моль).
Следовательно, 1 г BaSO4 растворяются в 1/2,33× 10 –3 = 429,2 л воды.
Задачи для самостоятельного решения
3. При некоторой температуре в 10 л воды растворяется 1,112 г хлорида свинца. Рассчитайте ПР этой соли.
4. При некоторой температуре рН насыщенного раствора гидроксида кальция составляет 13. Рассчитайте величину ПР этого основания.
1,4× 10 –2 моль/л; 4,4 г/л.
7. Вычислить растворимость (моль/л) Ni(OH)2 в 0,15 М растворе Ni(NO3)2, если ПР(Ni(OH)2) = 1,2× 10 –16 при 298 К.
10. При 298 К растворимость PbS в 0,015 М водном растворе K2S равна 4,1× 10 –26 моль/л. Определить G o 298 процесса растворения PbS.
Как составить химические уравнения по таблице растворимости использовать теорию
Порядок составления ионно-молекулярного уравнения
Для примера рассмотрим реакцию ионного обмена между растворами двух солей: нитрата серебра и хлорида натрия.
1. Составить молекулярное уравнение реакции, подобрав коэффициенты.
AgNO3 + NaCl = AgCl + NaNO3
2. Найти среди продуктов реакции вещество, образование которого вызывает протекание реакции. Это может быть осадок (тогда ставим стрелку ↓), газ (тогда ставим стрелку ↑) или слабый электролит.
AgNO3 + NaCl = AgCl↓ + NaNO3
3. Указать в молекулярном уравнении под формулой каждого вещества силу кислот и оснований, растворимость средних солей.
AgNO3 + NaCl = AgCl↓ + NaNO3
растворимая растворимая осадок растворимая
соль соль соль
4. Составить полное ионно-молекулярное уравнение, зная, что в виде ионов записывают только:
— сильные кислоты (HNO3, H2SO4, HCl, HBr, HI);
— сильные основания (гидроксиды щелочных металлов LiOH, KOH, NaOH и гидроксиды щелочно-земельных металлов Ca(OH)2, Sr(OH)2, Ba(OH)2);
— растворимые средние соли (см. таблицу растворимости).
Ag+ + NO3– + Na+ + Cl – = AgCl↓ + Na+ + NO3–
5. Исключить из обеих частей ионно-молекулярного уравнения формулы одинаковых ионов, т. е. ионов, не участвующих в реакции (подчеркнуть их).
В нашем примере одинаковыми ионами в левой и правой частях уравнения являются Na+ и NO3–. Подчеркиваем их:
Ag+ + NO3– + Na+ + Cl – = AgCl↓ + Na+ + NO3–
6. Выписать формулы оставшихся ионов и в результате получить сокращенное ионно-молекулярное уравнение, которое выражает сущность данной реакции.
В нашем примере убираем подчеркнутые формулы NO3– и Na+ и получаем сокращенное ионно-молекулярное уравнение: