Что показывает число авогадро в химии
Число Авогадро
Современная классическая физика полна архаизмов, одним из которых является «число Авогадро». Вот как оно определяется в современных справочниках по физике:
В 1814 году итальянский учёный Амадео Авогадро (1776 – 1856) опубликовал статью «Очерк об относительных массах молекул простых тел, или предполагаемых плотностях их газа, и о конституции некоторых из их соединений», в которой он сформулировал новый закон:
«…равные объёмы газообразных веществ при одинаковых давлениях и температурах отвечают равному числу молекул, так что плотности различных газов представляют собою меру масс молекул соответствующих газов».
Сам Авогадро ни в этой статье, ни позже, не предпринимал попыток посчитать это самое количество молекул, поэтому в этом смысле он никакого отношения к числу (постоянной) названной его именем не имеет. Вычислять это число стали позже и совсем другие учёные. Поскольку в то время атомная физика только только осваивала открывшиеся горизонты, ни кто и понятие не имел о структуре атома. Но подсчитать открытые Авогадро молекулы очень хотелось.
Первым эту попытку предпринял в 1866 г. Йозеф Лошмидт (1821-1895) и насчитал 1,81*10^(24) молекул в одном куб. метре газа.
Приблизительно в это же время голландский физик Ван дер Ваальс (1837 – 1923) предположил, что молекул в одном моле идеального газа (0,022414 куб. м) должно быть более 4,5*10^(23), что собственно уже представляло собой число Авогадро, но значение, которое ещё было далеко от реального.
В наше время, с иными финансовыми возможностями, «число Авогадро» определили следующим образом.
В 2010 году для этого использовались две сферы, сделанные из кремния-28. Сферы были получены в Институте кристаллографии имени Лейбница и отполированы в австралийском Центре высокоточной оптики настолько гладко, что высоты выступов на их поверхности не превышали 98 нм.
Для их производства был использован высокочистый кремний-28, выделенный в нижегородском Институте химии высокочистых веществ РАН из высокообогащённого по кремнию-28 тетрафторида кремния, полученного в Центральном конструкторском бюро машиностроения в Санкт-Петербурге.
Располагая такими практически идеальными объектами, можно с высокой точностью подсчитать число атомов кремния в шаре и тем самым определить число Авогадро.
Согласно полученным результатам, оно равно 6,02214084(18)*10^(23) моль^(-1). Однако в январе 2011 года были опубликованы результаты новых измерений, считающиеся более точными: N(A) = 6,02214078(18)*10^(23) моль^(-1).
Итак, казалось бы, эпопея с определением «числа Авогадро» подошла к своему финалу. Но не всё так просто.
Для того чтобы понять что же все таки сосчитало это самое «число Авогадро» необходимо разобраться с понятием «моль».
Сегодня под «молем» понимают количество вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг. При применении моля структурные элементы должны быть специфицированы и могут быть атомами, молекулами, ионами, электронами и другими частицами или специфицированными группами частиц.
Итак, под «молем» понимается 12 граммов углерода-12. Зная, сколько весит один атом углерода, не сложно определить, сколько таких атомов содержит один «моль».
В соответствии с таблицей Менделеева углерод-12 содержит в своём составе 6 протонов, 6 нейтронов и 6 электронов.
m(p) – 1,6726*10^(-27) кг;
m(n) – 1,6749*10^(-27) кг;
m(э) – 9,109*10*^(-31) кг.
Масса атома углерода-12 в этом случае равна
М(С) = 6m(p) + 6m(n) + 6m(э) = 20,0905^10(-27) кг
N = 0,012 / М(С) = 5,97297*10^(23) моль^(-1)
А теперь посмотрим, сколько максимум может содержать структурных элементов один килограмм идеального вещества состоящего только из одних протонов:
N(max) = 1 / m(p) = 5,978716*10^(26) кг^(-1) = 5,978716*10^(23) г^(-1)
Таким образом, во-первых, современный «моль» в определении «числа Авогадро» соответствует одному грамму, поэтому не совсем понятно кому нужен был этот мыльный пузырь. А, во-вторых, его «абсолютно точное» значение ни имеет никакого отношения к реальности – это чистой воды алхимия.
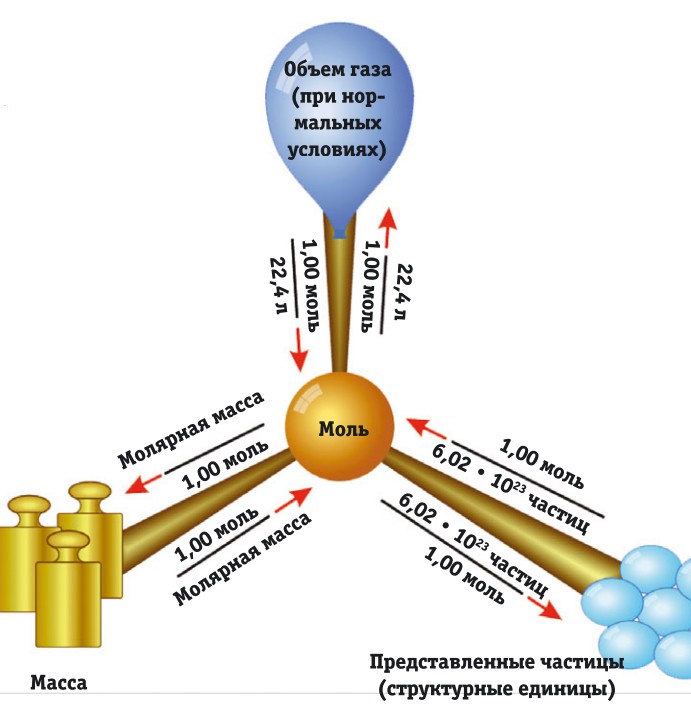
Молекулярная физика. Моль. Постоянная Авогадро. Количество вещества.
Моль — количество вещества, масса которого, выраженная в граммах, численно равна относительной атомной (молекулярной) массе.
Моль — единица количества вещества в СИ (одна из основных единиц СИ).
В 1 моле содержится столько молекул (атомов или других частиц вещества), сколько атомов содержится в 0,012 кг нуклида углерода 12 С с атомной массой 12.
Из этого определения следует, что в одном моле любого вещества содержится одно и то же число атомов или молекул.
Число это называется постоянной Авогадро и обозначается NA:
Постоянная Авогадро (число Авогадро) — это число атомов (молекул, или других структурных элементов вещества), содержащихся в 1 моле.
Постоянная Авогадро — одна из фундаментальных физических констант. Она входит в некоторые другие постоянные, например, в постоянную Больцмана.
Количество вещества.
Количество вещества — это число частиц вещества (атомов, молекул), выраженное в молях. Учитывая определение моля и числа Авогадро, можно сказать, что количество вещества v равно отношению числа молекул N в данном теле к постоянной Авогадро NA, т.е. к числу молекул в 1 моле вещества:

Постоянная Авогадро
Число́ Авога́дро, константа Авогадро — физическая константа, численно равная количеству специфицированных структурных единиц (атомов, молекул, ионов, электронов или любых других частиц) в 1 моле вещества. Определяется как количество атомов в 12 граммах (точно) чистого изотопа углерода-12. Обозначается обычно как NA, реже как L [1].
Значение числа Авогадро, рекомендованное 2006 году [2]:
Моль — количество вещества, которое содержит NA структурных элементов (т.е. столько же, сколько атомов содержится в 12 г 12 С), причем структурными элементами обычно являются атомы, молекулы, ионы и др. Масса 1 моля вещества, выраженная в граммах, численно равна его молекулярной массе. Так, 1 моль натрия имеет массу 22,9898 г и содержит примерно 6,02·10 23 атомов; 1 моль фторида кальция CaF2 имеет массу (40,08 + 2×18,998) = 78,076 г и содержит 6,02·10 23 молекул, как и 1 моль тетрахлорида углерода CCl4, масса которого равна (12,011 + 4×35,453) = 153,823 г и т. п.
Закон Авогадро
На заре развития атомной теории (1811) А. Авогадро выдвинул гипотезу, согласно которой при одинаковых температуре и давлении в равных объёмах идеальных газов содержится одинаковое число молекул. Позже было показано, что эта гипотеза есть необходимое следствие кинетической теории, и сейчас она известна как закон Авогадро. Его можно сформулировать так: один моль любого газа при одинаковых температуре и давлении занимает один и тот же объем, при нормальных условиях равный 22,41383 л. Эта величина известна как молярный объем газа.
Сам Авогадро не делал оценок числа молекул в заданном объеме, но понимал, что это очень большая величина. Первую попытку найти число молекул, занимающих данный объем, предпринял в 1865 Й. Лошмидт; было установлено, что в 1 см³ идеального газа при нормальных условиях содержится 2,68675·10 19 молекул. По имени этого ученого указанная величина была названа числом (или постоянной) Лошмидта. С тех пор было разработано большое число независимых методов определения числа Авогадро. Превосходное совпадение полученных значений является убедительным свидетельством реального существования молекул.
Связь между константами
См. также
Полезное
Смотреть что такое «Постоянная Авогадро» в других словарях:
постоянная Авогадро — Avogadro konstanta statusas T sritis Standartizacija ir metrologija apibrėžtis Apibrėžtį žr. priede. priedas( ai) Grafinis formatas atitikmenys: angl. Avogadro constant vok. Avogadro Konstante, f; Avogadrosche Konstante, f rus. константа Авогадро … Penkiakalbis aiškinamasis metrologijos terminų žodynas
постоянная Авогадро — Avogadro konstanta statusas T sritis fizika atitikmenys: angl. Avogadro’s constant; Avogadro’s number vok. Avogadro Konstante, f; Avogadrosche Konstante, f rus. постоянная Авогадро, f; число Авогадро, n pranc. constante d’Avogadro, f; nombre… … Fizikos terminų žodynas
постоянная Авогадро — Avogadro konstanta statusas T sritis Energetika apibrėžtis Apibrėžtį žr. priede. priedas( ai) MS Word formatas atitikmenys: angl. Avogadro’s constant vok. Avogadro Konstante, f; Avogadrosche Konstante, f rus. константа Авогадро, f; постоянная… … Aiškinamasis šiluminės ir branduolinės technikos terminų žodynas
АВОГАДРО ПОСТОЯННАЯ — (Авогадро число) (NA), число молекул или атомов в 1 моле вещества; NA=6,022?1023 моль 1. Названа по имени А. Авогадро … Современная энциклопедия
Авогадро постоянная — (Авогадро число) (NA), число молекул или атомов в 1 моле вещества; NA=6,022´1023 моль 1. Названа по имени А. Авогадро. … Иллюстрированный энциклопедический словарь
Авогадро Амедео — Авогадро (Avogadro) Амедео (9.8.1776, Турин, ‒ 9.7.1856, там же), итальянский физик и химик. Получил юридическое образование, затем изучал физику и математику. Член корреспондент (1804), ординарный академик (1819), а затем директор отделения… … Большая советская энциклопедия
Авогадро — (Avogadro) Амедео (9.8.1776, Турин, 9.7.1856, там же), итальянский физик и химик. Получил юридическое образование, затем изучал физику и математику. Член корреспондент (1804), ординарный академик (1819), а затем директор отделения физико… … Большая советская энциклопедия
АВОГАДРО ПОСТОЯННАЯ — (число Авогадро), число структурных элементов (атомов, молекул, ионов или др. ч ц) в ед. кол ва в ва (в одном моле). Названа в честь А. Авогадро, обозна чается NA. А. п. одна из фундаментальных физических констант, существенная для определения мн … Физическая энциклопедия
ПОСТОЯННАЯ — величина, имеющая неизменное значение в области её использования; (1) П. Авогадро то же, что Авогадро (см.); (2) П. Больцмана универсальная термодинамическая величина, связывающая энергию элементарной частицы с её температурой; обозначается k,… … Большая политехническая энциклопедия
Число Авогадро
Закон Авогадро гласит, что в одинаковых объемах идеальных газов при одинаковом давлении и одинаковой температуре содержится равное число молекул. Другими словами, моль любого газа при одинаковых давлении и температуре занимает один и тот же объем. Моль — количество вещества, которое содержит столько же структурных единиц, сколько содержится в 12 г изотопа углерода 12 С. Структурные единицы — это любые частицы (атомы, молекулы, электроны, ионы и т.д.). Их количество в 1 моле вещества называется числом Авогадро. Оно позволяет определить такие величины, как заряд электрона, масса атома или молекулы и др.
Как же все это понимать? Возьмем химическую реакцию, которая происходит при горении дерева. При соединении углерода древесины с кислородом воздуха образуется двуокись углерода СО2. У одного атома углерода такая же масса, как у 12 атомов водорода, а у двух атомов кислорода — как у 32 атомов водорода. Следовательно, соотношение масс участвующих в реакции углерода и кислорода всегда будет составлять 12 : 32. Соотношение остается неизменным при любых единицах измерения: 12 г углерода всегда реагируют с 32 г кислорода, 12 ц углерода — с 32 ц кислорода и т.д. В химических реакциях главное — относительное количество атомов каждого элемента, который участвует в реакции.
Следовательно, в 12 г углерода столько же атомов, сколько в 16 г кислорода. Именно это количество атомов химики и называют молем. Если принять относительную атомную массу вещества за n (иными словами, его атом в n раз тяжелее атома водорода), то масса одного моля этого вещества будет равна n г. Моль — мера количества вещества, как пара, десяток или сотня. Сапог в паре всегда два, яиц в десятке всегда десять, и в моле вещества всегда одно и то же количество атомов, ионов или молекул.
Но как ученые к этому пришли? Ведь сосчитать атомы очень сложно. Все началось с исследований итальянского химика Амедео Авогадро. Он знал, что, когда между газами протекает химическая реакция, соотношение между объемами газов равно соотношению между количествами их молекул. Так, когда три молекулы водорода Н2 вступают в реакцию с одной молекулой азота N., то образуется две молекулы аммиака NH3, а объем участвующего в реакции водорода оказывается в три раза больше объема азота. Авогадро пришел к выводу, что количество молекул в обоих объемах находится в соотношении 3:1, т. е. в равных объемах газа содержится равное количество атомов или молекул. Это и есть известный сегодня закон Авогадро.
Чему равно число Авогадро?
АВОГАДРО ЧИСЛО
Моль – количество вещества, которое содержит столько же структурных элементов, сколько атомов содержится в 12 г 12 С, причем структурными элементами обычно являются атомы, молекулы, ионы и др. Масса 1 моль вещества, выраженная в граммах, численно равна его мол. массе. Так, 1 моль натрия имеет массу 22,9898 г и содержит 6,02·10 23 атомов; 1 моль фторида кальция CaF2 имеет массу (40,08 + 2·18,998) = 78,076 г и содержит 6,02·10 23 молекул, как и 1 моль тетрахлорида углерода CCl4, масса которого равна (12,011 + 4·35,453) = 153,823 г и т.п.
Закон Авогадро.
На заре развития атомной теории (1811) А.Авогадро выдвинул гипотезу, согласно которой при одинаковых температуре и давлении в равных объемах идеальных газов содержится одинаковое число молекул. Позже было показано, что эта гипотеза есть необходимое следствие кинетической теории, и сейчас она известна как закон Авогадро. Его можно сформулировать так: один моль любого газа при одинаковых температуре и давлении занимает один и тот же объем, при стандартных температуре и давлении (0° С, 1,01Ч10 5 Па) равный 22,41383 л. Эта величина известна как молярный объем газа.
Сам Авогадро не делал оценок числа молекул в заданном объеме, но понимал, что это очень большая величина. Первую попытку найти число молекул, занимающих данный объем, предпринял в 1865 Й.Лошмидт; было установлено, что в 1 см 3 идеального газа при нормальных (стандартных) условиях содержится 2,68675Ч10 19 молекул. По имени этого ученого указанная величина была названа числом (или постоянной) Лошмидта. С тех пор было разработано большое число независимых методов определения числа Авогадро. Превосходное совпадение полученных значений является убедительным свидетельством реального существования молекул.
Метод Лошмидта
представляет только исторический интерес. Он основан на предположении, что сжиженный газ состоит из плотноупакованных сферических молекул. Измеряя объем жидкости, которая образовалась из данного объема газа, и зная приблизительно объем молекул газа (этот объем можно было представить исходя из некоторых свойств газа, например вязкости), Лошмидт получил оценку числа Авогадро
Определение, основанное на измерении заряда электрона.
Единица количества электричества, известная как число Фарадея F, – это заряд, переносимый одним молем электронов, т.е. F = Ne, где е – заряд электрона, N – число электронов в 1 моль электронов (т.е. число Авогадро). Число Фарадея можно определить, измеряя количество электричества, необходимое для растворения или осаждения 1 моль серебра. Тщательные измерения, выполненные Национальным бюро стандартов США, дали значение F = 96490,0 Кл, а заряд электрона, измеренный разными методами (в частности, в опытах Р.Милликена), равен 1,602Ч10 –19 Кл. Отсюда можно найти N. Этот метод определения числа Авогадро, по-видимому, является одним из самых точных.
Эксперименты Перрена.
Расчеты с использованием числа Авогадро.
С помощью числа Авогадро были получены точные значения массы атомов и молекул многих веществ: натрия, 3,819Ч10 –23 г (22,9898 г/6,02Ч10 23 ), тетрахлорида углерода, 25,54Ч10 –23 г и т.д. Можно также показать, что в 1 г натрия должно содержаться примерно 3Ч10 22 атомов этого элемента.
См. также АТОМНАЯ МАССА.