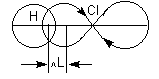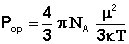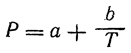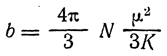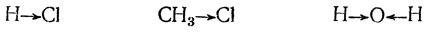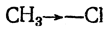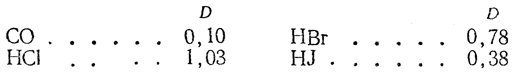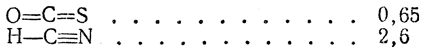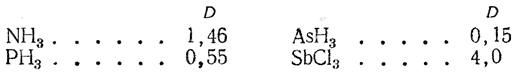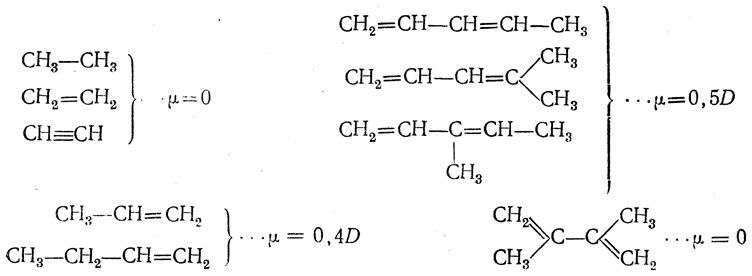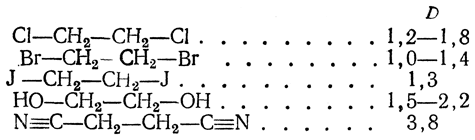Что показывает дипольный момент
Дипольный момент молекулы и связи
Министерство общего и профессионального образования РФ
Московский Государственный Технический Университет
Дипольный момент молекулы и связи
Выполнен студенткой гр. МТ10-42
Галямовой Ириной
Проверил Волков А.А.
Полярность молекулы (и полярность связи) характеризуется дипольным моментом молекулы (или связи).
Дипольные моменты обычно определяют экспериментально, измеряя относительную диэлектрическую проницаемость e веществ при различных температурах. Если вещество поместить в электрическое поле, создаваемое конденсатором, то емкость последнего возрастет в e раз, т.е. e=c/c0 (где c0 и с- емкость конденсатора в вакууме и в среде вещества).
Энергия электрического поля в конденсаторе U выражается соотношением:
где V- напряжение на обкладках конденсатора.
Температурную зависимость относительно диэлектической проницаемости вещества e выражает уравнение Ланжевена-Дебая:
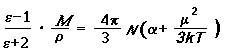
где М- относительная молекулярная масса вещества; r- плотность вещества, NA— постоянная Авогадро; k- постоянная Больцмана, равная R/ NA (R- универсальная газовая постоянная); a- деформационная поляризуемость молекул.
Измерив e при двух температурах, с помощью уравнения Ланжевена-Дебая можно определить a и m. Есть и другие методы экспериментального определения m.
Значения дипольных моментов для некоторых связей между разнородными атомами приведены в таблице:
Не следует путать дипольный момент связи и дипольный момент молекулы, так как в молекуле могут существовать несколько связей, дипольные моменты которых суммируются как векторы. Кроме того, на величину дипольного момента молекулы могут влиять магнитные поля орбиталей, содержащих электронную пару,- «неподеленные» электроны. Большое влияние на полярность молекулы оказывает ее симметрия.
Например, молекула метана CH4 обладает высокой степенью симметрии (центрированный тетраэдр), и поэтому векторная сумма дипольных моментов связей (m=0,4D) равна нулю:
Если заменить водородные атомы на атомы хлора и получить молекулу CCl4, у которой дипольный момент связи m=2,05D, те в пять раз больший, чем для C-H, то результат останется прежним, так как молекула CCl4 обладает таким же строением.
рис.2. схема строения молекулы СО2
Связь С=О обладает дипольным моментом 2,7D, однако линейная молекула СО2
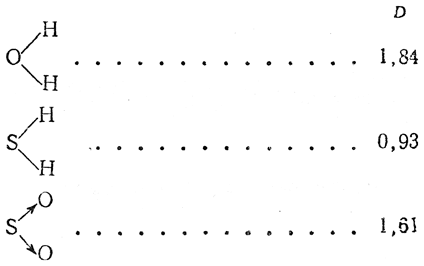
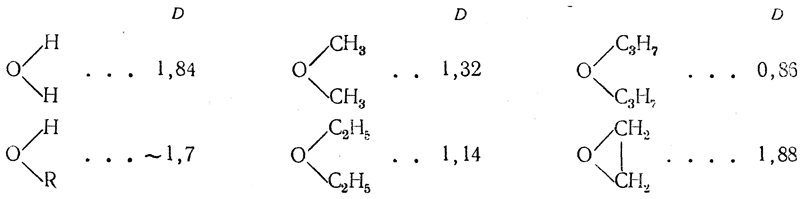
Таким образом, полярность молекул определяется довольно сложно, так как она учитывает все взаимодействия, которые могут возникнуть в такой сложной структуре, как молекула. Кроме того, ”полярность” молекулы не определяется лишь величиной дипольного момента, а зависит также от размеров и конфигурации молекул. Например, молекула воды более резко проявляет свои полярные свойства (образование гидратов, растворимость и т.д.), чем молекула этилового спирта, хотя дипольные моменты у них почти одинаковые (mн2о=1,84D; mс2н5он=1,70D).
Значения дипольных моментов для некоторых полярных молекул:
| молекула | m | молекула | m | молекула | m | молекула | m | молекула | m |
| Н2 | 0 | HF | 1,82 | Н2О | 1,84 | CO2 | 0 | CH4;CCl4 | 0 |
| О2 | 0 | HCl | 1,07 | Н2S | 0,93 | SO2 | 1,61 | CH3Cl | 1,86 |
| N2 | 0 | HBr | 0,79 | NН3 | 1,46 | SO3 | 0 | CH2Cl2 | 1,57 |
| Cl2 | 0 | HI | 0,38 | PН3 | 0,55 | SF6 | 0 | CHCl3 | 1,15 |
Физико-химические особенности полярных молекул определяются их способностью реагировать на внешние электрические поля (электрическая поляризация) и на поля, созданные другими полярными молекулами. В частности, за счет взаимодействия с полярными молекулами воды такие полярные молекулы, как HF, HCl и др.,могут подвергаться электролитической диссоциации.
Дополнительно используемая литература:
1.Общая и неорганическая химия. Карапетьян, Дракин
2. Теоретические основы общей химии. Горбунов, Гуров, Филиппов
Дипольный момент: как он рассчитывается и примеры
Содержание:
Дипольный момент μ является векторной величиной, поэтому на него влияют углы связей и, в целом, молекулярная структура.
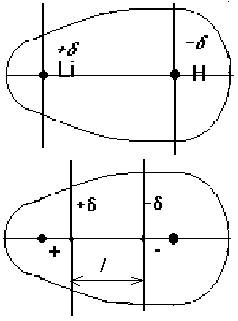
Когда молекула линейна, ее можно сравнить с двухцветным ластиком. Его отрицательный конец δ- будет соответствовать красному цвету; в то время как положительное, δ +, будет синим цветом. По мере увеличения величин отрицательных зарядов на δ-полюсе и расстояния, отделяющего его от δ +, дипольный момент увеличивается.
С химической точки зрения это означает, что чем больше разница в электроотрицательности между двумя атомами и чем больше расстояние, которое их разделяет, тем больше дипольный момент между ними.
Как рассчитывается дипольный момент?
Считается ковалентной связью между двумя атомами, A и B:
Расстояние между положительным и отрицательным частичными зарядами уже определяется длиной их связи:
Но поскольку это значение очень мало, используется единица Дебая:
Это значение μA-B может привести к предположению, что связь A-B является более ионной, чем ковалентной.
Примеры
вода
Чтобы вычислить дипольный момент молекулы, все дипольные моменты их соответствующих связей должны быть добавлены векторно, учитывая валентные углы и небольшую тригонометрию. Это в самом начале.
Вода имеет один из самых больших дипольных моментов, который можно ожидать для ковалентного соединения. На верхнем изображении мы видим, что атомы водорода имеют положительный частичный заряд, δ +, а кислород несет отрицательный частичный заряд, δ-. Связь O-H достаточно полярна (1,5D), и их две в молекуле H2ИЛИ.
Обычно рисуется вектор, направленный от наименее электроотрицательного атома (H) к наиболее электроотрицательному (O). Хотя они не нарисованы, на атоме кислорода есть две пары неподеленных электронов, которые еще больше «концентрируют» отрицательную область.
Из-за угловой геометрии H2Или дипольные моменты складываются в направлении атома кислорода. Обратите внимание, что сумма двух μO-H даст 3D (1,5 + 1,5); но это не так. Дипольный момент воды имеет экспериментальное значение 1,85D. Здесь показан эффект угла около 105 ° между связями H-O-H.
Метанол
Дипольный момент метанола составляет 1,69 D. Это меньше, чем у воды. Следовательно, атомные массы не имеют большого влияния на дипольный момент; но их атомные радиусы равны. В случае метанола мы не можем утверждать, что его связь H-O имеет μ, равную 1,5D; так как в CH3ОН и Н2ИЛИ.
Вот почему вам нужно будет измерить длину связи H-O в метаноле, чтобы рассчитать μO-H. Что можно сказать, так это то, что μO-H больше, чем μC-O, поскольку разница электроотрицательностей между углеродом и кислородом меньше, чем между водородом и кислородом.
Метанол указан как один из самых полярных растворителей, которые можно найти вместе с водой и аммиаком.
Аммиак
Связи H-N довольно полярны, поэтому азот из-за своей более высокой электроотрицательности притягивает электроны к себе (верхнее изображение). В дополнение к этому у нас есть неподеленная пара электронов, которые вносят свои отрицательные заряды в δ-область. Следовательно, на атоме азота аммиака преобладают электрические заряды.
Аммиак имеет дипольный момент 1,42D, меньше, чем у метанола. Если бы и аммиак, и метанол можно было превратить в ластики, было бы видно, что ластик из метанола имеет более определенные полюса по сравнению с ластиком из аммиака.
Этанол
В случае этанола CH3CH2ОН, его дипольный момент очень близок к дипольному моменту метанола, но, как правило, имеет более низкие значения. Поскольку в области δ + становится больше атомов углерода, атом кислорода, представляющий δ-, начинает терять часть своей «относительной отрицательной интенсивности».
Углекислый газ
Углекислый газ имеет две полярные связи C = O с соответствующими дипольными моментами μO-C. Однако, как видно на изображении выше, линейная геометрия CO2 Это заставляет два μO-C векторно компенсировать друг друга, даже когда углерод имеет положительный частичный заряд, а атомы кислорода имеют отрицательный частичный заряд.
По этой причине диоксид углерода является неполярной молекулой, поскольку μCO2 имеет значение 0D.
Метан
Если мы увидим молекулу CH4, его связи C-H полярны, а электроны направлены к атому углерода, потому что он немного более электроотрицателен. Можно было бы подумать, что углерод должен быть сильно отрицательной δ-областью; как ластик с темно-красным центром и голубоватыми концами.
Однако, разделив CH4 в середине мы получили бы две половинки H-C-H, одну слева, а другую справа, аналогичные молекуле H2О. Таким образом, дипольный момент, возникающий в результате сложения этих двух мкС-Н, компенсируется дипольным моментом другой половины. Следовательно, μCH4 имеет значение 0D.
Ссылки
Что такое мезография? Наиболее важные функции
Климат Африки по регионам и его характеристики
Что показывает дипольный момент
Виктор Александрович КОГАН
профессор, заведующий кафедрой физической и коллоидной химии
Ростовского Государственного Университета
ИЗБРАННЫЕ ЛЕКЦИИ ПО КУРСУ «МЕТОДЫ ИССЛЕДОВАНИЯ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ»
Метод дипольных моментов в химии
Лекция посвящена одному из важнейших физических методов исследования строения вещества – методу дипольных моментов. Рассмотрена природа дипольного момента и методы его определения, а также приведены отдельные примеры применения метода дипольных моментов для выяснения строения химических соединений.
1. Общие представления о природе дипольного момента
Дипольный момент – важная молекулярная константа, характеризующая электрическую симметрию молекулы.
Знание величины дипольного момента необходимо для изучения природы химической связи, оценки прочности донорно-акцепторных и межмолекулярных связей, для квантово-химических расчетов. По величине дипольного момента можно судить об изомерии и конформации органических соединений, конфигурации координационных узлов комплексов, о взаимном влиянии атомов и связей в молекуле.
Величина электрического дипольного момента (μ) определяется соотношением:
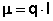
Причиной появления дипольного момента являются несколько факторов. В первую очередь – это различия в природе составляющих молекулу атомов. В простейшем случае для двухатомной молекулы μ = 0, если она состоит из двух одинаковых атомов. Это относится к H2, O2, N2 и т.д. В двухатомной молекуле с атомами разной природы проявляется постоянный дипольный момент, т. к., вследствие разной электроотрицательности, характеризующей способность атома оттягивать электронную плотность, появляется асимметрия электронной плотности. Другие причины – разные гибридные состояния орбиталей атомов. Так, например, для связи H-Cl, образованной 1s-орбиталью водорода и 3p-орбиталью хлора, вследствие различной формы s- и p-орбиталей, центр тяжести заряда перекрывания смещен в сторону водорода на ΔL, за счет чего возникает дополнительный, т. н. гомеополярный дипольный момент (рис.1):
Рис. 1. Схема происхождения гомеополярного диполя.
Естественно, молекулы HCl, HBr, HI имеют постоянные дипольные моменты, равные, соответственно, 1.95 D, 0.79 D, 0.40 D. Другие вклады в суммарный дипольный момент возникают из-за асимметрии связывающей и несвязывающей атомных орбиталей вследствие их гибридизации. Так, дипольный момент аммиака, 1.46 D, в основном обусловлен моментом несвязывающей пары электронов азота.
2. Методы определения дипольных моментов
Из всех методов получили наиболее широкое распространение методы определения дипольных моментов, основанные на измерении диэлектрической проницаемости (ε) вещества. Этими методами измерены дипольные моменты молекул более 10000 веществ. Переход от измеряемого значения ε газа, чистой жидкости или разбавленного раствора, т.е. макроскопической характеристики диэлектрика, к величине дипольного момента основан на теории поляризации диэлектриков. Считается, что при наложении электрического поля на диэлектрик его полная поляризация Р складывается из наведенной или индуцированной поляризации Рм и поляризации Рор и связана с μ уравнением Ланжевена-Дебая (2).
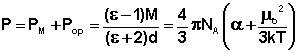
Измерения диэлектрической проницаемости проводят в постоянном поле или при низких частотах, обеспечивающих полную ориентацию молекул по полю. Кратко остановимся на типичной процедуре определения μо в разбавленных растворах. Она основана на предположении об аддитивности свойств составляющих раствор компонентов:
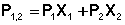
где Р1,2, Р1, Р2 – молекулярные поляризации раствора, растворителя и растворенного вещества соответственно;
Х1, Х2 – мольные доли растворителя и растворенного вещества.
С учетом уравнения (2) уравнение (3) для раствора будет выглядеть как (4):
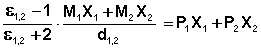
где М1 и М2 – молекулярные веса растворителя и растворенного вещества;
ε1,2 – диэлектрическая проницаемость раствора;
d1,2 – плотность раствора.
Из уравнения (4) можно вычислить Р2 – молекулярную поляризацию растворенного вещества. В этом методе допускается, что молекулы полярного вещества могут вести себя в растворах как в парообразном состоянии и свободно ориентироваться в приложенном поле только для бесконечно разбавленных растворов, поэтому значение Р2 следует экстраполировать на нулевую концентрацию (Х2 = 0) и найти значение молекулярной поляризации растворенного вещества при бесконечном разбавлении (Р2∞).
Эксперимент сводится к измерению диэлектрической проницаемости и плотности 5-7 разбавленных растворов исследуемого соединения при точно поддерживаемой температуре (обычно 25 °С) в интервале концентраций растворенного вещества от 0,001¸ 0,01 мольных долей. Выбор интервала концентраций зависит от растворимости и полярности вещества и может колебаться в сторону уменьшения мольных долей для более полярных соединений. Затем по формуле (4) находят значение молекулярной поляризации растворенного вещества для каждой концентрации и по полученным данным строят кривую зависимости Р2 от концентраций, по которой экстраполируют Р2 до нулевой концентрации и находят значение Р2∞. Эту величину можно также получить, используя различные приемы экстраполяции к нулевой концентрации для диэлектрической проницаемости и плотности.
Величину дипольного момента рассчитывают из уравнения Дебая (2)
из которого, подставляя значения N, κ, π, можно вычислить величину постоянного дипольного момента по формуле (5):
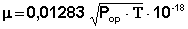
Найденное в эксперименте значение Р2∞ включает в себя электронную (Рэл) и атомную (Рат) молекулярные поляризации и поэтому Рор в уравнении (5) вычисляется как Рор = Р2∞ – Рат – Рэл.
Рэл считают равной рефракции вещества, которое вычисляется по той же схеме аддитивности на основании измерения коэффициентов преломления и плотности той же серии растворов, а Рат вследствие ее малости очень часто пренебрегают. Следует отметить, что Рэл можно рассчитать по рефракциям связей и групп, если не требуется высокая точность в значении дипольного момента.
Сходимость результатов, полученных различными методами при корректном использовании правильных расчетных формул бывает достаточно хорошей, как показано в табл. 1:
Таблица 1. Дипольные моменты молекул (в D)
ДИПОЛЬНЫЙ МОМЕНТ
Полезное
Смотреть что такое «ДИПОЛЬНЫЙ МОМЕНТ» в других словарях:
ДИПОЛЬНЫЙ МОМЕНТ — физическая величина, характеризующая свойства диполя. Электрический дипольный момент равен произведению положительного заряда электрического диполя на расстояние между зарядами и направлен от отрицательного заряда к положительному. Магнитный… … Большой Энциклопедический словарь
Дипольный момент — Классическая электродинамика Магнитное поле соленоида Электричество · Магнетизм Электростатика Закон Кулона … Википедия
дипольный момент — физическая величина, характеризующая свойства диполя. Электрический дипольный момент равен произведению положительного заряда электрического диполя на расстояние между зарядами и направлен от отрицательного заряда к положительному. Магнитный… … Энциклопедический словарь
дипольный момент — постоянный электрический момент частицы; дипольный момент; отрасл. постоянный дипольный момент Электрический момент частицы (молекулы или комплекса молекул) при отсутствии внешнего электрического поля … Политехнический терминологический толковый словарь
дипольный момент — dipolinis momentas statusas T sritis Standartizacija ir metrologija apibrėžtis Apibrėžtį žr. priede. priedas( ai) Grafinis formatas atitikmenys: angl. dipole moment vok. Dipolmoment, n rus. дипольный момент, m pranc. moment de dipôle, m; moment… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
дипольный момент — dipolinis momentas statusas T sritis chemija apibrėžtis Vektorinis dydis, lygus bet kurio dipolio elektros krūvio ir atstumo tarp polių sandaugai. atitikmenys: angl. dipole moment rus. дипольный момент ryšiai: sinonimas – elektrinio dipolio… … Chemijos terminų aiškinamasis žodynas
дипольный момент — dipolinis momentas statusas T sritis fizika atitikmenys: angl. dipole moment vok. Dipolmoment, n rus. дипольный момент, m pranc. moment dipolaire, m … Fizikos terminų žodynas
Дипольный момент — электрический, физическая величина, характеризующая электрические свойства системы заряженных частиц. Д. м. системы из N заряженных частиц равен где ei заряд частицы номера i, а ri её радиус вектор. Д. м. нейтральной в… … Большая советская энциклопедия
ДИПОЛЬНЫЙ МОМЕНТ — физ. величина, характеризующая свойства диполя. Электрич. Д. м. равен произведению положит. заряда электрич. диполя на расстояние между зарядами и направлен от отрицат. заряда к положительному. Магн. Д. м. контура с током пропорционален… … Естествознание. Энциклопедический словарь
Электрические свойства молекул и дипольный момент
Для познания природы органических молекул много дали исследования их электрических свойств. Начало этим исследованиям положил Дебай еще в 1912 г.
Исследуя диэлектрические постоянные растворенных веществ при разных температурах, Дебай нашел, что диэлектрические постоянные некоторых веществ не изменяются при изменениях температуры, тогда как для других веществ в растворах и в газообразном состоянии они зависят от температуры. Изменение поляризации с температурой Дебай объяснил тем, что молекулы этих веществ электрически полярны и что поэтому в электрическом поле, кроме обычной поляризации (в результате деформации молекул), происходит также поляризация вследствие определенной ориентации молекул-диполей по отношению к силам электрического поля. Если вещество находится в газообразном или растворенном состоянии, эта ориентация молекул-диполей нарушается вследствие теплового движения молекул. Поэтому слагающая поляризации, зависящая от ориентации молекул-диполей, уменьшается с повышением температуры
Молекулярная поляризация веществ этого рода в газообразном состоянии и в растворах может быть вычислена по формуле Дебая:
Здесь а — постоянная, а величина b определяется из следующего выражения:
μ — электрический момент молекулы-диполя, который и получил название дипольного момента.
Приведенное уравнение дает возможность вычислить дипольные моменты на основании экспериментальных данных для веществ в газообразном состоянии и в виде растворов в неполярных растворителях (гексан, сероуглерод, бензол и пр.).
Полярность молекул, бесспорно, подтверждается опытами, показавшими отклонение путей молекул, движущихся в электрическом поле.
С точки зрения электронных представлений о природе химической связи полярность молекул объясняется следующим образом.
Ковалентная связь, осуществляемая общей парой электронов, редко оказывается электрически симметричной. Это имеет место только при соединении одинаковых атомов или групп
или атомов с близким электронным сродством.
Если атомы (атомные ядра) или их группы обладают неодинаковым сродством к электронам, симметрия σ-связи, т. е. симметрия расположения электрических зарядов, нарушается; так будет, например, в случаях:
Такое смещение электронов связи часто обозначают стрелкой, направленной в ту сторону, в которую, как предполагается, смещены электроны:
Иногда стрелку ставят посредине ковалентного штриха, например:
Величину смещения электронов характеризует величина дипольного электрического момента:
где е — величина элементарного заряда, а r — расстояние между центрами тяжести положительных зарядов ядер и отрицательных зарядов электронных облаков у данной связи или у данной молекулы.
Таким образом, порядок величины дипольного момента определяется произведением элементарного заряда (4,8 ∙ 10 –10 эл.-ст. ед.) на длину, которая для межатомных расстояний в молекулах близка к 10 –8 см. Поэтому удобно выражать величины дипольных моментов в так называемых единицах Дебая (D), равных 10 –10 ∙ 10 –8 =10 –18 эл.-cт. ед.∙см.
В случаях, когда в молекуле полярна лишь одна связь, величина дипольного момента определяет полярность этой связи; в тех же случаях, когда в молекулах имеется несколько полярных связей, величина дипольного момента определяет лишь суммарную величину полярности молекулы. Поэтому величины дипольных моментов молекул, состоящих из двух атомов, представляют особый интерес.
Если электронная пара окончательно переходит в безраздельное обладание одного из партнеров связи, вместо ковалентной связи возникает, как уже раньше отмечалось, ионная связь.
Для чисто ковалентной (гомеополярной) связи дипольный момент должен равняться нулю, а для чисто ионной связи он должен был бы измеряться произведением заряда электрона (4,8 ∙ 10 –10 эл.-ст. ед.) на сумму атомных радиусов rA + rB обоих партнеров связи — элементов А и В.
Оказалось, что μ = 0 для следующих молекул:
1. Одноатомные газы: Не, Ne, Аr, Кr, Хе, пары К, Na.
3. Симметричные линейные трехатомные, четырехатомные и т. д. молекулы типа В—(А)n—В: О =С=О, S=C=S,
Существенно отличный от нуля дипольный момент имеют: 1. Несимметричные двухатомные молекулы типа А—В:
2. Несимметричные линейные молекулы типа В—А—С;
3. Нелинейные молекулы типа В—А—В:
Наличие дипольного момента у таких молекул, как Н2О, H2S, объясняется тем, что связи у кислорода и серы расположены под углом; по квантово-механическим соображениям этот угол должен быть равен 90°, однако он несколько искажается вследствие взаимного отталкивания заместителей. Поэтому у молекулы воды, например, угол НОН оказывается равным
Учитывая, что дипольные моменты, как величины направленные, должны подчиняться правилу векториального сложения, мы можем по дипольному моменту воды, зная величину угла НОН, построить параллелограмм моментов, вносимых каждой связью О—Н, и найти их величину. Эта величина μOH оказывается равной 1,51 D.
Молекула аммиака обладает значительным моментом. Для нее была доказана пирамидальная структура, причем плоский угол при вершине пирамиды, где находится ядро азота (угол HNH), составляет
107°. Расчет, аналогичный приведенному выше, дает для момента связи N—Н величину μNH=1,31 D.
Что касается органических соединений, то здесь оказалось, что не только для СН4 и СН3—СН3, но и вообще для всех предельных углеводородов дипольный момент равен нулю.
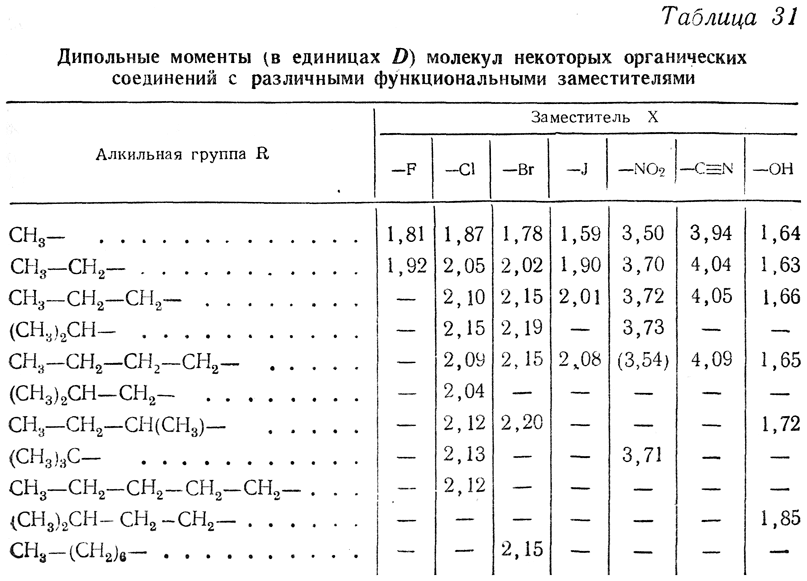
В табл. 31 сопоставлены дипольные моменты некоторых органических соединений, обладающих функциональными заместителями. Из данных табл. 31 можно сделать вывод, что величина дипольного момента у производных предельных углеводородов определяется в основном функциональной группой, оставаясь практически почти постоянной (или слабо возрастая) в пределах гомологического ряда (небольшие отклонения наблюдаются лишь у первых членов ряда).
В более сложных молекулах надо, однако, учитывать и некоторые особенности. Так, например, поскольку для СН4 и ССl4 дипольный момент равен нулю, СН3Сl и СНСl3 должны были бы обладать одинаковыми дипольными моментами. Однако оказывается, что для хлористого метила СН3Сl эта величина (1,87 D) значительно больше, чем для хлороформа СНСl3, для которого μ=0,95D. Это может быть объяснено тем, что взаимное отталкивание трех ядер галоида в молекуле хлороформа сильно деформирует угол СlССl в сторону его увеличения (от 109° до
116°), а следовательно, и углы НССl — в сторону их уменьшения.
Сопоставление дипольных моментов кислородных соединений
приводит к заключению, что угол между валентностями кислорода, составляющий у воды
105°, все более и более деформируется в сторону увеличения в ряду простых эфиров, стремящихся, очевидно, приобрести энергетически наиболее выгодную конфигурацию, напоминающую конфигурацию парафинов (угол 112°).
В ряду спиртов R—О—Н такая симметризация, очевидно, не может быть достигнута ни при каком радикале R, чем и объясняется сравнительное постоянство дчпольного момента в этом ряду (μ≈l,7 D). В молекуле окиси этилена уменьшение валентного угла у кислорода (этот угол стремится стать близким к 60°) обусловливает увеличение дипольного момента, даже по сравнению с водой, до величины 1,88 D.
Линейные симметричные молекулы, вроде О=С=О, имеют μ=0 благодаря взаимной компенсации противоположно направленных сильных диполей связи С—О (μСО=2,5 D). Аналогичная компенсация диполей происходит, например, в случае дихлорзамещенных производных этилена. В го время как у 1,1-дихлорэтилена μ=1,7 D и у цис-1,2-дихлорэтилена μ=2,5 D, у транс-1,2-дихлорэтилена, имеющего центр симметрии, μ=0.
Для ряда кетонов дипольный момент составляет величину 2,5—2,7 D (для СН3—СО—СН3 μ=2,71D). Для ацетальдегида μ=2,72 D. Тример ацетальдегида, циклический паральдегид, в соответствии с большой симметрией, обладает дилолъным моментом, равным только 1,92 D.
Интересно отметить изменение дипольных моментов в ряду — аммиак, первичные, вторичные и третичные амины:
О том, как сказывается строение молекулы на величине дипольного момента при наличии кратных связей, дает понятие следующее сопоставление:
Интересные результаты дает определение дипольных моментов у 1,2-замещенных этанов:
Для молекул этого типа возможно свободное, хотя и несколько ограниченное вращение вокруг оси С—С; очевидно, что при таком вращении дипольный момент, например, у Сl—СН2—СН2—Сl должен изменяться от некоторого максимального значения (при расположении атомов хлора друг над другом как бы в цис-положении, т. е. в заслоненной конформации) до нуля (при транс-положении атомов хлора, т. е. в заторможенной конформации).
Средний результирующий момент для дихлорэтана по расчету должен бы быть равен 2,4 D. На самом деле он много меньше, что подтверждает вытекающий из конформационных представлений вывод о преобладании заторможенной конформации. При повышении температуры, благодаря увеличению энергии вращения молекулы, вероятность возникновения энергетически менее выгодных конформации становится больше. Поэтому с повышением температуры у таких замещенных этанов дипольный момент увеличивается.
Дипольные моменты таких молекул, как С(СН2ОН)4, или С(ОС2Н5)4, или С(СН2СООСН3)4, которые, благодаря тождеству групп при тетраэдрическом атоме углерода, должны были бы быть разными нулю, оказывзются соответственно равными 2,0, 1,1 и 2,8 D. Это объясняется возможностью смещения векторов функциональных групп относительно направлений к вершинам тетраэдра.