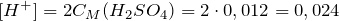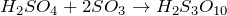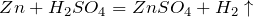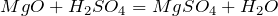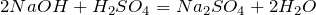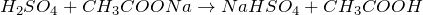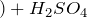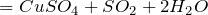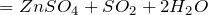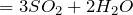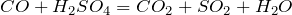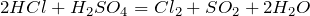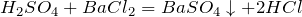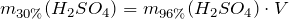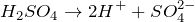Что показывает химическая формула н2so4
Свойства сернистой кислоты и её взаимодействие с другими веществами
Сернистая кислота — что она собой представляет
Сернистая кислота — это двухосновная кислородсодержащая кислота.
Сернистая кислота является неустойчивым веществом, распадающимся на диоксид серы S O 2 и воду. Валентность серы в сернистой кислоте равна IV, а степень окисления: +4. Структурная формула выглядит так:
Химические и физические свойства
Сернистый ангидрид S O 2 представляет собой бесцветный газ и обладает резким запахом.
Физические свойства сернистой кислоты:
Сернистая кислота в водном растворе является слабым электролитом. Диссоциация протекает обратимо по двум ступеням.
H 2 S O 3 ↔ H S O 3 – + H +
H S O 3 – ↔ S O 3 2 – + H +
В процессе самопроизвольного распада сернистой кислоты образуются диоксид серы и вода.
H 2 S O 3 ↔ S O 2 + H 2 O
Сернистая кислота вступает в химическую реакцию с сильными основаниями и их оксидами.
Взаимодействие сернистой кислоты с гидроксидами таких щелочных металлов, как натрий и калий, описывается уравнениями:
H 2 S O 3 + К О Н → K H S О 3 + H 2 O
H 2 S O 3 + 2 К О Н → К 2 S О 3 + 2 H 2 O
Среди всех химических свойств сернистой кислоты наиболее ярко выражены ее восстановительные свойства. Взаимодействуя с окислителями, сера повышают собственную степень окисления.
Обесцвечивание бромной воды с помощью сернистой кислоты:
H 2 S O 3 + B r 2 + H 2 O → H 2 S O 4 + 2 H B r
Процесс окисления сернистой кислоты азотной протекает достаточно легко по уравнению:
H 2 S O 3 + 2 H N O 3 → H 2 S O 4 + 2 N O 2 + H 2 O
Окисление сернистой кислоты с помощью озона:
H 2 S O 3 + O 3 → H 2 S O 4 + O 2
При контакте с сильными восстановителями могут проявляться окислительные свойства сернистой кислоты.
Взаимодействие сернистой кислоты и сероводорода сопровождается ее восстановлением до элементарной серы:
H 2 S O 3 + 2 Н 2 S → 3 S + 3 H 2 O
Качественная реакция на сернистую кислоту
Качественная реакция на сернистую кислоту представляет собой обесцвечивание раствора перманганата калия:
5 H 2 S O 3 + 2 K M n O 4 → 2 H 2 S O 4 + 2 M n S O 4 + K 2 S O 4 + 3 H 2 O
N a 2 S O 3 + 2 H C l → 2 N a C l + S O 2 ↑ + H 2 O
2 H + + S O 3 2 – → S O 2 ↑ + H 2 O
Способы получения и как применяется
Далее можно наблюдать реакцию, протекающую по уравнению:
C u ( м е д ь ) + 2 H 2 S O 4 ( с е р н а я к и с л о т а ) = C u S O 4 ( с у л ь ф а т с е р ы ) + S O 2 ( с е р н и с т ы й г а з ) + H 2 O ( в о д а )
Затем поток сернистого газа следует направить в пробирку с водой. При нахождении в ней газообразное вещество растворяется, частично протекает химическая реакция с водой. В итоге синтезируется сернистая кислота:
S O 2 ( с е р н и с т ы й г а з ) + H 2 O ( в о д а ) = H 2 S O 3
Таким образом с помощью пропускания сернистого газа через воду получают сернистую кислоту.
В процессе экспериментов с сернистым газом необходимо использовать индивидуальные средства защиты, так как вещество раздражает слизистую оболочку дыхательных путей. Подобное воздействие сопровождается воспалительным процессом и потерей аппетита. Длительное вдыхание сернистого газа приводит к потере сознания.
Сернистая кислота нашла применение в качестве восстановителя. Вещество используют для беления шерсти, шелка и других материалов, которые не способны выдержать отбеливание сильными окислителями в виде хлора. Сернистую кислоту используют в процессе консервирования плодов и овощей, а также для:
Серная кислота (H2SO4) Формула, свойства, структура и использование
серная кислота (Н2SW4) представляет собой жидкое химическое соединение, маслянистое и бесцветное, растворимое в воде с выделением тепла и вызывающее коррозию металлов и тканей. Обугливает древесину и большинство органических веществ при соприкосновении с ней, но вряд ли это может привести к пожару.
Серная кислота, пожалуй, самая важная из всех тяжелых промышленных химикатов, и ее потребление неоднократно указывалось в качестве показателя общего состояния экономики страны..
Длительное воздействие низких концентраций или кратковременное воздействие высоких концентраций может привести к неблагоприятным последствиям для здоровья. Безусловно, самое важное использование серной кислоты в промышленности фосфорных удобрений..
Другие важные области применения: нефтепереработка, производство пигментов, травление стали, извлечение цветных металлов и производство взрывчатых веществ, моющих средств, пластмасс, искусственных волокон и фармацевтических препаратов..
Витриоло, история серной кислоты
В средневековой Европе серная кислота была известна алхимикам как купорос, масло купороса или ликер купороса. Он считался наиболее важным химическим веществом и пытался использовать в качестве философского камня.
У шумеров уже был список нескольких видов купороса. Кроме того, Гален, греческий доктор Диоскорид и Плиний Старший, подняли вопрос о медицинском применении..
формула
-Номер Кас: 7664-93-9
Химическая структура
В 2D
3D
черты
Физико-химические свойства
Серная кислота относится к реакционноспособной группе сильных окисляющих кислот.
Реакции с воздухом и водой
— Реакция с водой незначительна, если кислотность не превышает 80-90%, тогда теплота гидролиза является чрезмерной, это может вызвать серьезные ожоги.
воспламеняемость
— Сильные окисляющие кислоты, как правило, не горючи. Они могут ускорить сгорание других материалов, обеспечивая кислородом место сгорания..
— Тем не менее, серная кислота обладает высокой реакционной способностью и способна воспламенить мелкодисперсные горючие материалы при контакте с ними..
— При нагревании выделяет высокотоксичные пары.
— Это взрывоопасно или несовместимо с огромным разнообразием веществ.
— Может подвергаться сильным химическим изменениям при высоких температурах и давлении.
— Может бурно реагировать с водой.
реактивность
— Серная кислота сильно кислотная.
— Реагирует бурно с пентафторидом брома.
— Взрывается с пара-нитротолуолом при 80 ° C.
— Смесь акрилонитрила с концентрированной серной кислотой должна хорошо охлаждаться, в противном случае происходит энергичная экзотермическая реакция.
— Температуру и давление повышают, смешивая в закрытом контейнере серную кислоту (96%) равными порциями с любым из следующих веществ: ацетонитрил, акролеин, 2-аминоэтанол, гидроксид аммония (28%), анилин, н-бутиральдегид, хлорсульфоновая кислота, этилендиамин, этиленамин, эпихлоргидрин, этиленциангидрин, соляная кислота (36%), плавиковая кислота (48,7%), пропиолактон, пропиленоксид, гидроксид натрия, мономер стирола.
— Серная кислота (концентрат) чрезвычайно опасна при контакте с карбидами, броматами, хлоратами, молниеносными материалами, пикратами и порошкообразными металлами.
— Он может вызвать бурную полимеризацию аллилхлорида и экзотермически реагирует с гипохлоритом натрия с образованием газообразного хлора..
— Смешивание хлорной и 98% серной кислот дает HCl.
токсичность
— Серная кислота вызывает коррозию всех тканей организма. Вдыхание паров может привести к серьезным повреждениям легких. Контакт с глазами может привести к полной потере зрения. Контакт с кожей может привести к серьезному некрозу.
— Прием серной кислоты в количестве от 1 чайной ложки до половины унции концентрированного химического вещества может быть фатальным для взрослого человека. Даже несколько капель могут быть смертельными, если кислота попадает в трахею.
— Хроническое воздействие может вызвать трахеобронхит, стоматит, конъюнктивит и гастрит. Могут возникнуть перфорация желудка и перитонит, за которыми может последовать нарушение кровообращения. Сердечно-сосудистый шок часто является непосредственной причиной смерти.
— Люди с хроническими респираторными, желудочно-кишечными или нервными заболеваниями и любыми заболеваниями глаз и кожи подвержены большему риску.
приложений
— Серная кислота является одним из наиболее используемых промышленных химических веществ в мире. Но большинство его применений можно рассматривать как косвенные, участвуя в качестве реагента, а не как ингредиент
— Большая часть серной кислоты превращается в кислоту, расходуемую на производство других соединений, или в виде какого-либо сульфатного остатка.
— Определенное количество продуктов включает серу или серную кислоту, но почти все они являются специальными продуктами небольшого объема..
— Рост спроса на серную кислоту во всем мире обусловлен, в порядке убывания, производством: фосфорной кислоты, диоксида титана, плавиковой кислоты, сульфата аммония, а также при переработке урана и металлургии..
косвенный
— Крупнейшим потребителем серной кислоты является, безусловно, промышленность удобрений. В 2014 году на него приходилось чуть более 58% общего мирового потребления. Однако ожидается, что эта доля уменьшится примерно до 56% к 2019 году, главным образом в результате более быстрого роста других химических и промышленных применений..
— Производство фосфорных удобрений, особенно фосфорной кислоты, является основным рынком сбыта для серной кислоты. Он также используется для производства удобрений, таких как тройной суперфосфат и моно- и диаммонийфосфаты. Незначительные количества используются для производства суперфосфата и сульфата аммония.
— В других отраслях промышленности значительные количества серной кислоты используются в качестве реакционной среды для дегидратации кислоты, в органической химии и нефтехимических процессах, включающих такие реакции, как нитрование, конденсация и дегидратация, а также при переработке нефти. где он используется при рафинировании, алкилировании и очистке неочищенных дистиллятов.
— В неорганической химической промышленности его использование примечательно при производстве пигментов TiO2, соляной кислоты и плавиковой кислоты.
— В металлообрабатывающей промышленности серная кислота используется для травления стали, выщелачивания минералов меди, урана и ванадия при гидрометаллургической переработке минералов, а также при подготовке электролитических ванн для очистки и металлизации металлов. цветной.
— Определенные процессы при производстве древесной массы в бумажной промышленности, при производстве некоторых текстильных изделий, при производстве химических волокон и при дублении кожи также требуют серной кислоты..
прямой
— Вероятно, наибольшее использование серной кислоты, в которой сера включена в конечный продукт, находится в процессе органического сульфирования, в частности, для производства моющих средств..
— Сульфирование также играет важную роль в получении других органических химических веществ и незначительных фармацевтических продуктов.
— Свинцово-кислотные аккумуляторы являются одним из самых известных потребительских товаров, содержащих серную кислоту, и составляют лишь небольшую долю от общего потребления серной кислоты..
— При определенных условиях серная кислота используется непосредственно в сельском хозяйстве для восстановления очень щелочных почв, таких как почвы, обнаруженные в пустынных районах на западе Соединенных Штатов. Однако это использование не очень важно с точки зрения общего объема используемой серной кислоты..
Развитие сернокислотной промышленности
Купорос процесс
Самым старым способом получения серной кислоты является так называемый «процесс купороса», основанный на термическом разложении купоросов, представляющих собой сульфаты различных типов природного происхождения..
Персидские алхимики Джабир ибн Хайян (также известный как Гебер, 721–815 гг. Н.э.), Рази (865–925 гг. Н.э.) и Джамал Дин аль-Ватват (1318 н.э.) включили в свои списки минералов классификацию купоросов.
Первое упоминание о «купоросном процессе» появляется в трудах Джабира ибн Хайяна. Затем алхимики Святой Альберт Великий и Василий Валентин описали процесс более подробно. В качестве сырья использовались квасцы и кальканит (синий купорос).
В конце средневековья серная кислота была получена в небольших количествах в стеклянных контейнерах, в которых сера сжигалась с помощью селитры во влажной среде..
Процесс купороса был использован в промышленном масштабе с шестнадцатого века из-за большего спроса на серную кислоту.
Витриоло де Нордхаузен
Процесс проводили в камбузах, некоторые из которых имели несколько уровней параллельно, чтобы получить большие количества купоросового масла.
Ведущие камеры
В 18 веке был разработан более экономичный процесс производства серной кислоты, известный как «процесс с использованием свинцовой камеры»..
До этого максимальная концентрация получаемой кислоты составляла 78%, в то время как с помощью «процесса купороса» были получены концентрированные кислота и олеум, поэтому этот метод продолжал использоваться в определенных секторах промышленности до появления «процесса контакт »в 1870 году, с помощью которого концентрированная кислота может быть получена дешевле.
Олеум или дымящая серная кислота (CAS: 8014-95-7) представляет собой раствор маслянистой консистенции и темно-коричневого цвета, переменного состава триоксида серы и серной кислоты, который можно описать формулой H2SW4.XSO3 (где х представляет собой свободное молярное содержание оксида серы (VI)). Значение для х 1 дает эмпирическую формулу H2S2О7, что соответствует дисульфуровой кислоте (или пиросерной кислоте).
процесс
Процесс свинцовой камеры был промышленным методом, используемым для производства серной кислоты в больших количествах, прежде чем его вытеснил «контактный процесс»..
В 1746 году в Бирмингеме, Англия, Джон Робак начал производить серную кислоту в свинцовых камерах, которые были прочнее и дешевле, чем стеклянные контейнеры, которые использовались ранее, и их можно было сделать намного больше..
Диоксид серы (от сжигания элементарной серы или металлических минералов, содержащих серу, таких как пирит), вводился с паром и оксидом азота в большие камеры, облицованные свинцовыми листами..
Диоксид серы и диоксид азота растворяются, и в течение примерно 30 минут диоксид серы окисляется до серной кислоты..
Это позволило эффективно индустриализировать производство серной кислоты, и с различными усовершенствованиями этот процесс оставался стандартным методом производства в течение почти двух столетий..
В 1793 году Clemente y Desormes добился лучших результатов, введя дополнительный воздух в процесс камеры свинца.
В 1827 году Гей-Люссак представил метод поглощения оксидов азота из отходящих газов из свинцовой камеры..
В 1859 году Гловер разработал метод восстановления оксидов азота из вновь образовавшейся кислоты путем увлечения горячими газами, что позволило непрерывно катализировать процесс с помощью оксида азота..
В 1923 году Петерсен представил усовершенствованный процесс башни, который позволял ее конкурентоспособность по отношению к процедуре контакта до 1950-х годов.
Камерный процесс стал настолько устойчивым, что в 1946 году он все еще представлял 25% мирового производства серной кислоты.
Текущее производство: контактный процесс
Контактный процесс представляет собой современный способ производства серной кислоты в высоких концентрациях, необходимый в современных промышленных процессах. Раньше катализатором этой реакции была платина. Однако в настоящее время предпочтительным является пятиокись ванадия (V2O5)..
В 1831 году в Бристоле, Англия, Peregrine Phillips запатентовал окисление диоксида серы до триоксида серы с использованием платинового катализатора при повышенных температурах..
Однако принятие его изобретения и интенсивное развитие процесса контакта начались только после того, как спрос на олеум для производства красителей увеличился с 1872 года..
Затем были найдены лучшие твердые катализаторы и исследована химия и термодинамика равновесия SO2 / SO3..
Процесс контакта можно разделить на пять этапов:
Основным недостатком процессов окисления азота (во время процесса в свинцовой камере) является то, что концентрация получаемой серной кислоты ограничена максимумом от 70 до 75%, в то время как в процессе контакта образуется концентрированная кислота (98). %).
С разработкой относительно недорогих ванадиевых катализаторов для контактного процесса, наряду с растущей потребностью в концентрированной серной кислоте, глобальное производство серной кислоты на заводах по переработке оксида азота неуклонно снижалось.
К 1980 году на заводах по переработке оксида азота в Западной Европе и Северной Америке практически не производили кислоту..
Процесс двойного контакта
Процесс двойного контакта с двойным поглощением (DCDA или двойной контакт с двойным поглощением) привел к улучшению процесса контакта для производства серной кислоты.
В 1960 году Байер подал заявку на патент для так называемого процесса двойного катализа. Первый завод, который использовал этот процесс, был запущен в 1964 году.
Газы возвращаются обратно через конечную абсорбционную колонну, получая не только высокую эффективность преобразования SO2 так3 (около 99,8%), но также позволяет получать более высокую концентрацию серной кислоты.
Существенная разница между этим процессом и обычным процессом контакта заключается в количестве стадий поглощения..
Начиная с 1970-х годов, основные промышленные страны ввели более строгие правила защиты окружающей среды, и процесс двойного поглощения был распространен на новых заводах. Тем не менее, традиционный контактный процесс продолжает использоваться во многих развивающихся странах с менее требовательными экологическими стандартами..
Наибольший импульс для нынешнего развития контактного процесса направлен на увеличение извлечения и использования большого количества энергии, производимой в процессе.
На самом деле, большой современный сернокислотный завод можно рассматривать не только как химический завод, но и как теплоэлектростанцию..
Сырье, используемое при производстве серной кислоты
пирит
Пирит был доминирующим сырьем в производстве серной кислоты до середины 20-го века, когда большие количества элементарной серы начали извлекаться из процесса переработки нефти и очистки природного газа, становясь основным материалом. отраслевая премия.
Диоксид серы
В настоящее время диоксид серы получают различными способами из нескольких видов сырья..
В Соединенных Штатах, промышленность была основана с начала двадцатого века в получении элементарной серы из подземных месторождений по «процессу Фраш».
Умеренно концентрированная серная кислота также получается путем повторного концентрирования и очистки большого количества серной кислоты, получаемой в качестве побочного продукта других промышленных процессов..
переработаны
Переработка этой кислоты становится все более важной с точки зрения окружающей среды, особенно в основных развитых странах..
Производство серной кислоты на основе элементарной серы и пирита, конечно, относительно чувствительно к рыночным условиям, поскольку кислота, полученная из этих материалов, представляет собой первичный продукт.
С другой стороны, когда серная кислота является побочным продуктом, произведенным в качестве средства устранения отходов другого процесса, уровень ее производства определяется не условиями на рынке серной кислоты, а условиями рынка для основной продукт.
Клинические эффекты
-Серная кислота используется в промышленности и в некоторых бытовых чистящих средствах, таких как чистящие средства для ванных комнат. Это также используется в батареях.
-Умышленное проглатывание, особенно продуктов с высокой концентрацией, может привести к серьезным травмам и смерти. Эти воздействия при приеме внутрь редки в Соединенных Штатах, но распространены в других частях мира.
-Это сильная кислота, которая вызывает повреждение тканей и коагуляцию белка. Он вызывает коррозию кожи, глаз, носа, слизистых оболочек, дыхательных путей и желудочно-кишечного тракта, а также любых тканей, с которыми он вступает в контакт.
-Тяжесть травмы определяется концентрацией и продолжительностью контакта.
-Легкое воздействие (концентрация менее 10%) вызывает только раздражение кожи, верхних дыхательных путей и слизистой оболочки желудочно-кишечного тракта..
-Проглатывание серной кислоты может привести к немедленной боли в эпигастральной области, тошнота, слюнотечение и рвота, мукоидного или геморрагический материальный аспект «молотого кофе». Изредка наблюдается рвота свежей кровью.
-Прием внутрь концентрированной серной кислоты может вызвать коррозию пищевода, некроз и перфорацию пищевода или желудка, особенно в привратнике желудка. Изредка наблюдается повреждение тонкой кишки. Более поздние осложнения могут включать стеноз и образование свища. Метаболический ацидоз может развиться после приема пищи.
-Серьезные ожоги кожи могут возникать при некрозе и рубцах. Они могут быть смертельными, если затронут достаточно большой участок поверхности тела.
-Глаз особенно чувствителен к коррозии. Раздражение, слезотечение и конъюнктивит могут развиваться даже при низких концентрациях серной кислоты. Брызги с серной кислотой в высоких концентрациях вызывают: ожоги роговицы, потерю зрения и иногда перфорацию баллона.
-Хроническое воздействие может быть связано с изменениями в функции легких, хронический бронхит, конъюнктивит, эмфизема, частые инфекции дыхательных путей, гастрит, эрозии зубной эмали, и, возможно, рака дыхательных путей.
Безопасность и риски
Заявления об опасности Глобально согласованной системы классификации и маркировки химических веществ (SGA)
Согласованная на глобальном уровне система классификации и маркировки химических веществ (SGA) представляет собой согласованную на международном уровне систему, созданную Организацией Объединенных Наций и призванную заменить различные стандарты классификации и маркировки, используемые в разных странах, путем использования согласованных глобальных критериев (Организация Объединенных Наций). United, 2015).
Классы опасности (и его соответствующая глава СГС) стандартов классификации и маркировки, а также рекомендации в отношении серной кислоты являются следующие (European Chemicals Agency, 2017 год; Организация Объединенных Наций, 2015 год; PubChem, 2017):
Классы опасности СГС
Коды пруденциальных советов
Р260, Р264, Р270, Р271, Р273, Р280, Р284, Р301 + Р330 + Р331, Р303 + P361 + P353, P304 + P340, P305 + P351 + P338, P307 + Р311, Р310, P312, P314, P320, P321, P363, P403 + P233, P405 и P501 (PubChem, 2017).
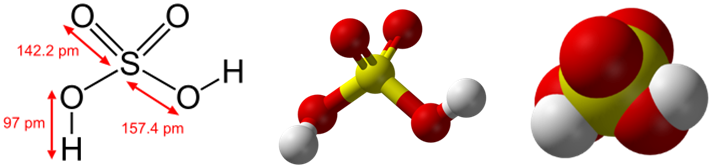
Формула серной кислоты
Химическая и структурная формула серной кислоты
Химическая формула: H2SO4
Молекулярная масса: 98,078г/моль.
Физические свойства серной кислоты
При обычных условиях – тяжёлая маслянистая жидкость без цвета и запаха (может иметь желтоватый оттенок), с кислым «медным» вкусом. Температура кристаллизации чистой серной кислоты +10°С.
Неограниченно смешивается с водой с выделением большого количества тепла, поэтому во избежание «вскипания» раствора всегда следует добавлять серную кислоту в воду, а не наоборот.
Раствор SO3 в серной кислоте называется олеум. Олеум содержит пиросерные кислоты, образующиеся по реакциям:
Химические свойства серной кислоты
Разбавленная серная кислота проявляет типичные свойства кислот:
Концентрированная серная активно поглощает пары воды, способна вытеснять воду из органических соединений, с образованием углерода, воды и выделением тепла (обугливание сахара):
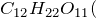
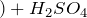
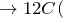
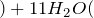
Концентрированная серная кислота – очень сильный окислитель:
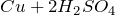
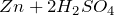
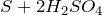
Качественная реакция на сульфат-ион – взаимодействие с растворимыми солями бария, с образованием нерастворимого в воде и кислотах белого осадка сульфата бария:
Концентрированная серная кислота – очень едкое вещество. При попадании на живые ткани дегидрирует углеводороды, выделяя избыточное тепло, что приводит к вторичному термическому ожогу, дополнительно к химическому ожогу. Поэтому повреждения, вызываемые серной кислотой, потенциально более опасны, чем повреждения, вызванные другими кислотами.
Примеры решения задач
| Задание | Рассчитать, сколько мл 96%-ного раствора серной кислоты с плотностью 1,8355 г/см  необходимо взять для приготовления одного литра 30%-ного раствора (плотность 1,219 г/см необходимо взять для приготовления одного литра 30%-ного раствора (плотность 1,219 г/см )? )? |
| Решение | Масса серной кислоты в 1 л 30%-ного раствора равна: |
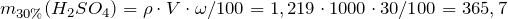
Масса серной кислоты в 1 мл 96%-ного раствора равна:
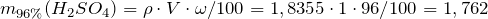
Объем 96%-ного раствора серной кислоты будет равен:
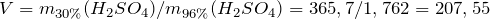
| Задание | К 3 л воды прибавили 2 мл 96% серной кислоты, плотность которой равна 1,84 г/мл. Вычислить pH полученного раствора. |
| Решение | Серная кислота – сильная кислота, в растворе полностью диссоциирует на ионы: |
Рассчитаем массу раствора серной кислоты:
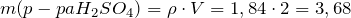
Рассчитаем массу серной кислоты в растворе:
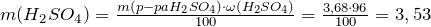
Молярная масса серной кислоты равна 98 г/моль.
Найдем количество вещества серной кислоты в растворе:
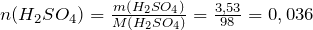
Суммарный объем раствора будет равен:
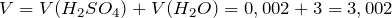
Рассчитаем молярную концентрацию серной кислоты:

Из уравнения реакции диссоциации серной кислоты следует, что концентрация ионов водорода равна: