Что показывает массовое число атома
Массовое число: что это такое и как получить (с примерами)
Содержание:
Примеры массовых чисел
Вот несколько примеров массовых чисел для хорошо известных элементов:
Водород
Самый стабильный и многочисленный атом водорода также самый простой: 1 протон и один электрон. Поскольку ядро водорода не имеет нейтронов, верно, что A = Z = 1.
Кислород
В ядре кислорода 8 нейтронов и 8 протонов, поэтому A = 16.
Углерод
Жизнь на Земле основана на химии углерода, легкого атома с 6 протонами в ядре плюс 6 нейтронов, поэтому A = 6 + 6 = 12.
Уран
Этот элемент, намного тяжелее предыдущих, хорошо известен своими радиоактивными свойствами. В ядре урана 92 протона и 146 нейтронов. Тогда его массовое число A = 92 + 146 = 238.
Как получить массовое число?
Посмотрим: все перечисленные элементы легкие, кроме урана. Атом водорода, как мы уже сказали, самый простой. В нем нет нейтронов, по крайней мере, в его наиболее распространенной версии, а в кислороде и углероде есть равное количество протонов и нейтронов.
То же самое происходит и с другими легкими элементами, такими как азот, еще один очень важный для жизни газ, который имеет 7 протонов и 7 нейтронов. Однако по мере того, как ядро становится более сложным, а атомы становятся тяжелее, количество нейтронов увеличивается с другой скоростью.
В отличие от легких элементов, уран с 92 протонами имеет примерно в 1 ½ раза больше нейтронов: 1 ½ x 92 = 1,5 x 92 = 138.
Все это становится очевидным на кривой на рисунке 2. Это график зависимости N от Z, известный каккривая ядерной устойчивости. Там вы можете увидеть, как легкие атомы имеют такое же количество протонов, что и нейтроны, и как с Z = 20 количество нейтронов увеличивается.
Таким образом, большой атом становится более стабильным, так как избыток нейтронов уменьшает электростатическое отталкивание между протонами.
Обозначения для атомов
Очень полезная запись, которая быстро описывает тип атома, следующая: символ элемента и соответствующие атомные и массовые числа записываются, как показано ниже на этой диаграмме:
В этих обозначениях атомы в предыдущих примерах будут:
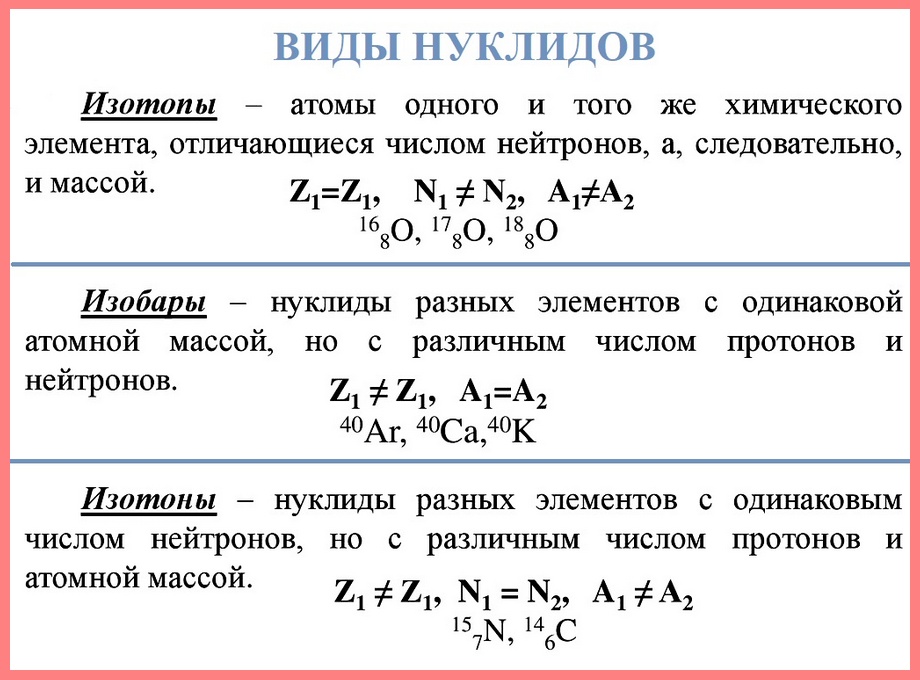
Изотопы
Число протонов в ядре определяет природу элемента. Например, каждый атом, ядро которого содержит 29 протонов, является атомом меди, несмотря ни на что.
Предположим, атом меди по какой-то причине теряет электрон, это все равно медь. Однако теперь это ионизированный атом.
Атомному ядру сложнее получить или потерять протон, но в природе это может происходить. Например, внутри звезд более тяжелые элементы непрерывно образуются из легких элементов, поскольку звездное ядро ведет себя как термоядерный реактор.
И прямо здесь, на Земле, есть феномен радиоактивный распад, в котором некоторые нестабильные атомы изгоняют нуклоны и излучают энергию, превращаясь в другие элементы.
Наконец, существует вероятность того, что атом определенного элемента имеет другое массовое число, в данном случае это изотоп.
Углерод-14 менее распространен, чем углерод-12, стабильный изотоп, а также радиоактивен. Это означает, что со временем он распадается, выделяя энергию и частицы, пока не станет стабильным элементом, которым в его случае является азот.
Изотопы углерода
Углерод существует в природе как смесь нескольких изотопов, наиболее распространенными из которых являются уже упомянутые 12 6С или углерод-12. А кроме углерода-14 есть 13 6C с дополнительным нейтроном.
Это обычное явление в природе, например, известно 10 стабильных изотопов олова. С другой стороны, из бериллия и натрия известен только один изотоп.
Каждый изотоп, природный или искусственный, имеет разную скорость превращения. Таким же образом можно создавать искусственные изотопы в лаборатории, которые, как правило, нестабильны и радиоактивно распадаются за очень короткий период долей секунды, в то время как для других требуется гораздо больше времени, равное возрасту Земли или больше.
Таблица природных изотопов углерода
| Изотопы углерода | Атомный номер Z | Массовое число A | Изобилие% |
|---|---|---|---|
| 12 6 C | 6 | 12 | 98.89 |
| 13 6 C | 6 | 13 | 1.11 |
| 14 6 C | 6 | 14 | Следы |
Примеры работы
— Пример 1
В чем разница между 13 7 N и 14 7 N?
Ответить
— Пример 2
Сколько нейтронов находится в ядре атома ртути, обозначаемого как 201 80 Hg?
Ответить
Поскольку A = 201 и Z = 80, а также зная, что:
И делается вывод, что в атоме ртути 121 нейтрон.
Ссылки
Домашний скот Новой Испании: характеристика и животные
Похоронные ритуалы в каменном веке: какими они были и что нам показывают
Что такое массовое число атомного ядра
Что такое массовое число атомного ядра? Массовое число численно равно сумме нейтронов и протонов ядра. Его обозначают буквой А. Понятие «массовое число» появилось в связи с тем, что масса ядра обусловлена числом ядерных частиц. Как связаны между собой масса ядра и количество частиц? Давайте выяснять.
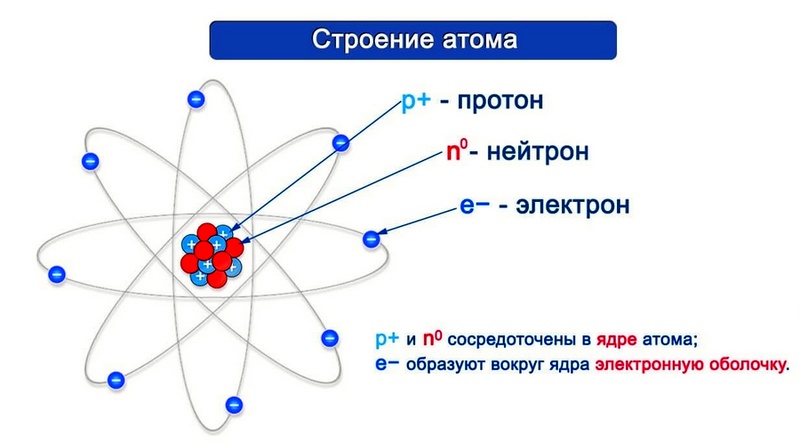
Строение атома
Строение ядра

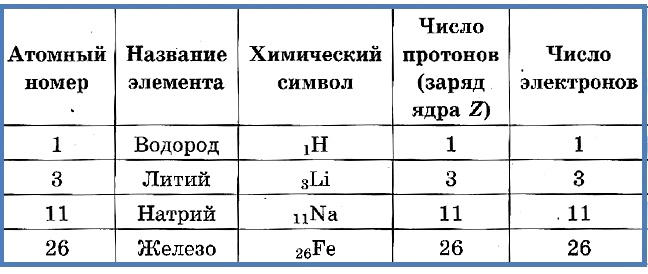
Ядро состоит из двух видов частиц – протонов и нейтронов. Протоны заряжены положительно, нейтроны не имеют заряда. Таким образом, заряд ядру дают протоны. Заряд каждого протона принят за +1. То есть, сколько протонов содержится в ядре, такой и будет заряд всего ядра. К примеру, в ядре углерода 6 протонов, заряд ядра +6.
В периодической системе элементов Менделеева все элементы расположены в порядке увеличения именно заряда ядра. У водорода заряд ядра +1, он расположен первым; у гелия +2, он второй в таблице; у лития +3, он третий и так далее. То есть заряд ядра соответствует порядковому (атомному) номеру элемента в таблице.
В целом любой атом электронейтрален. Это значит, что количество электронов равно заряду ядра, то есть количеству протонов. А поскольку количество протонов определяет атомный номер элемента, то зная этот атомный номер, мы, таким образом, знаем и количество электронов, и количество протонов, и заряд ядра.
Масса атома
Когда нужно знать массовое число?
Зная массовое число (A) и атомный номер элемента в периодической системе (Z), можно определить число нейтронов. Для этого нужно вычесть из массового числа протоны.
Зная массовое число, можно вычислить массу ядра или всего атома. Поскольку масса ядра обусловлена массой частиц, входящих в его состав, то она равна произведению количества этих частиц и массы этих частиц, то есть произведению массы нейтрона и массового числа. Масса нейтрона равна массе протона, в целом их обозначают как масса нуклона (ядерная частица).
К примеру, рассчитаем массу атома алюминия. Как видно из периодической системы элементов Менделеева, относительная атомная масса алюминия равна 26,992. Округлив, получаем массовое число ядра алюминия 27. То есть его ядро состоит из 27 частиц. Масса одной частицы – постоянная величина, равная 1,67 ∙ 10-24 г. Тогда, масса ядра алюминия равна: 27 ∙ 1,67 ∙ 10-24 г = 4,5 ∙ 10-23 г.
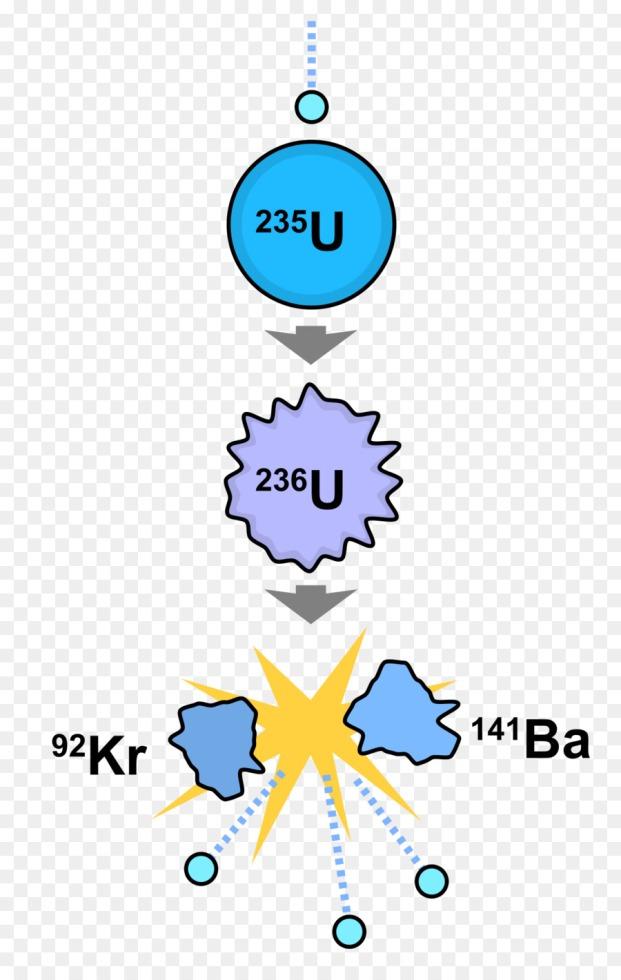
Что такое массовое число ядер элементов нужно знать при составлении реакций радиоактивного распада или ядерных реакций. Например, при делении ядра урана 235U, захватившего один нейтрон 1n, образуются ядра бария 141Ba и криптона 92Kr, а также три свободных нейтрона 1n. При составлении таких реакций пользуются правилом: сумма массовых чисел в правой и левой частях уравнения не меняется. 235+1 = 92+141+3.
Что показывает массовое число атома
Ключевые слова конспекта: строение атома, элементарные частицы, протоны и электроны в атомах, атомный номер, массовой число, число нейтронов, нуклид, изотопы, ионы, катионы, заряд иона.
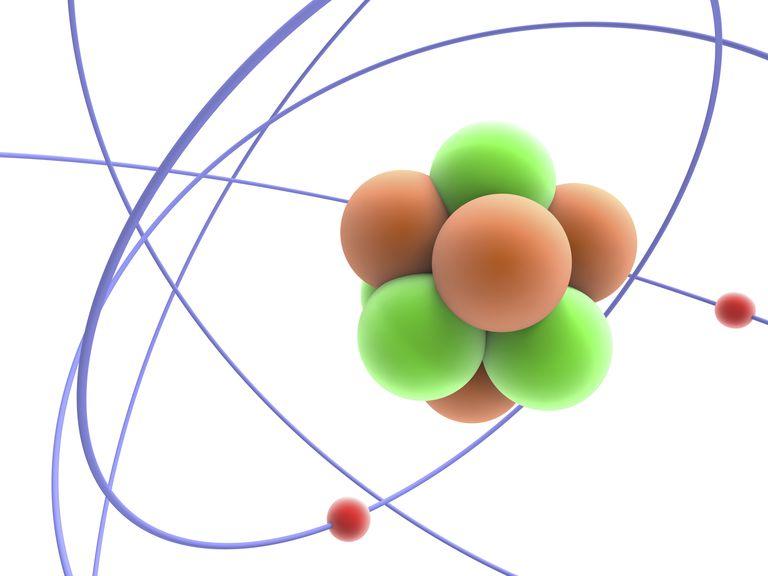
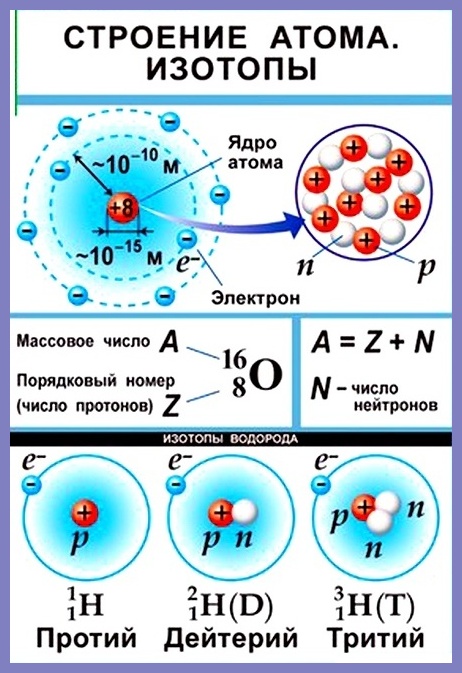
Согласно модели Резерфорда каждый атом состоит из находящегося в его центре ядра и электронной оболочки. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре. Электроны движутся вокруг ядра. Число электронов атома равно положительному заряду ядра.
Элементарные частицы — это протоны, электроны и нейтроны, из них состоят все атомы.
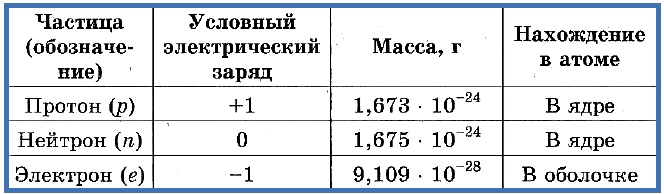
Таблица 1. «Элементарные частицы атома»
Число протонов разное у атомов различных видов, оно определяет заряд ядра атома и равно атомному номеру элемента в таблице Менделеева. Поскольку атом — электро-нейтральная частица, число электронов в нем равно числу протонов.
Таблица 2. «Протоны и электроны в атомах»
Атомный номер указывают слева внизу от символа элемента, например: 1Н, 26Fe. Обозначение атомного номера — прописная латинская буква Z.
Массовое число атома А — это сумма чисел его протонов и нейтронов в ядре. Массовое число указывают слева вверху от символа элемента или добавляют к названию элемента через дефис, например: 23 Na или натрий-23.
Массовое число кислорода, А( 16 О) = 16 = (8р + 8n).
Число нейтронов N в ядре атома определяют по формуле: N = A — Z. Например, для атома натрия с массовым числом 23, 23 Na: А = 23, Z = 11, N = А – Z = 23 — 11 = 12.
Нуклид — это вид атомов с определенным числом протонов и нейтронов в ядре. Например, в природе встречается три вида нуклидов кислорода: 16 О, 17 О и 18 О.
Изотопы — это атомы одного вида с одинаковым числом протонов, но разным числом нейтронов. Так, атомы 16 О, 17 О и 18 О — это изотопы. Природные изотопы урана — 234 U, 235 U и 238 U.
Таблица 3. «Обозначение и название ионов»
Конспект урока по химии «Строение атома».
Урок «Массовое число атома. Изотопы. Понятие о радиоактивности»
Урок 7. Массовое число атома. Изотопы. Понятие о радиоактивности
Цель: формирование представления о массовом числе атома; дать понятие об изотопах, явлении радиоактивности.
ü повторить, обобщить и систематизировать знания о строении атома;
ü формировать понятия «массовое число», «изотопы» на основании решений проблемных ситуаций;
ü продолжить формирование понятия «химический элемент»;
ü дать представление о природе радиоактивности;
ü формировать экологическую культуру подростков, обращая внимание на опасности, связанные с использованием радиоактивности.
Тип: усвоение новых знаний.
Учебно-методическое обеспечение: учебное пособие; рабочая тетрадь; сборник задач; периодическая система химических элементов Д. И. Менделеева.
1. Организационный момент
Учитель приветствует учащихся, создает благоприятную обстановку на уроке.
2. Проверка домашнего задания
Проводится графический диктант.
Ответьте: «да» — «_», «нет» — «–».
1) Атом имеет положительный заряд.
2) Атомный номер элемента равен заряду ядра атома.
3) Электрон имеет отрицательный заряд.
4) В состав атомных ядер входят протоны и электроны.
5) Все атомы одного элемента одинаковы по элементарному составу.
6) Электроны располагаются вокруг ядра слоями.
7) Атом — химически неделимая частица.
8) Электроны практически не влияют на массу атома.
9) Число нейтронов всегда равно числу протонов.
10) Химический элемент — это вид атомов с определенной массой.
11) Протоны — положительно заряженные частицы.
12) Самой важной характеристикой химического элемента является заряд ядра его атома.
13) Нуклоны — это разновидности одного химического элемента, они отличаются массой.
14) Элементы, стоящие в периодической системе друг за другом, отличаются зарядом ядра на 1.
15) Число нейтронов всегда совпадают с числом протонов.
16) Протоны и нейтроны можно назвать нуклидами.
17) В атоме электронов всегда больше, чем протонов.
18) Все химические элементы в периодической системе отличаются от предыдущих на 1 протон.
— А. М. Бутлеров писал: «Атомы не неделимы по своей природе, а неделимы только доступными нам ныне средствами. » Как вы понимаете это высказывание?
4. Актуализация знаний и умений учащихся
Проводится фронтальная беседа.
Когда и где впервые упоминалось понятие «атом»? Что оно означало?
Кто предложил планетарную модель строения атома? Опишите атом с точки зрения планетарной модели.
Из каких частиц состоит атомное ядро?
Перечислите физические характеристики протона.
Перечислите физические характеристики нейтрона.
Перечислите физические характеристики электрона.
Как определить число протонов, нейтронов и электронов в атоме?
5. Изучение нового материала и первичный контроль
1. Учитель объясняет новый материал.
— Сумма чисел протонов и нейтронов в ядре — это массовое число атома А. Массовое число практически определяет массу ядра, а следовательно, и массу всего атома, так как масса электронов составляет ничтожную часть общей массы атома. То есть массовое число приблизительно равно относительной атомной массе элемента.
2) Явление радиоактивности.
— В конце ХІХ — начале ХХ века начался новый этап развития периодического закона. Еще при жизни Менделеева были сделаны такие открытия, которые резко изменили взгляды ученых на атомы. В 1896 году открыто явление радиоактивности, при котором атомы урана, радия и других тяжелых металлов могли самопроизвольно распадаться. При этом выделялась энергия, происходило преобразование атомов одного элемента в другой. Д. И. Менделеев не согласился с выводами ученых, которые наблюдали явление радиоактивности. Он ошибочно полагал, что наличие изменчивости атома может нарушить периодическую систему. Позже ученые обнаружили в продуктах радиоактивного распада элементы, которые были похожи по своим свойствам на уже известные элементы, одна-ко имели другую атомную массу. Ученые не находили для них места в периодической системе. Как связать это явление с периодической системой, никто не знал. Не знал и сам Менделеев. Он ушел из жизни в 1907 году, когда нарушились старые представления о строении вещества, а новые еще не сложились. Но Менделеев с твердой уверенностью написал в своем дневнике: «Будущее не угрожает периодическому закону разрушением, а только надстройку и развитие обещает». Как же все объяснилось? Оказалось, что некоторые атомы самопроизвольно распадаются. Радиоактивность — самопроизвольное преобразование неустойчивых атомных ядер в другие ядра, сопровождающееся излучением различных частиц.
— Позже ученые обнаружили, что существуют одинаковые атомы с различной массой. Их назвали изотопами. В 1911 году Э. Резерфорд открыл в атоме положительно заряженное ядро и поручил своему ученику Г. Мозли исследовать величину заряда ядра. В 1913 году Мозли исследовал элемент за элементом и сделал важное открытие: заряд ядра элемента соответствует его порядковому номеру в таблице Д. И. Менделеева. Он удивился гениальной интуиции Д. И. Менделеева и поменял местами Ar и K, Ni и Со, Те и І. Заряды ядер этих элементов равны их порядковым номерам, а атомные массы отличаются. После открытия Мозли сразу стало понятно, что масса ядра равна массе всего атома и порядковый номер элемента в периодической системе равен заряду ядра его атома.
Изотопы — атомы одного элемента, имеющие одинаковое число протонов в ядре, но разные массовые числа. Часто изотопы данного атома называют нуклидами: кислород-17 или 17О, фтор-19 или 19F. Те изотопы, атомы которых способны к радиоактивному распаду, называют радионуклидами.
4) Определение химического элемента.
— Из сказанного выше можно сделать вывод о том, что заряд ядра является главной характеристикой, которая определяет его положение в периодической системе, а значит, все свойства этого элемента и его соединений. Поэтому современная формулировка периодического закона звучит следующим образом: свойства атомов химических элементов, а также состав и свойства веществ, которые образуются ими, находятся в периодической зависимости от зарядов атомных ядер.
Современное определение химического элемента звучит так: химический элемент — вид атомов с одинаковым положительным зарядом ядра.
2. Учащиеся выполняют тест (с. 83—84) из рабочей тетради.
7. Обобщение и систематизация изученного
Учащиеся выполняют задания 185—189 из сборника задач.
8. Информация о домашнем задании
§ 30; § 31, задания 2, 3, 6.
9. Подведение итогов
Учащимся предлагается составить синквейн термина «изотоп».
Масса атома
Массовое число. Массовое число-это суммарное число протонов и нейтронов в ядре атома. Оно обозначается символом А.
Говоря о конкретном атомном ядре, обычно употребляют термин нуклид, а ядерные частицы протоны и нейтроны-в совокупности называют нуклонами.
Атомный номер. Атомный номер элемента совпадает с числом протонов в ядре его атома. Он обозначается символом Z. Атомный номер связан с массовым числом следующим соотношением:
где N-число нейтронов в ядре атома.
Каждый химический элемент характеризуется определенным атомным номером. Другими словами, никакие два элемента не могут иметь одинаковый атомный номер. Атомный номер равен не только числу протонов в ядре атомов данного элемента, но также равен числу электронов, окружающих ядро атома. Это объясняется тем, что атом в целом представляет собой электрически нейтральную частицу. Таким образом, число протонов в ядре атома равно числу электронов, окружающих ядро. Это утверждение не относится к ионам, которые, разумеется, представляют собой заряженные частицы.
Первое экспериментальное обоснование атомных номеров элементов* получил в 1913 г. Генри Мозли, работавший в Оксфорде. Он бомбардировал твердые металлические мишени катодными лучами. (В 1909 г. Баркла и Кайи уже показали, что любой твердый элемент при бомбардировке быстрым пучком катодных лучей испускает рентгеновские лучи, характеристические для данного элемента.) Мозли анализировал характеристическое рентгеновское излучение, пользуясь фотографической методикой регистрации. Он обнаружил, что длина волны характеристического рентгеновского излучения увеличивается с возрастанием атомного веса (массы) металла и показал, что квадратный корень из частоты этого рентгеновского излучения прямо пропорционален некоторому целому числу, которое он обозначил символом Z.
Мозли установил, что это число приблизительно совпадает с половиной значения атомной массы. Он пришел к выводу, что это число-атомный номер элемента-является фундаментальным свойством его атомов. Оно оказалось равно числу протонов в атоме данного элемента. Таким образом, Мозли связал частоту характеристического рентгеновского излучения с порядковым номером излучающего элемента (закон Мозли). Этот закон имел большое значение для утверждения периодического закона химических элементов и установления физического смысла атомного номера элементов.
Исследование Мозли позволило ему предсказать существование трех недоста-вавших к тому времени в периодической таблице элементов с атомными номерами 43, 61 и 75. Эти элементы были обнаружены позже и получили названия технеций, прометий и рений соответственно.
Символы нуклидов. Массовое число нуклида принято указывать в виде верхнего индекса, а атомный номер-в виде нижнего индекса слева от символа элемента. Например, запись 1IC означает, что этот нуклид углерода (как и все другие нуклиды углерода) имеет атомный номер 6. Данный конкретный нуклид имеет массовое число 12. Другому нуклиду углерода отвечает символ 14C Поскольку все нуклиды углерода имеют атомный номер 6, указанный нуклид часто записывают просто как 14C или углерод-14.
Изотопы. Изотопами называются различные по свойствам атомные разновидности одного элемента. Они различаются числом нейтронов в их ядре. Таким образом, изотопы одного элемента имеют одинаковый атомный номер, но разные массовые числа. В табл. 1.1 приведены значения массового числа А, атомного номера Z и числа нейтронов N в ядре атомов каждого из трех изотопов углерода.