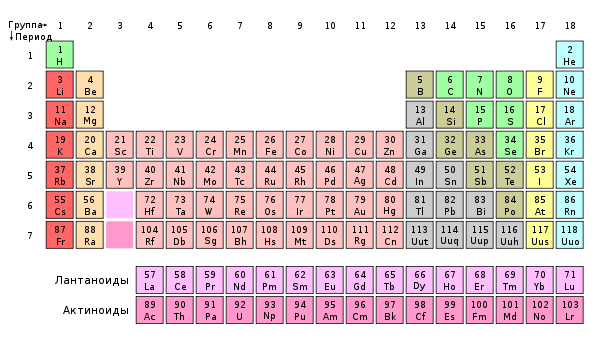
Что показывает номер группы химия
Группа периодической системы
Номер группы определяется количеством электронов на внешней оболочке атома (валентных электронов) и, как правило, соответствует высшей валентности атома.
В короткопериодном варианте периодической системы группы подразделяются на подгруппы — главные (или подгруппы A), начинающиеся с элементов первого и второго периодов, и побочные (подгруппы В), содержащие d-элементы. Подгруппы также имеют названия по элементу с наименьшим зарядом ядра (как правило, по элементу второго периода для главных подгрупп и элементу четвёртого периода для побочных подгрупп). Элементы одной подгруппы обладают сходными химическими свойствами.
С возрастанием заряда ядра у элементов одной группы из-за увеличения числа электронных оболочек увеличиваются атомные радиусы, вследствие чего происходит снижение электроотрицательности, усиление металлических и ослабление неметаллических свойств элементов, усиление восстановительных и ослабление окислительных свойств образуемых ими веществ.
Несмотря на то, что в России и в большинстве стран мира признаётся, что Дмитрий Иванович Менделеев изобрел периодическую таблицу, еще до «холодной войны» в США сформировалось мнение, что первооткрываетелем является Уильям Олдинг.
Нумерация групп
Несмотря на это, продолжают применяться ставшие традиционными системы нумерации с использованием римских цифр и латинских букв, отличающиеся для Америки и Европы.
Современная система нумерации содержит следующие группы (старые системы, Европейская и Американская, приведены в скобках):
Полезное
Смотреть что такое «Группа периодической системы» в других словарях:
Группа периодической таблицы — Группа периодической системы химических элементов последовательность атомов по возрастанию заряда ядра, обладающих однотипным электронным строением. Номер группы определяется количеством электронов на внешней оболочке атома (валентных электронов) … Википедия
Четвёртый период периодической системы — К четвёртому периоду периодической системы относятся элементы четвёртой строки (или четвёртого периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических)… … Википедия
Первый период периодической системы — К первому периоду периодической системы относятся элементы первой строки (или первого периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в… … Википедия
Второй период периодической системы — Ко второму периоду периодической системы относятся элементы второй строки (или второго периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в … Википедия
Пятый период периодической системы — К пятому периоду периодической системы относятся элементы пятой строки (или пятого периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в… … Википедия
Третий период периодической системы — К третьему периоду периодической системы относятся элементы третьей строки (или третьего периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов … Википедия
Седьмой период периодической системы — К седьмому периоду периодической системы относятся элементы седьмой строки (или седьмого периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов … Википедия
Шестой период периодической системы — К шестому периоду периодической системы относятся элементы шестой строки (или шестого периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в… … Википедия
Короткая форма периодической системы элементов — Короткая форма таблицы Менделеева основана на параллелизме степеней окисления элементов главных и побочных подгрупп: например, максимальная степень окисления ванадия равна +5, как у фосфора и мышьяка, максимальная степень окисления хрома равна +6 … Википедия
Группа — Сюда перенаправляется запрос «Группировка». На эту тему нужна отдельная статья … Википедия
Урок №58. Периодическая таблица химических элементов (короткая форма): А- и Б-группы, периоды
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Графическим изображением периодического закона является периодическая таблица. Короткая её форма содержит 7 периодов и 8 групп.
Короткая форма таблицы Д.И. Менделеева
Полудлинный вариант таблицы Д.И. Менделеева
Существует ещё и длинный вариант таблицы, он похож на полудлинный, но только лантаноиды и актиноиды не вынесены за пределы таблицы.
Оригинал таблицы Д. И. Менделеева
1. Период – химические элементы, расположенные в строчку (1 – 7)
Малые (1, 2, 3) – состоят из одного ряда элементов
Большие (4, 5, 6, 7) – состоят из двух рядов – чётного и нечётного
Периоды могут состоять из 2 (первый), 8 (второй и третий), 18 (четвертый и пятый) или 32 (шестой) элементов. Последний, седьмой период незавершен.
Все периоды (кроме первого) начинаются щелочным металлом, а заканчиваются благородным газом.
Во всех периодах с увеличением относительных атомных масс элементов наблюдается усиление неметаллических и ослабление металлических свойств. В больших периодах переход свойств от активного металла к благородному газу происходит более медленно (через 18 и 32 элемента), чем в малых периодах (через 8 элементов). Кроме того, в малых периодах слева направо валентность в соединениях с кислородом возрастает от 1 до 7 (например, от Na до Cl). В больших периодах вначале валентность возрастает от 1 до 8 (например, в пятом периоде от рубидия к рутению), затем происходит резкий скачок, и валентность уменьшается до 1 у серебра, потом снова возрастает.
Главные подгруппы состоят из элементов малых и больших периодов.
Побочные подгруппы состоят из элементов только больших периодов.
В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам.
Номер группы показывает высшую валентность элемента (кроме N, O, F).
Периодический закон
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.
Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.
Период, группа и электронная конфигурация
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Длина связи
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Основные и кислотные свойства
Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Восстановительные и окислительные свойства
Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.
Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.
С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Список химических элементов по атомным номерам
Это список химических элементов, упорядоченный в порядке возрастания атомных номеров. В таблице приводятся название элемента, символ, группа и период в Периодической системе, атомная масса (наиболее стабильного изотопа), плотность, температура плавления, температура кипения, год открытия, фамилия первооткрывателя. Цвета строк отвечают семействам элементов:
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
| № | Название | Символ | Период, группа | Масса (г/моль) | Плотность (г/см³) при 20 °С | Температура плавления (°C) | Температура кипения (°C) | Год открытия | Первооткрыватель |
|---|---|---|---|---|---|---|---|---|---|
| 1 | Водород | H | 1, 1 | 1,00794 (7) * * * | 0,084 г/л | -259,1 | -252,9 | 1766 | Кавендиш |
| 2 | Гелий | He | 1, 18 | 4,002602 (2) * * | 0,17 г/л | -272,2 (при 2,5 МПа) | -268,9 | 1895 | Рамзай и Клеве |
| 3 | Литий | Li | 2, 1 | 6,941 (2) * * * * | 0,53 | 180,5 | 1317 | 1817 | Арфведсон |
| 4 | Бериллий | Be | 2, 2 | 9,012182 (3) | 1,85 | 1278 | 2970 | 1797 | Воклен |
| 5 | Бор | B | 2, 13 | 10,811 (7) * * * | 2,46 | 2300 | 2550 | 1808 | Дэви и Гей-Люссак |
| 6 | Углерод | C | 2, 14 | 12,0107 (8) * * | 3,51 | 3550 | 4827 | доисторический период | неизвестен |
| 7 | Азот | N | 2, 15 | 14,0067 (2) * * | 1,17 g/l | -209,9 | -195,8 | 1772 | Резерфорд |
| 8 | Кислород | O | 2, 16 | 15,9994 (3) * * | 1,33 г/л | -218,4 | -182,9 | 1774 | Пристли и Шееле |
| 9 | Фтор | F | 2, 17 | 18,9984032 (5) | 1,58 г/л | -219,6 | -188,1 | 1886 | Муассан |
| 10 | Неон | Ne | 2, 18 | 20,1797 (6) * * | 0,84 г/л | -248,7 | -246,1 | 1898 | Рамзай и Трэверс |
| 11 | Натрий | Na | 3, 1 | 22,98976928 (2) | 0,97 | 97,8 | 892 | 1807 | Дэви |
| 12 | Магний | Mg | 3, 2 | 24,3050 (6) | 1,74 | 648,8 | 1107 | 1755 | Блэк |
| 13 | Алюминий | Al | 3, 13 | 26,9815386 (8) | 2,70 | 660,5 | 2467 | 1825 | Эрстед |
| 14 | Кремний | Si | 3, 14 | 28,0855 (3) * | 2,33 | 1410 | 2355 | 1824 | Берцелиус |
| 15 | Фосфор | P | 3, 15 | 30,973762 (2) | 1,82 | 44 (P4) | 280 (P4) | 1669 | Бранд |
| 16 | Сера | S | 3, 16 | 32,065 (5) * * | 2,06 | 113 | 444,7 | доисторический период | неизвестен |
| 17 | Хлор | Cl | 3, 17 | 35,453 (2) * * * | 2,95 г/л | -101 | -34,6 | 1774 | Шееле |
| 18 | Аргон | Ar | 3, 18 | 39,948 (1) * * | 1,66 г/л | -189,4 | -185,9 | 1894 | Рамзай и Рэлей |
| 19 | Калий | K | 4, 1 | 39,0983 (1) | 0,86 | 63,7 | 774 | 1807 | Дэви |
| 20 | Кальций | Ca | 4, 2 | 40,078 (4) * | 1,54 | 839 | 1487 | 1808 | Дэви |
| 21 | Скандий | Sc | 4, 3 | 44,955912 (6) | 2,99 | 1539 | 2832 | 1879 | Нильсон |
| 22 | Титан | Ti | 4, 4 | 47,867 (1) | 4,51 | 1660 | 3260 | 1791 | Грегор и Клапрот |
| 23 | Ванадий | V | 4, 5 | 50,9415 (1) | 6,09 | 1890 | 3380 | 1801 | дель Рио |
| 24 | Хром | Cr | 4, 6 | 51,9961 (6) | 7,14 | 1857 | 2482 | 1797 | Воклен |
| 25 | Марганец | Mn | 4, 7 | 54,938045 (5) | 7,44 | 1244 | 2097 | 1774 | Ган |
| 26 | Железо | Fe | 4, 8 | 55,845 (2) | 7,87 | 1535 | 2750 | доисторический период | неизвестен |
| 27 | Кобальт | Co | 4, 9 | 58,933195 (5) | 8,89 | 1495 | 2870 | 1735 | Брандт |
| 28 | Никель | Ni | 4, 10 | 58,6934 (2) | 8,91 | 1453 | 2732 | 1751 | Кронштедт |
| 29 | Медь | Cu | 4, 11 | 63,546 (3) * | 8,92 | 1083,5 | 2595 | доисторический период | неизвестен |
| 30 | Цинк | Zn | 4, 12 | 65,409 (4) | 7,14 | 419,6 | 907 | доисторический период | неизвестен |
| 31 | Галлий | Ga | 4, 13 | 69,723 (1) | 5,91 | 29,8 | 2403 | 1875 | де Буабодран |
| 32 | Германий | Ge | 4, 14 | 72,64 (1) | 5,32 | 937,4 | 2830 | 1886 | Винклер |
| 33 | Мышьяк | As | 4, 15 | 74,92160 (2) | 5,72 | 613 | 613 (subl.) | ca. 1250 | Альберт Великий |
| 34 | Селен | Se | 4, 16 | 78,96 (3) * | 4,82 | 217 | 685 | 1817 | Берцелиус |
| 35 | Бром | Br | 4, 17 | 79,904 (1) | 3,14 | -7,3 | 58,8 | 1826 | Балар |
| 36 | Криптон | Kr | 4, 18 | 83,798 (2) * * | 3,48 г/л | -156,6 | -152,3 | 1898 | Рамзай и Трэверс |
| 37 | Рубидий | Rb | 5, 1 | 85,4678 (3) * | 1,53 | 39 | 688 | 1861 | Бунзен и Кирхгоф |
| 38 | Стронций | Sr | 5, 2 | 87,62 (1) * * | 2,63 | 769 | 1384 | 1790 | Кроуфорд |
| 39 | Иттрий | Y | 5, 3 | 88,90585 (2) | 4,47 | 1523 | 3337 | 1794 | Гадолин |
| 40 | Цирконий | Zr | 5, 4 | 91,224 (2) * | 6,51 | 1852 | 4377 | 1789 | Клапрот |
| 41 | Ниобий | Nb | 5, 5 | 92,906 38 (2) | 8,58 | 2468 | 4927 | 1801 | Хэтчетт |
| 42 | Молибден | Mo | 5, 6 | 95,94 (2) * | 10,28 | 2617 | 5560 | 1778 | Шееле |
| 43 | Технеций | Tc | 5, 7 | [98,9063] * | 11,49 | 2172 | 5030 | 1937 | Перрье и Сегре |
| 44 | Рутений | Ru | 5, 8 | 101,07 (2) * | 12,45 | 2310 | 3900 | 1844 | Клаус |
| 45 | Родий | Rh | 5, 9 | 102,90550 (2) | 12,41 | 1966 | 3727 | 1803 | Уолластон |
| 46 | Палладий | Pd | 5, 10 | 106,42 (1) * | 12,02 | 1552 | 3140 | 1803 | Уолластон |
| 47 | Серебро | Ag | 5, 11 | 107,8682 (2) * | 10,49 | 961,9 | 2212 | доисторический период | неизвестен |
| 48 | Кадмий | Cd | 5, 12 | 112,411 (8) * | 8,64 | 321 | 765 | 1817 | Штромейер |
| 49 | Индий | In | 5, 13 | 114,818 (3) | 7,31 | 156,2 | 2080 | 1863 | Райх и Рихтер |
| 50 | Олово | Sn | 5, 14 | 118,710 (7) * | 7,29 | 232 | 2270 | доисторический период | неизвестен |
| 51 | Сурьма | Sb | 5, 15 | 121,760 (1) * | 6,69 | 630,7 | 1750 | доисторический период | неизвестен |
| 52 | Теллур | Te | 5, 16 | 127,60 (3) * | 6,25 | 449,6 | 990 | 1782 | фон Райхенштайн |
| 53 | Иод | I | 5, 17 | 126,90447 (3) | 4,94 | 113,5 | 184,4 | 1811 | Куртуа |
| 54 | Ксенон | Xe | 5, 18 | 131,293 (6) * * | 4,49 г/л | -111,9 | -107 | 1898 | Рамзай и Трэверс |
| 55 | Цезий | Cs | 6, 1 | 132,9054519 (2) | 1,90 | 28,4 | 690 | 1860 | Бунзен и Кирхгоф |
| 56 | Барий | Ba | 6, 2 | 137,327 (7) | 3,65 | 725 | 1640 | 1808 | Дэви |
| 57 | Лантан | La | 6 | 138,90547 (7) * | 6,16 | 920 | 3454 | 1839 | Мосандер |
| 58 | Церий | Ce | 6 | 140,116 (1) * | 6,77 | 798 | 3257 | 1803 | фон Хисингер и Берцелиус |
| 59 | Празеодим | Pr | 6 | 140,90765 (2) | 6,48 | 931 | 3212 | 1895 | фон Вельсбах |
| 60 | Неодим | Nd | 6 | 144,242 (3) * | 7,00 | 1010 | 3127 | 1895 | фон Вельсбах |
| 61 | Прометий | Pm | 6 | [146,9151] * | 7,22 | 1080 | 2730 | 1945 | Маринский и Гленденин |
| 62 | Самарий | Sm | 6 | 150,36 (2) * | 7,54 | 1072 | 1778 | 1879 | де Буабодран |
| 63 | Европий | Eu | 6 | 151,964 (1) * | 5,25 | 822 | 1597 | 1901 | Демарсе |
| 64 | Гадолиний | Gd | 6 | 157,25 (3) * | 7,89 | 1311 | 3233 | 1880 | де Мариньяк |
| 65 | Тербий | Tb | 6 | 158,92535 (2) | 8,25 | 1360 | 3041 | 1843 | Мосандер |
| 66 | Диспрозий | Dy | 6 | 162,500 (1) * | 8,56 | 1409 | 2335 | 1886 | де Буабодран |
| 67 | Гольмий | Ho | 6 | 164,93032 (2) | 8,78 | 1470 | 2720 | 1878 | Соре |
| 68 | Эрбий | Er | 6 | 167,259 (3) * | 9,05 | 1522 | 2510 | 1842 | Мосандер |
| 69 | Тулий | Tm | 6 | 168,93421 (2) | 9,32 | 1545 | 1727 | 1879 | Клеве |
| 70 | Иттербий | Yb | 6 | 173,04 (3) * | 6,97 | 824 | 1193 | 1878 | де Мариньяк |
| 71 | Лютеций | Lu | 6, 3 | 174,967 (1) * | 9,84 | 1656 | 3315 | 1907 | Урбэн |
| 72 | Гафний | Hf | 6, 4 | 178,49 (2) | 13,31 | 2150 | 5400 | 1923 | Костер и де Хевеши |
| 73 | Тантал | Ta | 6, 5 | 180,9479 (1) | 16,68 | 2996 | 5425 | 1802 | Экеберг |
| 74 | Вольфрам | W | 6, 6 | 183,84 (1) | 19,26 | 3407 | 5927 | 1783 | Элюяр |
| 75 | Рений | Re | 6, 7 | 186,207 (1) | 21,03 | 3180 | 5627 | 1925 | Ноддак, Таке и Берг |
| 76 | Осмий | Os | 6, 8 | 190,23 (3) * | 22,61 | 3045 | 5027 | 1803 | Теннант |
| 77 | Иридий | Ir | 6, 9 | 192,217 (3) | 22,65 | 2410 | 4130 | 1803 | Теннант |
| 78 | Платина | Pt | 6, 10 | 195,084 (9) | 21,45 | 1772 | 3827 | 1557 | Скалигер |
| 79 | Золото | Au | 6, 11 | 196,966569 (4) | 19,32 | 1064,4 | 2940 | доисторический период | неизвестен |
| 80 | Ртуть | Hg | 6, 12 | 200,59 (2) | 13,55 | -38,9 | 356,6 | доисторический период | неизвестен |
| 81 | Таллий | Tl | 6, 13 | 204,3833 (2) | 11,85 | 303,6 | 1457 | 1861 | Крукс |
| 82 | Свинец | Pb | 6, 14 | 207,2 (1) * * | 11,34 | 327,5 | 1740 | доисторический период | неизвестен |
| 83 | Висмут | Bi | 6, 15 | 208,98040 (1) | 9,80 | 271,4 | 1560 | 1753 | Жоффруа |
| 84 | Полоний | Po | 6, 16 | [208,9824] * | 9,20 | 254 | 962 | 1898 | Мария и Пьер Кюри |
| 85 | Астат | At | 6, 17 | [209,9871] * | 302 | 337 | 1940 | Корсон, Маккензи и Сегре | |
| 86 | Радон | Rn | 6, 18 | [222,0176] * | 9,23 г/л | -71 | -61,8 | 1900 | Дорн |
| 87 | Франций | Fr | 7, 1 | [223,0197] * | 1,87 | 27 | 677 | 1939 | Перей |
| 88 | Радий | Ra | 7, 2 | [226,0254] * | 5,50 | 700 | 1140 | 1898 | Мария и Пьер Кюри |
| 89 | Актиний | Ac | 7 | [227,0278] * | 10,07 | 1047 | 3197 | 1899 | Дебьерн |
| 90 | Торий | Th | 7 | 232,03806 (2) * * | 11,72 | 1750 | 4787 | 1829 | Берцелиус |
| 91 | Протактиний | Pa | 7 | 231,03588 (2) * | 15,37 | 1554 | 4030 | 1917 | Содди, Кранстон и Ган |
| 92 | Уран | U | 7 | 238,02891 (3) * * * | 18,97 | 1132,4 | 3818 | 1789 | Клапрот |
| 93 | Нептуний | Np | 7 | [237,0482] * | 20,48 | 640 | 3902 | 1940 | Макмиллан и Абелсон |
| 94 | Плутоний | Pu | 7 | [244,0642] * | 19,74 | 641 | 3327 | 1940 | Сиборг |
| 95 | Америций | Am | 7 | [243,0614] * | 13,67 | 994 | 2607 | 1944 | Сиборг |
| 96 | Кюрий | Cm | 7 | [247,0703] * | 13,51 | 1340 | 1944 | Сиборг | |
| 97 | Берклий | Bk | 7 | [247,0703] * | 13,25 | 986 | 1949 | Сиборг | |
| 98 | Калифорний | Cf | 7 | [251,0796] * | 15,1 | 900 | 1950 | Сиборг | |
| 99 | Эйнштейний | Es | 7 | [252,0829] * | 860 | 1952 | Сиборг | ||
| 100 | Фермий | Fm | 7 | [257,0951] * | 1952 | Сиборг | |||
| 101 | Менделевий | Md | 7 | [258,0986] * | 1955 | Сиборг | |||
| 102 | Нобелий | No | 7 | [259,1009] * | 1958 | Сиборг | |||
| 103 | Лоуренсий | Lr | 7, 3 | [260,1053] * | 1961 | Гиорсо | |||
| 104 | Резерфордий | Rf | 7, 4 | [261,1087] * | 1964/69 | Флёров | |||
| 105 | Дубний | Db | 7, 5 | [262,1138] * | 1967/70 | Флёров | |||
| 106 | Сиборгий | Sg | 7, 6 | [263,1182] * | 1974 | Флёров | |||
| 107 | Борий | Bh | 7, 7 | [262,1229] * | 1976 | Оганесян | |||
| 108 | Хассий | Hs | 7, 8 | [265] * | 1984 | GSI (*) | |||
| 109 | Мейтнерий | Mt | 7, 9 | [266] * | 1982 | GSI | |||
| 110 | Дармштадтий | Ds | 7, 10 | [269] * | 1994 | GSI | |||
| 111 | Рентгений | Rg | 7, 11 | [272] * | 1994 | GSI | |||
| 112 | Унунбий | Uub | 7, 12 | [285] * | 1996 | GSI | |||
| 113 | Унунтрий | Uut | 7, 13 | [284] * | 2004 | ОИЯИ (*), LLNL (*) | |||
| 114 | Унунквадий | Uuq | 7, 14 | [289] * | 1999 | ОИЯИ | |||
| 115 | Унунпентий | Uup | 7, 15 | [288] * | 2004 | ОИЯИ, LLNL | |||
| 116 | Унунгексий | Uuh | 7, 16 | [292] * | 1999 | LBNL (*) | |||
| 117 | Унунсептий | Uus | 7, 17 | [295] * | ещё не получен | ещё не получен | |||
| 118 | Унуноктий | Uuo | 7, 18 | [294] * | 2004 | ОИЯИ |
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
Аббревиатуры
Примечания
Ссылки
Полезное
Смотреть что такое «Список химических элементов по атомным номерам» в других словарях:
Список химических элементов по символам — См. также: Список химических элементов по атомным номерам и Алфавитный список химических элементов Содержание 1 Символы, используемые в данный момент … Википедия
Алфавитный список химических элементов — См. также: Список химических элементов по атомным номерам и Список химических элементов по символам Алфавитный список химических элементов. Азот N Актиний Ac Алюминий Al Америций Am Аргон Ar Астат At … Википедия
Периодическая законность химических элементов — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
Периодическая таблица химических элементов — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
Периодическая система элементов — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
ПСХЭ — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
Переодичная система — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
Периодическая система — химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским… … Википедия
Периодическая система Менделеева — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
Периодическая таблица — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия