Что показывает подгруппа в таблице менделеева
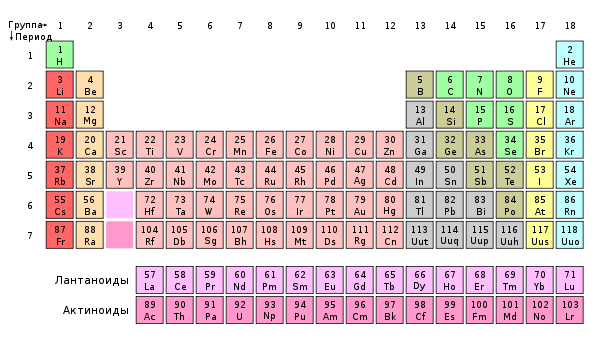
Группа периодической системы
Номер группы определяется количеством электронов на внешней оболочке атома (валентных электронов) и, как правило, соответствует высшей валентности атома.
В короткопериодном варианте периодической системы группы подразделяются на подгруппы — главные (или подгруппы A), начинающиеся с элементов первого и второго периодов, и побочные (подгруппы В), содержащие d-элементы. Подгруппы также имеют названия по элементу с наименьшим зарядом ядра (как правило, по элементу второго периода для главных подгрупп и элементу четвёртого периода для побочных подгрупп). Элементы одной подгруппы обладают сходными химическими свойствами.
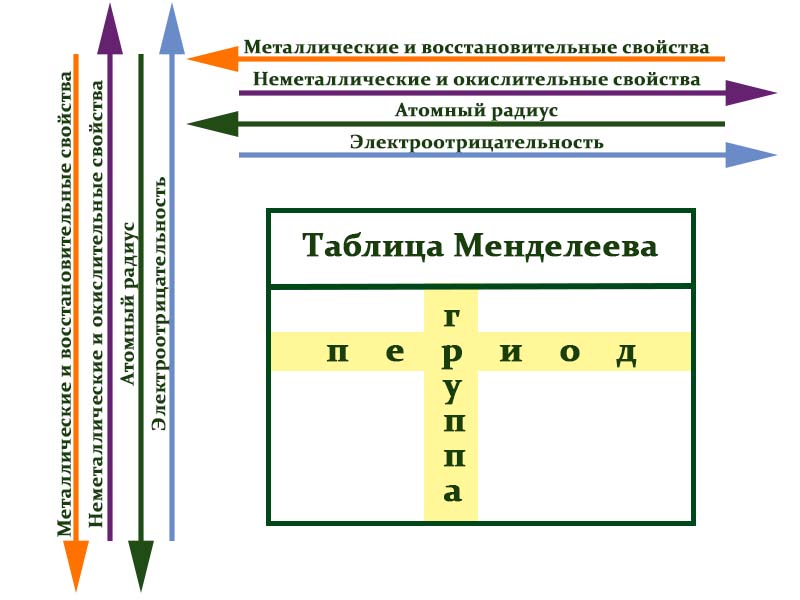
С возрастанием заряда ядра у элементов одной группы из-за увеличения числа электронных оболочек увеличиваются атомные радиусы, вследствие чего происходит снижение электроотрицательности, усиление металлических и ослабление неметаллических свойств элементов, усиление восстановительных и ослабление окислительных свойств образуемых ими веществ.
Несмотря на то, что в России и в большинстве стран мира признаётся, что Дмитрий Иванович Менделеев изобрел периодическую таблицу, еще до «холодной войны» в США сформировалось мнение, что первооткрываетелем является Уильям Олдинг.
Нумерация групп
Несмотря на это, продолжают применяться ставшие традиционными системы нумерации с использованием римских цифр и латинских букв, отличающиеся для Америки и Европы.
Современная система нумерации содержит следующие группы (старые системы, Европейская и Американская, приведены в скобках):
Полезное
Смотреть что такое «Группа периодической системы» в других словарях:
Группа периодической таблицы — Группа периодической системы химических элементов последовательность атомов по возрастанию заряда ядра, обладающих однотипным электронным строением. Номер группы определяется количеством электронов на внешней оболочке атома (валентных электронов) … Википедия
Четвёртый период периодической системы — К четвёртому периоду периодической системы относятся элементы четвёртой строки (или четвёртого периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических)… … Википедия
Первый период периодической системы — К первому периоду периодической системы относятся элементы первой строки (или первого периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в… … Википедия
Второй период периодической системы — Ко второму периоду периодической системы относятся элементы второй строки (или второго периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в … Википедия
Пятый период периодической системы — К пятому периоду периодической системы относятся элементы пятой строки (или пятого периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в… … Википедия
Третий период периодической системы — К третьему периоду периодической системы относятся элементы третьей строки (или третьего периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов … Википедия
Седьмой период периодической системы — К седьмому периоду периодической системы относятся элементы седьмой строки (или седьмого периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов … Википедия
Шестой период периодической системы — К шестому периоду периодической системы относятся элементы шестой строки (или шестого периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в… … Википедия
Короткая форма периодической системы элементов — Короткая форма таблицы Менделеева основана на параллелизме степеней окисления элементов главных и побочных подгрупп: например, максимальная степень окисления ванадия равна +5, как у фосфора и мышьяка, максимальная степень окисления хрома равна +6 … Википедия
Группа — Сюда перенаправляется запрос «Группировка». На эту тему нужна отдельная статья … Википедия
Урок №58. Периодическая таблица химических элементов (короткая форма): А- и Б-группы, периоды
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Графическим изображением периодического закона является периодическая таблица. Короткая её форма содержит 7 периодов и 8 групп.
Короткая форма таблицы Д.И. Менделеева
Полудлинный вариант таблицы Д.И. Менделеева
Существует ещё и длинный вариант таблицы, он похож на полудлинный, но только лантаноиды и актиноиды не вынесены за пределы таблицы.
Оригинал таблицы Д. И. Менделеева
1. Период – химические элементы, расположенные в строчку (1 – 7)
Малые (1, 2, 3) – состоят из одного ряда элементов
Большие (4, 5, 6, 7) – состоят из двух рядов – чётного и нечётного
Периоды могут состоять из 2 (первый), 8 (второй и третий), 18 (четвертый и пятый) или 32 (шестой) элементов. Последний, седьмой период незавершен.
Все периоды (кроме первого) начинаются щелочным металлом, а заканчиваются благородным газом.
Во всех периодах с увеличением относительных атомных масс элементов наблюдается усиление неметаллических и ослабление металлических свойств. В больших периодах переход свойств от активного металла к благородному газу происходит более медленно (через 18 и 32 элемента), чем в малых периодах (через 8 элементов). Кроме того, в малых периодах слева направо валентность в соединениях с кислородом возрастает от 1 до 7 (например, от Na до Cl). В больших периодах вначале валентность возрастает от 1 до 8 (например, в пятом периоде от рубидия к рутению), затем происходит резкий скачок, и валентность уменьшается до 1 у серебра, потом снова возрастает.
Главные подгруппы состоят из элементов малых и больших периодов.
Побочные подгруппы состоят из элементов только больших периодов.
В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам.
Номер группы показывает высшую валентность элемента (кроме N, O, F).
Расшифровка таблицы Менделеева: как пользоваться

Расшифровка обозначений элементов
Каждому химическому элементу в таблице отведена одна клеточка, в которой указаны символ и название элемента, порядковый номер и относительная атомная масса.
Расшифровка обозначений элементов таблицы Менделеева:
Чтобы узнать количество нейтронов в ядре элемента, необходимо из относительной атомной массы (массового числа) вычесть порядковый номер.
Элементы периодической таблицы Менделеева
Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
Расшифровка групп и периодов таблицы Менделеева
В таблице химические вещества расположены в специальном порядке: слева направо по мере роста их атомных масс. Все они в периодической системе объединены в периоды и группы.
Периоды — это горизонтальные ряды в таблице. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Номер периода, в котором находится элемент, совпадает с номером его валентной оболочки. Эта валентная оболочка постепенно заполняется от начала к концу периода.
Группы — это столбцы. Элементы во всех группах имеют одинаковое электронное строение внешних электронных оболочек. В каждой группе на внешнем энергетическом атома одинаковое число электронов, то есть номер группы совпадает с числом валентных электронов, которые могут участвовать в образовании химических связей. Поэтому номер группы часто совпадает с валентностью элементов. Например, номер группы совпадает с валентностью s-элементов и с наибольшей возможной валентностью p-элементов.
Атомное число показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Валетность — это свойство элементов образовывать химические связи. То есть это количество химических связей, которые образует атом или число атомов, которое может присоединить или заместить атом данного элемента. Валентность бывает: постоянная и переменная (зависит от состава вещества, в которое входит элемент).
Определить валентность:
— Постоянная валентность идентична номеру группы главной подгруппы. Номера групп в таблице изображаются римскими цифрами.
— Переменная валентность (часто бывает у неметаллов) определяется по формуле: 8 вычесть № группы, в которой находится вещество.
Расшифровка периодов и групп периодической таблицы Менделеева
Каждый элемент имеет свой порядковый (атомный) номер, располагается в определённом периоде и определённой группе.
Периоды
В таблице 7 периодов. В каждом содержится определённое число элементов:
1-й период — 2 элемента (малый период),
2-й период — 8 элементов (малый период),
3-й период — 8 элементов (малый период),
4-й период — 18 элементов (большой период),
5-й период — 18 элементов (большой период),
6-й период — 32 элемента (18+14) (большой период),
7-й период — 32 элемента (18+14) (большой период).
Группы и подгруппы
В Периодической таблице может использоваться разное обозначение групп. Поэтому согласно такому обозначению бывает разная расшифровка групп таблицы менделеева:
Элементы с порядковыми номерами 58–71 (лантаноиды) и 90–103 (актиноиды) вынесены из таблицы и располагаются под ней. Это элементы IIIB группы. Лантаноиды относятся к шестому периоду, а актиноиды — к седьмому.
Элементы главной подгруппы
1 группа главная подгруппа элементов (IA) — щелочные металлы.
Это мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним электроном на внешней оболочке и прекрасно вступают в реакцию.
Литий Li (3), Натрий Na (11), Калий K (19), Рубидий Rb (37), Цезий Cs (55), Франций Fr (87).
3 группа главная подгруппа (IIIА).
Все элементы данной подгруппы, за исключением бора, металлы. Главную подгруппу составляют составляют бор, алюминий, галлий, индий и таллий. На внешнем электронном уровне элементов по три электрона. Они легко отдают эти электроны или образуют три неспаренных электрона.
5 группа главная подгруппа (VA).
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
8 группа главная подгруппа (VIIIA) — инертные (благородные) газы.
(He, Ne, Ar, Kr, Xe, Rn, Og). У них полностью заполнен внешний электронный уровень. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными». У инертных газов есть способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Элементы побочной подгруппы
Элементы побочных подгрупп кроме лантаноидов и актиноидов — переходные металлы.
Твёрдые (исключение жидкая ртуть), плотные, обладают характерным блеском, хорошо проводят тепло и электричество.
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
3 группа побочная подгруппа (IIIB) шестого и седьмого периодов — лантаноиды и актиноиды.
Для удобства их помещают под основной таблицей.
Неметаллы
Кислородные и водородные соединения
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения.
Существует 8 форм кислородных соединений: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4,
где R — элемент группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют 4 формы водородных соединений: RH4, RH3, RH2, RH.
Характер соединений: RH — сильнокислый; RH2 — слабокислый; RH3 — слабоосновный; RH4 — нейтральный.
Периодическая система состоит из семи периодов, десяти рядов и восьми групп, каждая из которых делится на главную и побочную подгруппы.
Группа периодической системы химических элементов (ПСХЭ) — вертикальный ряд химических элементов, расположенных по возрастанию заряда атомного ядра, которые имеют одинаковую высшую валентность в их соединениях, равную номеру группы. Номер группы указывается римской цифрой.
Например, атом натрия (Z=11) имеет высшую валентность I, т. к расположен в I группе ПСХЭ, а атом хлора (Z=17) – VII, т. к. расположен в VII группе.
Например, все элементы II группы имеют высшую валентность II, поэтому формула высших оксидов элементов II периода в общем виде RO (MgO, CaO, BaO, ZnO и т. п.). Все элементы IV периода проявляют высшую валентность равную IV, поэтому формула высших оксидов элементов IV периода в общем виде RO2 (CO2, SiO2, TiO2, GeO2, и т. п.).
Иключения составляют элементы, указанные в таблице 1.
В короткопериодном варианте периодической системы группы подразделяются на подгруппы — главные (или подгруппы A) и побочные (подгруппы В).
Главные подгруппы начинаются с элементов первого и второго периодов, побочные – с элементов IV периода.
Главная подгруппа содержит элементы малых и больших периодов. Побочная подгруппа содержит элементы только больших периодов.
Рис. 2. Главная и побочная подгруппа 1 группы
Рис. 3. Некоторые главные подгруппы ПСХЭ
Рис. 4. Некоторые побочные подгруппы ПСХЭ
Подгруппы также имеют названия по элементу с наименьшим порядковым номером (как правило, по элементу второго периода для главных подгрупп и элементу четвёртого периода для побочных подгрупп).
Инертные элементы или благородные газы
Элементы одной подгруппы обладают сходными химическими свойствами, т. к. элементы подгрупп сходны между собой по строению внешнего электронного уровня.
Закономерные изменения, наблюдаемые в главных подгруппах.
В каждой главной подгруппе сверху вниз происходит усиление металлических и ослабление неметаллических свойств, также усиливаются восстановительные и ослабевают окислительные свойства элементов и образуемых ими соединений.
Все элементы подочных подгрупп являются металлами.
Вопросы для самопроверки
1. Из каких структурных элементов состоит периодическая система химических элементов.
2. Что такое группа?
3. Сколько групп в периодической системе химических элементов?
4. Элементы каких периодов входят в главную подгруппу?
5. Сколько подгрупп в периодической системе?
6. Элементы каких периодов входят в побочные подгруппы?
7. На сколько подгрупп делится каждая группа?
8. Что общего у элементов одной группы?
9. Что общего у элементов одной подгруппы?
10. Как изменяются свойства элементов главных подгрупп сверху вниз?
11. Какими свойствами обладают элементы побочных подгрупп?
12. Какая группа содержит одну главную и три побочных подгруппы?
1. Из периодов, рядов, групп и подгрупп.
2. Группа — вертикальный ряд химических элементов, расположенных по возрастанию заряда атомного ядра, которые имеют одинаковую высшую валентность в их соединениях, равную номеру группы.
4. Малых и больших. Главная подгруппа начинается элементом малого периода (I или II). См. рис 3.
6. Только больших. Главная подгруппа начинается с элемента IV периода. См. рис 4.
7. I – VII группы делятся на две подгруппы – главную и побочную. VIII группа состоит из одной главной – инертные газы и трех побочных: подгруппа железа, подгруппа кобальта и подргуппа никеля.
8. Как правило, высшая валентность элементов. Она равна номеру группы, в которой находится элемент.
9. Химические свойства, т. к. элементы подгрупп сходны между собой по строению внешнего электронного уровня.
10. В каждой главной подгруппе сверху вниз происходит усиление металлических и ослабление неметаллических свойств, также усиливаются восстановительные и ослабевают окислительные свойства элементов и образуемых ими соединений.
Задачи для самостоятельного решения.
1. В какой группе и подруппе находятся элементы с порядковыми номерами 6, 40, 26, 53, 80? Укажите их символ, русское название, относительную атомную массу.
2. Напишите символ, название, порядковый номер элемента и относительную атомную массу элемента, который находится: а) в III периоде, главной подгруппе VI группы; б) в V периоде, побочной группе II группы; в) в VI периоде, главной подгруппе IV группы;
г) в IV периоде, побочной группе VII группы.
3. Напишите символы, названия и порядковые номера всех элементов малых периодов, которые находятся в главной подгруппе IV группы.
4. Напишите символы, названия и порядковые номера всех элементов, которые находятся в побочной подгруппе II группы.
5. Какие элементы главной подгруппы V группы являются элементами больших периодов? Напишите их символы, русские названия и порядковые номера.
6. Какой элемент: кальций или барий имеет более выраженные металлические свойства и почему?
7. Какой элемент: сера или кислород имеет более выраженные неметаллические свойства и почему?
8. Какой элемент VII группы главной подгруппы является самым активным неметаллом? Почему?
9. Какой элемент I группы главной подгруппы является самым активным металлом? Почему?
10. В каких группах периодической системы все элементы являются металлами?
11. В какой группе всего один неметалл?
12. В каких группах периодической системы все элементы являются неметаллами?
13. Напишите форм, 25, 48, 13, в которых эти элементы имеют высшую валентность.
14. Напишите формулы оксидов всех элементов IV группы главной подгруппы, в которых эти имеют высшую валентность.
V группа главная подгруппа периодической таблицы Менделеева (азот, фосфор)
К элементам главной подгруппы V группы периодической таблицы Менделеева относятся:
Общая характеристика элементов 5 группы главной подгруппы
От N к Bi (сверху вниз в периодической таблице)
Увеличивается
Уменьшается
Электронные конфигурации у данных элементов схожи, все они содержат 5 электронов на внешнем слое ns 2 np 3 :
N – 2s 2 2p 3 ;
P – 3s 2 3p 3 ;
As – 4s 2 4p 3 ;
Sb – 5s 2 5p 3 ;
Bi – 6s 2 6p 3
Db – 7s 2 7p 3
Электронное строение азота и фосфора
Нахождение в природе азота и фосфора
Азот – это основной компонент воздуха (79% по массе). В земной коре азот встречается в основном в виде нитратов. Входит в состав белков, аминокислот и нуклеиновых кислот в живых организмах.
Фосфор встречается только в виде соединений. В основном это апатиты (например, Ca3(PO4)2), фосфориты и др.). Фосфор входит в состав важнейших биологических соединений — фосфолипидов.
Аллотропные модификации фосфора
Способы получения азота
Лабораторный способ
Промышленный способ
Кроме этого, широко применяются азотные установки и станции, для адсорбционного и мембранного разделения
Химические свойства азота
Молекула азота химически устойчива, вследствие чего азот химически инертен.
Но при определенных условиях он реагирует с металлами, тяжелее с неметаллами.
В реакциях с металлами он выступает в качестве восстановителя, а в реакциях с неметаллами – в качестве окислителя.
Со сложными веществами азот практически не взаимодействует, т.к. его реакционная способность очень мала.
Реакция возможна только с активными веществами и в жестких условиях.
Взаимодействие азота с простыми веществами
С кислородом
С кислородом взаимодействует только при температуре электрических искровых разрядов (2000 о С, в природе – во время грозы):
Процесс сопровождается поглощением теплоты (эндотермическая реакция)
С галогенами (F, Cl, Br, I)
Взаимодействует только со фтором, с образованием фторида азота:
С водородом
Взаимодействует с водородом с образованием аммиака. Реакция обратима, поэтому для смещения равновесия в сторону продуктов реакции реакцию проводят в присутствии катализатора, при высоком давлении и высокой температуре:
При этом происходит выделение теплоты (экзотермическая реакция)
С серой
Не взаимодействует
С фосфором
Не взаимодействует
С углеродом
Реакция протекает при высокой температуре (2000 о С или действие электрического разряда) с образованием дициана:
В присутствии соды реакция протекает с образованием цианид натрия:
С кремнием
Взаимодействие с кремнием с образованием нитрида кремния
С металлами
Реагирует с щелочными и щелочноземельными металлами с образованием нитридов
Взаимодействие возможно как с чистым азотом, так и при горении металлов на воздухе
Взаимодействие азота со сложными веществами
С водой
Не взаимодействует
С кислотами
Не взаимодействует
С водными растворами щелочей
Не взаимодействует
С солями
Не взаимодействует
С оксидами
Не взаимодействует
С гидридами активных металлов
Реагирует с образованием нитридов:
Фосфор
Способы получения фосфора
Таким способом получается фосфор в газообразном состоянии
Химические свойства фосфора
Фосфор вступает в реакции как с металлами, так и неметаллами. В реакциях с элементами, расположенными ниже и левее в Периодической системе фосфор выступает в качестве окислителя, с элементами, расположенными выше и правее – в качестве восстановителя.
При недостатке окислителя образуются соединения фосфора (III), при избытке — соединения фосфора (V)
Взаимодействие фосфора с простыми веществами
С кислородом
Взаимодействие с кислородом воздуха приводит к образованию оксидов – ангидридов соответствующих кислот:
С галогенами (F, Cl, Br, I)
Взаимодействует с галогенами с образованием галогенидов с общей формулой PHal3 – при недостатке галогена и PHal5 – при избытке галогена:
С водородом
Непосредственно не взаимодействует
С серой
При взаимодействии с серой образуются сульфиды:
С азотом
Не взаимодействует
С углеродом
Не взаимодействует
С кремнием
С кремнием азот реагирует в очень жестких условиях, с образованием нитридов:
С металлами
В реакциях с активными металлами фосфор выступает в качестве окислителя, образуя фосфиды металлов:
Взаимодействие фосфора со сложными веществами
С водой
Красный фосфор реагирует с водой при температуре 700-900ºС и в присутствии катализатора (Cu, Pt, Ti, Zr):
С кислотами
Взаимодействует с кислотами – окислителями:
С водными растворами щелочей
С щелочными растворами вступает в реакции диспропорционирования, с образованием фосфина: