Что получается при электролизе воды
Электролиз
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом ряду напряжений металлов.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом активности металлов.
Теперь вы точно будете знать, что выделяется на катоде 😉
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3, NaF, FeI2, CH3COOLi.
Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде, то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH (обычно в продуктах оставляют именно запись «NaOH», не подвергая его дальнейшему электролизу)
Запишем реакцию электролиза для CuSO4:
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Электролиз воды

Всего получено оценок: 178.
Всего получено оценок: 178.
Процесс электролиза – это окислительно-восстановительная реакция, возможная только под действием электричества. Электролиз протекает в расплавах и растворах. В лабораториях для получения чистых газов – водорода и кислорода – проводят электролиз воды.
Что такое электролиз
Для осуществления процесса электролиза в раствор или в расплав помещают два электрода, подключённых к противоположным полюсам источника тока. В качестве электродов чаще всего используется металл или графит, так как эти материалы пропускают электрический ток.
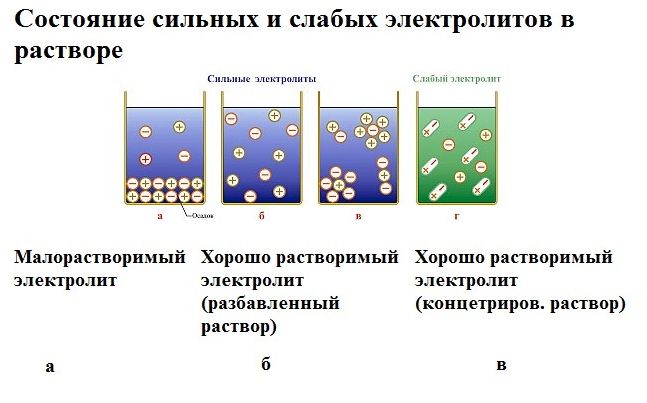
Под действием электричества электрод, подключенный к отрицательному полюсу, становится катодом, а электрод, соединённый с положительным полюсом, превращается в анод. Катод и анод притягивают противоположные ионы: к катоду направляются положительно заряженные катионы, к аноду – отрицательно заряженные анионы.
Катод является окислителем, на нём происходит процесс восстановления катионов. На аноде протекает процесс окисления: анод восстанавливает анионы и окисляется.
Процесс электролиза можно разделить на два этапа. Сначала происходит диссоциация – распад электролита (раствора или расплава) на ионы. Затем протекают реакции на электродах.
Электролиз воды
Если пропустить через воду электрический ток, жидкость начнёт диссоциироваться на составляющие молекулу воды атомы. В результате процесса электролиза воды получают кислород и водород. Однако в зависимости от природы электродов можно получить озон и перекись водорода.
Схема электролиза воды:
Вода – слабый электролит, поэтому электролиз чистой, дистиллированной воды протекает медленно или не идёт вовсе. Для ускорения процесса в воду добавляют сильный электролит, увеличивающий проводимость электрического тока.
Электролит выбирается так, чтобы исключить конкуренцию между катионами электролита и катионами воды (H + ). В противном случае водород не будет произведён. Чтобы исключить конкуренцию, необходимо подобрать электролит, катионы которого будут иметь меньший электродный потенциал, чем H + воды. На роль катиона электролита подходят:
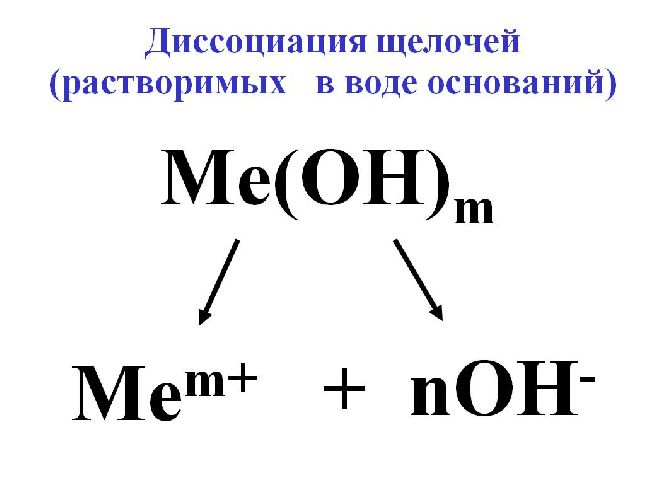
Для электролиза воды используются сильные щелочи: гидроксид калия (KOH) или натрия (NaOH). В некоторых случаях применяется сильная кислота, например, H2SO4.
Что мы узнали?
Электролиз – процесс образования и оседания на электродах ионов вещества под действием электрического тока. Вода разделяется на катионы водорода и анионы кислорода. Положительные катионы движутся к катоду, отрицательные анионы – к аноду. В некоторых случаях вода диссоциируется на озон и перекись водорода. Из-за низкой способности к диссоциации в воду добавляется сильный электролит, не мешающий образованию водорода и кислорода. Чаще всего добавляется щёлочь или сильная кислота.
Разделяй и властвуй: совершенствование электролиза воды
Одной из самых известных химических формул, которые нам известны еще со школьной скамьи, является H2O — оксид водорода, т.е вода. Без этого простого на первый взгляд вещества жизнь на нашей планете была бы совершенно иной, если вообще была бы. Помимо своих животворящих функций у воды имеется масса других применений, среди которых стоит выделить получение водорода (H). Одним из методов достижения этого является электролиз воды, когда ее разделяют на составляющие, т.е. на кислород и водород. Это достаточно сложный, затратный, но эффективный метод. Тем не менее, нет в мире такого, что ученые не хотели бы улучшить. Команда исследователей из университета штата Вашингтон и Лос-Аламосской национальной лаборатории нашли способ усовершенствовать электролиз воды, значительно снизив себестоимость его проведения без снижения результата. Какие изменения пришлось внедрить в электролиз воды, почему были использованы те или иные вещества, и какие результаты показывает обновленный метод добычи водорода? Об этом нам поведает доклад ученых. Поехали.
Основа исследования
Водород во многом уникальный элемент: он самый легкий среди элементов периодической таблицы, а его одноатомный вариант является самым распространенным веществом во Вселенной. Кроме того водород крайне дружелюбный элемент, с легкостью формирующий ковалентные связи с большинством неметаллов. В природе мы встречаем водород чаще в составе какого-то вещества, в том числе и в воде, нежели, так сказать, в одиночку.
При обычных условиях водород представляет собой газ без запаха и вкуса с химической формулой Н2. У него есть и жидкий эквивалент — жидкий водород, который хоть и не так популярен в массовой культуре, как жидкий азот, но не менее экстремален в аспекте температур: точка замерзания −259.14 °C; точка кипения −252.87 °C.
Для перечислений всех конкретных применений водорода понадобится немало времени, так как он принимает активное участие в самых разных сферах производства: пищевая промышленность, металлургия, производство электроники, производство аммиака и т.д. Не говоря уже об использовании водорода в качестве ракетного топлива.
Методов получения водорода также существует несколько: из природного газа, из угля и посредством электролиза воды. В год в мире по примерной оценке используется порядка 70 миллионов тонн, из которых лишь 100 000 тонн производится методом электролиза.
Такая методологическая «дискриминация» обусловлена сложностью и ценой электролиза в совокупности с получаемыми объемами водорода по сравнению с другими методами. Однако всегда есть возможность для совершенствования, о чем и пойдет речь далее, но обо всем по порядку.
Движущей силой электролиза воды для ее расщепления на кислород и водород является электричество. По словам ученых, низкотемпературный электролиз воды представляет особый интерес для сферы возобновляемой энергетики, так как этот метод может позволить хранить электроэнергию из возобновляемых источников в химических связях в форме водорода высокой чистоты.
При низкотемпературном электролизе воды в качестве электролита (проводящее ток вещество) используется концентрированный раствор KOH (гидроксид калия), протонообменная мембрана (PEM от proton-exchange membrane) или щелочная анионообменная мембрана (AEM от alkaline anion exchange membrane).
Основное преимущество AEM электролиза над другими вариантами заключается в его стоимости. То есть для его реализации нет необходимости использовать металлы платиновой группы (PGM от platinum-group metals) в качестве катализаторов. Однако всегда есть подвох, заключающийся в данном случае в нестабильности щелочного метода, ввиду чувствительности к перепадам давления и низкой скорости производства водорода.
В традиционных щелочных электролизерах (установка для электролиза) жидкий щелочной электролит (30–40 мас.% КОН) циркулирует через электроды, которые разделены пористой мембраной (1а).

Изображение №1: схема низкотемпературного электролиза воды.
2.0 В), чем у щелочных электролизеров, поскольку протонообменная мембрана имеет более высокую проводимость. (1b).
Использование твердых электролитов в PEM электролизе воды позволяет создать компактную систему с долговечными и устойчивыми структурными свойствами при высоких перепадах давления (200–400 psi). Но даже в этом методе есть свои недостатки, в частности высокая стоимость установки для электролиза, ввиду дорогостоящего кислотостойкого оборудования и необходимости в металлах платиновой группы.
В AEM электролизе за последние несколько лет произошло несколько изменений. Одним из самых важных является создание полимерных AEM (1с). Щелочной AEM-электролиз сочетает в себе многие преимущества других методов: возможность использовать катализаторы без PGM; возможность применять чистую воду или низкоконцентрированный щелочной раствор вместо концентрированных щелочных электролитов; низкие омические потери из-за высокой проводимости и тонких AEM. В дополнение к этому мембранная конструкция установки позволяет ей работать при значительных перепадах давления, а также снижает ее габариты и вес. Не говоря уже о снижении стоимости данного устройства.
В своем исследовании ученые решили попытаться избавиться от некоторых недостатков данного метода, тем самым сделав его более привлекательным для массового производства водорода. Исследователи выяснили, что высокая концентрация четвертичных аммониевых соединений необходима для повышения активности реакций выделения водорода и кислорода в AEM электролизере. Также было установлено, что фенильные группы в основной цепи иономера* имеют негативный эффект, образуя кислые фенолы при высоких анодных потенциалах.
Иономер* — полимеры, состоящие из электрически нейтральных и ионизированных составных звеньев, ковалентно связанных с основной цепью полимера в виде боковых групп атомов.
Кватернизаця* — преобразование соединений элементов 15-ой группы (N, P, As, Sb), атомы которых имеют свободную электронную пару, в четвертичные соли при взаимодействии с реагентами типа RX (Х — анионоидная группа).
Результаты исследования
Прежде чем понять, на что способен усовершенствованный AEM электролизер, необходимо было установить, чего он не может, т.е выяснить факторы, ограничивающие его производительность. Для этого были проведены эксперименты с вращающимся дисковым электродом (RDE от rotating disk electrode). RDE эксперименты предоставляют информацию о различных требованиях к электролитам, используемым в топливных элементах и электролизерах, путем измерения реакции выделения кислорода (OER), реакции выделения водорода (HER), реакции восстановления кислорода (ORR) и реакции окисления водорода (HOR).

Изображение №2: влияние концентрации NaOH (гидроксид натрия) на активность электрокатализаторов.
На графиках выше показаны поляризационные кривые OER с использованием IrO2 и HER с использованием поликристаллического платинового электрода (Pt poly) в зависимости от концентрации NaOH. Активность OER и HER для AEM электролизера значительно увеличивалась при увеличении концентрации NaOH с 0.01 М (рН = 12) до 1 М (рН = 14). HOR активность Pt poly проявляет максимальную активность при концентрации NaOH в 0.02 М (вставка на 2b). Потеря активности HOR при более высокой концентрации NaOH (> 0.1 М) также сопровождалась более низкой плотностью тока, ограничивающей диффузию.
Более низкая HOR активность Pt poly с концентрированным раствором NaOH объясняется кумулятивной совместной адсорбцией катион-гидроксид-вода, что ограничивает доступ водорода к поверхности катализатора. Однако совместная адсорбция не влияет на активность HER и OER, поскольку адсорбция происходит от 0 до 0.9 В. Влияние концентрации NaOH на активность ORR Pt poly показало тенденцию, аналогичную HOR.
ORR-активность Pt поли увеличивалась при увеличении концентрации NaOH с 0,01 до 0.1 М, затем начинала уменьшаться при дальнейшем увеличении концентрации NaOH до 1 М.
Результаты экспериментов предполагают, что концентрация гидроксида аммония, необходимая для AEM электролизеров и AEM топливных элементов, может быть различной. Для AEM электролизеров предпочтительнее иономер с более высокой ионообменной емкостью (IEC от ionexchange capacity). Для AEM топливных элементов лучше подойдет иономер со средним IEC, так как иономеры с более высоким IEC вызывают ограниченный перенос газа из-за нежелательной совместной адсорбции катион-гидроксид-вода.
Далее ученые решили выяснить, каким должен быть иономер для AEM электролизеров. Эксперименты с RDE показали, что обеспечение условий с высоким pH (> 13) в электродах имеет важное значение для создания высокоэффективных AEM электролизеров.
На данный момент доступные анионообменные иономеры имеют две критические проблемы, которые могут ограничивать среду с высоким pH в AEM электролизерах.
Первая проблема заключается в наличии фенильных групп в основной цепи иономера. Ранее проведенное исследование показало, что фенильная группа в основной цепи иономера может окисляться при OER потенциалах и образовывать фенольное соединение, которое является кислым (pKa = 9.6). К сожалению, большинство стабильных щелочных иономеров содержат фенильные группы в своей структуре.
Следовательно, AEM электролизеры, использующие иономеры, содержащие фенильную группу, так или иначе подвержены образованию фенола.
В аспекте окисления фенильной группы было обнаружено несколько крайне важных особенностей. Скорость образования фенола связана с энергией адсорбции фенильной группы на поверхности OER катализаторов, а незамещенные фенильные группы в боковой цепи полимера оказывают более вредное воздействие по сравнению с замещенной аммонием фенильной группой.
Структура и размер фрагментов основной цепи в полиароматических соединениях сильно влияют на адсорбцию фенила, тогда как функционализированная боковой цепью фенильная группа демонстрирует гораздо более низкую энергию адсорбции из-за конкурирующей адсорбции с аммониевыми группами. Кроме того, биметаллические платиновые катализаторы (например, PtRu, PtNi и PtMo) могут эффективно снижать энергию адсорбции фенила.
0.1 М). Неоднородное распределение иономера в электроде дополнительно снижает эффективность реакции и проводимость гидроксида. Следовательно, иономеры с более высоким IEC должны быть полезны для повышения производительности AEM электролизера.
Однако одно тянет за собой другое, так как для синтеза иономера с высоким IEC необходимо учитывать несколько критериев.
Во-первых, существует ограничение на максимальное количество аммониевых групп на полимерное составное звено (группа атомов, составляющих полимер).
Во-вторых, анионообменные иономеры с высоким IEC часто подвергаются реакции сшивания во время процесса функционализации, что затрудняет дальнейшую обработку.
И, в-третьих, когда анионообменные иономеры синтезируются с высоким IEC, они часто становятся растворимыми в воде, что непригодно для применения в электродах.
Как ни крути, а обойти все эти ограничения будет не так и просто. Тем не менее, взяв за основу вышеописанные данные, ученые подготовили несколько функционализированных триметиламмонием полистирольных иономеров (3а).

Изображение №3: химическая структура полимерных материалов, использованных в исследовании.
Созданные иономеры обладали достаточно уникальными характеристиками по сравнению с обычными иономерными связующими, разработанными для AEM топливных элементов.
Во-первых, основная алифатическая полимерная цепь не содержит фенильной группы. Отсутствие фенильной группы в основной цепи полимера исключает возможность адсорбции фенила и образования кислого фенола.
Во-вторых, основная цепь полимера не содержит длинных неионных алкильных цепей, которые могут снизить растворимость полимера.
В-третьих, все фенильные группы в боковых цепях имеют замещенные аммониевые или аминные группы, которые минимизируют адсорбцию фенильных групп и помогают поддерживать высокий рН.
По завершению синтеза иономеров было обнаружено, что их IEC варьируется в диапазоне от 2.2 до 3.3. Для AEM был подготовлен HTMA-DAPP, т.е. полифенилен Дильса-Альдера, функционализированный гексаметилтриметиламмонием (3b). Гидроксидная проводимость HTMA-DAPP составляла 120 мСм/см при 80 °C (мСм — миллисименс; сименс — единица измерения электрической проводимости).
Основная цепь полифенилена в высокомолекулярном полимере HTMA-DAPP обеспечивает превосходную механическую прочность (растягивающее напряжение > 20 МПа при относительной влажности 90% при 50 °C). А вот кватернизованный полистирол слишком хрупок для создания мембран и поэтому не подходит для применений с водным AEM электролизером, который требует механически стабильных AEM.
Щелочная стабильность HTMA-DAPP также достаточно высока: проявление минимального разложения в течение > 3000 часов в 4 М NaOH при 80 °C. Этот показатель гарантирует проведение испытаний AEM электролизера при рабочей температуре в 85 °C.
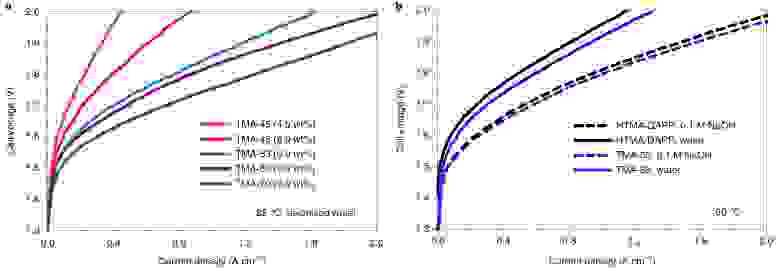
Изображение №4: влияние иономеров на производительность AEM.
На графике 4а продемонстрирован прогресс улучшения рабочих характеристик электролизера за счет исследуемого иономера.
Помимо влияния иономеров на производительность электролизера, ученые также исследовали влияние фенильной группы в иономере (4b). Для этого были проведены эксперименты, в которых сравнивались два МЕА, которые были одинаковы, за исключением связующего электрода. Первый электрод — это MEA с HTMA-DAP, а второй — с TMA-53. Содержание иономера (9 мас.%) и значение IEC (2,6) для обоих электродов было также одинаковым.
Подобные наблюдения указывают на то, что работа электролизера менее чувствительна к 0.1 М NaOH. Это может объясняться тем, что кислотные фенолы от окисления фенильной группы были нейтрализованы щелочным раствором.
Далее было проведено более детальное изучение характеристик MEA с TMA-70 посредством использования катализаторов, не содержащих металлов платиновой группы. В качестве анода был использован катализатор на основе нанопены NiFe.
Проверка характеристик MEA с разным содержанием иономеров в анодном NiFe катализаторе позволила определить, что 20 мас.% содержание иономера является наиболее эффективным.

Изображение №5: производительность AEM электролизера с анодным катализатором без применения металлов платиновой группы.
Далее для большей наглядности рабочие характеристики MEA с анодным NiFe катализатором сравнили с характеристиками электролизера с протонообменной мембраной (PEM), в которых используются катализаторы с металлами платиновой группы.
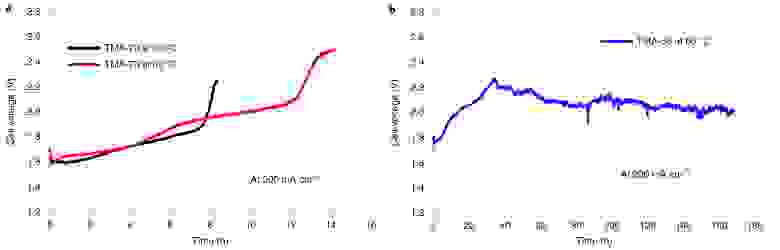
Изображение №6: показатели прочности AEM электролизеров с NiFe катализатором.
Было обнаружено, что частицы катализатора были вымыты как из анодного, так и из катодного выходных потоков. Это может свидетельствовать о том, что иономер с высоким IEC (TMA-70) не удерживал частицы катализатора во время непрерывной работы.
Увеличение силы связывания иономера можно было достичь путем применения того же иономера с более низким IEC при 60 °C.
На 6b показан кратковременный тест на прочность AEM электролизера с использованием иономера TMA-53. По результатам четко видно, что система работает стабильно в течение более 100 часов после начального повышения напряжения с 1.75 до 2.1 В. Начальное повышение напряжения в течение первых 40 часов, вероятно, связано с окислением фенила.
Вывод достаточно печальный — система хоть и показывает отличные результаты по производительности, но не может похвастаться тем же в аспекте долговечности.
Для более подробного ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых.
Эпилог
В данном труде исследователи продемонстрировали модель связующей системы для электродов, которая способна повысить производительность AEM электролизера. Такой вариант по своим характеристикам не уступает современным PEM электролизерам, при этом он не нуждается в металлах платиновой группы, что значительно снижает себестоимость всей системы.
Связующее для электродов было синтезировано на основе результатов экспериментов с вращающимся дисковым электродом, которые показали важность высокого локального pH для эффективной реакции выделения водорода и реакции выделения кислорода.
Удаление фенильных групп из основной цепи полимера позволяет предотвратить образование кислых фенолов, которые могут нейтрализовать гидроксид четвертичного аммония и снизить рН электролита. Кроме того, повышение рН электродов было достигнуто путем увеличения содержания иономера и IEC.
AEM электролизер, использующий кватернизованный иономер полистирола аммония, продемонстрировал отличную производительность даже без циркулирующего щелочного раствора.
Конечно не обошлось и без недостатков. В дальнейшем ученые намерены провести ряд дополнительных исследований для улучшения производительности разработанной системы и для повышения ее долговечности.
В совокупности все рассмотренные наблюдения являются дополнительными сведениями в области разработки высокоэффективных систем электролизеров, а также позволяют понять, как эффективнее хранить возобновляемую энергию.
Как говорят сами авторы исследования, суть заключается в том, что источники возобновляемой энергии весьма нестабильны. За одинаковый промежуток времени можно получить разный объем энергии, поскольку могут быть разные условия (например, ветрогенератор в безветренную погоду не особо эффективно работает). Тем не менее, порой имеется излишек энергии, которую необходимо эффективно утилизировать. Авторы сего труда считают, что использовать данную возобновляемую энергию нужно для производства водорода, необходимость в котором из года в год только растет.
Благодарю за внимание, оставайтесь любопытствующими и хорошей всем рабочей недели, ребята. 🙂







