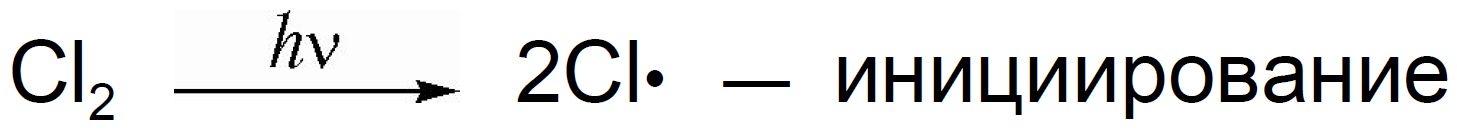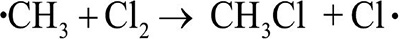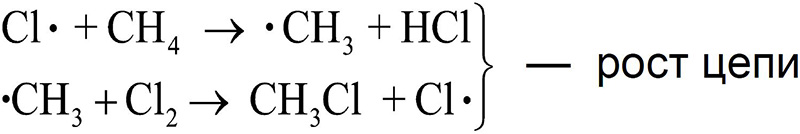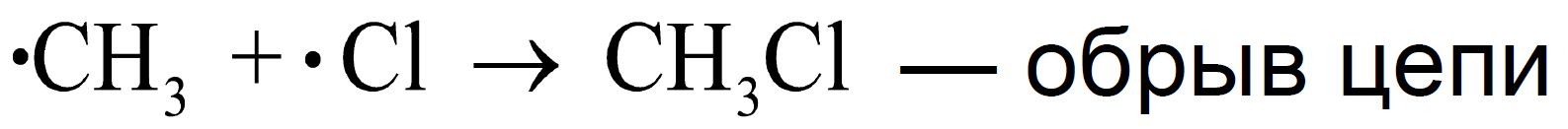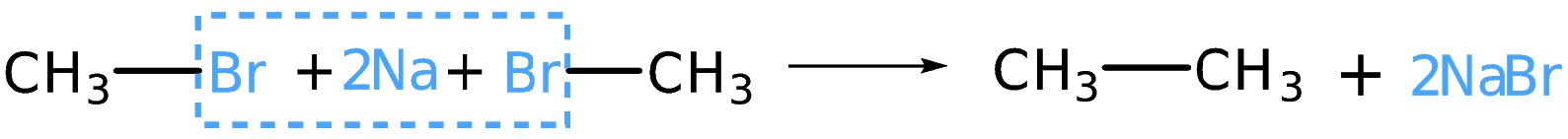Что получится при действии на пентан хлора при уф облучении
Большая Энциклопедия Нефти и Газа
Практическое использование находит также хлорирование пентана в качестве первой стадии процесса производства амиловых спиртов на основе нефтяного пентана. Эта реакция была подробно изучена С. С. Наметкиным и А. Г. Серебренниковой [98] и ими был предложен метод хлорирования пентана, пригодный для промышленного использования. [16]
Возможности получения других важных продуктов из продуктов хлорирования пентана далеко не исчерпываются рассмотренными примерами. [23]
Из емкости 12 хлорированные продукты первой стадии хлорирования пентана поступают в реактор 2, в котором процесс хлорирования завершается при высокой температуре в паровой фазе. Тепло реакции в зоне реактора 2 снимается за счет испарения четыреххлористого углерода, циркулирующего в системе. [24]
В работе [98] впервые был предложен процесс хлорирования пентана в полихлорпентаны с последующим высокотемпературным. Было показано, что при этом происходит циклизация углеродного скелета с образованием до 75 % от теорет. [25]
Наиболее эффективный промышленный метод производства гексахлорцик-лопентадиена основан на хлорировании пентанов или пентенов хлором или их смеси, легко выделяемой из нефтепродуктов. В качестве исходных продуктов можно использовать также пиперилен и циклопентадиен, но в этом случае хлорирование сопровождается образованием ряда побочных трудно отделяемых продуктов. [26]
Иногда возможна первичная конденсация хлорпроизводных и даже углеводорода ( хлорирование пентанов ) с получением НС1 в газообразном виде, более пригодном для утилизации. [27]
Примером процесса, полностью удовлетворяющего1 этому требованию, может служить хлорирование пентана и гидролиз хлористых амч-лов в амиловые спирты. Именно поэтому на основе этого процесса, детально рассмотренного выше, в США возникла крупная отрасль химической промышленности. [28]
Методы получения амиловых спиртов путем гидроформилиро-вания более рентабельны, чем хлорированием пентанов и гидролизом полученных монохлорпентанов. Этим и объясняется быстрое развитие промышленности оксосинтеза. [29]
Единственный промышленный процесс получения спиртов из парафиновых углеводородов хлорированием последних, а именно: хлорирование пентана и гидролиз хлористых амилов в амиловые спирты, эксплуатирующийся в США, можно было реализовать лишь вследствие благоприятных обстоятельств, подробно описанных выше ( см. стр. [30]
Реакция метана с йодом не идет, а с фтором протекает со взрывом даже в темноте и при комнатной температуре. Обычно для получения насыщенных фтор- и йодпроизводных используют другие методы синтеза.
Таким образом, реакционная способность галогенов в реакции с метаном изменяется в следующем порядке: F2 > Cl2 > Br2 (> I2)
В реакциях галогенов с другими алканами порядок изменения их реакционной способности не меняется.
Термин «реакционная способность» очень распространен в органической химии. Как правило, при сравнении реакционной способности сравнивают скорость или легкость протекания реакции. Если утверждается, что хлор по отношению к метану, более реакционноспособен, чем бром, это означает, что в идентичных условиях хлорирование метана происходит быстрее, чем бромирование. Чтобы реакция с бромом протекала с такой же скоростью, как с хлором, ее надо проводить в более жестких условиях (при более высокой температуре или при больших концентрациях).
Механизм реакции галогенирования алканов
Поскольку хлорирование и бромирование метана и других алканов протекает по одному механизму, его знание обеспечит понимание всех реакций галогенирования алканов. Как уже было отмечено выше, механизм реакции должен объяснять известные экспериментальные факты. В реакции хлорирования метана механизм не должен противоречить следующим фактам:
· смесь метана и хлора не реагирует в темноте при комнатной температуре;
· реакция протекает в темноте при температурах выше 250 о С;
· реакция протекает при комнатной температуре при обучении реакционной смеси ультрафиолетовым светом;
· реакция может протекать в темноте при комнатной температуре или незначительном нагревании в присутствии соединений, способных в этих условиях генерировать свободные радикалы (например, Pb(C2H5)4);
· если реакция протекает при ультрафиолетовом облучении, то она имеет высокий квантовый выход (на каждый поглощенный системой фотон образуется несколько тысяч молекул хлористого метила);
· присутствие в реакционной смеси кислорода замедляет реакцию. Длительность периода замедления зависит от количества кислорода в смеси.
Следующий механизм свободнорадикального замещения полностью объясняет приведенные выше факты:
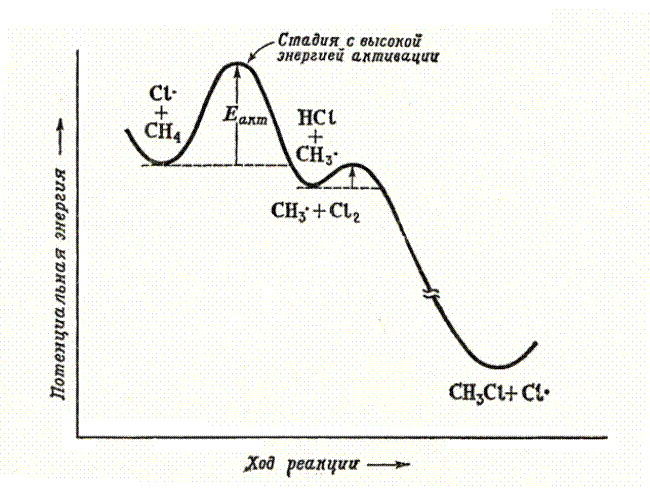
Столкновение атома хлора с молекулой метана приводит к отрыву от последней атома водорода и образованию метильного радикала (стадия 2а). Образовавшийся свободный метильный радикал имеет лишь семь электронов и, стремясь к электронному октету и уменьшению энергии за счет образования связи, проявляет очень высокую реакционную способность.
Далее метильный радикал отрывает от молекулы хлора атом со связывающим электроном, образуя хлористый метил (стадия 2b). В реакционной массе вновь генерируется свободный атом хлора.
Рис 6.1. Энергетическая диаграмма хлорирования метана
Рассмотренная реакция является не просто реакцией свободнорадикального замещения (SR), а цепным процессом. Цепной называется реакция, которая включает ряд стадий, на каждой из которых образуется частица, вызывающая следующую стадию. Единственную отечественную Нобелевскую премию по химии за исследования цепных реакций получил академик Н.Н. Семенов (1956 г.).
Стадии роста цепи (2a и 2b) не могут продолжаться бесконечно. Стадии, в которых радикальные частицы не генерируются, называются стадиями обрыва цепи (рекомбинация свободных радикалов) и показаны выше на схеме (3a-c).
Данный механизм объясняет все приведенные выше экспериментальные факты.
Галогенирование высших алканов протекает по тому же механизму, что и галогенирование метана. Реакция осложняется тем, что, начиная с пропана, возможно образование изомерных галогенопроизводных.
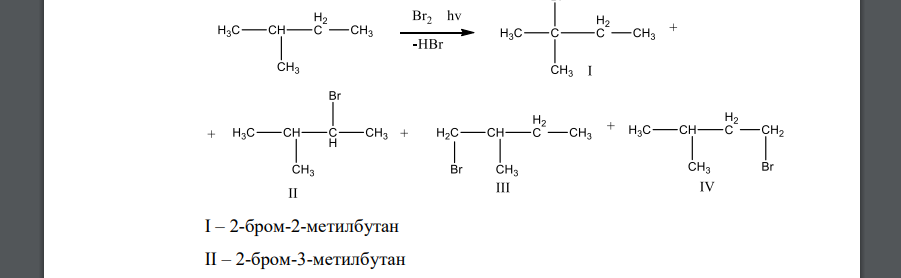
Рассмотрим бромирование метилбутана (см. схему). В этой реакции возможно образование четырех монобромпроизводных I-IV. Соединения I и IV являются первичными бромопроизводными, II – третичными, а III – вторичными. Учитывая, что в молекуле метилбутана 1 третичный, 2 вторичных и 9 первичных атомов водорода, то при одинаковых скоростях реакций по этим положениям следует ожидать соотношение изомеров I и IV : III : II = 9 : 2 : 1. Однако в опыте образуется смесь с другим соотношением изомеров. В результате бромирования получено более 95 % соединения II, около 5 % соединения III и следы соединений I и IV.
Такой результат реакции позволяет сделать вывод, что бромирование по третичному атому происходит быстрее, чем по вторичному, а по вторичному, в свою очередь, быстрее, чем по первичному. Поскольку стадией, определяющей скорость галогенирования, является образование алкильного радикала (см. рис. 6.1.), легкость образования свободных радикалов уменьшается в ряду:
третичный > вторичный > первичный > метильный
В той же последовательности снижается и стабильность радикальных частиц. Общая закономерность органической химии: чем устойчивее частица, тем легче она образуется. Этот вывод относится к свободным радикалам, катионам и анионам.
Причина указанного выше изменения стабильности свободных радикалов заключается в делокализации неспаренного электрона, находящегося на p-орбитали и состоящего в сопряжении с электронами s-связей. Чем больше разветвлена углеродная цепь у атома, несущего неспаренный электрон, тем выше стабильность радикала и, следовательно, тем легче и быстрее он образуется.
Чтобы распечатать файл, скачайте его (в формате Word).
Какие продукты получаются при бромировании 2-метилбутана и циклопентана при облучении
 |  | Химия |
 |  | Решение задачи |
 |  | 18 февраля 2021 |
 |  | Выполнен, номер заказа №16800 |
 |  | Прошла проверку преподавателем МГУ |
 |  | 167 руб. |
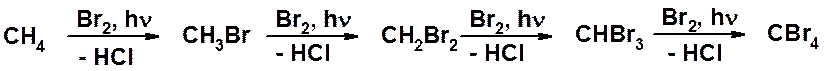
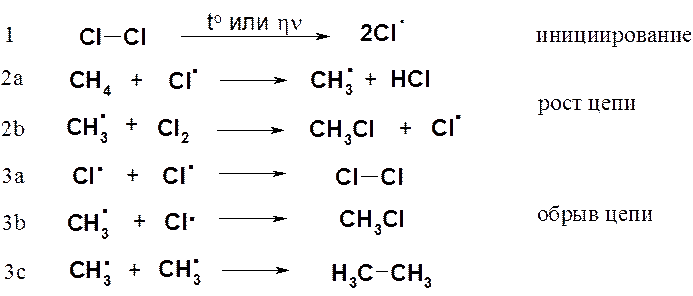
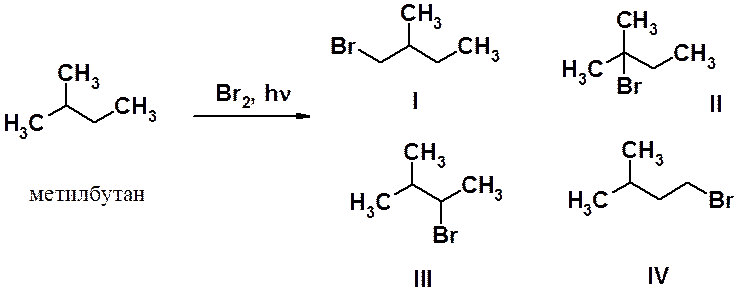



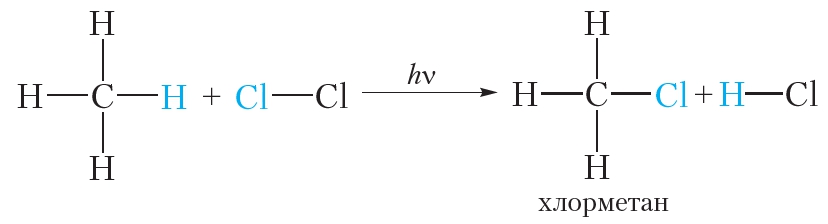
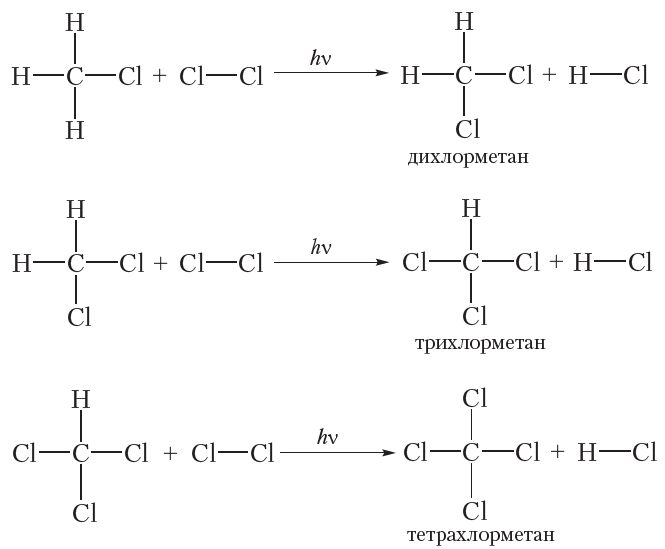
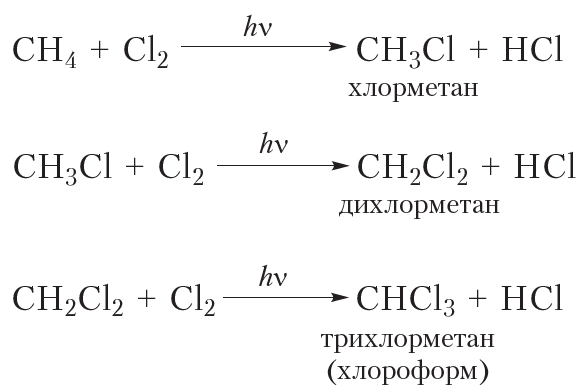
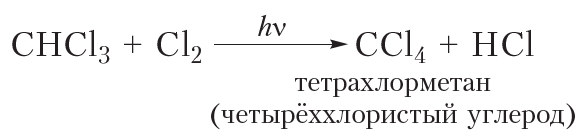
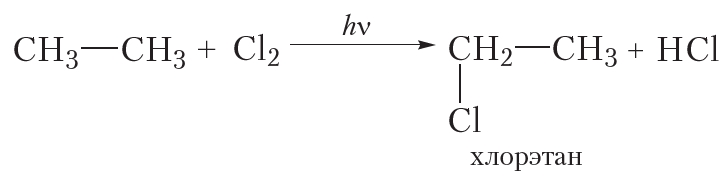

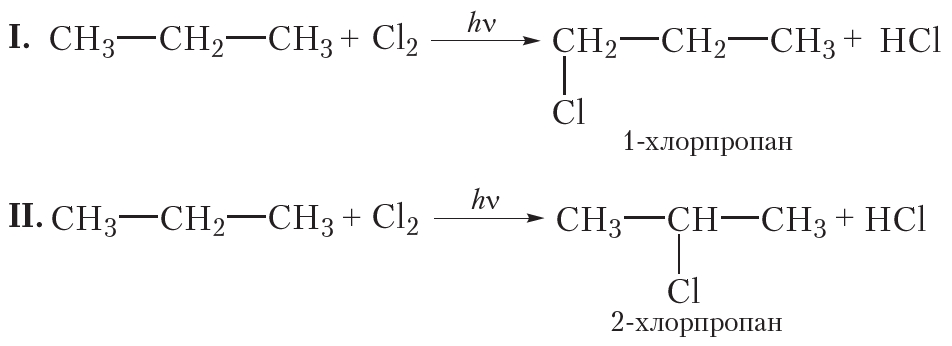
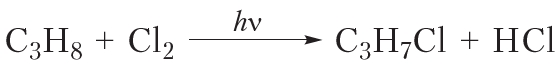
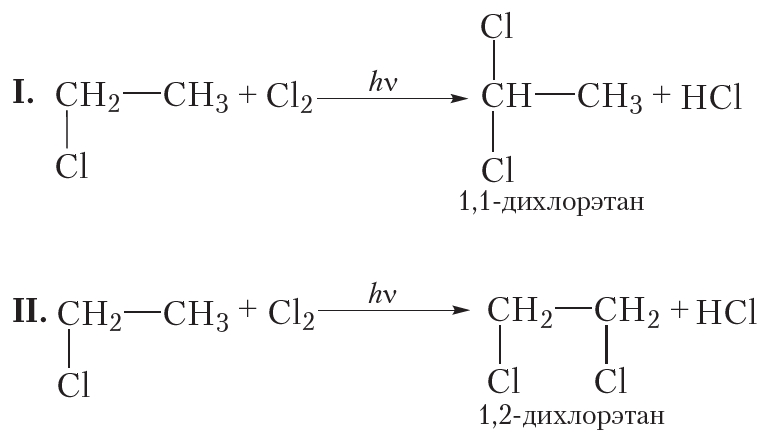
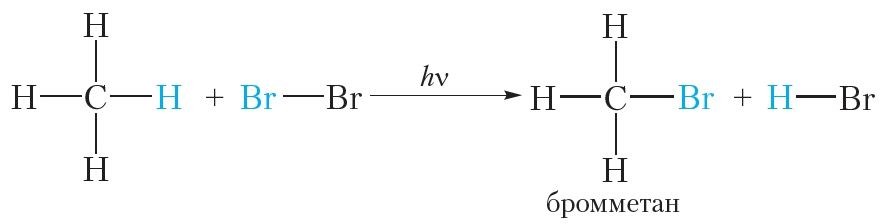
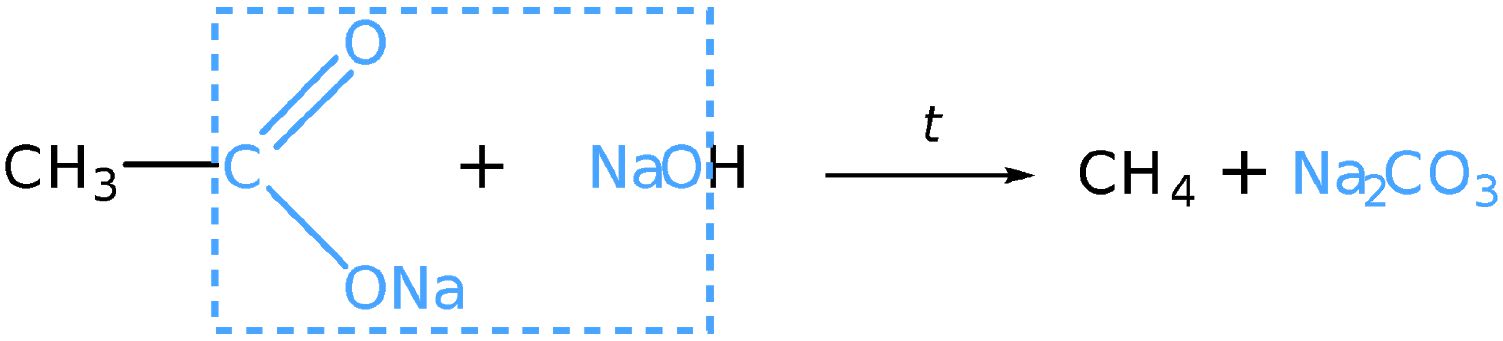
 В заключение ещё раз обратим внимание, что реакции алканов с хлором и бромом протекают в жёстких условиях: при облучении или нагревании.
В заключение ещё раз обратим внимание, что реакции алканов с хлором и бромом протекают в жёстких условиях: при облучении или нагревании. и
и  . В результате молекулы алканов могут быть полностью разрушены с образованием углерода и водорода. Разложение веществ при высоких температурах называют пиролизом (от греч. пиро — огонь, жар и лизис — разложение, распад). Например:
. В результате молекулы алканов могут быть полностью разрушены с образованием углерода и водорода. Разложение веществ при высоких температурах называют пиролизом (от греч. пиро — огонь, жар и лизис — разложение, распад). Например: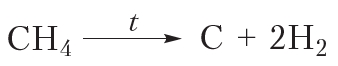
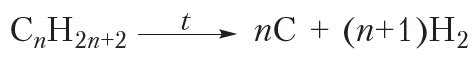
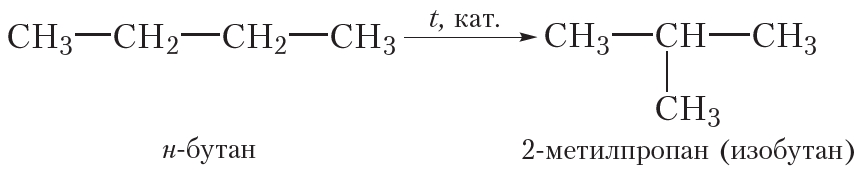

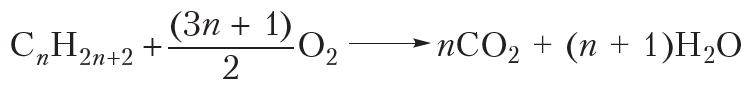
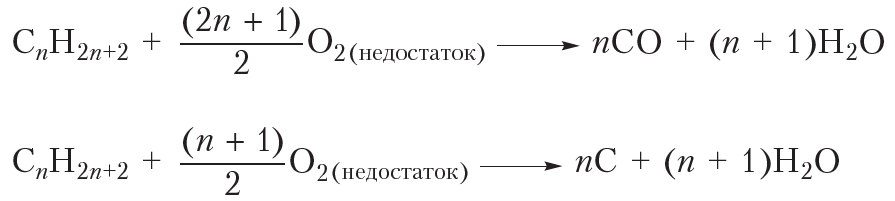

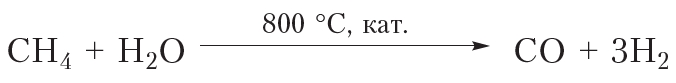
 и
и  . В результате молекулы алканов могут быть полностью разрушены с образованием углерода и водорода (пиролиз).
. В результате молекулы алканов могут быть полностью разрушены с образованием углерода и водорода (пиролиз).